「第29回 製薬協 政策セミナー」を開催
2017年03月01日
セミナー
2017年3月1日、東京コンファレンスセンター・品川にて、「創薬イノベーションと製薬産業の将来像」をテーマに「第29回 製薬協 政策セミナー」を開催しました。持続的なイノベーションを核に飛躍的な成長を遂げてきた製薬産業はいま、大きな転換期を迎えています。これまでは世の中に大いに歓迎されてきた革新的な新薬が、薬価制度の見直しにつながる議論を引き起こす事態となっています。単純に良いものを創れば受け入れられるという時代が終わり、革新的な新薬を低いコストで、しかも短期間に市場に投入することが製薬産業にとって大きな課題となってきました。問われているのはイノベーションの中身です。今回の政策セミナーでは、よりいっそう効率的にイノベーションを進めていくための研究開発分野における大胆な外部資源の活用、臨床情報の活用を含めた産学官の有機的な連携のあり方等が討議され、多数の参加者が熱心に聴講しました。
 会場風景
会場風景
「第29回 製薬協 政策セミナー」は、製薬協伍藤忠春理事長の開会挨拶で幕を開けました。基調講演に立った日本医療研究開発機構(AMED)理事長の末松誠氏からは、「臨床研究のデータを研究機関や国家の枠組みを超えて広くシェアすることによりイノベーションを実現する環境作りを進めるAMEDの方針」について詳細に説明がありました。続くパネリスト講演では、厚生労働省医政局研究開発振興課長の森光敬子氏が、国が進めている疾患登録情報を活用した臨床開発のインフラ整備について詳細に紹介し、また、ベンチャー企業を代表して登壇されたサンバイオ代表取締役社長の森敬太氏は、「2014年の再生医療新法の施行に伴い活動の拠点を米国から日本へと移した」同社の経験から、イノベーションと法規制の調和の重要性を訴えました。製薬協の畑中好彦会長は、「従来の製薬ビジネスの枠を超えた多様な産業との協働や技術・サービスとの融合による創薬イノベーションの実現」を提唱し、今後の創薬におけるオープンイノベーションの重要性を指摘しました。講演後には、慶應義塾大学医学部医療政策・管理学教室教授の宮田裕章氏をコーディネーターに迎え、講演された4氏によるパネルディスカッションが行われました。
以下、当日の講演概要を紹介します。
開会挨拶
製薬協 伍藤 忠春 理事長

われわれ製薬業界はこのところ非常に大きな変動に見舞われています。本日のテーマであるイノベーションの結果、C型肝炎の治療薬と、免疫を介してがんを叩く薬剤が登場しました。このような革新的な新薬の登場は、これまでは世の中から大いに歓迎されることが常でありました。しかし、われわれの業界は税金や保険等の公的な分野との関係が非常に深く、革新的な新薬の登場が薬価制度の抜本改革の議論を引き起こすことになりました。
このような流れを眺めてみると、われわれ製薬産業には、革新的な新薬を創出するというイノベーションを核としつつ、高い品質を維持しながらコストをいかに下げて効率的に生産するためのイノベーションや、安全性を確保するとともに早く製品化するためのイノベーション等、複数のイノベーションが総合的に求められているのではないかと考えています。本セミナーで、こうした議論が展開されることを期待しています。
基調講演 AMEDのミッション:創薬イノベーションのための産学連携推進
日本医療研究開発機構 理事長 末松 誠 氏

日本医療研究開発機構の現状
日本医療研究開発機構(AMED)は、2015年4月に発足し、現在年間予算1400億~1500億円で運営されています。発足以来ほぼ2年が経過し、2016年までに研究費の効率的な活用のための「研究費の機能的運用」のルールについて文部科学省、厚生労働省、経済産業省の関係3省庁間との調整が進みました。ただ、大学の研究機関の中にはこのルールの浸透が十分でない点も見られ、いっそうの啓発活動が必要であると考えていますが、相当改善されたのは事実です。
しかし、研究費の運用ルールの調整が進められただけで医療の研究開発(R&D)が加速されるものではないのは明らかです。なぜなら、スポーツにたとえると、R&Dはマラソンのように1人で全コースを走り切るものではなく、駅伝のように第1走者、第2走者から最終走者にいたるまで、タスキを次々につないでいかなければならないものだからです。そして、タスキの受け渡しを円滑に行う手伝いをするのが、われわれAMEDであると考えています。それはちょうどわれわれの生体内でエネルギーを生み出す、クエン酸回路(TCA cycle)にもたとえられます。TCA cycleでは、アミノ酸、グルコース、脂質の3つの異なる「燃料分子」を材料としてTCA cycle内でエネルギーのもととなるアデノシン三リン酸(ATP)が生成されます。この過程の円滑で急速な進行には触媒システム(電子伝達系)が必須です。R&Dにおいて、ATPに相当する研究の成果を得るための触媒システムにあたるものがAMEDであるともいえるのです。
しかし、AMED発足当時の医療研究体制にはさまざまな課題がありました。米国のScience誌の2015年5月8日号に、「Japan's 'NIH' starts with modest funding but high ambitions」というタイトルでAMEDについての論評が掲載されました。私はこのタイトルを「ボロは着てても、心は錦」と意訳していますが、この記事は問題点をなかなか的確に捉えていると思います。記事中に「Balkanization」という単語が出てきます。その意味するところは、同じ日本語を話すのに、たとえば、研究者と医師、研究者と官僚、大学と大学、大学と業界で話しが通じない、アイデアやデータが共有できない状態のことです。この約2年間創薬や医療機器開発にかかわってきて、最大の問題と感じたのは、「異なったセクター同士で一見話しが通ったように見えても実際にはそれぞれまったく異なることを考えている」という「Balkanization」の状態にAMEDがあることでした。
この時思い起こしたのは、40年以上前にプロボクシングのモハメド・アリ氏とプロレスリングのアントニオ猪木氏の間で戦われた「異種格闘技戦」です。この一戦では、事前にルールの調整はあったものの、猪木氏は寝たまま、アリ氏は逃げ回るのみに終始して試合は終わりました。日本の医療研究でも、おそらく駅伝の走者間の関係がアリ-猪木と同様の関係となり、思うように進めることができなかったのではないかと考えています。
医療における「Balkanization」
従来、次世代シークエンサーを利用すれば、医療がすべて良くなり、個別医療が実現できるという幻想に似た期待がありました。これに関係してScience誌の先ほどの記事は痛烈に批判しています。「文部科学省が導入した次世代シークエンサーがどこの大学に設置されているかを、病院を管轄する厚生労働省はまったく知らなかった」というのです。つまり、患者さんや臨床医は次世代シークエンサーによる成果を強く求めているのですが、シークエンサーの情報を管理する担当者は臨床医や患者さんにどのような問題とニーズがあるのかをまったく知らないのです。これは悪意や怠惰に基づくものではなく、知る方法がなかったからです。両者のコミュニケーションが取れていなかったのです。研究者と省庁の間も同様です。研究者は自身の研究が唯一無二のものだと思いがちで、自分の研究テーマ以外には意識が向きません。私もかつてはそうでした。大学と産業界の間はどうでしょう。これも同様で、「良いシーズができたね、共同研究しましょう」となっても、お互いが考えているシーズの定義がまったく違うのです。日本には、複数の有力な国立大学が比較的狭い地域に集中している場合がありますが、これらの大学が協力して1つの成果を出そうとすることはありませんでした。このように大学間にも「Balkanization」は存在します。
では、医学以外のサイエンスの領域はどうでしょうか。最近、地球から38光年先に地球型の惑星7つを含む恒星系が発見されました。あの発見は、ハッブル宇宙望遠鏡等の少数の観測機器からのデータを世界各国の天文学者が共有し、それぞれの国から論文を出すことで得られた成果だといいます。
AMEDがより良く機能するために
AMED発足時の懸念の一つは、関係3省庁からの人材が十分に融合して機能してくれるかどうかでありましたが、これは杞憂に終わり、「研究費の機能的運用」のルールの見直しも比較的短期間に進んだことは喜ばしいことでした。しかし、AMEDの業務を加速するには、以下のような問題の解決にあたらなければなりません(図1)。
 図1 AMED創成期の改革目標
図1 AMED創成期の改革目標
1つ目は、国際的な協調関係・協力関係とそれに関連する測定や分析方法の標準化です。職員はそれぞれ懸命に調整にあたるものの、省庁の常として2年ごとの人事異動で顔ぶれが変わるたびに、海外等の担当者が誰になにを言って良いのかわからなくなるという事態にこれまで何度か陥ってきました。やはり、国と国できちんと協定を結び、情報共有・情報交換を行い、経験を共有する。それが必要ではないかと考えています。米国の国立衛生研究所(National Institutes of Health、NIH)と協定を締結し、さらに2017年2月に英国の医学研究会議(Medical Research Council、MRC)と基礎研究を中心とする協定を結んだのも、この流れに沿ったものです。大学にも改革が必要なことは、先ほど申した通りです。
2つ目は、医療研究開発の大きなボトルネックと考えられる英語化の問題です。これについては、日本の省庁にはかなり抵抗感があるように感じられます。2016年にファンディングの過程を英語化しようとしたのですが、なかなか進んでおりません。しかし、2017年1月の時点で、数あるプロジェクトのうちの8つは英語で募集し、日本と米国、あるいは日本とシンガポールというように2国間で評価委員会を設置し、すべて英語で審査し、その審査結果も英語で返し、報告も英語を使用するというようにしました。8プロジェクトと全体からするとわずかではありますが、このように英語化を徐々に進めています。そして、2017年4月からはAMEDに応募するすべての課題で、数ページではありますが、英文タイトル、英文キーワード、研究者番号等をデータベース化し、自然言語解析等を用いて研究のトレンドやニッチのありかを戦略的に解析可能とするシステムを構築中です。そこに英語で情報を入れ、さらに海外のデータベースも利用して、課題の分析や今後の戦略立案に役立てられるシステムを目指しているところです。
このような英語によるシステムの構築は基礎にも臨床にも必要なことですが、特に臨床の場では多国籍の多施設共同試験となることが多いため英語使用が必須となります。
3つ目は、予算の安定化です。予算の安定化のためには、製薬協のご協力は欠かせません。現在製薬業界も厳しい状況にあることはよく承知しています。そのような状況下にありますが、みなさんから官民パートナーシップ(Public Private Partnership、PPP)として貴重な資金を提供いただき、そこに公的資金を加えて生物統計の専門家養成プログラムを2017年から開始することになりました。従来より、公的資金による助成では、1年目には相当額の予算が組まれるものの、2年目あるいは3年目に入ると資金が減額されてしまうことが少なくありませんでした。いわゆる「心電図予算」です。AMEDがバッファリングすることにより心電図予算を回避し、研究者のモチベーションを損なわないようにしたい、というのがわれわれの願いであります。そのために民間の資金を活用させていただこうと考えています。
最後の1つは、今までの医療のR&Dというと、創薬と医療機器開発に限られ、これらを二本柱として健康医療戦略も立てられてきました。今回、この二本柱に、新たな柱としてMedical Artsを加えることにしました。Medical Artsとはどのようなものかというと、たとえば外科医の天才的な手術手技や、特定の病理学者が有する暗黙知のことで、これらを抽出して広く臨床で使用できるようにすることを指します。あるいは、医療にかかる財務的負担を軽減する画期的な医療システムの創出にかかわるソフトウエアや発想等を指します。従来、このようなMedical Artsには、予算が付くことはありませんでした。このような領域を第3のカテゴリーとして必要であるとの考えから、Medical Artsという比較的簡略な言葉で定義して、創薬と医療機器開発に並ぶ柱としました。今後おそらく、製薬企業でも薬剤のみを供給するのではなく、その薬剤の服薬をどのように患者さんは順守したか、さらにそのモニタリングを行うシステムや、患者さんの情報を収集してそれを臨床の場へフィードバックできるシステム等の開発が進められるようになると考えられます。これらもMedical Artsであり、データシェアリングを実現することにもつながります。
データシェアリングの重要性とAMEDの取り組み
データシェアリングについて、考える際に興味深い動物をご紹介します。広鼻下目の一種であるコモンマーモセットは、わが国でも脳科学研究の実験動物として使われていますが、彼らはお互いにアイコンタクトをします。また、ボーカルコミュニケーションをすることから、なんらかの言語をもつと推定されます。そして、最大の特徴は、仲間が飢えていると食物をシェアすることです。研究者はこのシェア、つまりデータのシェアがなかなかできないのです。
そこでAMEDでは、発足当時からデータシェアリングに注力してきました。たとえば、難病・未診断疾患の領域では未診断疾患イニシアチブ(Initiative on Rare and Undiagnosed Diseases、IRUD)を設立し、また、がん領域では国立がん研究センターと協力して、産学連携全国がんゲノムスクリーニング事業であるSCRUM-Japanを設立しました。これらの2つは、AMEDの代表的なデータシェアリングの取り組みです。
このうちのIRUDの現状について紹介します(図2)。そもそもなぜ「Balkanization」が、診断のスピードを遅らせるのかについては以下のように考えられます。臨床研究に携わる現場の医師は、診療に基づく知見をデータ化して研究論文として発表し、自分のアイデンティティを高めるとともに、診療能力を向上させてさらなるデータ化を進めるということを繰り返しています。ところが、この過程でデータの囲い込みが起きています。特に難病・未診断疾患に関しては、データが囲い込まれると他施設を受診した患者さんは、診断がつかないままDiagnostic Odysseyとなってしまうおそれが多分にあります。
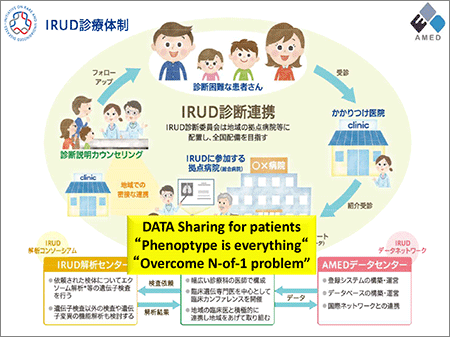 図2 IRUD診療体制
図2 IRUD診療体制
そこで、医療施設間の垣根を低くし情報共有を進める必要があります。IRUDでは、小児疾患を中心に体系的に診断する医療システムと、次世代シークエンサーを用いたエクソーム解析結果等の患者さん情報を収集蓄積して診断結果を開示するシステムの2つを確立することを目指しており、全国200以上の総合病院がIRUD拠点病院となっています。現在、設立後約1年半が経過しましたが、その間の登録家族数は2230家族で、これまで記録がなかった疾患を12例発見、海外の症例とのケースマッチングが成立したものが2例、まだ診断がつけられないが2例目の患者さんが出れば確実に診断がつくと思われるものが77家族、そして、これまで診断がついていなかった症例に対して診断結果を通知できたものが487例あります。なお、このプロジェクトが加速する大きな推進力となったのは、東北メディカル・メガバンク機構が公開している健康な日本人2000名分のゲノム情報です。
今後はIRUDの成果をより発展させるため「IRUD Beyond」として「Beyond Diagnosis」、「Beyond Genotyping」、「Beyond Borders」の3つを掲げ、診断から治療への橋渡し、診断成功率のさらなる向上、さらなるデータシェアリング等による国際連携を進めます。
平成29年度のポイントと今後の取り組み
平成29(2017)年度の計画とポイントについて触れます。全国の大学病院の臨床情報の共有化についても二次情報の利用を含め推進します。データシェアリングについては、お互いの信頼が必要であるため、信頼関係が比較的醸成しやすい領域から進めていきます。IRUDはその1例であり、そのほかNational Clinical Database(NCD)の臨床研究者へのさらなる公開、院内感染に関する情報共有の推進等があります。
さらに、今後の広域連携・分散統合の連携に向けた取り組みを進めたいと考えています。厚生労働省の電子的診療情報交換推進事業に基づくフォーマットが全国的に使用されていますが、個人情報保護等の安全性の問題、どこになんのデータがあるのかお互いにわかる広域でのデータ共有については未整備です。そこで、現場の医師が臨床データを記録した時点で、自動的に匿名化された状態のデータがコピーされ、情報が蓄積されるようなシステムが必要と思われます。
日本には、国立情報学研究所が運営するSINET5という、全国の国立大学、私立大学の多くを網羅した強力な高速情報ネットワークが、諸外国に先駆けて構築されています。AMEDではこのようなネットワーク利用の一端として、画像診断が多用される日本医学放射線学会、日本消化器内視鏡学会、日本病理学会の3学会による統合的なデータベース構築をNCDの協力のもと、推進しようとしています。
パネリスト講演 創薬支援に向けた新たな取り組み
-イノベーションを患者に届けるために-
厚生労働省 医政局 研究開発振興課長 森光 敬子 氏

国の創薬支援の方向性
これまで、国の創薬支援の方向性を示す、さまざまな戦略や報告が出されてきました。平成26(2014)年には、「健康・医療戦略」の「世界最先端の医療に向けた取り組み」として、イノベーションの促進を目的に「再生医療やゲノム医療の実現」が打ち出されました。また、「基礎的な研究開発から実用化のための研究開発まで一貫した研究開発を推進」するという取り組みが始められました。この取り組みを受けて創設されたのが、日本医療研究開発機構(AMED)であることはご存知の通りです。さらに、「臨床研究及び治験実施環境の抜本的向上」が挙げられています。
「健康・医療戦略」は、平成29(2017)年2月に一部変更されました。その目指すところがイノベーションの促進である点は変わりありませんが、「治験実施環境の抜本的向上」の項で、拠点の整備について臨床研究中核病院が医療法に位置づけられたため、今後の展開として「医療機関が連携して症例の集約化を図るネットワークを整備する」、「臨床研究中核病院の機能を強化する」等が挙げられました。臨床研究中核病院の機能強化については、創薬支援や臨床研究の底上げを目標とした具体的議論が始まるところです。また、「中央倫理・治験審査委員会の設置・運用を推進する」ということで、情報を1ヵ所に集中し、審査を迅速に進める方針も打ち出されました。さらに、データシェアリングについても、「共有・広域連携を強化する」とされました。
平成27(2015)年の「医薬品産業強化総合戦略」においては、わが国は世界でも数少ない新薬の創出国であるため、医薬品産業を成長産業の一つと位置づけており、「イノベーションの推進」として、臨床研究・治験の活性化、産学官の連携強化が提唱されました。
治験・臨床研究の基盤整備
治験・臨床研究の基盤整備については、平成15(2003)年に「全国治験活性化3カ年計画」が出され、その後何度かの再策定を経た後、平成24(2012)年に集大成として「臨床研究・治験活性化5カ年計画2012」が出され、現在に至っています。これらの計画策定途上においては、治験コーディネータ(CRC)の確保、生物統計家の位置づけ等の初期の課題を経て、ネットワークや研究の整備を図るための予算化等が進められてきました。先ほども触れましたように、平成27(2015)年4月からは医療法により臨床研究中核病院の位置づけが行われたことで、基盤整備も1つの段階を越えたと考えられます。従来の医療法では、病院は診療の場ということでしたが、今回の改定により病院の機能に臨床研究の場という位置づけが加わったと見るのがわかりやすいかと思います。これに伴い、病院の中に臨床研究を推進するセクションを新たに設ける必要が生じ、また、臨床データを収集する機能も加わることになりました。
研究開発の早期段階における創薬支援
研究開発の早期段階における創薬支援策の一環としてAMEDが創設され、「産学官共同創薬プロジェクト」(GAPFREE)の仕組みが作られました。平成27(2015)年12月に採択された「GAPFREE 1」では、アカデミアと企業のマッチングという形で基礎研究がスタートしました。次いで、平成28年11月に採択された「GAPFREE 2」では、リバーストランスレーショナルリサーチ(rTR)を用いた創薬研究として、3課題が採択されました。
以下、若干の私見を交えて、この取り組みを例に産学連携への課題についてご紹介します(図3)。産学連携では、マッチングから採択まで最短で5ヵ月程度となっていますが、実際には十分な調整のための時間と人が必要です。また、本音の議論ができる場が必要です。さらに、長期的な視野をもつことと仲介役を立てることも大切です。仲介役については、まさにAMEDに担っていただきたいところであります。これらを踏まえ、各社とアカデミアがなにを目指したいか、どのようなデータを収集したいかを十分に話し合い、企業間の共同開発に資するとともに、アカデミアの能力を引き出せる協力のあり方が求められていると考えています。
 図3 産学連携への課題
図3 産学連携への課題
診察データの活用 -ビッグデータとレジストリ
診察データの活用については、本当になにが役に立つか今後詳細に詰めていく必要があります。クリニカル・イノベーション・ネットワークの背景には、世界的に医薬品・医療機器の開発コストが高騰している状況があります。一方、スウェーデンでは、ナショナルレジストリを活用した無作為化比較試験を実施し、1症例当たりのコストを50ドルに抑制しました。これを受けてわが国でも症例登録システムの検討が始められました。
わが国で考えられている症例登録システムは、(1)患者が、(2)どこに、(3)なにの疾患で、(4)どのような状態で存在しているか、を収集・記録するデータバンクと位置づけられます。
疾患登録システムの活用法としては、市場調査、患者リクルート、シングルアーム試験の対照群、市販後安全性調査等に有用であることはわかっていますが、実際にそれを薬事申請や承認に利用可能かどうかが重要で、データの信頼性を担保する方策が求められます。そこで現在、疾患登録システムに関するガイドライン案の作成を進めているところです。
医療システムの変革が求められるイノベーションへの対応
従来の製薬産業は、薬剤そのものを社会に送り出すという役割を担ってきました。今後は薬剤が患者さんに届く過程において、患者さんをどのように選定するか、どのような能力をもつ人がその過程で必要なのか、を検討しないと患者さんの手元に届かない時代になってきていると思われます。たとえば、分子標的薬を考える場合、患者さんをどのように選んでいくのか、そのうえでどの患者さんを対象とするのか、また、シークエンサーを用いてゲノム解析を行う場合、薬剤を投与するだけでなく遺伝子カウンセリングも必要ではないか等の患者さん周辺の条件を考慮できていないと、目の前の患者さんを本当に治療することはできないのではないかと考えています。まさに、イノベーションによってもたらされる変化の量と質を考えることが重要ではないでしょうか。産学官の連携は、特に革新的イノベーションを医療システムに導入するときこそ、重要だと考えられます。
パネリスト講演 イノベーション実現へのチャレンジ
サンバイオ株式会社 代表取締役社長 森 敬太 氏

再生医療新法がベンチャー企業に追い風
サンバイオは再生細胞医薬による損傷した脳や神経組織の再生に取り組むベンチャー企業として、2001年に米国サンフランシスコで創業したベンチャー企業です。私が16年前に立ち上げた際に目指したものは、新しい分野をヘルスケア領域の中で作り出していきたいということでした。そして、再生医療であればその目標が実現できるであろうと考えました。具体的には、中枢神経系、脳、脊髄、目の再生医療の開発事業化に取り組んでいます。
一般的に再生医療の夢は非常に大きいと認識されている一方で、いつ実現するのか、夢のような話で実現はかなり先だろうと考える方もいるようです。しかし、当社ではすでにヒトにおける臨床での有効性の確認(proof of concept)を確立するとともに、日本国内の大手製薬企業との提携も果たしています。ですから、そう遠くない将来に承認を得て患者さんに成果を届け、再生医療は現実的治療なのだということを示していけると考えています。
最近、後遺症をもつ脳梗塞患者に対するPhaseI/IIa試験の論文がまとまり、期待された結果が得られたことから、全米ネットワークのテレビニュース等で紹介されました。ニュースの画面から引用すると、対象となった女性患者さんは慢性期の脳梗塞で、発症後少なくとも6ヵ月が経過しているため、リハビリテーションの効果も限られる段階でした。治療前には四肢が動かず車椅子使用、構音障害もありました。治療後は四肢も動くようになり、構音障害も著しく改善したと本人が証言しています。
サンバイオの主な強みとして、以下の3つのことが挙げられます。1つ目は研究開発体制です。創業科学者として慶應義塾大学医学部長の岡野栄之先生に指導いただいているほか、再生医療の開発や製造過程におけるリーダー的存在の研究者・技術者を集め、米国と日本で研究、開発、製造開発を展開しています。
2つ目は、冒頭で触れましたように、誰もが受けられる再生医療を目指して他家移植によるアプローチを創業時から行っていることです。現在、量産化の体制を築いております。
3つ目は、これは私どもだけでなく日本企業共通の強みといえますが、2014年の薬事法の改正によりいわゆる“再生医療新法”が施行されて、市販までの期間が大幅に短縮されました。これは世界で最も進んだ最高の再生医療開発環境・事業環境であると考えられます。世界のベンチャー、再生医療事業者がうらやむ環境ではないでしょうか。前述の通り当社は米国で設立したのですが、現在は薬事法改正を機に環境の整った日本に戦略の中心を移し、再生医療分野におけるグローバルなリーダーを目指しています。
創薬イノベーションの中心はベンチャー企業
ベンチャー懇談会(医療のイノベーションを担うベンチャー企業の振興に関する懇談会)は、塩崎恭久厚生労働大臣の私的懇談会で、医療系ベンチャーのエコシステムを議論する場として設けられました。2015年12月から計10回開催され、2016年7月に報告書が出されました。その意図するところは、「医療系ベンチャーをイノベーションの牽引車に」ということで、規制から育成へ、慎重からスピードへ、マクロからミクロへ、が3つの柱となりました(図4)。すなわち、イノベーションを基本として、日本を、世界で最も優れた事業環境を備えた国にすることを目指して、世界で戦える制度作りを提言するというものでした。
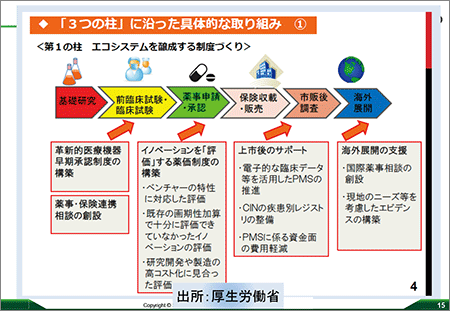 図4 「3つの柱」に沿った具体的な取り組み
図4 「3つの柱」に沿った具体的な取り組み
この提言の内容は、決してベンチャーだけを利するものではなく、製薬企業等新薬の開発に携わっている立場であれば、研究開発が促進されて良い形で世界展開が可能となり、産業全体に利益をもたらす制度だと考えています。
まとめられた報告書で最も重要だと思われるのは、「今後の医薬品・医療機器開発におけるイノベーションの中心はベンチャーである」という点ではないでしょうか。これについては、(1)欧米のメガファーマにおいては、分業化が進む中、ベンチャー由来の新薬が多数あること、(2)医療機器等の開発において、他分野の最先端技術を活用した異分野からの参入が進行していること、(3)日本では優れた基礎研究やものづくりの技術があるが医療系ベンチャーの活躍が限定的であること、等がその背景にあります。
イノベーション実現へのチャレンジ —サンバイオ ケーススタディ
最後に当社のケーススタディを通して、イノベーション実現への参考にしていただけたらと思います。
イノベーションの定義は種々ありますが、私自身は技術革新や画期的な方法で社会を大きくポジティブに変えてゆくことだと考えています。創薬イノベーションに限れば、基礎研究の成果を事業化して普及させ、多くの患者さんにその成果を届けることではないでしょうか。
事業化の実現の途上には多くのハードルと落とし穴があります。事業化の実現に向けた当社の例では、2001年に創業し翌年に関連特許を取得しています。2002~2004年にはベンチャーキャピタルから、合計で30億円の資金調達を行いました。次に自社で小規模な研究施設を開設し、2005年にGMPでの製造を開始しました。量産化しなければ普及しないためこの点にはこだわりをもって進めています。そしてビジネス面では、資金と販売網の確保のため、2009年に日本の製薬企業と提携、2010年には米国食品医薬品局(FDA)から治験許諾(IND)を得ました。時を同じくして米国企業との提携も果たしました。
そして、2011年に次のステップに進もうと考え、製造規模を拡大しております。この時点で事業化の目途が立ってきました。そして、2014年のヒトにおけるPOCの確立に伴い北米での提携が本格化し、共同開発、ライセンス契約の締結に至り販売網も確保できました。同時に後期臨床試験に向けた資金も得られ、現在米国で150名規模のphaseII/III試験を実施中です。
ベンチャー企業は研究開発のみでは経営の継続は難しく、製造も手掛ける必要があります。そしてビジネスとして資金調達や販売網の確保も必要です。こういったことをトータルにすべてやり抜くことが、事業化の実現であると考えています。このような事業展開は、アカデミアや大手製薬企業では困難な面があると思われ、そこにベンチャーが参入して、研究開発の橋渡しを行う必要があると考えています。
パネリスト講演 創薬イノベーションの実現
-より高い創薬力を発揮できる産業を目指して-
製薬協 畑中 好彦 会長

製薬産業の貢献
本日は、創薬イノベーションの実現に向けて最前線で取り組んでいる産業界の立場から、これまで進めてきた取り組みや今後の課題等について紹介します。
製薬産業は、さまざまな最先端の科学技術を取り込むことにより、革新的な医薬品を世に送り出してきています。そのスタートは、アスピリンのような天然物の医薬創出から始まり、その後低分子医薬、バイオ医薬、抗体医薬と、時とともにさまざまなモダリティを生み出してまいりました。世界の医薬品業界を見ると、新薬創出を行う国は10ヵ国程度と限られており、その中で日本は、米国に次いで世界第2位の新薬創出国となっています。
国内に目を転じて、主要製造業別の売上高研究開発費比率を見ると、他の製造業と比較して製薬産業は極めて高い水準の投資を行っていることがわかります。すなわち、製薬産業は医薬品を生み出すために長期にわたるリスクを取って積極的な投資を継続しているのです。
財団法人ヒューマンサイエンス振興財団が実施した医師を対象としたアンケート調査によると、2005年から2014年の10年間に患者さんの治療満足度が向上し、その向上に医薬品が大きく貢献していることがわかります。これは、製薬産業がアンメット・メディカル・ニーズに対する治療薬の開発を精力的に進めた結果であると推測されます。
さらに、医薬産業政策研究所の分析によると、新薬の登場により1995年から2008年までの13年間で、日本人1人当たり約0.5年の平均余命の延伸がみられ、これを経済効果に換算すると、9.8兆円の経済価値が創出されたと考えられます。革新的な医薬品は、患者さんの健康や医療の質の向上に貢献するのみならず、寿命を延ばすことにより経済価値を生み出し、国全体の成長にも大きく貢献するものであると、私どもは考えております。
製薬産業を取り巻く環境変化
近年、製薬産業を取り巻く環境は大きく変化しています。研究開発型製薬企業に共通する課題でもある、収益性の低下や創薬難度の上昇に直面しています。一方で、高齢化のさらなる進展に伴い、いまだ数多くのアンメット・メディカル・ニーズが存在していることに加え、科学技術やICT等の進歩、国の研究予算の一元化、新薬承認審査の加速化等、創薬イノベーションを促進する動きも見られます。
私たち製薬産業は、アンメット・メディカル・ニーズに応えるため、イノベーション促進の動きを的確に捉え、創薬の生産性の向上を図ることにより、革新的な医薬品を患者さんのもとに届け、国民全体の健康増進を通じて社会の期待に応える必要があると考えています。
製薬産業の目指すべき姿
前述した社会の期待に応えるため、私たち製薬協は10年後の製薬産業のあり方を展望し、製薬協およびその会員各社が目指すべき姿を明確にするため、「製薬協 産業ビジョン2025 世界に届ける創薬イノベーション」を取りまとめました。本ビジョンでは、(1)先進創薬で次世代医療を牽引する、(2)健康先進国の実現を支援する、(3)世界80億名に革新的な医薬品を届ける、(4)高付加価値産業として日本経済をリードする、という4つの使命を通じて、(5)志高き信頼される産業となる、の5本柱を打ち出しています。
特に私たちは、創薬イノベーションの実現に向けて、今後も研究開発への積極的な投資を継続し、アンメット・メディカル・ニーズに応える医薬品の創出を目指したいと考えています。たとえば、医療ビッグデータの創薬への活用や全世界から創薬資源と知恵を集約することによるトップレベルの創薬力の維持・向上、イノベーションの実現に必要な制度の構築や人材育成等に、これまで以上に積極的に取り組みます。
創薬イノベーション実現に向けた取り組み
創薬イノベーション実現のための大きな方向性の一つは、オープンイノベーションへの取り組みです(図5)。すなわち、従来の製薬ビジネスの中で行ってきた、大学、研究機関、医療機関、ベンチャー企業との連携と協働をこれまで以上に推し進めることに加え、従来の製薬ビジネスの枠を越えた多様な産業との協働あるいは新技術・サービスとの融合がオープンイノベーションのコンセプトです。今後はこのコンセプトなしには新薬創出は不可能ではないかと考えています。
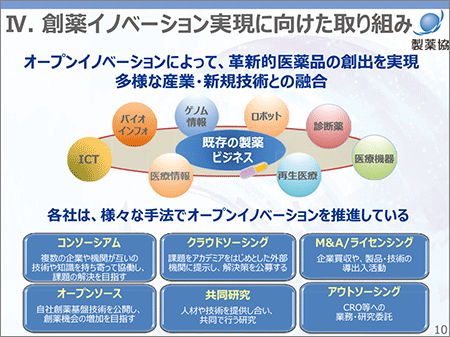 図5 創薬イノベーション実現に向けた取り組み
図5 創薬イノベーション実現に向けた取り組み
会員各社では、すでにオープンイノベーションに基づく取り組みを開始していますが、海外においてもこの傾向は見られ、その1例として世界のトップ製薬企業の多くが研究コンソーシアムに参加しています。
会員各社による取り組み事例では、製薬協加盟17社による大規模ライブラリ(Japan Compound Library Consortium、J-CLIC)の相互利用による効率的な化合物スクリーニング、会員3社共同によるバイオマーカーの基盤構築、医療ビッグデータの創薬・臨床研究への利活用等、各社がさまざまな手法でオープンイノベーションを推進しています。
今後も創薬イノベーションを推進していくうえで課題となるものは、以下のようなものと考えられます。創薬シーズの探索では、大学・研究機関から創薬シーズを公募する際の窓口の一元化や、さまざまな他産業や創薬ベンチャーとの連携強化が必要です。バイオマーカーの探索では、臨床サンプルの解析技術、解析のスペシャリストの育成あるいは提供が必要です。医療ビッグデータの活用では、各企業が保有する情報・技術・ノウハウの提供、生物統計家の育成等の環境整備への貢献が必要です。
私たちはこうしたさまざまな課題に対して、必要なリソースを共有することにより、産学官連携の一層の強化を図るとともに、イノベーション創出のための環境整備にも取り組んでいきます。
より高い創薬力を発揮できる産業を目指して
私たち研究開発型の製薬産業は、革新的な医薬品の創出を通じて、患者さんにその成果を届けて医療の質の向上とそれを通じた社会や経済への貢献を果たしたいと考えています。それが私たちの使命であり、活動のベースとなるものでもあります。
そして、私たちが長期間にわたるリスクを取り、より高い創薬力を発揮できる産業へと進化を遂げ、将来にわたって使命を果たしていくためには、イノベーションを生み出すための環境整備とイノベーションが適切に評価される仕組みの2つが必要であると考えています。
引き続き、ステークホルダーのみなさんとの対話を続けながら、その実現に取り組んでいきます。
パネルディスカッション
-
コーディネーター
慶應義塾大学医学部医療政策・管理学教室
教授 宮田 裕章 氏 -
パネリスト
日本医療研究開発機構 理事長 末松 誠 氏
厚生労働省医政局 研究開発振興課長 森光 敬子 氏
サンバイオ株式会社 代表取締役社長 森 敬太 氏
製薬協 畑中 好彦 会長
製薬産業のこれまでの貢献
 慶應義塾大学医学部医療政策・管理学教室
慶應義塾大学医学部医療政策・管理学教室
教授の宮田 裕章 氏
- 宮田
- 第1部では、日本の創薬開発を推進するうえで好ましい流れとなる日本医療研究開発機構(AMED)による研究費の運用ルールの見直し、最終的には"患者さんの手元へ"を念頭に、創薬開発支援に取り組む厚生労働省の姿勢が示されました。他方、創薬開発の軸としてのベンチャー企業の実績と将来性、医療の質、患者満足度、コスト、スピードを意識した創薬開発のための連携といった製薬協のビジョンをうかがうことができました。これらの点を踏まえ、パネリストの方々と議論していきたいと思います。
まず、これまでに製薬企業が果たしてきた貢献について、改めてうかがいたいと思います。 - 畑中
- 私たち製薬企業は、そのときどきで最先端の科学技術を取り込み、既存の知識と融合させながら新薬を開発してきました。その結果、日本は世界第2位の新薬創出国に位置づけられるようになりました。
- 宮田
- これまでの新薬開発における製薬企業の貢献について議論の余地はないと思われますが、昨今はベンチャー企業の存在が重要性を増しているように感じます。
- 森
- ベンチャー企業は、今や創薬イノベーションの中心になっていると自負していますが、それは後期臨床試験の段階で協力いただく既存の製薬企業の存在があって初めて実現できたことだと捉えています。
医薬品の価値の変容に対する取り組み
 日本医療研究開発機構
日本医療研究開発機構
理事長の末松 誠 氏
- 宮田
- 今お話しいただいたように、これまでの新薬開発における製薬企業の貢献は多大なものがありますが、昨今、医薬品の価値が変容してきたように見えます。AMEDが重視しているのはどのような点でしょうか。
- 末松
- AMEDは「創薬」、「医療機器」に次ぐ第3のコアとして「Medical Arts」の領域を創出しようと考えています。「MedicalArts」とは、これまで研究費配分の対象としての公募がほとんど行われてこなかった無形の医療技術のことで、その開発や医療を支援するソフトウエアの開発を目指しています。そして、この3つのコアを支援するうえで重要なポイントの一つが、費用対効果の評価であり、それに応じて研究費を配分することにあるということです。これからの医薬品価値の主要な尺度の一つが費用対効果であり、AMEDはこれを研究費配分の判断に採り入れ、定着させようと考えています。
- 宮田
- 本セミナーの冒頭で製薬協の伍藤理事長が述べられた、「イノベーションと持続可能性の両立」も時代の要請だと思います。新薬は世に出して終わりではなく、誰がどのように使い、どのような効果を得ているか、実態を把握し、たとえば、薬価改定においても引き下げ前提ではなく、従来に比較し、早期に治癒するのであれば加算を考慮するという動きもあると聞いています。厚生労働省は、医薬品の価値の変容を業務にどのように反映させようとお考えなのでしょうか。
- 森光
- 一連の治療の中でどのような重みをもつか、役立っているか、医薬品の価値とは患者さんが病気にかかってから通常の生活に戻るというプロセスにおけるこれらの点にあると考えています。厚生労働省が2015年に提案したアカデミアと企業との協働スキームであるクリニカル・イノベーション・ネットワーク(CIN)は、基本的には新薬開発費用の引き下げを目的としていますが、これが機能して基盤整備が進めば開発期間が短縮し、患者さんの手元に新薬をより早く届けることが可能になります。
- 宮田
- 価値観が多様化する中で、持続可能性という観点も交えた創薬が求められている一方、稀少疾患の治療薬の開発が重要な課題となっています。開発できたとしても企業の収益に結び付かない可能性の大きい稀少疾患治療薬について、AMEDではどのように考えているのですか。
- 末松
- 稀少がんを含む稀少疾患、あるいは多剤耐性菌(AMR)に有効な薬剤を民間の製薬企業が研究開発の対象にしづらいのは事実です。これを公的な資金で後押しするのがAMEDの基本スタンスです。
- 宮田
- 畑中会長は、稀少疾患の治療薬開発に携わった経験をおもちだとうかがっています。
- 畑中
- 私どもの会社では、患者数が日本全国で一桁台という稀少疾患の治療薬開発を経験しています。これは未承認薬開発促進スキームに従って行ったものです。私どもの会社だけでなく、製薬協加盟各社が協力して積極的に取り組んだ結果であり、ここ数年は学会等の要望にも応えられるようになっています。このような状況にはあるものの、一般論として、一企業では取り組みきれない新薬開発については官と民のパートナーシップや公的資金提供、あるいは研究開発が継続できる形でのインセンティブが必要だと考えています。
創薬イノベーションにおける日本の強みと弱み
 サンバイオ株式会社
サンバイオ株式会社
代表取締役 社長の森 敬太 氏
- 宮田
- 森社長は、2014年の薬事法改正を機に本社を米国から日本に移転させたとのことですが、この日本の環境変化は患者さんにとってどのような意味をもつとお考えですか。
- 森
- 2014年薬事法改正の重要なポイントの一つは、「再生医療等製品の条件及び期限付承認制度の創設等の所要の措置」を講じたことです。この法改正により再生医療製品の開発期間が半分以下に短縮され、患者さんの手元により早く製品が届けられる可能性が出てきました。現在、弊社が日本と米国とで開発治験を行っている製品は、おそらく世界に先駆け日本で最初に承認されることになると予想しています。
- 宮田
- 再生医療製品については、法的整備の中で速やかな承認が可能になったということで、これは創薬イノベーションにおける日本の強みと言えます。他方、末松理事長のご講演にありましたScience誌の指摘のように、この国には「Balkanization」という弱みがあるのも事実のようです。パネリストのみなさんは、創薬イノベーションにおける日本の強みと弱みをどのように捉えているのでしょうか。
- 末松
- 日本の一番の強みは、臨床現場で医師が正確な医療データを誠実かつ厳格に収集し蓄積していることです。一方、最大の弱点はそれを日本語で行っていることです。
- 宮田
- 確かに、使用言語は大きな問題です。森光課長はどのように捉えていらっしゃいますか。
- 森光
- 極めて層の厚い基礎研究が日本の強みだと考えています。ただ、その強みを臨床研究に活かしきれていない。厚生労働省にとっても日本の臨床研究の底上げは重要な課題であり、支援体制に対して批判を受けているところです。ただ、諸外国に比べ、日本の実際の臨床現場の質は高いレベルにあり、かつ均質です。これは大きな潜在的優位性だと考えています。
- 宮田
- 基礎研究でしか博士号を取れないという状況が、臨床研究や応用研究の弱体化を生んできた要因の一つだと思います。森社長、米国との比較においてどのようにお考えですか。
- 森
- 弊社が当初米国を拠点としたのは、2001年当時、革新的な治験を行える環境が日本になかったからです。シリコンバレーで開発治験に着手したところ、日本の技術の高さについて現地の研究者から賞賛を受けました。その流れで開発、製造、販売を、米国を拠点に行っていたのですが、先ほども申し上げたように、2014年に薬事法が改正され、早期承認という点での米国の優位性はなくなりました。なお、「Balkanization」は日本特異的な弱みではないと考えています。その存在は、ベンチャー企業が強みを発揮するうえでむしろ有利な環境と捉えています。
- 宮田
- ベンチャーの覚悟を実感するお話しをいただきましたし、そのような企業をどのように取り込み育成するかということも、日本の創薬イノベーションにおける大きな課題の一つだと感じました。畑中会長、日本に創薬開発の障害があるとすれば、それはなんでしょうか。
- 畑中
- 4~5年前までは、変化に対する環境整備に多少の遅れがあったようにも思いますが、製薬業界内におけるコンソーシアムや連携構築、AMEDによる支援、法改正等により、現時点では諸外国との間に大きな差はなくなっていると考えています。弊社の状況を見ましても、かつてはほとんどが米国の企業であった提携先が、今では半数以上を日本のベンチャーを含めた製薬企業あるいはアカデミアが占めています。
日本の製薬企業の創薬イノベーションにおける戦略
- 宮田
- グローバルには、ビッグファーマ同士が分野を決めすみ分ける戦略を採る状況が見受けられます。それに対して、日本の製薬企業はどのような策を模索しているのでしょうか。
- 畑中
- 欧米のビッグファーマの状況を見ますと、合併による企業体力増大の後、宮田先生が指摘されたように主要な領域を分け合う動きがあります。しかしながら、それが創薬イノベーションにおける必要十分条件ではないことは、結果が如実に示しています。もちろん最終的には個別の企業が判断することですが、製薬協としては企業連携を含めて柔軟に対応していきます。
- 宮田
- 企業連携は日本の強みの一つであり、グローバルなビッグファーマに追随する以外にも道があることがよく理解できました。
創薬イノベーション推進戦略
 厚生労働省 医政局
厚生労働省 医政局
研究開発振興課長の森光 敬子 氏
 製薬協の畑中 好彦 会長
製薬協の畑中 好彦 会長
- 宮田
- では、創薬イノベーションをどのように推進するかについての議論に移りたいと思います。末松理事長から、中央倫理・治験審査委員会(central IRB)の整備が平成29(2017)年度のAMEDの活動のポイントに挙げられました。この点について、会場から"効率化と質の担保を両立させることが困難になるのでは"という懸念が寄せられています。
- 末松
- そのご懸念は当然あると思います。倫理審査委員会の中央化が最も進んでいるのは英国で、日本と米国は遅れていました。しかし、米国は2016年1月に改正コモンルールができ、パブリックコメントも終了、今年の5月には一括審査が義務化される見通しです。日本は未整備ですが、現在は施設ごとに行われているIRBを集約していく方向で検討しています。いきなり日本全体でというわけにはいかないので、主要な大学の倫理審査委員会に参加してもらい、侵襲性の高い治療の開発治験やゲノム情報を含む観察研究を手始めに、その後、対象研究の範囲を徐々に広げていく方針で臨んでいます。インフォームドコンセントの文書統一化も、その一環として行っています。一方で、会場から懸念が呈されたように、質の担保をおろそかにはできません。これは作業を進めながら確立していくしかないと考えています。
- 宮田
- Central IRBの審査基準をどのようなものにするか、その運用をどうするかが重要なポイントですが、チェックの統一化は研究開発の質向上につながると思われます。もう1つ、会場から出資金事業について説明を追加していただきたいというご要請がありました。
- 末松
- AMEDでは、「産学官連携による創薬・医療機器開発の推進に向けた出資金事業(550億円)」として、2017年3月中旬から下旬に公募を開始することにしています。事業名は、「医療研究開発革新基盤創成事業~Cyclic Innovation for Clinical Empowerment(CiCLE)~」です。事業の代表機関がAMEDとの間で複数年(原則として最長10年)の契約(1億~100億円)を結び、事業終了後15年かけて返済するという内容になっています。健康医療戦略上の国策として重要な課題、製薬企業が手を出しにくい稀少疾患やAMRといった分野を対象に、柔軟な資金提供を目指しています。
- 宮田
- 本日ご出席の企業の方々には、ぜひ、活用を考えていただきたいですね。CiCLEの中でも例示されていますが、産学官連携が創薬イノベーションに必須であることは、本セミナーにおいても繰り返し確認されました。他方、厚生労働省は立場上なかなか難しい舵取りを迫られていると推察されます。
- 森光
- おっしゃる通りで、私の所属部署名は「研究開発振興課」ですが、安全性の確保のために規制をかけるという、名称とは一見相反する機能ももっています。ただ、産学官連携を進めるにあたって、国の支援策を1つにまとめていくことが厚生労働省の重要な役割だと認識しています。
- 宮田
- 研究開発に対し、安全性を担保しつつアクセルを踏む支援をするというのが厚生労働省の目指す方向なのですね。さて、森社長は、創薬イノベーション推進戦略にどのようなことを期待されますか。
- 森
- 新しいものを開発する段階で、正解を知っている人間はいないと思います。産学官連携においても同様で、立場が同列だと進まないと考えています。誰かが牽引しなければ前に進まない。その誰かは、創薬開発においてはベンチャー企業だと思います。もちろん大企業が牽引車になれないわけではありません。たとえば、社長直轄のタスクフォースを作るといった方法がありますが、ベンチャーのほうが適任です。
- 宮田
- 森社長が言及されたように、産学官連携においても、既存の製薬企業やビッグファーマゆえに可能なことがあります。たとえば、保有する成分をre-positioningしたうえで連携による可能性を見いだし、創薬につなげるといった戦略ですが、畑中会長はどのようにお考えですか。
- 畑中
- 産学官連携を考えた場合、誰がどこでリスクを取るかが重要になると思います。従来の製薬企業は、すべてのリスクを取りながら研究の上流から販売まで自社内で完結してきました。個別の企業で取り切れないリスクである場合は開発を断念してきました。しかし、これからはリスクを同業者、ベンチャー企業、アカデミア、あるいは官にも負ってもらうことで、以前なら不可能と考えたイノベーションが起こせるというイメージをもっています。
- 宮田
- 産学官連携において、製薬協はどのような形でリーダーシップを発揮されるのでしょう。
- 畑中
- かつて、日本の製薬企業はどこも同じようなことを行っていましたが、今では独自性を出しながらも、少なくとも製薬協加盟企業は日本を創薬イノベーション基地にするための環境を作るという同じ方向を見ています。そのために、業界内での取り組みにとどまらず、医療にかかわる諸課題に対する製薬協の立ち位置を明確にしたうえで、行政に対しても意見を述べていこうと考えています。
インセンティブ確保と人材の育成
- 宮田
- 末松理事長、AMEDの創薬イノベーション推進戦略について、なにか付け加えておくことはありませんか。
- 末松
- CiCLEの出資金は、年度という切れ目なしに使えますので、必要な人材の育成のための活用が可能になると思います。もう1つ付け加えておきたいのは、畑中会長も触れられましたが、インセンティブです。研究開発の成果として効率化が図られたとします。ここでの効率化は費用対効果の向上や劇的な改善効果等を意味し、その評価に基づいて関係者に還元されるものがインセンティブです。AMED内では、この仕組みを「政策パッケージ」と称し、インセンティブとしては新規研究費予算の確保、データ保護期間の延長、備蓄を見据えた製品購入等を各省とも相談のうえ検討しています。
- 宮田
- 欧州連合では、開発された製品が社会貢献を果たした場合、出資金の返済が免除される「Social Impact Bond」という制度を導入しているようです。私がかかわる研究チームは、価値のあるデータの収集が継続できる環境を作るために、在院日数を劇的に短縮できるような治療法に対してインセンティブを設ける方法について研究しています。また、人材育成というお話しがありました。この点について、パネリストの方々のご意見をうかがいたいと思います。
- 森光
- 厚生労働省は、治験中核病院や臨床研究中核病院を認定し整備していますが、その質を支えるのは人ですので、人材育成の重要性はよく認識しています。どのような育成支援ができるのかについては、目下検討中です。
- 森
- ベンチャー企業としては成功事例を積み重ね、1人でも多くの参画者を募ることが人材育成につながると考えています。
- 宮田
- 起業に興味のある日本の学生の割合が、米国に比べて絶望的に低いという調査結果があると聞いています。森社長がベンチャー企業を立ち上げたきっかけはどのようなものだったのですか。
- 森
- もともと社内ベンチャーを立ち上げようと考えてビール会社に就職したこともあり、米国でベンチャー企業の活動を見ているうちに自分で作ってみようという気持ちになりました。
- 宮田
- 製薬企業にはさまざまな人材がいて、これからはMRの役割も変容していくように思われますが、人材育成についてはどのようにお考えですか。
- 畑中
- イノベーションの創出においては、人材育成と同時に個人や組織のマインドセットも重要だと考えています。これを企業として整えたうえで産学官連携を通じてさまざまな人材と接触していけば、その方々との相違を理解し、柔軟に対応し、最終的にはマネジメントできる人間に育つと考えています。
- 宮田
- 相互交流が人を育てるということですね。
- 末松
- 英国は、人件費に70%を充てることを条件にした10年間にわたる資金提供を通じて、特定領域に極めて詳細な知識をもつ200名の医療情報専門のマネジャーの育成に成功しました。日本も英国を見習い、大学の人事制度改革を促すような資金提供が進められるべきだと思っています。
高度な創薬力をもつうえで必要なこと
- 宮田
- 最後に、創薬イノベーションが可能な製薬産業の将来像についてうかがいます。
- 末松
- 日本には、世界を席巻している物作りの技術が溢れています。創薬においてそのようなテクノロジーの延長線上に登場する新技術を活用できれば、ビッグファーマが成し得ていない画期的な薬剤、たとえば高分子の生物学的製剤等を培養ではなく完全な化学合成によって作ることも可能だと考えています。日本の製薬企業が製薬に固執せず、他業種であっても高度な技術を保有する企業と組むことができれば、このような創薬を生み出すことも夢ではない。そうなることを大いに期待しています。
- 森光
- これまでのイノベーションのほとんどは、眺めの違うところから湧いてきました。創薬も同じだと思います。その眺めの違う場所にある技術が創薬に活かされる環境を整える、あるいはお互いに眺めの違う場所にいる研究者同士の議論の場を設けるために何ができるか、厚生労働省としても支援のあり方を模索していきたいと思います。
- 森
- ベンチャー企業としてはこれまで以上に結果を出し、企業数を増やし、規模を拡大することが重要だと考えています。敢えて日本の強みや弱みを意識せず、特定のカテゴリーの制覇を目指せば、創薬の世界でビッグファーマにも伍していけると思います。
- 畑中
- 進歩を続ける科学技術を柔軟に取り込んでいくことが、創薬イノベーションにつながると考えています。日本の状況を悲観的に見る向きもありますが、他に類を見ない高齢化の進展により世界で最初に超高齢社会を体験し、一方で国民皆保険というユニークな制度を有することが、世界に向けて大きな革新を発信するうえで極めて有利な環境と捉えることも可能です。私ども製薬協は、この柔軟な考えのもとで創薬イノベーションを実現していきたいと考えています。
- 宮田
- 創薬イノベーションと製薬産業の将来像について、患者さんあるいは社会にとっての価値という視点を交えてディスカッションしてきました。その中でキーワードとなったのが「連携」です。日本の製薬企業における連携は諸外国にはない強みであり、製薬以外の業種にもその範囲を広げていくことが、この強みを創薬の世界においてさらに磨くことにつながると思います。新薬の開発・製造・販売にとどまらず、持続可能性をもって社会システムとも連携し、開発コスト、費用対効果といったシステムイノベーションを起こし得るビジネスモデルを確立できれば、海外のビッグファーマとも十分に戦えるということを確信しました。
貴重なご発言をいただいたパネリストの方々に深謝いたしまして、パネルディスカッションを閉じたいと思います。

