政策研のページ アンメット・メディカル・ニーズに対する医薬品の開発・承認状況 —2022年の動向—
公益財団法人ヒューマンサイエンス振興財団による2019年度の治療満足度調査をもとに、60疾患に対する2022年5月末日時点での日本における新薬の開発パイプライン数と直近3年間の60疾患に対する新薬承認品目数を調査しました。また、近年の調査で開発品目数が最も多い『肺がん』について、その薬物治療の変遷を新薬の承認数の推移、治療満足度、および薬剤貢献度の推移との関連性とともに振り返りましたので、その内容について報告します※1。
-
※1医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発・承認状況 —2022年の動向—」政策研ニュース No.66(2022年7月)
1. はじめに
政策研では、公益財団法人ヒューマンサイエンス振興財団(以下、HS財団)による医療ニーズに関する調査結果※2をもとに、新薬の承認および開発パイプラインに関するデータを集計し、アンメット・メディカル・ニーズに対する製薬企業の取り組み状況を継続的に分析しています※3※4。
前回の政策研ニュースNo.61(2020年11月)では2019年度の治療満足度調査の結果に基づき、60疾患に対する2020年8月末時点での開発パイプライン数を示すとともに、2019年度の調査において新たに60疾患に加わった8つの疾患について、既承認薬の情報および選抜5疾患の国内開発状況について報告しました※5。本稿では2019年度の治療満足度調査をもとに、最新60疾患に対する2022年5月末日時点での開発パイプライン数、2019年から2021年までの3年間の60疾患に対する新薬承認品目数の調査結果を報告するとともに、近年の調査で開発品目数が最も多い『肺がん』について、その薬物治療の変遷を新薬の承認数の推移、治療満足度、および薬剤貢献度の推移について、その関連性も含めて振り返ろうと思います。
-
※2HS財団「2019年度 国内基盤技術調査報告書 -60疾患に関する医療ニーズ調査(第6回)-」等。HS財団は2021年3月末をもって解散しました。本医療ニーズ調査などの研究事業は明治薬科大学社会薬学研究室において引き続き実施されることになっています。
https://u-lab.my-pharm.ac.jp/~soc-pharm/achievements/ (参照日:2022年6月5日) -
※3医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発・承認状況」政策研ニュースNo.31(2010年10月)、No.34(2011年11月)、No.38 (2013年3月)、No.52(2017年11月)、No.59(2020年3月)。
-
※4医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発状況」政策研ニュースNo.41(2014年3月)、No.45(2015年7月)、No.61(2020年11月)。
-
※5医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発状況」No.61(2020年11月)
https://www.jpma.or.jp/opir/news/061/09.html (参照日:2022年6月5日)
2. 治療満足度別にみた新薬の開発状況
図1は2019年度HS財団調査における治療満足度※6(横軸)、薬剤貢献度※7(縦軸)に沿って疾患をプロットし、今回調査した開発品目数※8を円の大きさおよび数値で示したものです。前回調査と同様の製薬会社20社※9の2022年5月末日時点における国内開発品目(フェーズI~申請中)を集計対象としました※10。該当の開発品目数は330件※11であり、そのうち新規有効成分(NME※12)の数は126件(38%)でした。調査対象の一部企業においてウェブサイト上の公表ステージをフェーズIII以降からフェーズII以降へ変更した影響が含まれていますが、前回の調査時と比べ60疾患の開発品目数は46品目増加し、そのうちNME数は4品目増加しました。治療満足度が50%以上かつ治療に対する薬剤貢献度50%を示す領域、いわゆる第1象限の開発品目数割合が78.2%(前回は79.6%)であり、前回調査から微減したものの前回調査と同様に今回調査においても開発品の多くの割合を占めていることがわかりました。第2、4象限の開発品目数についてはそれぞれ4.2%、9.1%と前回とほぼ変わらない割合でした(前回はそれぞれ4.6%、8.8%)。治療満足度、薬剤貢献度がともに50%以下の領域(第3象限)の開発品目数割合は8.5%であり、前回の7.0%から1.5%の微増でしたが、品目数としては20品目から28品目へ増加しました。
-
※6HS財団の医療ニーズ調査では、アンケート回答の4つの選択肢(十分に満足/ある程度満足/不満足/治療が行えているとはいえない)のうちの「十分に満足」と「ある程度満足」を合計した割合(%)を治療満足度としています。
-
※7HS財団の医療ニーズ調査では、アンケート回答の4つの選択肢(十分に貢献/ある程度貢献/あまり貢献していない/効く薬がない)のうちの「十分に貢献」と「ある程度貢献」を合計した割合(%)を治療に対する薬剤の貢献度としています。
-
※8各疾患の該当にあたっては、当該疾患ならびに当該疾患に起因する疾患、また当該疾患の予防につながるものも含めています。
-
※9対象企業はアステラス製薬、アストラゼネカ、エーザイ、大塚製薬、小野薬品工業、グラクソ・スミスクライン、協和キリン、サノフィ、塩野義製薬、住友ファーマ、第一三共、武田薬品工業、田辺三菱製薬、中外製薬、日本イーライリリー、日本ベーリンガー・インゲルハイム、ノバルティスファーマ、バイエル薬品、ファイザー、MSDです。
-
※10データソースは各社ウェブサイト・決算資料、製薬協ウェブサイト、「明日の新薬」(テクノミック)を用いました。ただし、上記3つのデータソースで「明日の新薬」のみに記載されている開発パイプラインは加えていません。
-
※1160疾患に該当する複数の効能を対象にした試験がありますが、疾患別にそれぞれカウントしました。
-
※12ここでいうNMEとは、厚生労働省薬事食品衛生審議会部会審議品目または報告品目において、新有効成分含有医薬品、新効能医薬品、および新再生医療等製品として承認される可能性のある品目のうち「新有効成分含有医薬品」と「新再生医療等製品」に相当するものを対象としました。
図1 治療満足度・薬剤貢献度(2019年度)別にみた開発件数(2022年5月末日時点)
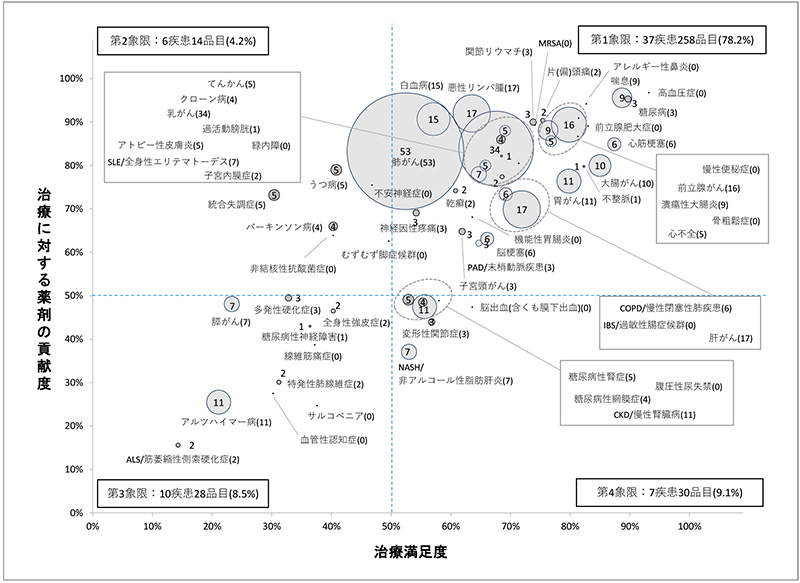
注:数字(かっこ内含む)は該当新薬の開発件数を示します。
出所:HS財団による調査結果、各社公表情報、製薬協ウェブサイト、明日の新薬をもとに医薬産業政策研究所にて作成。
増加した46品目のうち、がん疾患関連のものが40品目であり、前回調査で50%だった60疾患開発品目数に占めるがん疾患の開発品目数割合が55%(183/330)に増加しました(図2左)。また、がん疾患の開発品目数に占めるNMEの割合は前回調査で31%(44/143)だったものが27%(49/183)に低下しました。すなわち、増加した40品目のうち5品目がNME、35品目が効能追加(用法・用量追加を一部含む)ということであり、ある特定のがん疾患で開発されているものが、同一がん疾患の他の適応へ、あるいはその他のがん疾患への応用が展開されていることが示唆されました(図2右)。
図2 60疾患における開発品目の概略(左:60疾患に占める10がん疾患品目数、右:10がん疾患に占めるNME品目数)

注:NMEには遺伝子治療、細胞治療といった承認時に新再生医療等製品に分類されるものも含みます。
出所:HS財団による調査結果、各社公表情報、製薬協ウェブサイト、明日の新薬をもとに医薬産業政策研究所にて作成。
先に述べましたが前回調査と同様に今回調査においても、治療満足度、薬剤貢献度がともに50%以上の領域、いわゆる第1象限の開発品目数割合が78.2%であり開発品の多くの割合を占めていました。60疾患のうち第1象限に含まれる疾患の比率が61.7%(37/60)であることを考慮しても本領域に含まれる開発品目数(78.2%)はかなり多いといえます。これに関しては前回のニュース(政策研ニュースNo.61(2020年11月)でも記載しましたが、60疾患中の10疾患ががん疾患であり、膵がん以外のがん9疾患が第1象限に含まれています。また、がんは遺伝子の変異で起こる疾患であり、遺伝子の変異にはさまざまなタイプがあることから、「○○がん」という1疾患がさまざまな適応で細分化されており、それに合わせて治療薬の開発がなされているものが多いことなどから、がん9疾患が含まれる第1象限の新薬開発品目比率が高くなっていると考えられます。
治療満足度、薬剤貢献度を示すパーセントがともに50を超えているとしても、その満足度、貢献度の内訳は「ある程度満足(貢献)」が「十分に満足(貢献)」を大きく上回っています。また100に至っていない残りのパーセントの多くは「不満足」「あまり貢献していない」ですが、中には「治療が行えているとはいえない」「効く薬がない」との回答も含まれています。たとえば第1象限に含まれるがん9疾患について、「不満足」と回答された割合の平均は25.1%(11.7~42.1)、「治療が行えているとはいえない」は平均6.2%(3.3~9.8)、「あまり貢献していない」は平均16.5%(6.0~31.8)、「効く薬がない」は平均2.4%(0.9~4.9)です※13。このようなことから、たとえ第1象限にある疾患であっても、まだまだ医薬品が疾患治療に貢献できる余地は十分にあり、かつ、それが求められていると考えられます。
60疾患における開発品目数を疾患別に見ていくと、多い順に「肺がん(53)」「乳がん(34)」「悪性リンパ腫(17)」「肝がん(17)」「前立腺がん(16)」「白血病(15)」と続き、7番目に「胃がん(11)」「CKD/慢性腎臓病(11)」「アルツハイマー病(11)」(数字は品目数)となっており、開発品目数の上位はがん疾患で占められていることがわかりました。「肺がん」に関しては2014年1月時点の調査(政策研ニュースNo.41(2014年3月))以降、開発品目数が60疾患の中で最も多い疾患であるという調査結果が続いています※14。
-
※13がん9疾患それぞれの「不満足」「治療が行えているとはいえない」「あまり貢献していない」「効く薬がない」の割合を平均した値です。なお、第3象限に位置する「膵がん」の「不満足」「治療が行えているとはいえない」「あまり貢献していない」「効く薬がない」の割合はそれぞれ60.0、16.7、38.5、13.5%でした。
-
※142011年6月、2013年1月時点の調査(政策研ニュースNo.38(2013年3月))では、「糖尿病」が1番目に多く、次いで、2、3番目として「肺がん」または「乳がん」と続いていました。
3. 治療満足度別にみた新薬の承認状況
図3は2019年度HS財団調査における治療満足度(横軸)、薬剤貢献度(縦軸)に沿って疾患をプロットし、直近3年(2019~2021年)に日本で承認された新医薬品※15のうち、60疾患への適応をもつ新薬の承認件数を円の大きさおよび数値で示したものです。当該期間での承認件数は294製品、うち60疾患に関するものが133品目(130製品)でした※16。このうち、NMEは新有効成分含有医薬品として53品目(52製品)、新再生医療等製品として6品目(5製品)でした。133品目のうち、内資系企業による承認取得は54品目(54製品)、外資系企業による申請は79品目(76製品)でした※17。
-
※15厚生労働省薬事食品衛生審議会部会審議品目または報告品目における新有効成分含有医薬品、新効能医薬品、および新再生医療等製品として承認された品目を集計の対象としました。
-
※161製品で2つ以上の適応症がある場合はそれぞれを1としてカウントしています。
-
※17申請当時合弁会社であったアステラス・アムジェン・バイオファーマの1件は、2020年4月1日よりアムジェン株式会社になったため、外資系企業に加えました。
図3 治療満足度・薬剤貢献度(2019年度)別にみた新薬の承認件数(2019~2021年)
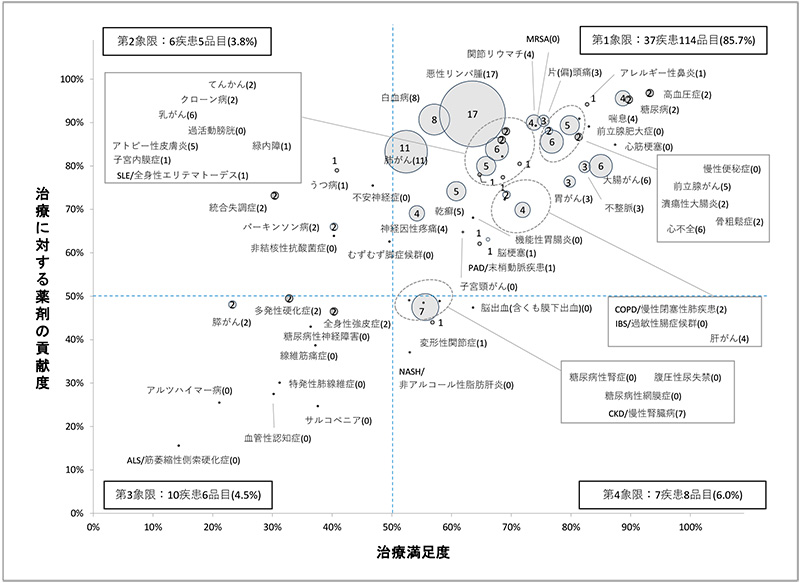
注:数字(かっこ内含む)は該当新薬の承認品目数を示します。60疾患のうち異なる2疾患に同一薬剤が承認された場合は別々にカウントしています。
出所:審査報告書、明日の新薬、各薬剤添付文書をもとに医薬産業政策研究所にて作成。
60疾患に関連する承認品目数を象限別に見ていくと、先の開発品目数の分析と同様に治療満足度および薬剤貢献度がともに50%以上である第1象限に含まれる疾患の承認品目が85.7%(114/133)と大部分を占めていました。第1象限に位置する37疾患で114品目の新薬が承認され、1疾患あたり3品目、すなわち1年に1品目の割合で承認されている計算となりました。
一方、第2、3、4象限に含まれる疾患の承認品目数はそれぞれ3.8%(5/133)、4.5%(6/133)、6.0%(8/133)でした。これら3つの象限に位置する23疾患で19品目の承認となりましたが、そのうちの15疾患はこの3年間で承認された品目が0でした。
なお、60疾患に関連する承認品目数を疾患別に見ていくと、多い順に「悪性リンパ腫(17)」「肺がん(11)」「白血病(8)」「CKD/慢性腎臓病(7)」「大腸がん(6)」「乳がん(6)」(数字は品目数)でした。
今回の承認件数の調査で特徴的だったことの1つ目として、60疾患に関連する承認品目に新再生医療等製品が複数含まれていたことが挙げられます。2015年に心不全の治療に使用されることを目的にハートシート(R)『ヒト(自己)骨格筋由来細胞シート』が条件および期限付承認されましたが、それ以降では60疾患に関連する品目の承認はありませんでした。2019年から2021年の間に、新再生医療等製品9製品が承認されましたが、そのうちの6品目(5製品)が60疾患にかかわるものでした。具体的には、CAR-T細胞療法用としてキムリア(R)『チサゲンレクルユーセル』(白血病、悪性リンパ腫)、イエスカルタ(R)『アキシカブタゲンシロルユーセル』、ブレヤンジ(R)『リソカブタゲン マラルユーセル』(ともに悪性リンパ腫)、およびヒト間葉系幹細胞としてアロフィセル(R)『ダルバドストロセル』(クローン病)が承認され、遺伝子治療用としてコラテジェン(R)『ベペルミノゲンペルプラスミド』(末梢動脈疾患(PAD))が条件および期限付承認されました。これら6品目(5製品)はいずれも第1象限領域に位置する疾患に対する治療薬であり、その他3つの象限に位置するものではありませんでしたが、前者4製品は「希少疾病用再生医療等製品」に指定された後に承認された製品であり、後者コラテジェン(R)は末梢動脈疾患の「閉塞性動脈硬化症」のほかに「バージャー病」という指定難病における潰瘍の改善に適応をもつ製品でした。
従来型の低分子医薬品、バイオ医薬品としての抗体医薬品、組換えタンパク製剤医薬品に加え、核酸医薬品、遺伝子細胞治療等さまざまなモダリティが選択肢として加わり、これまで治療困難であった疾患に対する治療法が増加したことで、今後さらなる治療満足度・薬剤貢献度の向上が期待されます。
2つ目の特徴としてはがん疾患の承認品目数の多さです。図4は2009年以降に承認された最新60疾患に関する新医薬品のうち、がん疾患(10がん疾患)が占める割合を2009~2011年の3年間、2014~2016年の3年間、および直近2019~2021年の3年間に分けて示したものです。
図4 60疾患承認品目に占めるがん10疾患の割合の推移
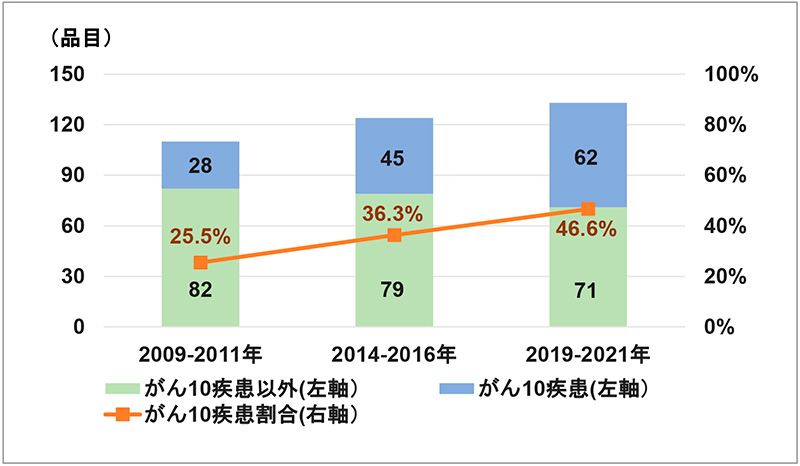
注:数字は該当新薬の承認品目数を示す。60疾患のうち、異なる2疾患に同一薬剤が承認された場合は別々にカウントしています。
出所:審査報告書、明日の新薬、各薬剤添付文書をもとに医薬産業政策研究所にて作成。
2009~2011年、2014~2016年、2019~2021年の各3年間における60疾患に関連する承認品目はそれぞれ110、124、および133品目でしたが、それに対してがん10疾患の新薬承認件数はそれぞれ28、45、および62品目であり、割合にするとそれぞれ25.5、36.3、および46.6%と年を追うごとに増加し、直近3年間では60疾患における承認品目の約半数ががん10疾患によるものでした。
4. 肺がんの薬物治療の変遷
2022年5月末日時点の国内20社の開発品の調査において、最も品目数の多かった肺がんの薬物治療について、60疾患に関する治療満足度と治療に関する薬剤貢献度の推移とともに振り返ってみました。
肺がんについて
肺がんは全がんの中で、1年あたりの罹患患者数が大腸がん、胃がんに次いで3番目に多く、年間約12万例におよびます。死亡者数としては、全がんの中で最も多く約7万5000名(2020年)となっています。5年相対生存率(2009~2011年)は34.9%であり、がん全部位の5年相対生存率64.1%に比べかなり低い数字です※18。
肺がんの治療方法は、手術療法、放射線療法、薬物療法、緩和ケアからなり、これらを組み合わせて行われます。ステージ早期では主に手術主体となりますが、ステージが進行するに従い薬物療法が主体となっていきます。肺がんは大きく分けて、小細胞肺がんと非小細胞肺がんに分類され、非小細胞肺がんが約85~90%を占めています。非小細胞肺がんはさらに「扁平上皮がん」「腺がん」「大細胞がん」に分類されます※19※20(図5)。
-
※18国立研究開発法人国立がん研究センター がん情報サービス「がん統計」
https://ganjoho.jp/reg_stat/index.html (参照日:2022年6月5日) -
※19国立研究開発法人国立がん研究センター東病院ウェブサイト 肺がんについて
https://www.ncc.go.jp/jp/ncce/clinic/thoracic_surgery/060/010/ (参照日:2022年6月5日) -
※20がん情報サイト「オンコロ」 肺がんとは
https://oncolo.jp/cancer/lung (参照日:2022年6月5日)
図5 肺がんの種類
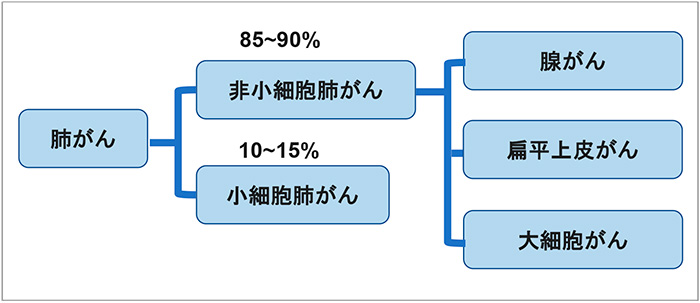
出所:国立がん研究センター がん情報サービス等をもとに医薬産業政策研究所にて作成。
薬物治療の推移
図6は肺がんの治療満足度および薬剤貢献度の推移と新規肺がん治療薬の承認品目数(新有効成分+効能追加)を適応となる分類別に示したものです。肺がんに限定されるものではありませんが、がん治療薬には細胞障害性抗がん薬、分子標的薬、免疫チェックポイント阻害薬の3つのパラダイムがあるといわれています※21。医療ニーズ調査が開始される以前の1993年までに、すでに多くの細胞障害性抗がん薬が開発されていました。1980年代後半からシスプラチン等の白金製剤が開発され、90年代以降に開発された植物由来の化学療法剤との併用療法が開発されました。白金製剤併用の化学療法は今日でも肺がん薬治療の標準的な治療方法となっていますが、抗がん剤治療に伴う副作用を軽減する支持療法としての制吐剤等の開発が進んだことも重要な点です。
-
※21肺癌薬物療法50年の歩み 福岡正博 呼吸臨床2018年2巻12号 論文No.e00064.
https://www.jstage.jst.go.jp/article/kokyurinsho/2/12/2_e00064/_article/-char/ja/ (参照日:2022年6月5日)
図6 「肺がん」の治療満足度、薬剤貢献度と新薬承認品目数
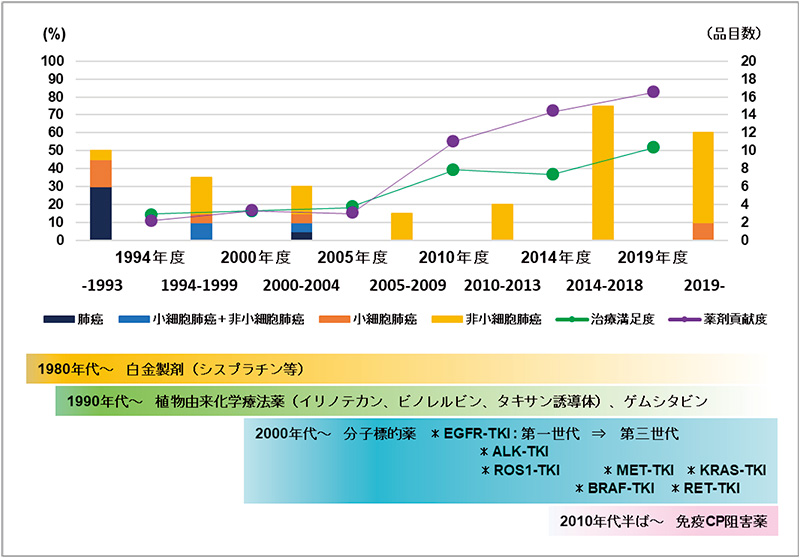
出所:HS財団 国内基盤技術調査報告書「60疾患に関する医療ニーズ調査」(1994年度、2000年度、2005年度、2010年度、2014年度、2019年度)、審査報告書、および明日の新薬(2022年3月末までに承認された新有効成分含有医薬品および新効能医薬品を年ごと、適応症ごとにカウント)をもとに医薬産業政策研究所にて作成。
科学技術および分子生物学の進歩により、がんの発生、増殖、転移のメカニズムが明らかになるとともに2002年にEGFR(上皮増殖因子受容体)チロシンキナーゼ阻害薬(EGFR-TKI)の『ゲフィチニブ』が承認されました。その後、EGFR遺伝子に変異がある腫瘍に有効性が高いことがわかり※22※23、第2、第3世代EGFR-TKIの開発が進みました。またそれに並行しその他の遺伝子変異(ALK、ROS1、BRAF、MET、RET、KRAS)に対応する分子標的薬の開発が行われました(表1)。
-
※22Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. Lynch T J, et al. N Engl J Med 350, p2129-2139(2004).
-
※23EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Paez J G, et al. Science 304, p1497-1500(2004).
表1 非小細胞肺がんを適応に承認されたチロシンキナーゼ阻害薬
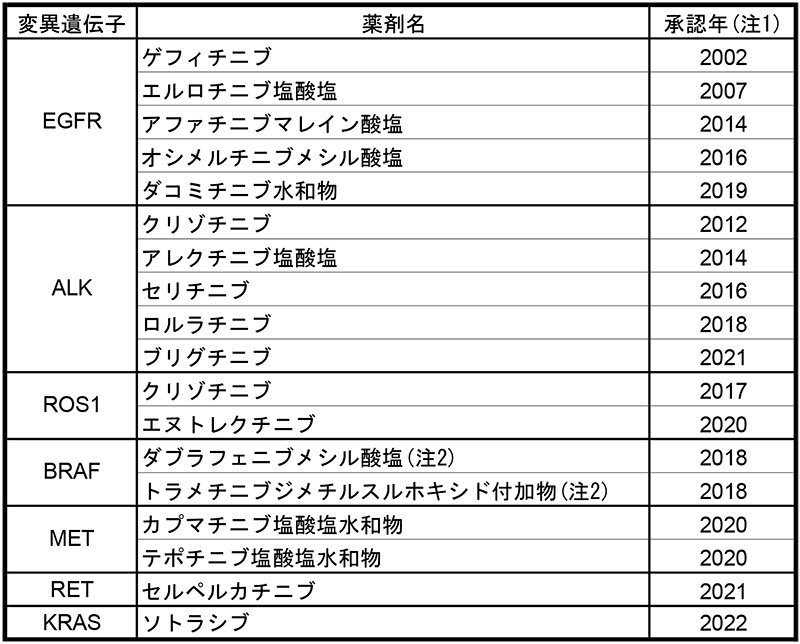
注1:非小細胞肺がんを適応として初承認された年であり、非小細胞肺がん内での効能追加分は含みません。
注2:それぞれの薬剤の併用。
出所:審査報告書、明日の新薬(2022年3月末までに承認された新有効成分含有医薬品および新効能医薬品)をもとに医薬産業政策研究所にて作成。
2014年にすでにメラノーマの治療薬として承認されていた抗PD-1抗体薬『ニボルマブ』が非小細胞肺がんを効能として2015年に承認されました。その後抗PD-1抗体薬『ペムブロリズマブ』が2016年に、抗PD-L1抗体薬『アテゾリズマブ』『デュルバルマブ』が非小細胞肺がんを適応として2018年に承認されました。
「肺がん」に対する治療満足度と薬剤貢献度の推移を見てみると、2005年度の調査までに20種類以上の治療薬が承認されていましたが、治療満足度、薬剤貢献度ともに20%以下の値であり、図1あるいは図3の第3象限にありました。2000年代前半の分子標的薬の登場で2010年度調査では治療満足度が19%から40%へ、薬剤貢献度は16%から56%へと向上し第2象限に移動しました。2014年度の調査では治療満足度は37%と前回調査とほとんど変化がありませんでしたが、薬剤貢献度は73%に向上、2010年代前半からの第2、第3世代EGFR-TKIの登場、EGFR以外の分子標的薬の登場、2015年以降の免疫チェックポイント阻害薬の登場により、2019年度調査では治療満足度が52%へ向上、薬剤貢献度は83%となり、ようやく第1象限に到達しました。
先述の通り2005年度の調査までに20種類以上の治療薬が承認されていたにもかかわらず、治療満足度、薬剤貢献度ともに20%以下の値であったものが、分子標的薬ゲフィチニブの承認から8年後の2010年度調査において治療満足度・薬剤貢献度に大きな変化が見られました。この2005年度から2010年度調査にかけての治療満足度と薬剤貢献度の増加の要因についてもう少し詳細に見ていこうと思います。
2010年度の治療満足度・薬剤貢献度の増加について
EGFR遺伝子変異陽性の腫瘍に効果があるという発見後、日本で実施されたEGFR遺伝子変異陽性の非小細胞肺がん患者を対象とした2つの無作為化比較試験(ゲフィチニブvs化学療法:WJOG3045※24、NEJ002※25試験)において、いずれの試験においてもゲフィチニブ投与群で無増悪生存期間(PFS)が約2倍延長することが示されました※26。
2000年代初頭に確立した進行・再発非小細胞肺がんに対する1次治療の標準治療である白金製剤と化学療法薬との併用療法のPFSが約6ヵ月であったことから、分子標的薬単剤でPFSが約10ヵ月に延長したことは非常に大きなインパクトを与えました※27。また、2005~2009年の間に非小細胞肺がんを適応に承認された新薬はEGFR-TKIの『エルロチニブ』ほか、血管新生阻害薬である『ベバシズマブ』(他の抗悪性腫瘍薬との併用)と葉酸代謝拮抗薬『ペメトレキセド』の3品目であり品目数としては多い期間ではなかったが、上記ゲフィチニブに関する臨床試験結果、ゲフィチニブおよびエルロチニブを使用した医師の直接的な臨床経験が治療満足度および薬剤貢献度の向上につながったのではないかと示唆されました※28。
-
※24Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor
(WJTOG3405): an open label, randomised phase 3 trial. Mitsudomi T, et al., Lancet Oncol. 11, p121-128(2010). -
※25Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. Maemondo M, et al., N Engl J Med 362, p2380-2388(2010).
-
※26WJOG3405試験では、ゲフィチニブ群とシスプラチン+ドセタキセル群のPFSはそれぞれ9.6ヵ月、6.6ヵ月、NEJ002試験では、ゲフィチニブ群とカルボプラチン+パクリタキセル群のPFSはそれぞれ10.8ヵ月、5.4ヵ月でした。
-
※27各種がんにおける薬物療法トピックス —肺がん— 近藤征史 現代医学67(2)、p12-17(2020).
-
※28HS財団「平成23年度(2011)国内基盤技術調査報告書 —2020年の医療ニーズの展望II—【分析編】」
https://u-lab.my-pharm.ac.jp/~soc-pharm/achievements/img/index/h23.pdf (参照日:2022年6月5日)
2000年代以降の分子標的薬の開発・承認、2010年代半ば以降の免疫チェックポイント阻害薬の開発・承認と肺がんの治療満足度・薬剤貢献度の増加に相関性がうかがえましたが、肺がんの生存率はどのように推移したのでしょうか。以下に国立がんセンターによる肺がんの5年相対生存率の推移を進行度※29別(限局、領域、遠隔)に示しました(図7)。病巣が広がるに従って生存率が低下していますが、3群いずれにおいても年を追うごとに生存率の増加が見られました(図7左)。また、薬物治療が主体になると考えられる遠隔転移期(ステージIVに相当)の生存率はいまだ生存率が1桁台ではあるものの、2002年までより2003年以降の生存率の改善ポイント※30が大きいことがわかりました。肺がん全体の50~60%を占める腺がん(非小細胞肺がんの一つ)の約50%にEGFR遺伝子変異があるとの報告※31があり、EGFR-TKIという分子標的薬の登場とその臨床的有効性が肺がんの生存率向上に寄与していたのではないかと考えられました(図7右)。
-
※29国立研究開発法人国立がん研究センター がん情報サービス「がんに関する用語集」“臨床進行度”の項参照のこと。
https://ganjoho.jp/public/qa_links/dictionary/dic01/modal/rinshoshinkodo.html (参照日2022年6月5日) -
※30診断年1993~1996年から2000~2002年において、遠隔転移期の生存率は1.2ポイント上昇しました。一方、診断年2003~2005年から2009~2011年においては2.7ポイント上昇しました。
-
※31国立研究開発法人国立がん研究センター中央病院ウェブサイト 肺腺がんについて
https://www.ncc.go.jp/jp/ncch/clinic/thoracic_surgery/200/20201211234617.html (参照日2022年6月5日)
図7 肺がんの5年相対生存率 —進行度別—
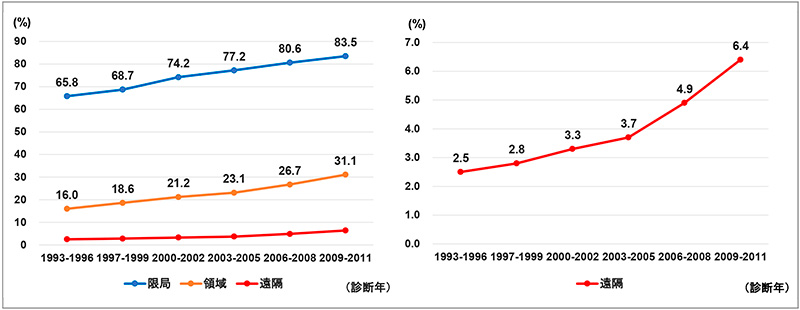
注1:「DCO、第2がん以降、悪性以外、年齢不詳および100歳以上、または遡り調査患者」を除外した解析です。
注2:限局=原発臓器に限局している;領域=所属リンパ節転移(原発臓器の所属リンパ節への転移を伴うが、隣接臓器への浸潤なし)または隣接臓器浸潤(隣接する臓器に直接浸潤しているが、遠隔転移なし);遠隔転移=遠隔臓器、遠隔リンパ節などに転移・浸潤あり。
出典:全国がん罹患モニタリング集計 2009-2011年生存率報告(国立がん研究センターがん対策情報センター、2020)。国立がん研究センターがん研究開発費「地域がん登録精度向上と活用に関する研究」平成22年度報告書。
出所:国立がん研究センター がん情報サービス 地域がん登録によるがん生存率データをもとに医薬産業政策研究所にて作成。
今後の展望
第2、第3のパラダイムである分子標的薬、免疫チェックポイント阻害薬は、いずれも非小細胞肺がんを適応とした薬剤でしたが、2019年以降、進展型小細胞肺がんを適応として『アテゾリズマブ』および『デュルバルマブ』が化学療法との併用療法として承認されました。また、今回の開発品調査において確認された肺がん治療薬の作用メカニズムの中には既述の治療薬の併用療法に加え、細胞障害性抗がん剤と抗体とをリンカーで結合した薬物-抗体複合体(ADC)、新規チロシンキナーゼ阻害薬、新規抗体治療薬等、多種多様な薬剤が開発されていることがわかりました。これら開発品に高い有効性が確認され、肺がんの薬物治療ラインナップの増加により、さらなる治療満足度の向上が期待されるとともに、患者さんを含むあらゆるステークホルダーにとっての“満足度”が向上することを期待します。
5. おわりに
最新のがん統計によると、日本人が一生のうちにがんと診断される確率は男性65.0%(2人に1人)、女性50.2%(2人に1人)であり、日本人ががんで死亡する確率は男性26.7%(4人に1人)、女性17.9%(6人に1人)であることが報告されています※18。
60疾患に含まれるがん疾患のみならず、その他のがん疾患においても、日本での新薬開発・承認が進み、がんによる死亡率が改善されること、さらに、その他アンメット・メディカル・ニーズに対する新薬開発を続けていくことにより、日本に住む人々の健康寿命が延伸することが期待されます。
(医薬産業政策研究所 主任研究員 中尾 朗)

