政策研のページ ドラッグ・ラグ:国内未承認薬の状況とその特徴
2018年度に行われた薬価制度の抜本改革における新薬創出・適応外薬解消等促進加算制度の見直しや、2021年度の中間年改定の実施等、薬価をめぐる環境は年々厳しくなっており、日本の医薬品市場への上市インセンティブ低下に伴う「ドラッグ・ラグ」の再燃を危惧する声が多くなっています。今回のニューズレターでは、2010年から2020年に日米欧各極で新有効成分含有医薬品(New Molecular Entity、NME)として承認された品目を対象とし、「ドラッグ・ラグ」の一つの側面である「国内未承認薬」の状況とその特徴について、政策研ニュースNo. 63で取り上げた内容を紹介します※1。
1-1. はじめに
「国内未承認薬」とは、海外で承認されていながら日本では承認されていない薬のことです。現在、国内未承認薬を使用した場合、それにかかわる費用は個人負担となります。また、病院で国内未承認薬による治療を受けた場合、本来医療機関が保険請求できる薬剤費・診察料・検査料もすべて保険請求ができなくなります。その場合は、治療にかかったすべての費用を全額自己負担しなければならないこともあります。さらに、国内未承認薬を使って万一副作用が出た場合は、国の医薬品副作用被害救済制度は適用されません※2。
この国内未承認薬の問題は、2000~2010年代にかけて我が国で課題として指摘されてきた「ドラッグ・ラグ」の一つの側面です。ドラッグ・ラグは、海外ですでに承認されている薬が日本国内での薬事承認を得るまでに長い年月を要するという問題のことですが、製薬協によるとドラッグ・ラグには2つの側面があるとされており、1つは、ほかの国では発売されているのに日本では発売されていないという国内未承認薬の問題。もう1つは、日本でも発売されてはいるものの発売までに要した期間がほかの国よりも長かったという「ラグ(遅延)」についてです※3※4。
最近、独立行政法人医薬品医療機器総合機構(PMDA)理事長の藤原康弘氏は、国立研究開発法人国立がん研究センターの調査による「米国か欧州で承認され、日本未承認または適応外であるがん領域の医薬品数とその推移」をもとに、抗がん剤のドラッグ・ラグが拡大しているとの報告を行っています※5。要因の一つとして、日本法人や国内管理人をもたない新興バイオ医薬品企業(Emerging Biopharma)が多くの抗がん剤開発を担っているため、日本で開発を行っていない実態があると述べています。また、段落冒頭にて「適応外」という言葉が出てきましたが、日本で医薬品として承認され使用されている薬でも、海外で認められている使い方(適応症)が認められていない場合があります。これを「未承認適応(適応外使用)」といい、国内未承認薬と同じように患者さんにとって問題となっています※2。
-
※1医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬とその特徴」政策研ニュース No.63(2021年7月)
-
※2製薬協「くすりの情報Q&A 55、第7章 製薬産業の社会的貢献」https://www.jpma.or.jp/about_medicine/guide/med_qa/q52.html (2021年9月1日アクセス)
-
※3製薬協「くすりの情報Q&A 55、第5章 くすりを創り育てる」https://www.jpma.or.jp/about_medicine/guide/med_qa/q39.html (2021年9月1日アクセス)
-
※4「ラグ(遅延)」の問題については、国と製薬産業が課題解決に取り組んだ結果、日本を含む国際共同治験の増加、日本の審査期間短縮・安定化、薬事・薬価制度の環境整備等がその短縮要因となり、近年改善されつつあることを以下で報告しています。
医薬産業政策研究所「世界の売上高上位300製品の上市状況の日米欧比較—ドラッグ・ラグの解消は進んでいるのか—」政策研ニュース No.57(2019年7月)、医薬産業政策研究所「ドラッグ・ラグ:国内NME承認品目の上市状況—米国・欧州との上市時期比較—」政策研ニュース No.63(2021年7月) -
※5健康・医療戦略推進本部「第1回 医薬品開発協議会 資料2-6」(2020年10月27日)
https://www.kantei.go.jp/jp/singi/kenkouiryou/iyakuhin/dai1/siryou2-6.pdf -
※6厚生労働省「医療上の必要性の高い未承認薬・適応外薬検討会議」
https://www.mhlw.go.jp/stf/shingi/other-iyaku_128701.html -
※7医薬産業政策研究所「製薬企業に開発要望された未承認薬・適用外薬—薬事承認にみる実用化促進に向けた措置の現況—」政策研ニュース No.45(2015年7月)
-
※8第III回および第IV回開発要望品については、要望時期が比較的最近であるため現状では未承認の件数が多くなっています。しかし、現在進行中で開発および検討が行われており、近い将来、対象となる未承認薬・適応外薬の多くが承認されると考えられます。
-
※9PMDA未承認薬データベース
https://www.pmda.go.jp/review-services/drug-reviews/review-information/p-drugs/0013.html (2021年7月2日アクセス) -
※10医薬産業政策研究所「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
※11医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較—2019年承認実績を中心に—」政策研ニュース No.61(2020年11月)
-
※12医薬産業政策研究所「日本で承認された新医薬品とその審査期間—2020年承認実績と過去10年の動向調査—」政策研ニュース No.62(2021年3月)
-
※13ワクチンと再生医療等製品(欧州医薬品庁(EMA)にてAdvanced therapy medicinal products(ATMP)に該当する品目を含む)に区分される品目については、PMDA「未承認薬データベース(更新日2021年3月1日)」の調査対象、または、政策研にて構築したデータベースの情報源である米国食品医薬品局(FDA)Center for Drug Evaluation and Research(CDER)の承認対象に含まれず、2010年から2020年の日米欧各極でのNME承認品目の抽出が困難であったため、今回の調査対象から外しています。
-
※14解析に用いたデータセット、統計解析手法、および統計解析結果の詳細については、政策研ニュース No. 63[1]参照。
-
※15国内開発情報のない国内未承認薬149品目のうち、Bempedoic acid/Ezetimibe(米国:Esperion、欧州:第一三共)、Ospemifene(米国:Duchesnay、欧州:塩野義)以外の147品目は、米欧にて海外企業により開発された品目でした。
-
※16薬効分類は世界保健機関(WHO)の下記ウェブサイトを参照し、各品目のThe Anatomical Therapeutic Chemical code(ATC code)をもとに行いました。また、ATC codeが付与されていない品目については類縁医薬品から予想されるものを採用しました。
ATC/DDD Index 2021:https://www.whocc.no/atc_ddd_index/ -
※17医薬産業政策研究所「希少疾病用医薬品(Orphan drug)の開発動向—FDAで承認されたOrphan drugの日本での開発状況の分析—」政策研ニュース No.59(2020年3月)
-
※18IQVIA “Global Trends in R&D: Overview through 2020”, May 19, 2021. https://www.iqvia.com/insights/the-iqvia-institute/reports/global-trends-in-r-and-d
-
※19三菱総合研究所「AMED委託、国内外における感染症及び病原体に対する医薬品開発研究等に関する調査:1.2 Pull Incentiveに関する調査検討」(2020年3月27日) https://www.amed.go.jp/content/000064112.pdf
1-2. 未承認薬および適応外薬問題への取り組み
2010年4月に薬価制度として「新薬創出・適応外薬解消等促進加算」が試行的に導入されるとともに、厚生労働省は、「医療上の必要性の高い未承認薬・適応外薬検討会議」(以下、検討会議)を設置し、製薬企業による未承認薬・適応外薬の開発を促進してきました※6※7。ここで、国内未承認薬および適応外薬の開発促進の状況を理解するため、本検討会議での検討結果を受けて開発企業の募集または開発要請が行われた医薬品の承認状況を示します(表1、図1)。
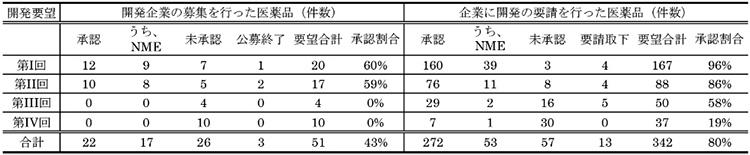 表1 開発企業の募集または開発要請が行われた医薬品の承認状況(開発要望時期別)
表1 開発企業の募集または開発要請が行われた医薬品の承認状況(開発要望時期別)
注1:共同開発案件や複数の開発要請案件を1つの薬事承認で取得しているものもあり、重複集計を行っている。
注2:各回の開発要望時期は以下の通り(第I回:2009年6月18日~8月17日。第II回:2011年8月2日~9月30日。第III回:2013年8月1日~2015年6月30日。第IV回:2015年7月1日~現在。現在は、要望を随時募集している)。
出所:厚生労働省「医療上の必要性の高い未承認薬・適応外薬検討会議:開発企業の募集又は開発要請を行った医薬品の一覧」(更新日:2021年2月15日)をもとに政策研にて作成
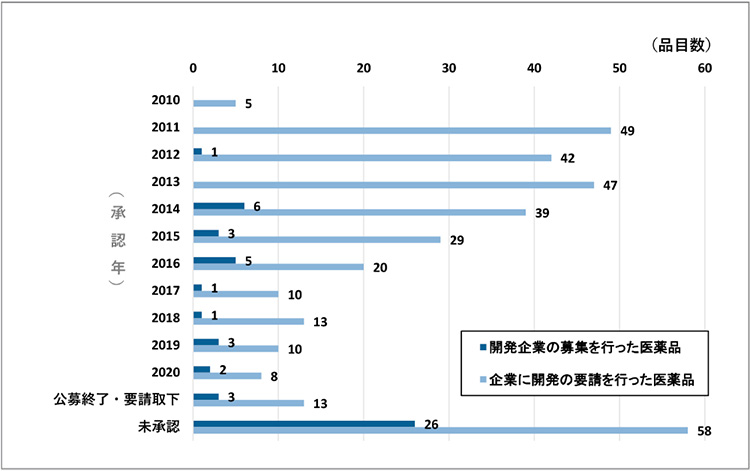 図1 開発企業の募集または開発要請が行われた医薬品の承認状況(承認年別)
図1 開発企業の募集または開発要請が行われた医薬品の承認状況(承認年別)
注:共同開発案件や複数の開発要請案件を1つの薬事承認で取得しているものもあり、重複集計を行っている。
出所:厚生労働省「医療上の必要性の高い未承認薬・適応外薬検討会議:開発企業の募集又は開発要請を行った医薬品の一覧」(更新日:2021年2月15日)をもとに政策研にて作成
これまでに厚生労働省から第I~IV回の計4回の開発要望が出されており、要望された医薬品の総計は393件に上ります。開発要望医薬品の承認状況を見ると、要望件数全体393件のうちの294件(75%)が承認されており、そのうちの70件63品目が新有効成分含有医薬品(New Molecular Entity、NME)でした。開発要望医薬品の承認状況を承認年別に見ると、ドラッグ・ラグが課題となっていた2010年代前半に数多くの対象となる医薬品の承認が得られていました※8。このように、国、医療関係者、製薬企業の一体となった取り組みにより、多くの未承認薬・適応外薬が開発され薬事承認に至り、この問題が改善されてきました。
2. 調査方法
調査対象は2010年から2020年に日米欧各極でNMEとして承認された品目とし、欧米での承認日と日本での承認状況を比較することで、国内未承認薬を特定しました。具体的には、PMDA「未承認薬データベース(更新日2021年3月1日)」に記載の品目をもとに※9、政策研にて構築したデータベース※10※11※12を用いて日米欧のNME承認情報を確認し、情報を補完しました※13。
なお、本調査は承認数や開発状況の観点からの分析であり、日本国内の医療ニーズを考慮した調査でないことを調査の限界として事前に提示しておきます。
3. 国内未承認薬数とその割合の経時変化
国内未承認薬数の推移を確認するため、2010年から2020年の日米欧各極のNME承認情報を用い、調査時点(各年12月末日)ごとに国内未承認薬数および欧米で承認されたNMEについての日本国内での承認率を集計しました※14。本データセットを用い、2014年から2020年の調査時点ごとに直近5年の国内未承認薬数を集計し、5年分の合計値を算出しました。比較として、欧米NME数合計値についても同様に算出し、加えて、欧米NME数に対する国内未承認薬数の割合を算出し経時変化を追いました(図2)。
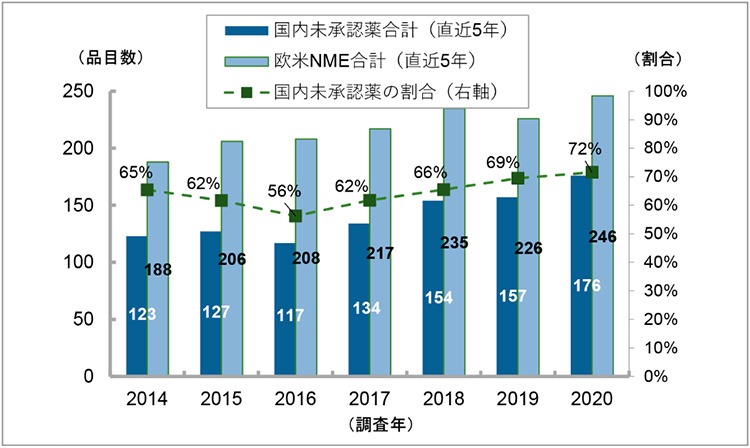 図2 国内未承認薬数とその割合の年次推移(直近5年合計値)
図2 国内未承認薬数とその割合の年次推移(直近5年合計値)
注:2010年から2020年に日米欧で承認されたNMEを対象とし、調査時点(各年12月末日)ごとに直近5年の国内未認薬数および欧米NME数を調査し5年分の合計値を算出した。欧米両極で承認されているNMEの場合は、最初に承認された年にのみ1カウントした。
出所:PMDA、FDA、EMAの各公開情報をもとに政策研にて作成
経時変化を追った結果、2014年から2016年調査時点にかけて国内未承認薬の割合は減少(65%→56%)していましたが、2016年調査時点を底として国内未承認薬の割合が増加し、2020年末時点では直近5年の欧米NME数の72%が国内未承認薬でした。また、この期間は欧米NME数自体も増加しているため、国内未承認薬数(直近5年合計)は2016年末時点では117品目でしたが、2020年末時点では176品目と1.5倍に増加していました。
ここで、2010年代後期において国内未承認薬数の増加傾向があるという上記結果を検証するために統計解析を試みました。図2作成時のデータセットを用い、2010年から2020年の欧米で承認されたNMEについて日本国内での累積承認率の動向に関するパネルデータを作成しました。そして、2010年代前期(2010~2014年)と後期(2015~2020年)に分けて、欧米NMEの初承認年からの経過年数と承認率との関係を調べるため、ロジスティック回帰分析を行いました(図3)※14。
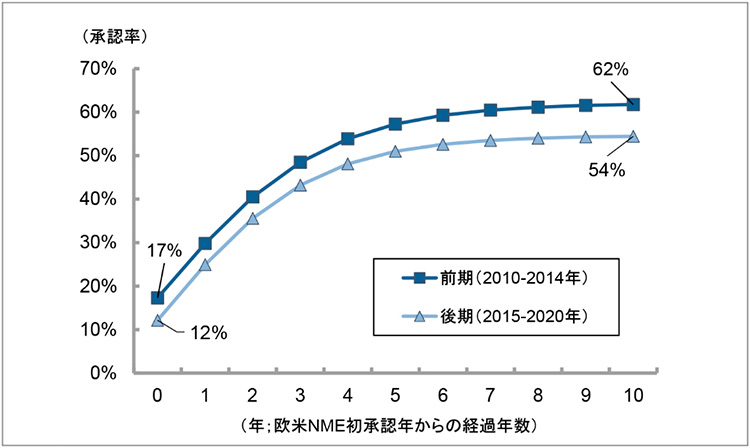 図3 2010年代前期と後期での欧米NMEの国内承認率の比較(統計解析結果)
図3 2010年代前期と後期での欧米NMEの国内承認率の比較(統計解析結果)
注:2010年から2020年の欧米で承認されたNMEについて日本での累積承認率の動向に関するパネルデータを作成し、ロジスティック回帰分析を実施した。グラフは下記の推計結果式より作図した。
・前期:y=-0.274+0.895/(1+exp(-0.574×x), R2=0.644
・後期:y=-0.303+0.849/(1+exp(-0.622×x), R2=0.882
出所:PMDA、FDA、EMAの各公開情報をもとに政策研にて作成
解析の結果、2010年代前期では欧米と国内とで同年に承認された品目の割合が17%であったのに対し、2010年代後期では12%でした。欧米承認後10年の水準を比較すると、2010年代前期では欧米で承認された品目の62%が国内で承認されたが、2010年代後期では54%まで水準が低下しました。つまり、前期のほうが曲線の高さが初期にも最終的にも高いことを示唆しています。この2010年代前期と比較して2010年代後期に日本国内での承認率が低下したことは、統計学的に有意でした※14。
4-1. 国内未承認薬の欧米での承認状況
ここからは、2010年から2020年の間に欧米で初めて承認されたNMEのうち、2020年12月末時点で国内未承認であった265品目について詳細に調査していきます。
最初に、2020年12月末時点での国内未承認薬数と欧米での承認状況の内訳を図4に示しました。2020年12月末時点での国内未承認薬の265品目のうち、米国、欧州の両地域で承認されているグローバル承認品目は125品目と全体の47%を占めました。また、米国のみで承認されている品目については119品目(45%)とグローバル承認品目とほぼ同数を占め、他方、欧州のみで承認されている品目は21品目(8%)と少数でした。
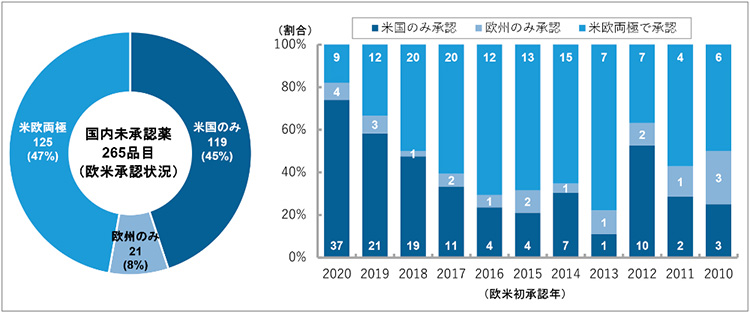 図4 国内未承認薬の欧米での承認状況(2020年12月末時点)
図4 国内未承認薬の欧米での承認状況(2020年12月末時点)
注:棒グラフ中の数値は、国内未承認である品目数を表す。米欧両極で承認されているNMEの場合は、最初に承認された年にのみ1カウントした。
出所:PMDA、FDA、EMAの各公開情報をもとに政策研にて作成
次に、欧米初承認年ごとに見ると、直近の2020年、2019年、そして2012年を除いて、米欧両極で承認されている国内未承認薬の割合が各年で5割を超えていました。また、2020年に近づくにつれて米国のみで承認された国内未承認薬の割合が多く、欧州のみで承認されている品目は各年に数個ある程度でした。ただし、近年の調査の結果から、NMEの日米欧の上市順位は米国、欧州、日本の順となるのが最も一般的なパターンとされており※4、本調査時点で米国のみで承認されている国内未承認薬についても、2021年以降に欧州や日本において承認されていく品目が複数あると想定できます。
4-2. 国内未承認薬の国内開発状況
2020年12月末時点での国内未承認薬の国内開発状況の内訳を図5に示しました。国内未承認薬265品目のうち国内開発中の品目は83品目(31%)あり、これらの品目については欧米との承認時期の「ラグ(遅延)」はあるものの国内での臨床開発試験は進行中であるため、近い将来、国内で薬事承認される可能性があります。
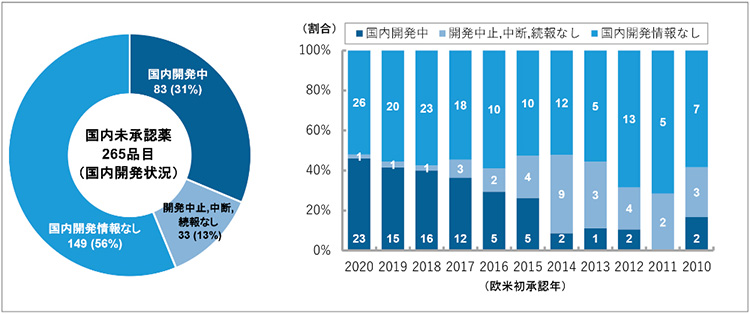 図5 国内未承認薬の開発状況(2020年12月末時点)
図5 国内未承認薬の開発状況(2020年12月末時点)
注1:開発情報については、医薬品開発情報データベース「明日の新薬」(株式会社テクノミック)の記載に準じる。開発ステージ情報を得てから3年程度経過したものに対して、開発継続に関する情報が確認できなかった品目に関しては「続報なし」としている。
注2:棒グラフ中の数値は、国内未承認である品目数を表す。欧米両極で承認されているNMEの場合は、最初に承認された年にのみ1カウントした。
出所:PMDA、FDA、EMAの各公開情報、「明日の新薬」をもとに政策研にて作成
他方、国内開発中止・中断の判断をされた品目(3年間開発情報の続報がない品目含む)については33品目(13%)ありました。「中止・中断」の理由を特定するのは難しいのですが、戦略上の理由、事業環境の変化、国内臨床試験失敗、欧米にて重篤な副作用が報告された等、多岐にわたっていました。また、国内開発情報のない品目は149品目(56%)でした。これらの現在開発が動いていない国内未承認薬182品目(69%)については、2021年以降に新たに国内開発が開始されない限り、今後も国内未承認薬として残っていきます。
次に、欧米での初承認年ごとに、国内未承認薬として残っている品目の開発情報を確認しました。開発中の83品目のうち8割を占める66品目が2017年から2020年に、9割以上を占める76品目が2015年から2020年に欧米で承認された品目であり、それ以上前の2014年以前の品目で開発情報があるものは開発中の品目全体の1割以下(7品目)でした。ただし、2014年以前の国内未承認薬に関しても、現在開発中の品目(7品目)と開発中止・中断となっている品目(21品目)を合計した28品目については、国内で開発されていた形跡がありました。この視点で国内未承認薬全体を見ると、製薬企業により国内での薬事承認を得るための努力が行われていた品目は116品目あり、国内未承認薬全体の44%でした。
4-3. 国内開発情報のない未承認薬の特徴
ここで、国内未承認薬のうち2020年12月末調査時点までに国内での開発が行われた形跡のない「国内開発情報なし」となった149品目についての特徴を調査しました(図6)。
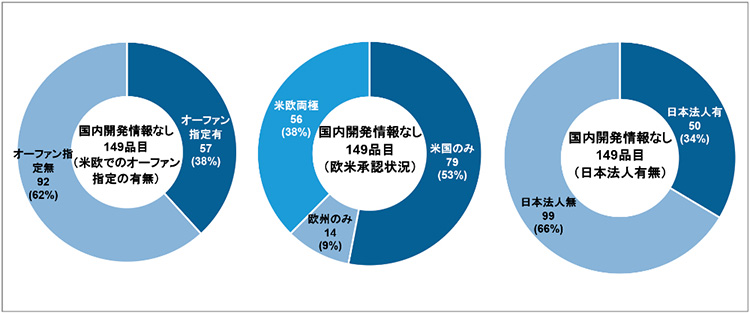 図6 国内未承認薬のうち、国内開発情報のない品目の特徴(2020年12月末時点)
図6 国内未承認薬のうち、国内開発情報のない品目の特徴(2020年12月末時点)
注1:開発情報については「明日の新薬」の記載に準じる。
注2:日本法人の有無については各社公開情報をもとに著者が分類した。
出所:PMDA、FDA、EMAの各公開情報、各社公開情報、「明日の新薬」をもとに政策研にて作成
最初に、米欧でのオーファン指定の有無を確認しました。対象の149品目についてオーファン指定での区分けを行ったところ、オーファン指定有の品目が57品目(38%)を占めました。政策研ニュースNo. 61によりますと、米国および欧州にて承認されたNMEの過去5年間(2015~2019年)のオーファン指定品目割合は40%前後で推移していました※11。つまり、国内未承認薬のうち国内開発情報なしの品目の米欧でのオーファン指定の割合は、米国および欧州にて承認されたNMEのオーファン指定の割合と大差がありませんでした。
次に、欧米での承認状況を確認しました。国内開発情報のない国内未承認薬149品目のうち56品目(38%)は米国と欧州の両極で承認されているグローバル承認品目でした。図4の国内未承認薬全体の場合と比較すると、国内開発情報なしの品目については米欧両極で承認されている割合が9%少なく、米国のみで承認されている割合は8%多くなっていました。
最後に、国内開発情報なしの品目について欧米での開発企業を調査したところ、149品目のうち147品目が海外企業による開発品でした※15。さらに開発企業について詳細を見るために、対象となる海外企業の日本法人の有無について確認しました。結果、99品目(66%)が日本法人をもたない海外企業により開発された品目であることがわかりました。
4-4. 国内未承認薬の薬効分類と開発状況
調査の最後として、2020年12月末時点での国内未承認薬265品目についての薬効分類※16と国内開発状況を図7に示しました。
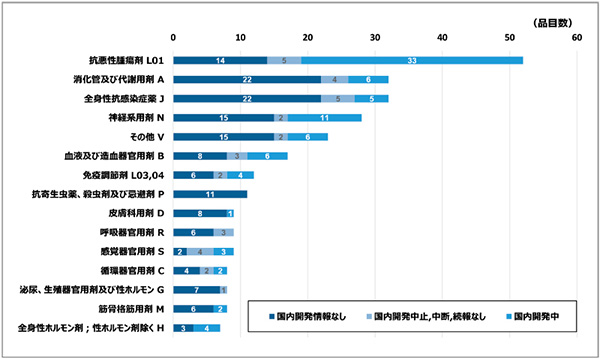 図7 国内未承認薬の薬効分類と開発状況(2020年12月末時点)
図7 国内未承認薬の薬効分類と開発状況(2020年12月末時点)
注:開発状況については「明日の新薬」の記載に準じる。開発ステージ情報を得てから3年程度経過したものに対して、開発継続に関する情報が確認できなかった品目に関しては「続報なし」としている。
出所:PMDA、FDA、EMAの各公開情報、WHO ATC index、「明日の新薬」をもとに政策研にて作成
国内未承認薬を薬効分類別に見ると、抗悪性腫瘍剤(L01)が52品目(20%)と最も多くありました。続いて図5において示した国内開発中の83品目について薬効分類別に見ると、抗悪性腫瘍剤(L01)が33品目と国内開発中の品目全体の40%を占めていました。この数は、抗悪性腫瘍剤の国内未承認薬52品目のうちの63%を占める品目数でした。このように、抗悪性腫瘍剤の未承認薬については、ほかの薬効分類と比較して国内開発中の品目数が多いだけでなく割合も大きく、多くの品目が国内開発に着手されていたことがわかりました。
一方、国内開発情報のない149品目について薬効分類別に見ると、全身性抗感染症薬(J)が22品目、消化管及び代謝用剤(A)22品目、神経系用剤(N)が15品目、その他(V、診断薬等)が15品目、抗悪性腫瘍剤(L01)が14品目と続いており、抗悪性腫瘍剤よりも多い薬効分類を4分類確認しました。このうち、国内未承認薬数の多かった全身性抗感染症薬(J)や消化管及び代謝用剤(A)については、国内開発中の品目がそれぞれ6品目、5品目と国内開発中の品目全体(83品目)の5~6%を占める程度であり、多くの未承認薬は開発されないまま残っていることがわかりました。
5. 考察
ここからは、国内未承認薬の状況とその特徴の調査から得られた結果について考察します。
まず、国内未承認薬数とその割合の経時変化からは、2010年代後期に国内未承認薬数の増加傾向が見られました。国内未承認薬はドラッグ・ラグの一つの側面であることを述べましたが、承認品目数や承認割合の観点から調査した結果、本側面については拡大の兆候が見られると言えます。この理由を探るため、2020年12月末時点での国内未承認薬について詳細に調査を行いました。
欧米での承認状況の調査からは、米国、欧州の両地域で承認されているグローバル承認品目である国内未承認薬が約半数(47%)含まれていることがわかりました。国内で未承認薬となっている品目にはグローバルで展開されないそれぞれの地域のローカルドラッグが大部分含まれるのではないかと考えていましたが、その考えは否定されました。
国内開発状況の調査からは、国内未承認薬全体の44%は各製薬企業により国内開発されていましたが、残りの56%は開発情報のない品目でした。「国内開発中の品目」については、「ラグ(遅延)」ができるだけ短くなることが望ましいものの、将来的には国内において患者さんがその薬剤にアクセスできる可能性があります。しかし、「開発情報のない品目」については調査時点以降に国内開発が開始されない限り、このまま未承認薬として残っていきます。
開発情報のない品目をさらに分析調査したところ、38%は欧米でのオーファン指定品目でしたが、その割合と欧米NME全体でのオーファン指定品目割合とを比較することで、2つの間に大きな差はないことを示しました。ただし、オーファン指定品目については、希少であるがゆえに市場規模や臨床試験の実施可能性の問題が生じるので、今後国内単独で臨床開発を開始する割合は低いと考えられ、多くが国内未承認薬として残っていく可能性があります。国内未承認薬となっているオーファン指定品目には国内の患者数が著しく少なく治験が実施できない遺伝性疾患や希少がんの薬剤等が含まれます※17。海外開発・承認が先行してしまうと、日本で検証試験は困難となり、日本人での科学的根拠が希薄となり、結果としてドラッグ・ラグを引き起こしてしまいます。製薬企業は、国民に最先端医療を提供するために、日本人も含めた有効性と安全性を検討できる規模の国際共同試験に参加し、結果として国内と海外との同時承認もあり得る状況に最初からもっていくことが重要であると考えます。
国内開発情報のない品目では、国内未承認薬全体での結果と比較して、米国のみで承認されている品目の割合が大きくなっていました。加えて、国内未承認薬のうち国内開発情報のない品目の66%は、日本法人をもたない海外企業により欧米で開発されたNMEでした。最近のIQVIAの調査レポート“Global Trends in R&D: Overview through 2020”によりますと、過去3年間で承認されたNMEの40%以上が新興バイオ医薬品企業(Emerging Biopharma)により開発・発売されているとされ※18、これら新興バイオ医薬品企業の多くは日本法人をもちません。また、新興バイオ医薬品企業の多くは米国発祥で、米国でのみ開発・販売する割合が高いと考えられ、そのため、国内未承認薬のうち国内開発情報のない品目については米国のみで承認されている割合が高くなっていると思われました。このことから、新興バイオ医薬品企業をどのように国内開発に呼び込むかが、国内未承認薬の問題を解決するための一つの課題として浮かび上がりました。国際共同治験のしやすい環境を構築することや、国内で臨床開発を行いたくなるような環境と企業へのインセンティブを整備すること、魅力ある国内市場を作ること等で新興バイオ医薬品企業自体を国内に呼び込むことも重要であり、新興バイオ医薬品企業の品目に特化して国内導入することで国民の新薬へのアクセスを確保するという戦略をもつ国内製薬企業が出てきても良いのかもしれないと考えます。
国内未承認薬の薬効分類別調査からは、抗悪性腫瘍剤の国内未承認薬の数はほかの薬効分類と比較して最も多いが、国内臨床開発中の割合も最大であり、多くの未承認薬について製薬企業による開発努力が続けられていることがわかりました。今後は、より承認時期の「ラグ(遅延)」が短くなること、および希少がんの薬剤等の開発されていない国内未承認薬の割合がさらに減っていくことを期待したいと思います。
開発情報のない品目の薬効分類別調査では、抗感染症薬に分類された未承認薬の割合が高かったが、これまで国内に薬剤耐性(AMR)菌治療用等の感染症を対象とした医薬品の研究開発の促進に寄与するような企業へのインセンティブが少なかったこと等も原因であろうと推察します。2020年秋に厚生労働省により「特定用途医薬品」の指定制度が創立されたことで一定の対策は打たれたと認識していますが、昨今のCOVID-19パンデミックに対する国内の研究開発状況を見ると、より効果の高い抗感染症に対する打ち手が必要であるとも感じています。たとえば、2020年に英国で実装されたサブスクリプション(定額課金)型償還モデルのような新型のインセンティブを本格的に議論する時期にきているのかもしれません※19。
6. まとめ
今回、国内未承認薬の状況とその特徴について採り上げてきました。ドラッグ・ラグの一つの側面である国内未承認薬については、2010年代後期に拡大の兆候が見られており、特に、新興バイオ医薬品企業をどのように国内開発に呼び込むかが、国内未承認薬の問題を解決するための一つの課題として浮かび上がりました。また、国内未承認薬数の多い抗悪性腫瘍剤だけでなく、国内開発情報のない品目の多い抗感染症薬等の領域への対策が必要であることもわかりました。これら課題の解決に向けて重要な点として、(1)国際共同治験のしやすい環境の構築、(2)日本国内で臨床開発を行いたくなるような環境の整備、(3)感染症等における企業への新型インセンティブの付与、(4)魅力ある国内市場を作ること、の4点を挙げました。
冒頭でも述べましたが、日本の医薬品市場への上市インセンティブ低下に伴うドラッグ・ラグの再燃を危惧する声が多くなっています。このまま欧米NMEの国内での承認率が低下し国内未承認薬が増加していくことになると、将来的に国民は革新的な新薬への迅速なアクセスができなくなる可能性があります。イノベーションと医薬品の価値を理解した適正な制度が運用されるように国民的な議論が進むことを期待し、本稿を閉じたいと思います。
(医薬産業政策研究所 主任研究員 吉田 昌生)

