政策研のページ 医薬品産業におけるCOVID-19パンデミックへの対応と今後
世界中で感染拡大が収まらない新型コロナウイルス感染症は、効果が明確に実証されたワクチンや治療薬がない中、国民の生活や社会活動、そして多種多様な産業における事業活動に影響を及ぼし、その結果として、多大な社会的、経済的損失をもたらしています。それに加えて、今後の社会活動、企業活動等に少なからぬ変化と変化に対応するための変革を強いているように見受けます。本稿では、本感染症の拡大が医薬品産業に及ぼす影響についてポイントを絞ってまとめるとともに、世界中で望まれているワクチンや治療薬の開発動向、さらに、将来に起こり得る新たな感染症の流行に備えるべく必要な対策等について述べていきます。
はじめに
新型コロナウイルス(SARS-CoV-2)による感染症(COVID-19)※1パンデミックは、ワクチンや抗ウイルス薬といった感染拡大抑止に有効な手段がない中、甚大な健康被害をもたらしており、いまだに収束の見通しが立っていません。他者との接触を極力避けることが現時点で最も効果的な感染防止策ですが、徹底し続ける代償としてリーマンショック後を凌ぐ社会的、経済的損失を世界中にもたらすこととなりました。感染防止と社会的、経済的活動の活性化との適度なバランスの模索は、産学官民を問わず世界中の人々にとって正解のない難問となっていますが、そのような中、国民の健康維持の一翼を担う医薬品産業は、その社会的使命を継続して果たすべく努力を重ねています※2。本稿では、当産業に対するCOVID-19の影響と、COVID-19の予防、治療薬の研究開発動向、そして将来起こり得る第2、第3の新興感染症パンデミックを想定した今後の取り組みについて述べていきます。
-
※1SARS-CoV-2は、人類に重篤な呼吸障害(Severe Acute Respiratory Syndrome)をもたらした2番目のコロナウイルス(CoV:Coronaviruses)の略称であり、COVID-19はcoronavirus disease 2019の略称である。
-
※2新型コロナウイルス感染症に対する国内製薬会社の取り組みは、製薬協の特設サイト等でも公開されている。
1. 産業活動に対する影響
(1)業績に対する影響
2020年度の国内医薬品市場は、2年ごとに行われる診療報酬改定に伴う薬価改定により▲4.38%(医療費ベースでは0.99%)の圧縮が講じられたことに加えて、COVID-19に対する緊急事態宣言等に伴う患者の受診抑制による影響が生じています※3。その中で、患者の受診抑制に伴い、品目によっては需要の縮小によって売上高が減少しているケースもありますが、2020年1~3月期、4~6月期、7~9月期の連結決算報告(研究開発志向型製薬企業を会員とする製薬協の上場会員会社26社の集計)(図1)からは医薬品産業の売上高、営業利益は、他産業に比べると総じて堅調に推移していることが読み取れます。殊に、4~6月期の営業利益は、各社の経営戦略に伴って各社各様ではありますが、全体としては医薬情報提供活動等、対外的な業務の自粛や研究開発活動の制限等による販売管理費の抑制が寄与していると考えられます。
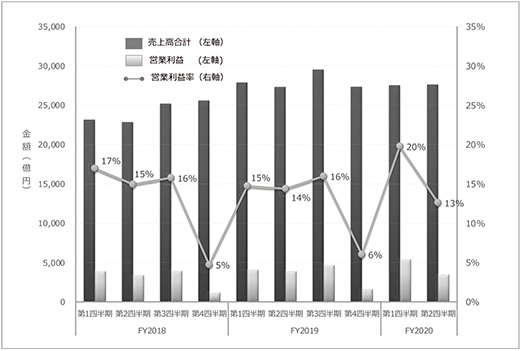 図1 国内製薬企業の四半期別売上高と営業利益率のトレンド
図1 国内製薬企業の四半期別売上高と営業利益率のトレンド
対象:製薬協加盟の東証一部上場企業のうち、対象期間を通じて四半期売上高、営業利益データが入手可能な企業(26社)
出所:SPEEDA((株)ユーザベース)に基づき、政策研にて作成
今後受診動向が回復基調に転ずるか否か等、市場を取り巻く環境が不透明であることはいうまでもありませんが、4~9月期を経た段階に限ると、パンデミックに伴って業界全体として事業継続への深刻な影響を及ぼす業績へのインパクトはないように見受けられます。さらに連結売上高を構成する国内外売上高の推移を検討したところ(26社のうち、医薬品事業の売上高が総売上高の50%超で調査期間中の海外売上高データが入手可能な16社を集計)、やはりCOVID-19パンデミックによる国内売上高に対する明確なネガティブインパクトは認められませんでした(図2)。
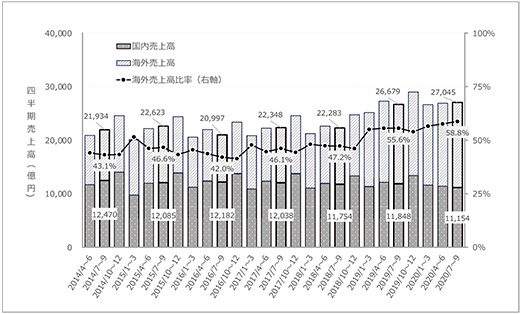 図2 国内製薬企業の四半期別国内外売上高トレンド
図2 国内製薬企業の四半期別国内外売上高トレンド
対象:製薬協加盟 東証一部上場企業(医薬品売上高比率 50%超)のうち、対象期間を通じて海外売上高データが入手可能な企業(16社)
出所:SPEEDA((株)ユーザベース)、各社決算短信、同補足資料に基づき、政策研にて作成
(2)サプライチェーンに対する影響
COVID-19が拡大する中、日本ではマスクや防護服といった医療物資の不足が大きな問題となっていました。また、医薬品の一部においても出荷制限がかかる等、供給不安の声があがる時期もありました。医薬品のうち、医療用医薬品に関しても、その生産に必要な原薬等の調達先としていた海外で製造、輸出が滞ったために2020年5月末から7月末にかけて供給不安に陥る可能性のある製品は計14品目を数えましたが、いずれも企業間での調整による欠品回避や、代替薬について各企業が学会と連携し、対応が図られています※4。医療用医薬品全体でみると、図3に示すように医薬品の国内生産額と医薬品の輸入金額の月次推移において、世界で流行が進んだ2020年2月以降も2019年同月と比べて大きな変化は認められず、また、2020年5月から6月にかけて輸入原薬を使用した国内生産製品や輸入最終製品生産の着実な回復がうかがわれており、医療用医薬品の供給面でも、幸いにしてCOVID-19パンデミックによるネガティブインパクトは認められませんでした。
-
※4
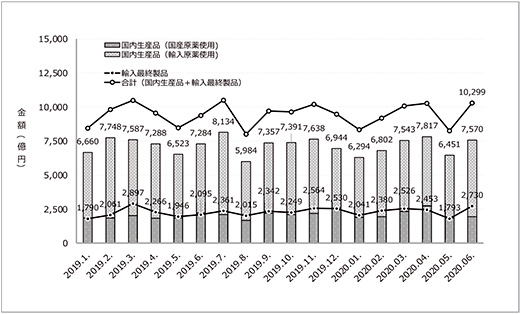 図3 医薬品生産額月次トレンド(薬事工業生産動態統計調査)
図3 医薬品生産額月次トレンド(薬事工業生産動態統計調査)
出所:薬事工業生産動態統計調査(厚生労働省)に基づき、政策研にて作成
医薬品の供給不安が回避された理由の一つに、先発品を中心に製品および製剤化前の原薬の在庫を製薬企業各社が6ヵ月分程度確保していたことが挙げられます※5。図3に示すように医薬品の生産に関しては輸入原薬使用を含め国内生産が全体の7~8割を占めており、製品のみならず原薬を確保しておくことで供給体制の安定化が図られてきました。2008年に新型インフルエンザのパンデミックに備え、製薬協から「製薬企業における業務継続のための新型インフルエンザ対策ガイダンス」が策定され※6、これをもとに各社の判断で重要と考えられる医薬品の在庫確保等を行ってきたことも安定供給の確保に寄与していると思われます。
(3)臨床試験に対する影響
COVID-19の流行により、医療従事者の負担が増え、被験者の感染リスクが高まったことで、臨床開発にも影響が出ています。公益社団法人日本医師会が国内の臨床試験実施施設を対象にCOVID-19の影響について調査しており、一部の施設では、新規の治験の受け入れ中止、実施中の臨床試験の中断や新規の患者登録の中止等の対応が取られていることが明らかとなっています※7。この傾向は世界的に同様で、ニューヨークがん研究所とIQVIA社が2020年3~4月にかけて実施したアンケート調査によれば、がん領域の臨床試験に関し、新型コロナウイルス流行前と比較して遅延もしくは中断されている施設の割合は米国80%、欧州86%、アジアでは40%とされています※8。このような臨床試験の遅延はCOVID-19パンデミック前に見込んでいた新薬の上市時期の遅れ等につながり、事業計画や中長期的な業績にも影響を及ぼす可能性があります。
-
※7日本医師会治験促進センターウェブサイト
-
※8Samik Upadhaya, et al.,「Impact of COVID-19 on oncology clinical trials」Nature Reviews Drug Discovery, vol.19, p376-7, 18 May 2020.
2. COVID-19の予防、治療に向けた新薬の研究開発動向
COVID-19パンデミックに対応するため、世界各国の製薬企業を中心にCOVID-19関連の医薬品開発が急ピッチで進んでいます。医薬品の研究開発情報を収集しているBioCenturyの情報によると、2020年8月3日現在、世界各国で承認もしくは第I相以降の臨床試験が実施されている化合物は治療薬243品目、ワクチン35品目となっています※9。グローバルで見ると、米国企業が開発スピードおよび数でリードしていますが、国内でも多くの製薬企業※10に加え、バイオベンチャーやアカデミアがCOVID-19に対する治療薬、ワクチンの開発を進めています。一日も早くヒトにおける有効性、安全性を検証し、世界中で広く予防、治療に供することも医薬品産業の最大の使命であり、各社とも、最大限の努力を払っています。
-
※9BioCenturyに掲載されている情報(2020年8月3日アクセス)より筆者集計
-
※10製薬協「製薬協加盟各社による、治療薬・ワクチンの研究開発の取り組みについて」(2020年8月4日アクセス)
(1)治療薬
現在、国内でCOVID-19の適応で承認されている医薬品は、レムデシビル(ブランド名:ベクルリー)およびデキサメタゾンの2剤です(2020年12月現在)。レムデシビルはもともとエボラ出血熱の治療薬として米国ギリアド社が開発を進めていた薬剤ですが、COVID-19に対する治療効果が示唆されたことから、米国における緊急使用許可に基づく使用実績を踏まえて、2020年5月7日に国内で特例承認されました。またデキサメタゾンは、古くから使用されているステロイド薬で重症感染症の適応を有しますが、厚生労働省「新型コロナウイルス感染症診療の手引き」の中で「日本国内で承認されている医薬品」として掲載されています。
レムデシビルやデキサメタゾンのように、すでにヒトでの使用実績がある薬剤を、本来の治療対象とする疾患以外の疾患の治療に転用する手法、所謂ドラッグ・リポジショニングが活用されています。直近では、抗インフルエンザウイルス剤として承認されているファビピラビル(ブランド名:アビガン)について、そのSARS-CoV-2に対する抗ウイルス効果の期待から臨床試験が進められていましたが、統計学的に有意な症状改善効果が認められ、承認申請が行われた事例※11が挙げられます。国内における主要なドラッグ・リポジショニング活用例を表1に示しましたが、それぞれの既承認適応症や薬理作用が多岐にわたっており、COVID-19の臨床像の多様性と治療の困難さがうかがわれます。また国立研究開発法人理化学研究所と京都大学は共同で、世界最高水準の計算能力を有するスーパーコンピュータ"富岳"を活用し、既存薬2128種の薬剤からSARS-CoV-2に効果を示すことが期待できる薬剤数十種類を選択(そのうち12種類はすでにCOVID-19に対する臨床研究や臨床試験が実施中)することに成功したとの報道※12がされており、その後の評価の進展が期待されるところです。
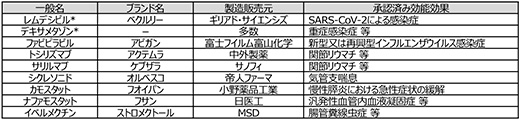 表1 主要なドラッグ・リポジショニング活用例(国内)
表1 主要なドラッグ・リポジショニング活用例(国内)
出所:厚生労働省「新型コロナウイルス感染症COVID-19診療の手引き 第2.2版」、独立行政法人医薬品医療機器総合機構(PMDA)医療用医薬品情報、各社・各大学による公表情報をもとに政策研にて作成
既存薬の活用だけでなく、COVID-19治療を主目的とする新規医薬品の開発が国内製薬企業各社でも進められています。武田薬品工業ではCOVID-19回復患者の血清から高度免疫グロブリン製剤(H-Ig)の開発を進めており、中外製薬は、COVID-19に対する抗体医薬品の開発を進めています。こういった新規医薬品には高い有効性が期待されるものの、ドラッグ・リポジショニングに比べ特に安全性に関する検討が必要であり、実用化までにはより長期間を要すると考えられます。
-
※11富士フイルム富山化学株式会社 ニュースリリース(2020年11月17日アクセス)
-
※12理化学研究所、報道発表資料(2020年8月4日アクセス)
(2)ワクチン
治療薬と並んで、あるいはそれ以上に感染や重症化の予防に有効なワクチンに対するニーズは高く、世界中で政府等からの強力な支援を受けて、多数の候補品の研究開発が進められています。表2に世界保健機関(WHO)の情報をもとに第III相段階にあるとされている品目をまとめました。WHOの調べでは、2020年11月12日の時点で世界のいずれかの国で臨床評価段階にあるワクチンは48品目を数える※13に至っています。これらの中で、開発が先行していたBNT162b2とmRNA-1273では、それぞれの第III相試験の中間評価の結果として、重篤な副作用は認められず、良好な感染予防効果を示唆するデータが得られたとの情報が開示され※14※15、有効なワクチン実用化に向けて明るい兆しが見えてきたことから、最終的な評価結果が待たれるところです※16。
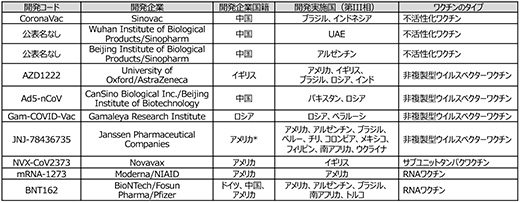 表2 第III相試験中の主要なCOVID-19ワクチン候補
表2 第III相試験中の主要なCOVID-19ワクチン候補
*親会社であるJohnson & Johnsonの本社国籍
出所:WHO Draft landscape of COVID-19 candidate vaccines (2020 Sep. 30th)、ClinicalTrials.gov、各社・各機関による公表情報をもとに政策研にて作成
国内企業によるワクチン開発では、第一三共(RNAワクチン;DS-5670)、田辺三菱製薬(植物由来ウイルス様粒子を活用したワクチン;MT-2766)、塩野義製薬(遺伝子組み換えワクチン)等、大手製薬企業だけでなく、バイオベンチャー企業であるアンジェスが自社創製したDNAワクチンの臨床試験(第I/II相)を実施している等、ワクチンの研究開発や技術ノウハウを有する企業やアカデミア等さまざまなプレイヤーが協力し合いSARS-CoV-2に対するワクチンの研究開発を進めています。
欧米諸国を中心に海外では、社会、経済活動の本格的な再開を目指してかなり前のめりに規制緩和、解除を試みていますが、より積極的に推進した国々の中には再び感染者数が増加し始める事態に陥っており、ワクチン接種開始への期待が非常に高まっています。ワクチンでは健常者が投与対象となるため、投与によるリスクとベネフィットの評価を、患者が投与対象となる治療薬に比べてより厳格かつ客観的に進める必要があります。早期開発成功への大きな期待とプレッシャーがかかる中、欧米製薬企業9社が実施中のワクチン開発に対し、安全性を最優先し、効果が確認されるまでは当局に承認を求めないとの共同声明を発表して、医薬品産業の生命関連産業としての矜持を示したことは特筆に値するものです。
-
※13WHO Draft landscape of COVID-19 candidate vaccines (2020, Nov. 12th)(2020年11月17日アクセス)
-
※14Pfizer Inc. プレスリリース(2020年8月4日アクセス)
-
※15Moderna, Inc. プレスリリース(2020年11月17日アクセス)
-
※162020年12月17日の時点では、複数のワクチンに関し、第III相臨床試験において好ましいリスク・ベネフィットが示されたとの報告がなされ、英国、米国などにおいてすでに承認あるいは緊急使用許可を受け、医療従事者や高齢者等に対して優先的に接種が開始されている。
3. 将来への備えのために
米国では2020年4~6月期の実質GDP(国内総生産、季節調整済み、速報値)が年率換算で前同期比32.9%減となり、これは1932年の大恐慌時を超える歴史的な落ち込みと伝えられ、また、本邦でも同様に27.8%減(年率換算、物価変動調整済み、速報値)と報じられているように、COVID-19パンデミックに伴う景気悪化が大きいことが確認されています。その後7~9月期には、日米欧でGDPの大幅な回復を記録したものの、10月に入り感染再拡大期に入り、景気回復の行方が見通せなくなってきました。
景気悪化の影響は、主要国、新興国を問わず、また、自動車産業、電気・電子機器産業等の製造業をはじめ、観光関連産業や飲食業等サービス業まで幅広い業種にわたっていますが、医薬品産業においては、2020年1~3月期、4~9月期いずれにおいても、そのビジネスが受けた負の影響は他産業に比べて軽微でした。また、COVID-19感染拡大によって国際物流や海外生産拠点の機能が停滞する結果、海外調達製品群の輸入減に伴う国内における医療用医薬品の供給不足や停止が一時懸念されましたが、幸いなことに大事に至らずに済みました。これは、かつて新型インフルエンザ感染症パンデミックの国内波及が懸念された際に必要な対応策と認識した、主に代替製品がない、あるいは供給が限定的な医療用医薬品を中心として、その想定必要量の生産、供給を担保するために原薬と最終製品の十分な在庫を製薬各社が確保することに努めてきたことが奏効した結果といえます。
(1)医薬品の安定供給:ハードよりソフト面の充実が重要
予断を許さないCOVID-19感染再拡大や新たな感染症パンデミックを踏まえて設置された「医療用医薬品の安定確保策に関する関係者会議」では、海外からの調達依存度の高い医薬品を中心に、国際物流の停滞による供給不足、停止に対するリスクマネジメント策として、在庫量の確保とともに国内生産力の維持策等が論じられ、2020年9月には安定確保医薬品※17を対象とする「供給不安を予防する取組」「供給不安の兆候をいち早く捕捉し早期対応に繋げるための取組」「実際に供給不安に陥った際の対応」よりなる取り組みが取りまとめられています。将来、国際物流や海外生産機能の停滞がどの程度の期間継続するかという点がポイントとなりますが、今回の経験から、およそ半年分相当の製品、原薬在庫を確保することで、数ヵ月間の国際調達製品群の供給回復まで医薬品の供給を十分維持できることを実証したといえ、少なくとも生産拠点の国内回帰のニーズはあまり高くないように見受けます。また、在庫維持に要するコストと国内生産拠点を新・増設、維持するために要するコストとの費用対効果比較も考慮する必要がありますが、そのコストと時間を勘案すると、代替製品がない、あるいは供給が限定的な医薬品にのみ焦点を当てた国内生産回帰策が最優先の選択肢とは必ずしもいえないところです。
新たな感染症パンデミックに、すでに確立した在庫管理等の対策を、より効果的、機動的に運用するためには、ハード面の強化よりも、世界中のコントロール困難な感染症に関する情報の収集と関係機関、業界へのより迅速かつオープンな共有を可能とするソフト面での対策強化が重要であると考えます。そのためには、製薬協をはじめ、一般社団法人日本経済団体連合会(経団連)、東京都等が提言している、司令塔機能としての役割を果たす専門機関の設置が望まれるところです。そのモデルといわれる米国疾病対策予防センター(Centers for Disease Control and Prevention、CDC)は、疾病、傷害、および障害の防止と管理により、健康と生活の質の向上を使命とした非常に守備範囲の広い役割と機能を有しています。ここでは、特に感染症分野に特化し、たとえば、CDC傘下の国立予防接種・呼吸器疾患センター(National Center for Immunization and Respiratory Diseases、NCIRD)や、CDCとは別の組織である国立衛生研究所(National Institutes of Health、NIH)傘下の国立アレルギー・感染症研究所(National Institute of Allergy and Infectious Diseases、NIAID)のような研究機能を併せもった機能の設置を意図しています。
-
※17日本医学会傘下の主たる学会の各専門領域において、医療上必要不可欠であって、汎用され、安定確保が求められる医薬品として提案されたもので、我が国の安全保障上、国民の生命を守るため、切れ目のない医療供給のために必要で、安定確保について特に配慮が必要とされる医薬品をいう。(医療用医薬品の安定確保策に関する関係者会議取りまとめ、2020年9月)
(2)研究開発促進:新興感染症対策に向けたインフラとインセンティブの充実が重要
いうまでもなく、感染防止と社会的、経済的活動の活性化を両立するために、治療薬やワクチンの開発成功は重要です。前述のように、国内でも製薬企業を中心に鋭意注力していますが、現状の開発ステージを比較すると、欧米企業の後塵を拝していることは否めません。その要因として、感染拡大初期における情報とその量、それに対する感度に加えて、未知の病原感染因子を取り扱う研究環境等におけるわずかな差の相乗作用によってもたらされた初動の遅れが考えられます。未知の病原感染因子の研究を進めるにあたって、少なくともその病原性等が明らかとなるまでは有効な治療法がなく、特に致死率が高い病原体と同等の高度の封じ込め実験施設(バイオセーフティレベル(BSL)-4施設)※18の利用が研究者のリスク低減の点で望ましいですが、国内では、1施設が稼働中、1施設が建設中という状況で、10施設以上を保有する米国とは大きな開きがあります。また、医薬品候補物質のSARS-CoV-2に対する抗ウイルス効果検証研究等に必要な実験施設(BSL-3)数も限られており、司令塔専門機関への設置と共用促進が即時対応に必要と考えます。
ところで、新規医薬品の製品化に必要な研究開発に長期間を要し、その成功確率が非常に低いことは、最近、一般にも徐々に認知されつつありますが、それゆえに投資の回収という点でビジネスリスクが高いといえます。わけてもCOVID-19のような流行性新興感染症の場合、さらに研究開発リスクは高く、かつ将来の市場性が不透明なため、治療薬やワクチンの製品化加速と十分量の供給確保のために公的な経済支援が重要となります。COVID-19対策として、すでに国内外で対応が図られているように、製品化に向けた資金支援、いわゆる"プッシュ型インセンティブ"と、上市された際の価格や政府による買い取り条件についてもあらかじめ保証するといった"プル型インセンティブ"の両輪が機動的に発動される仕組みが平時より確保されていることも、将来の新興感染症パンデミックへの備えとして有効と考えます。
-
※18国立感染症研究所では、SARS-CoV-2はBSL-3で、また、感染疑いのある患者由来の臨床検体は同2で取り扱うことと定めている。
https://www.niid.go.jp/niid/ja/byougen-kanri/9367-n-cov-bio.html
(3)ワクチン供給:製造キャパシティの確保が必要
最近の報道によると、日本政府が、海外の製薬企業と、開発成功時のワクチン供給に関する契約を取り交わし、その数量は数千万から1億回投与分という多大な量だとのことです。対象となる一部のワクチンについては、研究開発が成功し、国内での薬事(特例)承認のもと、供給を受けることが現実味を帯びてきつつある中、国内で最終製品を製造する品目もあるようで、すでにその受託先の目途もついているとのことですが、2017年における国内のワクチン総生産量相当量と見積もられ※19、各国がワクチン確保に動いている状況下、将来の新興感染症パンデミックに対する備えという観点からも、国内での十分な製造拠点確保も重要な課題になると考えられます。さらに、菅義偉新政権が目指すすべての国民に行きわたる量のワクチンが確保された際には、全国で混乱なく確実にワクチン接種が行われるために、恐らく必要となるであろうコールドチェーンの確保、接種体制の整備が重要であり、行政と医療機関、そして製品供給サイド間の緊密な連携が解決の鍵となるでしょう。
おわりに
今回のCOVID-19パンデミックでは、医薬品産業は、初期対応としてその社会的使命を果たすことができた一方、今後の感染拡大を抑え込むために有効な治療薬、ワクチンの開発、製造、供給に向けて改善、解決すべき課題を再認識することができました。その課題に対する対策は、将来の新興感染症パンデミックへの備えにもつながるものとなりますが、確実に達成するためには、産学官間連携が必要であり、特に司令塔専門機関の設置は、国民の健康維持に直結する戦略として重要なものになるといえます。
過去を振り返ると、古くは黒死病といわれたペスト、天然痘、インフルエンザ、発疹チフス、エイズ、SARS等、人類はさまざまな致死性感染症パンデミックの脅威にさらされ、大きな犠牲を払いながらも克服をしてきました。かつては公衆衛生面で劣悪な生活環境下にあったことに加え、原因の特定が困難であったことが大きな犠牲を払う結果につながりました。COVID-19では、感染拡大から1ヵ月が経ったかどうかという短期間に原因ウイルスが特定され、そのゲノム配列が決定され、1年も経たずに遺伝情報を利用した複数のワクチンが世界中で開発後期段階にあることは、喜ぶべき驚きです。これは、ひとえにライフサイエンス関連技術の進歩とデジタル技術に支えられた情報共有のなせる業であり、将来起こり得る新興感染症パンデミックに対しても同様に対応できる可能性が示唆され、未知の新興感染症に対し必要以上に恐怖を感じることはないのかもしれません。その一方で、公衆衛生面のインフラが整備されている国々を中心に多数のCOVID-19による死者が発生し、不幸にも全世界で100万人を超えた事実は、どのような教訓を示唆しているのでしょうか。
ロックダウン等により、かつては当たり前のように送っていた心地良い日々の生活が奪われた世界中の人々の目や耳に入る膨大な量の情報の中に、信用したい誤った情報も多く含まれているために、それらを理由に、たとえば"三密"回避の対策を取らない等といった不適切な行動を取ってしまい、クラスター感染や症状の重篤化、その結果として一部では取り返しのつかない転帰につながってしまった可能性は、一要因として否定できません。いまだに堅固な有用性が検証されたワクチンや有効な治療薬がない中、今後しばらくの間はCOVID-19リスクと共存しながら社会活動、経済活動を進めていかなければならないと考えると、感染症拡大抑止にとって最適な行動につながる正しい情報提供と正しい理解が必須であり、政府、行政、国民すべての関係者が相互に役割を果たして、社会基盤ともいうべき情報リテラシーの向上に向けた努力を続けることが重要です。
斯様に正しい情報をいち早く手にし、適切な対策と必要な行動指針を策定し、さらに新たな情報等に基づき最適化をして、タイムリーに国民に伝えること、また、併せて国民が日ごろから感染症パンデミックに対する正しい知識を身に付けられるような教育あるいは啓発活動が重要であり、そのためにも司令塔専門機関を中心に産学官が連携して機能することが重要と考えます。
(本稿は、「産業立地」誌 59巻5号 2020年9月号(一般財団法人日本立地センター)に寄稿した「医薬品産業のCOVID-19パンデミックへの対応、そして今後に向けて」をもとに、一部改訂を行ったものです)
(医薬産業政策研究所 統括研究員 村上 直人、主任研究員 鍵井 英之、澁口 朋之、枡田 竜育)

