政策研のページ 中国製薬企業による新薬臨床開発動向
2019年11月、1回以上の事前治療歴のあるマントル細胞リンパ腫(Mantle Cell Lymphoma、MCL)の治療薬として、中国BeiGene社が開発したBTK阻害剤であるBrukinsa™(一般名:zanubrutinib)が米国食品医薬品局(FDA)に迅速承認されました。中国の製薬企業はこれまでジェネリック医薬品の製造・販売を多く手掛けてきましたが、近年、新薬開発にも積極的に参画するようになり、前述の通り米国で承認される新薬も出始めています。中国製薬企業による臨床開発品目数の年次推移や、それら品目の特徴について調査しましたので報告します。
研究方法
政策研ニュースNo.44「低分子医薬品とバイオ医薬品の研究開発状況」の調査方法を参考※1にInforma社の Pharmaprojects®を用い、2019年以前はトレンドデータ、2020年に関しては2020年5月時点のデータを用いて解析を行いました。新薬上市を目指す新有効成分の品目を集計するにあたり、低分子医薬品(New Chemical Entity、NCE)、合成核酸、合成ペプチド、バイオ医薬品を選択し、かつバイオシミラーや新剤形の薬剤や合剤は集計から外しました。中国製薬企業によって開発された品目についてはその"Originator"の企業国籍から特定しました※2※3。
-
※1医薬産業政策研究所「低分子医薬品とバイオ医薬品の研究開発状況」政策研ニュース No.44(2015年3月)
-
※2Pharmaprojects®内のカテゴリーである"Originator"およびその"Company HQ Country"をもとに集計した。
-
※3政策研で行っている「創出企業の国籍」調査とは異なり、各品目の基本特許を調査したものではない。そのため、出願時の親会社が別国籍企業の可能性もある。
臨床開発品目数の年次推移
2011~2020年の10年間における中国製薬企業を"Originator"とする新有効成分のステージごとの臨床開発品目数の年次推移を図1に示します。開発ステージは各品目の中で最も進んでいるステージです※4。図1左がその集計結果ですが、この10年間で品目数は約25倍増え、2020年時点で614品目が臨床開発中であることがわかりました。一方、必ずしもそれらがすべてグローバル展開を目指しているとは限りません。図1右に示す通り、北米・欧州・日本のいずれかで開発を行っている、グローバル展開を視野に入れていると考えられる品目は2020年において614品目中93品目であり、約15%に絞られました。
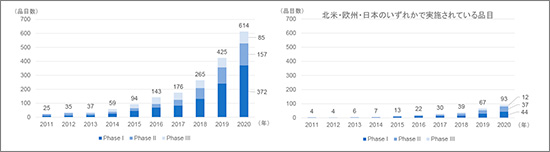 図1 中国製薬企業による臨床開発品目数の年次推移
図1 中国製薬企業による臨床開発品目数の年次推移
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
図2に臨床開発実施国の内訳を示します。2020年において614品目中、463品目(全体の75%)が中国国内のみで開発されていました。「その他」にはオーストラリアやシンガポール等が含まれます。なお、中国国外で開発が行われている品目は基本的に中国国内でも研究開発が進められていました。開発ステージに関しては、北米・欧州・日本のいずれかで開発を行っている品目のほうがPhase II以降の品目の割合が多く、安全性が確認されたものが中国国外での開発に進んでいる可能性も考えられます。
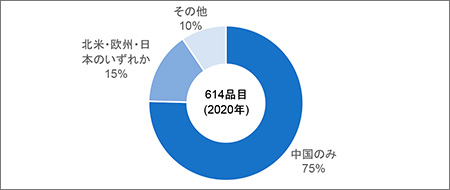 図2 臨床開発実施国の内訳
図2 臨床開発実施国の内訳
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
グローバル開発品の特徴
前節で記した通り、中国製薬企業によって創出された品目の臨床開発は主に中国国内で行われており、その一部が中国国外で開発が進められていることがわかりました。本節では、北米・欧州・日本のいずれかで開発を行っている品目(以下、グローバル開発品)について、次節では中国国内のみで開発が進められている品目についてまとめます。
グローバル開発品の特徴を図3に示します。薬効分類※5※6として一番多いのが抗腫瘍剤であり、全体の7割近くを占めました。続いて消化器官および代謝性医薬品、抗感染症薬と続きました。モダリティは6割近くを低分子医薬品が占め、モノクローナル抗体等バイオ医薬品は4割程度でした。バイオ医薬品の中では、モノクローナル抗体等抗体医薬品が7割近くを占め、後述する中国国内で積極的に開発が進められているキメラ抗原受容体発現T細胞療法(Chimeric Antigen Receptor T-cell、CAR-T)は2品目にとどまりました。なお、モノクローナル抗体(その他抗体含む)にはPD-1/PD-L1等を標的とする免疫チェックポイント阻害剤が多くを占めました。
-
※5薬効分類およびモダリティはPharmaprojects®内のカテゴリーである"Therapeutic Class"をもとに分類した。
-
※61つの品目に複数の薬効が付与されている場合もある。
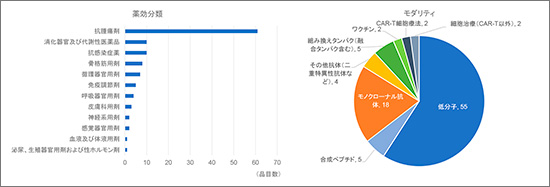 図3 グローバル開発品の特徴(2020年、93品目)
図3 グローバル開発品の特徴(2020年、93品目)
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
これら93品目の中に米国や欧州にてOrphan Drug指定等薬事上の特別措置を受けている品目は14品目確認でき、その一部としてFDAからBreakthrough Therapy指定やFast Track指定、EMA(欧州医薬品庁)からPRIME指定を受けている6品目を表1にまとめました※7。一部作用機序が明らかでないものがあるものの、いずれもFirst-in-Classと考えられるものや、これまで承認薬のない疾患を対象とした品目でした。NEUCARDIN®は組み換えヒトneuregulin-1フラグメントです。ErbB4受容体のアゴニストとして作用し、軽度から中程度の慢性心不全治療薬として開発が進められています。LCAR-B38MとCT-053はいずれもB細胞成熟抗原(B-cell maturation antigen、BCMA)を標的とするCAR-T細胞療法であり、FDAとEMAの両方から特別措置を受けています。また、LCAR-B38Mに関してはJanssen社と共同開発を行っており、中国国外ではJNJ-4528としてJanssen社が開発を行っています。albuvirtideと3-BNC117との併用療法は多剤耐性HIV感染症に対してFast Track指定を受けています。albuvirtideがFrontier Biotechnologies社の開発したHIVエンベロープのgp41アンタゴニストとして作用する合成ペプチドであり、3-BNC117はロックフェラー大学により開発されたHIVに対する中和抗体(モノクローナル抗体)です。HIV感染症治療には種々の抗ウイルス剤が上市されていますが、本開発品は感染防御の効果が期待されています。HTD-1801は原発性硬化性胆管炎(Primary Sclerosing Cholangitis、PSC)および非アルコール性脂肪肝炎(Non-Alcoholic SteatoHepatitis、NASH)に対してFDAからFast Track指定を受けている低分子医薬品です。残念ながら作用機序は明らかにされていませんが、いずれも世界でいまだ承認された医薬品が存在しない疾患です。ORIN-1001は再発・難治性転移性乳がんに対してFast Track指定を受けていますが、こちらもその作用機序は明らかにされていません。
-
※7各薬事上の特別措置の内容は、医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較」政策研ニュース No.58(2019年11月)の補足を参照。
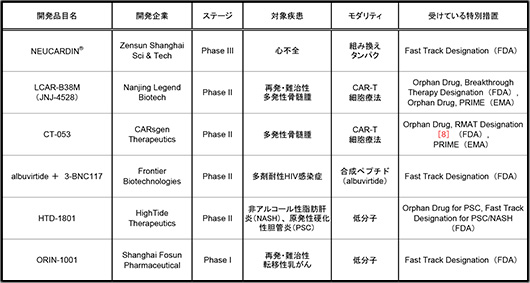 表1 海外で薬事上の特別措置を受けている中国製薬企業創生品(一部)
表1 海外で薬事上の特別措置を受けている中国製薬企業創生品(一部)
出所:Pharmaprojects®|Informa, 2020および各社公表情報をもとに医薬産業政策研究所にて作成
-
※8Regenerative Medicine Advanced Therapy(RMAT):再生医療先進治療に用いられる製品において、指定された要件を満たす製品に対し迅速承認制度等を適用し得ることを規定した制度。2016年の21st Century Cures Act.成立とともに制定された。
表2に表1記載品目の創出企業の拠点や設立年等、その創設背景を中心に概要についてまとめます。Shanghai Fosun Pharmaceutical社のようにジェネリック医薬品の製造・販売等を主としていた企業の新薬開発事業への展開もありますが、その他は2000年以降に設立された新薬開発を目的とする新興企業でした。Zensun Shanghai Sci & Tech社、CARsgen Therapeutics社、およびFrontier Biotechnologies社は国内外の研究機関在籍時の研究成果をもとに特定の疾患領域をターゲットとした創薬を行っているようでした。また、Nanjing Legend Biotech社の場合、親会社であるGenScript社がCAR-T細胞療法開発と関連の深い遺伝子合成技術を有しており、自社技術を活かした事業展開と考えられます。
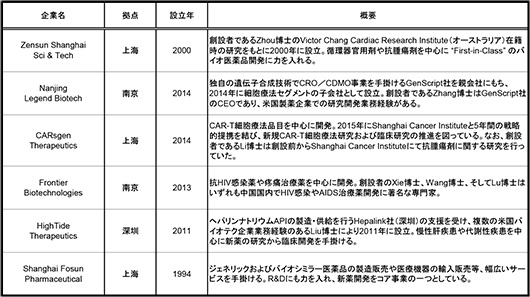 表2 表1記載品目の創出企業について
表2 表1記載品目の創出企業について
出所:各社公表情報をもとに医薬産業政策研究所にて作成
中国国内のみ開発品の特徴
中国国内でのみ開発を行っている品目の特徴を図4に示します。グローバル開発品と同様に抗腫瘍剤が最も多く、5割以上を占めました。続いて抗感染症薬、消化器官および代謝性医薬品が続きます。抗感染症薬に関してはCOVID-19の世界的流行が続いていますが、それに対するワクチンは3品目であり、2020年特異的に増加したデータではないようでした。
モダリティに関してはグローバル開発品とは傾向が異なり、低分子医薬品よりもバイオ医薬品が多くを占めました。特にワクチンやCAR-T細胞療法の割合が多いのが特徴です。ワクチンに関しては55品目中50品目が感染症に対するものであり、さらにそのほとんどがインフルエンザや肝炎ウイルスをはじめとする抗ウイルスワクチンでした。
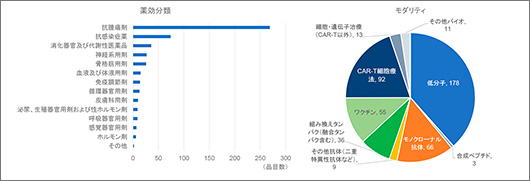 図4 中国国内のみ開発品の特徴(2020年、463品目)
図4 中国国内のみ開発品の特徴(2020年、463品目)
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
CAR-T細胞療法
前節で示した通り、中国国内においてCAR-T細胞療法の開発品目数が多く見られ、その数はモノクローナル抗体の品目数よりも多いものでした。特にここ数年、品目数増加のみならず新規企業、主に新興企業の参入が相次いでいます。図5に示すように2016年5月時点で臨床開発品が2品目、1企業として初めて確認されて以降、年々新規数としての臨床開発品目数の増加が続いています。2020年では前年に比べて46品目増加、新規に11企業が参入する等過去最高の増加数となりました。特に上海、北京、南京に拠点を構える企業が多く、バイオクラスターを形成している様子がうかがえました。
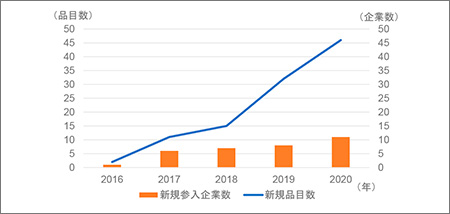 図5 CAR-T細胞療法の新規品目数推移と新規参入企業数推移
図5 CAR-T細胞療法の新規品目数推移と新規参入企業数推移
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
最後に標的とする抗原の種類を図6に示します。CD19が最も多く、TNFRSF17(B細胞成熟抗原:BCMAと同じ)が続きました。その他血液がんのみならず固形がんを標的とする抗原も複数見られますが、同じ抗原を標的とするものが多く、数自体は増加しつつあるものの今後開発が進むにつれ、品目の淘汰がある程度進むと考えられます。
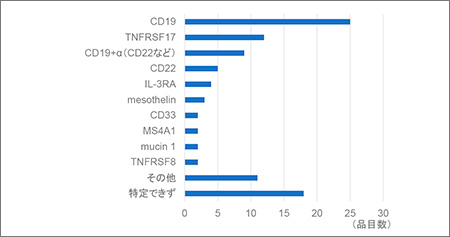 図6 標的抗原の種類と品目数
図6 標的抗原の種類と品目数
出所:Pharmaprojects®|Informa, 2020をもとに医薬産業政策研究所にて作成
まとめ
これまで見てきたように中国製薬企業による新薬開発は活発化しており、特にここ数年で品目数が急増していることがわかりました。科学技術イノベーション政策に関与する「国民経済・社会発展第13次5ヵ年計画(2016~2020年)」や、今後の製造業発展計画を記した「中国製造2025」では、バイオ医薬品開発・製造が国家の重要戦略の一つとして採り上げられており、図1に示したようなここ最近の開発品目数の増加はそれら政策の影響もあると考えられます。
品目の内訳として、その多くは抗腫瘍薬であり、特にCAR-T細胞療法等、バイオ医薬品の開発が盛んでした。中にはFDAやEMAから薬事上の特別措置に指定されている等、新興企業を中心にグローバル展開のポテンシャルをもつ品目もあり、中国製薬企業の創薬力向上が確認できました。
中国国内で特に製品化に向けた研究開発が盛んになっているCAR-T細胞療法は、上海や北京を中心に相次いでスタートアップの設立・参入が進んでおり、バイオクラスターが形成されやすい土壌であることがうかがわれます。一方、標的とする抗原に関してはすでに報告例のあるものが多く、新規性という点では課題があると言えます。
図2に示したように中国製薬企業による新薬開発はその多くが自国内でのみ行われており、グローバルに展開できる品目がまだ多くないのは各品目の新規性に課題があるためかもしれません。各々の品目について精査する必要はありますが、新薬開発が活発化していることは間違いなく、その動向について今後も注視していく必要があると考えます。
(医薬産業政策研究所 主任研究員 澁口 朋之)

