目で見る製薬産業 日米欧の新薬承認状況と審査期間の比較 2018年承認実績を中心に
医薬産業政策研究所 主任研究員 粟村眞一朗
医薬産業政策研究所では、PMDA、FDA、及びEMAがそれぞれホームページ等で公表している情報をもとに、日本、米国、及び欧州の医薬品の承認情報及び審査期間に関して継続的に収集、分析している1)。政策研ニュース第55号2)では2017年までの新薬審査期間の日米欧比較を、政策研ニュース第56号3)では2018年に日本で承認された医薬品情報に関する分析結果を報告した。今回のニュースでは、2018年に日本、米国、および欧州で承認された新薬の承認品目数、審査期間等に関して調査した。
調査方法
PMDA、FDA及びEMAのそれぞれのホームページに公表されている情報を元に、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。
日本は、政策研ニュース第56号と同様、対象はPMDAホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。NMEの集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。
米国は、FDA Center for Drug Evaluation Research(CDER)が承認した「CDER Drug and Biologic Approvals for Calendar Year」5)に掲載されているNew Drug Application(NDA)及びBiologic License Application (BLA) に該当する医薬品を対象とした。NMEの集計は、「New Molecular Entity (NME) Drug & Original BLA Calendar Year Approvals」に掲載されている医薬品を対象とした。
欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」6)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。
また、薬事上の特別措置として、日本では優先審査、迅速審査、希少疾病用医薬品、先駆け審査指定制度を、米国ではPriority Review、Orphan、Fast Track、Breakthrough Therapy、Accelerated Approvalを、欧州ではOrphan、Conditional Approval、Exceptinal Circumstances、Accelerated Assessment、Priority Medicine(PRIME)を対象に集計した。各薬事上の特別措置の内容は補足にまとめた。
新医薬品の承認品目数の日米欧比較
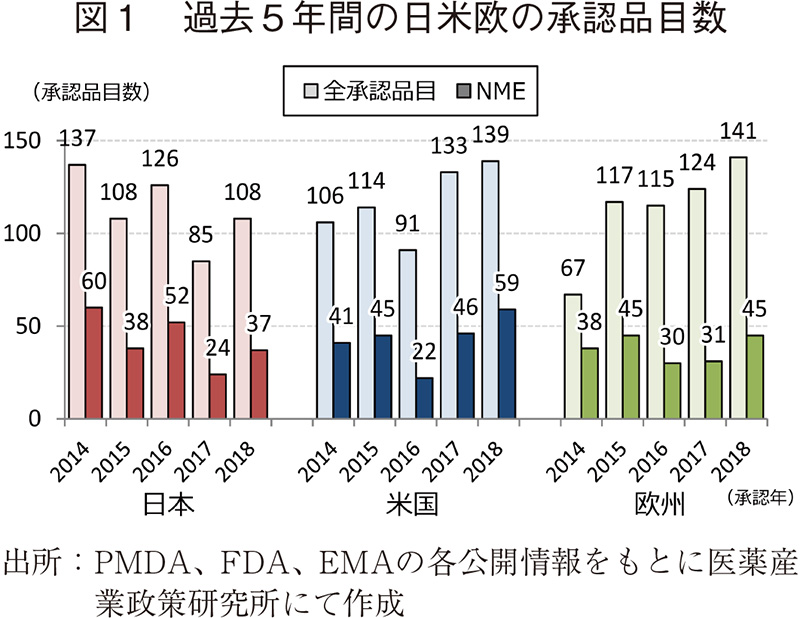
過去5年間(2014~2018年)の日本、米国、および欧州で承認された新医薬品の承認品目数を図1に示した。
日本では2018年の承認品目数が108品目、NMEが37品目であり、2017年と比較し、それぞれ23品目、13品目多かった。2014年や2016年と比較すると少なく、2015年と同程度であった。それに対し、米国では承認品目数が139品目、NMEが59品目と、承認品目数が多かった2017年より多く、いずれも過去5年間で最も多かった。欧州は2018年の承認品目数は141品目、NMEが45品目であり、過去5年間で最も多い品目数であった(2016年とNMEは同数)。
薬事上の特別措置を受けた承認品目数(NME)
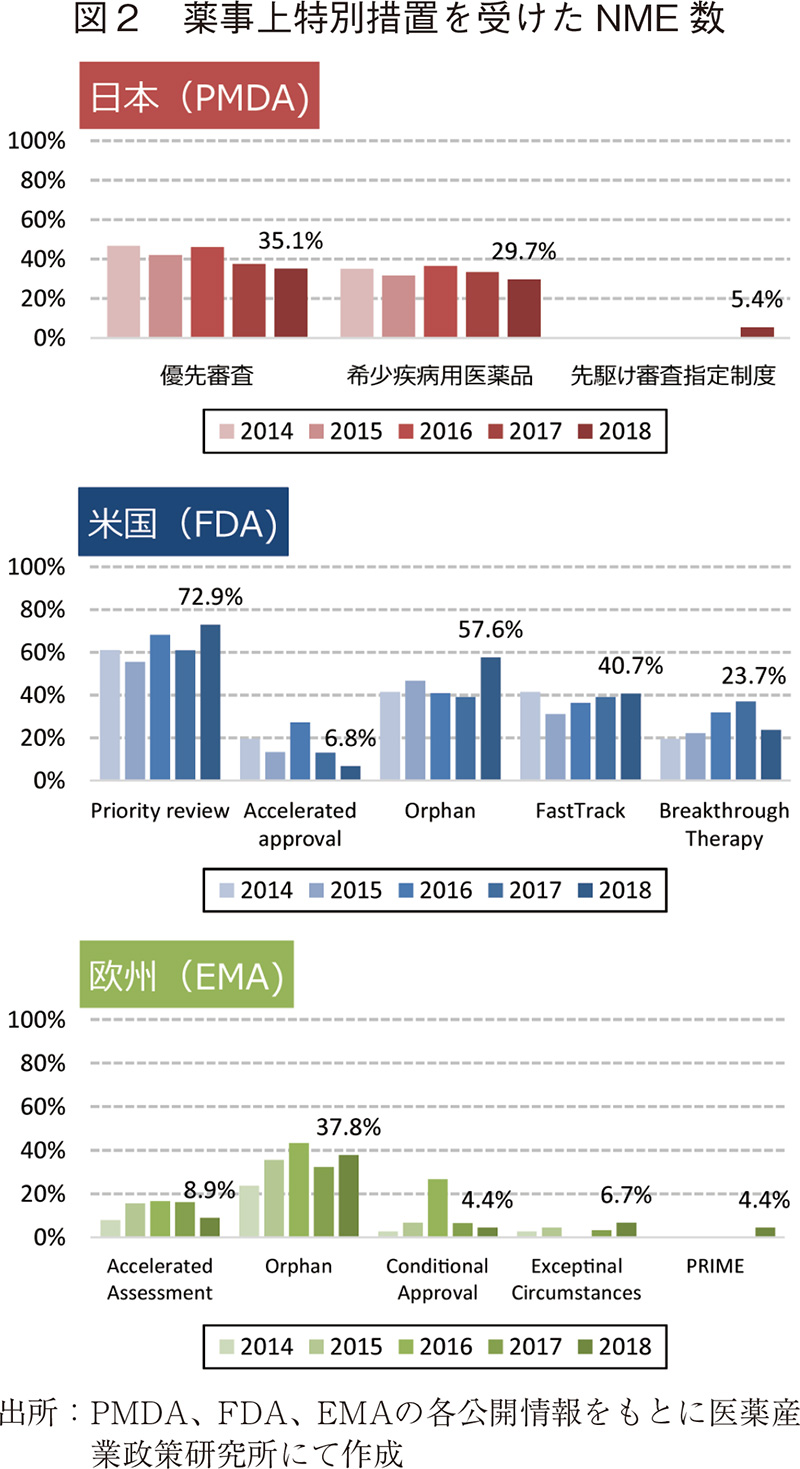
つづいて、日米欧で過去5年間(2014~2018年)に承認されたNMEのうち、薬事上の特別措置を受けた品目数について調査した(図2)。
2018年に日本で承認されたNME37品目中、優先審査(希少疾病用医薬品を含む)は13品目(35.1%)、希少疾病用医薬品は11品目(29.7%)で、先駆け審査指定制度の指定品目は2品目(同指定品目のもう1品目は新投与医薬品)であった7)。優先審査、希少疾病用医薬品は2013年以降全体の割合がそれぞれおおよそ35~45%、30~35%で推移しており、2018年は特に増加傾向は示さなかった。米国では、2018年承認されたNME59品目中、Priority reviewが43品目(72.9%)、Orphan指定品目が34品目(57.6%)と、2010年以降で最も高い割合となった。一方、Fast Track指定品目は24品目(40.7%)で、Breakthrough Therapy指定品目は14品目(23.7%)であり、Fast Trackは2017年以前と同程度、Breakthrough Therapyは2016年、2017年と比較して、その割合は低下していた。欧州については、2018年に承認されたNME45品目中、Orphan指定品目は17品目(37.8%)であったが、Accelerated Assessment、Conditional approval、Exceptinal Circumstancesはそれぞれ4品目(8.9%)、2品目(4.4%)、3品目(6.7%)と2017年以前と同様に少なかった(2016年のConditional approvalを除く)。また、欧州の新薬開発促進の措置として開始されたPRIMEの指定品目が2018年に初めて2品目(4.4%)承認された。
2018年の最も大きな特徴は米国にて希少疾病用医薬品(Orphan)の承認数が大幅に増加したことであった。新医薬品の開発が世界で最初に行われることが多い米国で8)希少疾病用医薬品の開発が増えてきていることから、欧州、日本を含め、世界的なトレンドとなる可能性もあるだろう。
2018年承認品目の審査期間の日米欧比較
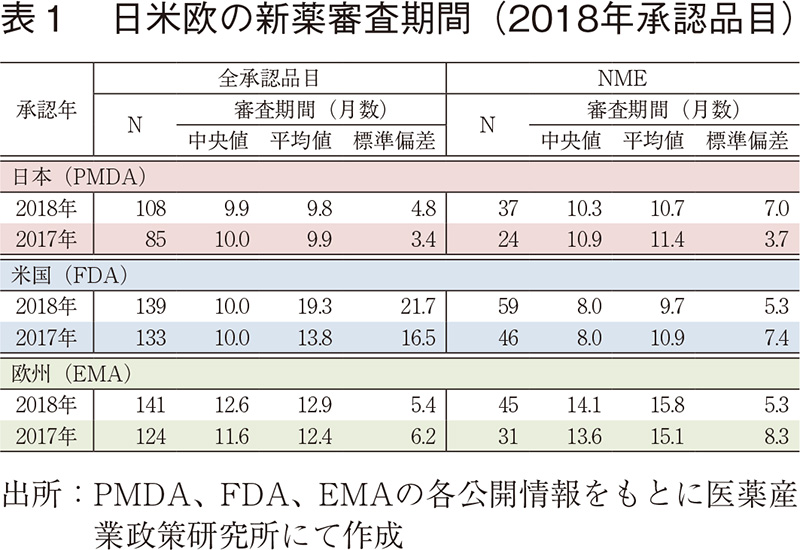
2018年承認品目の日米欧の審査期間を表1に示した。2018年承認品目のそれぞれの審査期間(中央値)は日本9.9ヶ月、米国10.0ヶ月、欧州12.6ヶ月であり、日本、米国が同様で欧州が長く、2017年と同様の結果であった。NMEに関しては、2018年承認品目の審査期間(中央値)は、日本10.3ヶ月、米国8.0ヶ月、欧州14.1ヶ月であった。日本は米国より2.3ヶ月長く、欧州より3.8ヶ月短く、こちらも2017年と同様の結果であった。米国ではNMEに占めるPriority review指定品目の割合が70%を上回り、日本の優先審査、欧州のAccelerated Assessmentと比較して高いことから、審査期間(中央値)の短縮につながっていると考える。
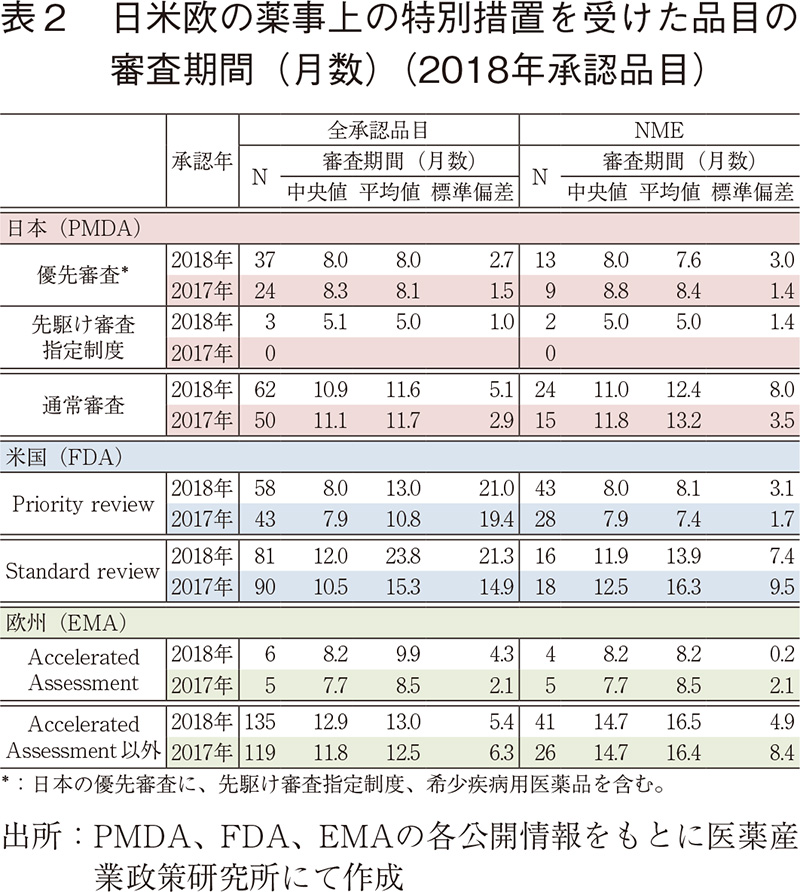
優先審査品目の審査期間の日米欧比較
2018年承認品目のうち審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆け審査指定制度、米国:Priority review、欧州:Accelerated Assessment)の指定を受けた品目の審査期間(月数)を表2に示した。日本では2018年は優先審査品目の承認数は全承認品目、NMEともに増加したが、審査期間(中央値)は8.0ケ月と2017年と同程度であり、通常審査品目と比較して審査期間は短かった。また、2018年に初めて先駆け審査指定制度の指定品目として3品目(そのうちNME2品目)が承認されたが、審査期間は5ヶ月程度と非常に短かった。米国では、2018年はPriority review指定品目の承認数が全承認品目、NMEともに2017年より大幅に増加したが、その審査期間(中央値)は2017年と同様8ヶ月程度であり、Standard review品目と比較して短かった。また、欧州では日本や米国と比較し優先的に審査を受ける品目の割合が少ないが、2018年のAccelerated Assessment指定品目の審査期間(中央値)は8.2ヶ月と2017年に引き続き、Accelerated Assessmentの指定を受けていない品目と比較して短かった。なお、PRIME指定を受けた品目が2品目(Kymriah、Yescarta)が承認されたが、これらの品目はPRIME指定を受けていることから申請当初はAccelerated assessmentの適用が検討されていたが、審査の過程でAccelerated assessmentが適切でない9)、10との判断で標準的な審査となった。これらの品目の審査期間は13.0、9.8ヶ月であった。
審査期間の中央値の年次推移(日米欧)
日本、米国及び欧州で承認された医薬品の承認年毎(2000~2018年)の審査期間(月数)を表3に、審査期間の中央値の年次推移を図3に示した。
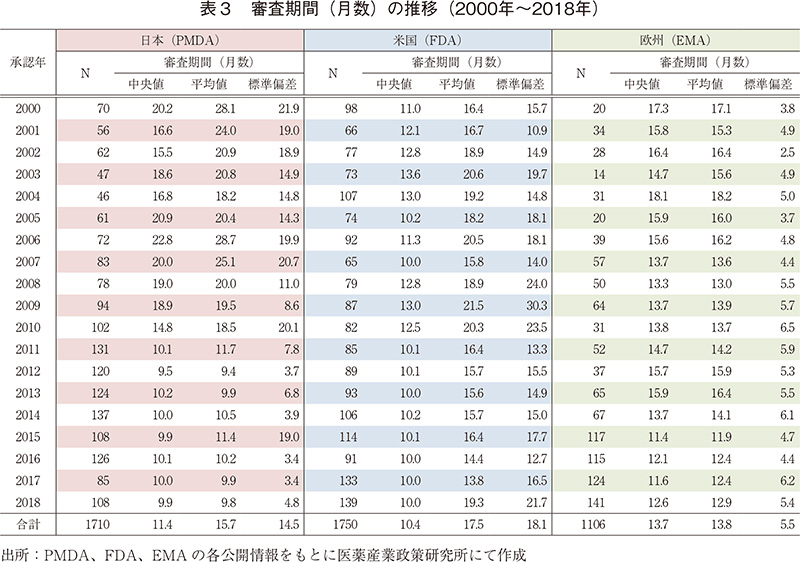
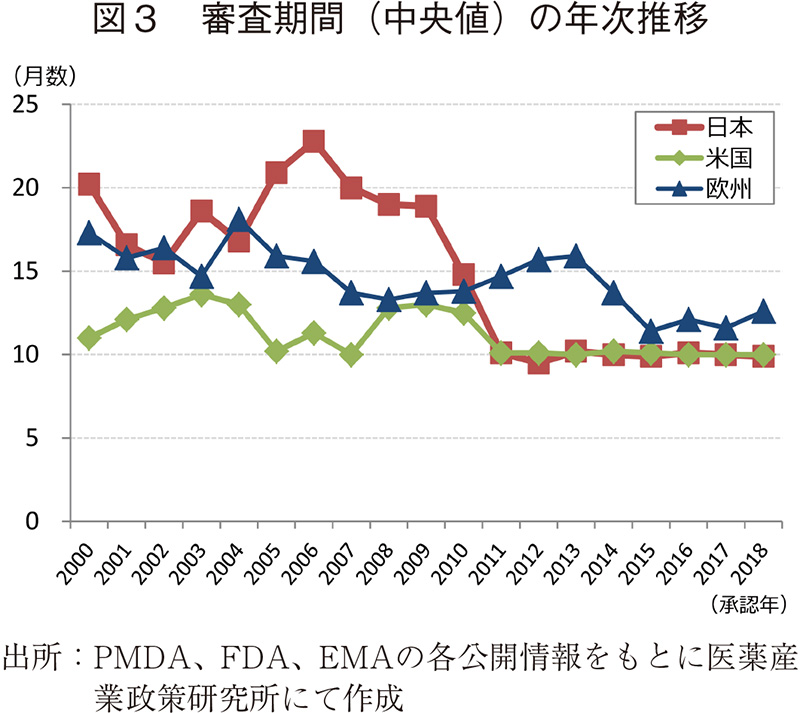
調査対象の全期間における審査期間の中央値は、日本11.4ヶ月、米国10.4ヶ月、欧州13.7ヶ月であった。2000~2010年までの期間は概ね米国、欧州、日本の順に審査期間が短かったが、2010年以降、日本では大幅な審査期間の短縮を認め、それ以降、日本と米国が同様、続いて欧州の順に審査期間が長い傾向を示すようになり、2018年も同様の結果で推移した。
まとめ
日本、米国及び欧州で2018.年に承認された新医薬品の承認品目数および審査期間について、それぞれの規制当局の公表情報を元に集計、比較した。2018年の承認品目数は、日本、米国および欧州ともに2017年と比較し増加しており、特に米国のOrphan指定品目の承認数が大幅に増加しているのが特徴であった。また、審査期間(中央値)は、日本(PMDA)は米国(FDA)と同様であり、欧州(EMA)より短い傾向を示し、2011年以降続くこの傾向は2018年も持続していた。一方、NMEに限定した場合、2017年と同様、米国の審査期間(中央値)が最も短く、日本、欧州の順であり、2017年と同様であった。米国ではNMEに占めるPriority review指定品目の割合が高く、これらの指定品目の審査期間は短かったことが大きな要因と考えられた。
日本(PMDA)では画期的な治療法のより早期の実用化を目指し、2015年から先駆け審査指定制度の試行的導入が開始され、2018年には3品目の承認があり、その審査期間の中央値は5ケ月程度と非常に短かった。また、欧州でも同様の目的で始まったPRIMEの指定を受けた品目が2018年に初めて2品目承認された。先駆け審査指定制度は、その利用により革新的医薬品がいち早く患者の元へ届けられるだけでなく、日本が世界の中で今後も魅力的な市場であるためにも重要な制度である。現在のところ指定品目数の割合は少ないが、今後、本制度が制度化され、指定品目の承認が増えることを期待したい。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「新薬審査期間の日米欧比較-2017年承認実績を中心に-」政策研ニュース No.55(2018年11月)
-
3)医薬産業政策研究所.「日本における新医薬品の承認状況と審査期間-2017年承認品目に関する調査-」政策研ニュース No.53(2018年3月)
-
4)独立行政法人医薬品医療機器総合機構 承認情報 Accessed on Sep 24,2019.
-
5)Food and Drug Administration (FDA). Drug and Biologic Approval Reports Accessed on Sep 24,2019.
-
6)European Medicines Agency Annual Reports Accessed on Sep 24,2019.
-
7)日本で2014年~2018年に承認されたNMEの中に優先審査品目を除き、迅速審査に該当する品目はなかった。
-
8)医薬産業政策研究所.「世界の売上高上位300製品の上市状況の日米欧比較 -ドラッグ・ラグの解消は進んでいるのか-」政策研ニュース No.53(2019年7月)
-
9)European Medicines Agency Kimriah:EPAR - Public assessment report(P.16) Accessed on Oct 2,2019.
-
10)European Medicines Agency Yescarta:EPAR - Public assessment report(P.17) Accessed on Oct 2,2019.

