「ICHモントリオール会合」が開催される
2025年01月14日
医薬品規制調和国際会議(ICH)の会合が、2024年11月2日~6日の日程で、カナダのモントリオールにて開催されました。会合では、全ICHメンバーが参加する総会に加え、総会に提案し議論される内容の準備やICHの運営等を検討する管理委員会等が行われました。また同期間には、12トピックの会議も並行して開催され、各専門家もモントリオールに参集しました。今回の会合でも、ICHの技術的ガイドラインについての検討や具体的なガイドライン文書の進捗が図られ、特に2つのトピックにおいて技術文書案がICH総会で承認され、ICH上重要なマイルストンであるステップ2に到達しました。
 総会全体写真
総会全体写真
ICHモントリオール会合の参加団体の内訳は、創設メンバーである日米EUの産官6団体※1、常任メンバー2団体(ヘルスカナダ、スイスメディック)、メンバー15団体※2、常任オブザーバー2団体※3、オブザーバー17団体でした。ICH会合は、対面会議が原則とされており、開催地モントリオールには世界各国から500名以上が参集し、製薬協からも作業部会の専門家を含め28名が現地参加しました。
-
※1米国食品医薬品局(FDA)、欧州委員会/欧州医薬品庁(EC/EMA)、厚生労働省/医薬品医療機器総合機構(MHLW/PMDA)、米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA)、日本製薬工業協会(JPMA)
-
※2ブラジル国家衛生監督庁(ANVISA)、アルゼンチン医薬品食品医療技術管理局(ANMAT)、メキシコ連邦衛生リスク対策委員会(COFEPRIS)、エジプト当局(EDA)、シンガポール保健科学庁(HAS)、ヨルダン食品医薬品局(JFDA)、韓国食品医薬品安全処(MFDS)、英国医薬品医療製品規制庁(MHRA)、中国国家薬品監督管理局(NMPA)、サウジアラビア食品医薬品庁(SFDA)、台湾食品薬物管理署(TFDA)、トルコ医薬品医療機器庁(TITCK)、バイオテクノロジーイノベーション協会(BIO)、世界セルフケア連盟(GSCF)、国際ジェネリック・バイオシミラー医薬品協会(IGBA)
-
※3国際製薬団体連合会(IFPMA)、世界保健機関(WHO)
以下にモントリオール会合のICH管理委員会、ICH総会を踏まえた特記事項を記載します。
1.新規メンバー、オブザーバー
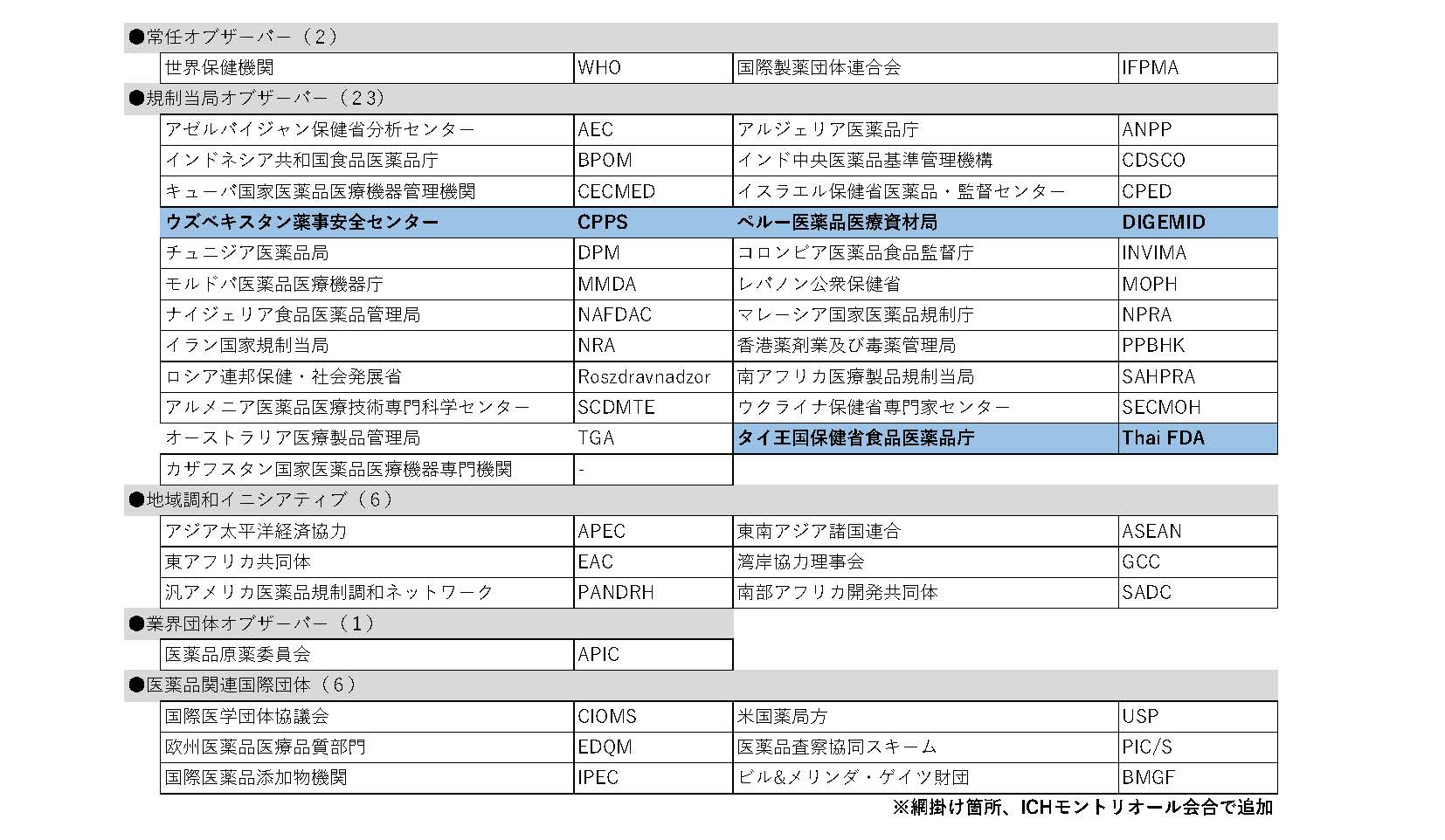
新規ICHオブザーバーには、ウズベキスタン当局(CPPS)、ペルー当局(DIGEMID)およびタイ当局(Thai FDA)の3団体より申請がありました。いずれの規制当局もICH総会にて承認され、ICHへの加盟が認められました。なお、今回ICHオブザーバーからICHメンバーへの昇格の申請はありませんでした。
この結果、ICHメンバーは23団体(増減無)、オブザーバーは38団体(3増)となり、ICH全体としては61団体の組織体制となりました(末尾の参考資料参照)。
2.ICH技術トピックの動向
今回の会合では、11の専門家作業部会(ワーキンググループ)と1つのディスカッショングループが参集しました。各グループは、普段は定期的なウェブ会議を開催していますが、この機に4日間あるいは5日間集中的に対面で会議を行い、ガイドライン作成の進捗を図るべく、ディスカッションを重ねました。
会合をもったワーキンググループおよびディスカッショングループ
- Q1/Q5C EWG:「医薬品の安定性試験ガイドライン」の改定
- Q3E EWG:医薬品の抽出物及び溶出物ガイドライン
- Q6(R1) EWG:「医薬品の規格及び試験方法の設定」の改定
- E2D(R1) EWG:承認後の安全性情報:個別症例安全性報告の取扱い及び報告のための定義と基準
- E6(R3) EWG:「医薬品の臨床試験の実施の基準」の改定
- E21 EWG:臨床試験への妊婦・授乳婦の組み入れ
- E22 EWG:患者選好試験の一般的考察
- M2 EWG:医薬品規制情報の伝送に関する電子的標準
- M4Q(R2) EWG:「コモン・テクニカル・ドキュメント-品質に関する文書の作成要領に関するガイドライン」の改定
- M11 EWG:電子的に構造化・調和された臨床試験実施計画書
- M13 EWG:即放性経口固形製剤の生物学的同等性試験
- CGTDG:細胞・遺伝子治療ディスカッショングループ
本会期中に、E6(R3)およびM15の技術文書案がICH総会で承認され、ICH上重要なマイルストンであるステップ2に到達しました。また、2024年6月のICH福岡会合以降の半年間でもM13AおよびE11Aがステップ4に到達し、それぞれICHガイドライン(英語版)が完成しました。
特にE6(R3)については、ガイドラインの本体となる包括的GCP原則および付属書1が間もなくステップ4に到達するというところまで来ています。また今回の総会でステップ2に到達した付属書2(非従来型介入試験のGCP)についても、2025年中頃にはステップ4への到達が見込まれており、いよいよGCP刷新が本格的に動き出します。
ステップ4を迎えたトピック
- M13A:即放性経口固形製剤の生物学的同等性試験(2024年7月)
-
E11A:小児用医薬品開発における外挿(2024年8月)
(ステップ4到達とは、ガイドライン案がICH総会の規制当局代表者によって最終的に合意、採択され英語版ガイドラインが確定したことを意味します。今後、各地域・国の規制当局における実装プロセスに入ります。)
ステップ2を迎えたトピック
- E6(R3) Annex 2:医薬品の臨床試験の実施に関する基準のガイドライン 付属書2(2024年11月ICH総会)
-
M15:Model-Informed Drug Development(2024年11月ICH総会)
(ステップ2到達とは、技術文書をベースにしたガイドライン案がICH総会の規制当局代表者により承認され、今後各地域・国の規制当局によってパブコメを実施していくステップ3に移行することを意味します。)
3.ICH運営
ICHのメンバー・オブザーバーが拡大する中で、近年ICH活動も多様化しており、ICH運営を持続可能な体制へと刷新する議論が2024年春以降進められてきました。組織体制や手順書の整備など、ICH事務局運営の近代化、ポートフォリオ管理などについて、今後も引き続き検討されることになります。
4.2025年新規トピック検討プロセスについて
ICHの新規トピックは、毎年ICH管理委員会での検討を経てICH総会で決定しています。2025年の検討プロセスについても、現在稼働中のワーキンググループの数や今後優先して開始されるトピックの状況などを勘案しつつ議論されました。その結果、1団体につき提案は3トピックまで、少なくとも2団体(提案者含む)が支持していること等の一定の制約はあるものの、2025年は通常のプロセスで新規トピックの選定を検討していくこととなりました。
5.ICH実施状況調査
ICHでは、加盟各国/地域でのICHガイドライン実施状況を外部組織(CIRS)に委託して調査しています。これまで2019年、2021年に調査を行ってきましたが、2024年に最新の調査が実施されました。この調査は、国際的なハーモナイゼーションの進捗状況をモニターし、規制当局のトレーニングやキャパシティビルディングのニーズを特定することなどを主な目的としていますが、2024年6月の前回会合(ICH福岡会合)で行われたICH 選出MC選挙の適格基準を規制当局メンバーが満たしているかを判断することにも活用されています。これらの調査結果に関する報告書は、すべてICHウェブサイトにて公開されており、最新の2024年の結果についても2024年10月に公表されました。
6.次回ICH会合
2025年5月10日~14日の日程で、マドリード(スペイン)にて開催予定です。
なおICHでは、ICH会合の成果を含め、ICHの活動に関する情報を積極的に公開し、関係者のみならず一般の方々に理解を深めていただけるようにしています。今回のICHモントリオール会合の成果や各トピックのコンセプトペーパー、作業計画等はICHウェブサイト(https://www.ich.org/)よりご覧いただけます。
参考資料:ICHメンバー、オブザーバー一覧(2024年11月現在)
表1:メンバー(23団体)
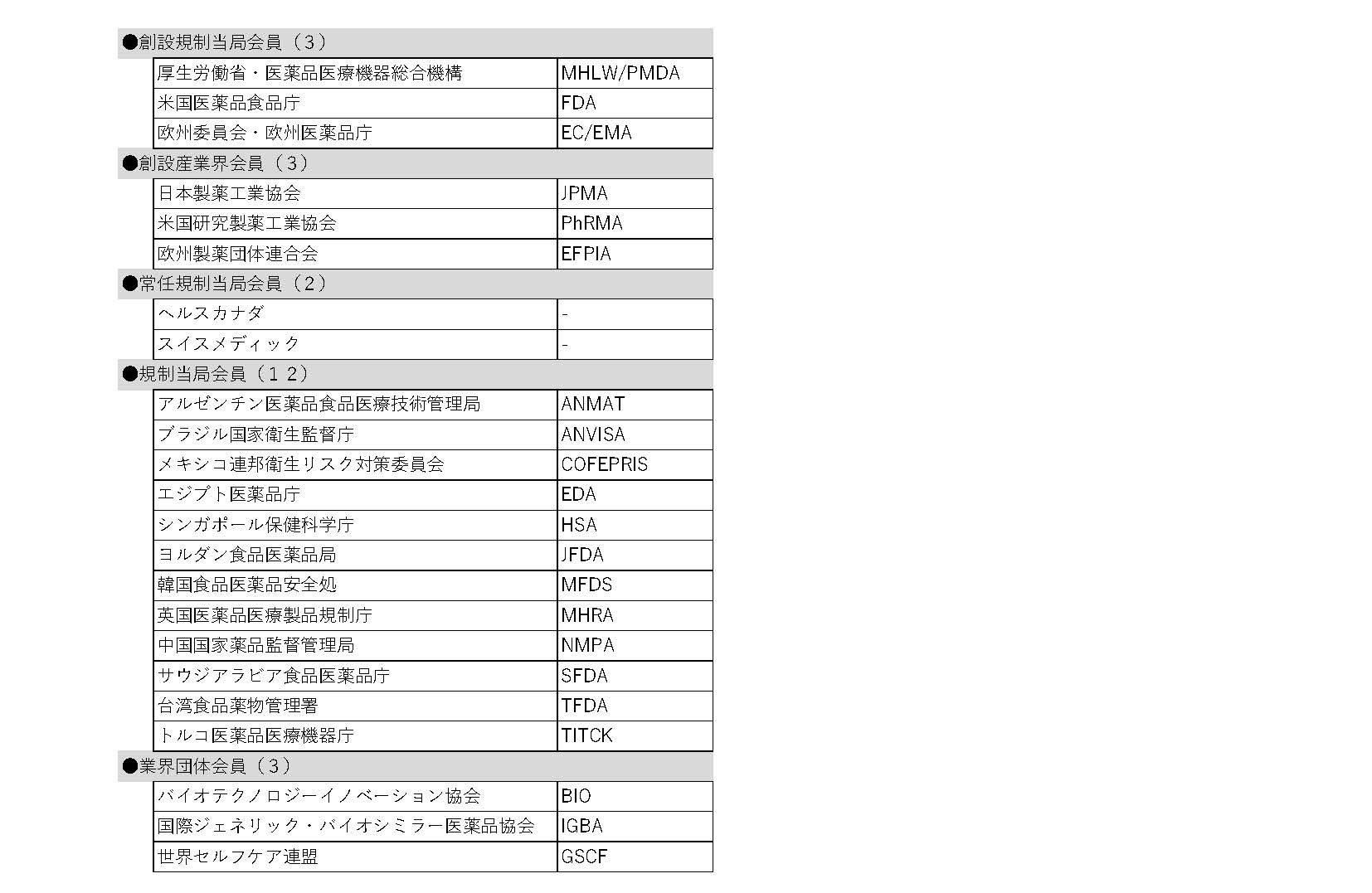
表2:オブザーバー(38団体)
(国際規制調整部長 加藤 真理子)

