経済財政運営と改革の基本方針(骨太の方針)2020に向けた提案
2020年06月10日
日本製薬工業協会
会長 中山 讓治
厚生労働大臣 加藤 勝信 殿
新型コロナウイルス感染症の世界規模での蔓延により、有効で安全な治療薬およびワクチンの迅速な研究開発と安定的な供給が強く求められている。また、今回の事態を受けて、安心で安全な社会の根幹を成すのは、国民の健康であることが改めて広く認識された。製薬産業は、パンデミックはもとより、未だ治療薬や治療方法が確立されていない疾病(アンメットメディカル)ニーズに応えること、更にはSociety5.0時代の新技術の実装により予防・先制医療を実現し、一人でも多くの人が社会の支え手として健康で豊かな生涯を全うできることに一層貢献していかなければならない。また、その他すべての疾患に必要な医薬品を安定的に供給し続けることも極めて重要であると認識している。
研究開発型製薬産業としてこの使命を果していくためには、産業自身の努力に加え、国民の安心の元になる健康・医療産業を日本の基幹産業と明確に位置付け、産学官の更なる連携によりライフサイエンス分野のイノベーション創出環境を整備することが急務である。その実現のために下記事項を提案する。
1.新型コロナウイルス感染症に対する治療薬・ワクチンの創出
新型コロナウイルス感染症の根絶は容易ではない中、治療薬およびワクチンの研究開発を進めることが収束に向う手段であり、製薬業界はこれにコミットし、鋭意努力を続けていく。その研究開発を促進し、また、供給体制を構築するための環境整備を図っていただきたい。
(1)治療薬・ワクチン創出に向けた支援
新型コロナウイルス感染症の治療薬・ワクチンの創出は、1)ドラッグ・リポジショニング、2)ワクチン、3)新規治療薬(血液製剤、未承認薬を含む)の3つのアプローチで対処していくことが有効であり、各々の対応策の支援が求められる。
1)ドラッグ・リポジショニング(既存薬の転用)による早期対応
既存の医薬品が、新型コロナウイルス感染症にも有効性が確認された場合、既存薬はヒトに対する安全性が確認済みであり、また生産供給体制も構築済みであることから、医療機関への迅速な提供が可能となるため、ドラッグ・リポジショニングは早期対応に有効である。
-
医薬品は様々な副作用を伴うため、候補薬を1つに絞り込むのではなく、複数のリポジショニング薬を準備する必要がある。既存の抗ウイルス薬のみならず、重症化予防等を目的とした既存薬等の適応拡大のための研究開発支援促進が必要である。
-
ドラッグ・リポジショニングを効率化および活性化するためには、既に承認された医薬品等をプールしたライブラリーを構築し、緊急時に迅速な薬効評価が行える体制を整備するとともに、追加された効能を評価し、薬価を加算するインセンティブ制度の導入が求められる。
-
既存薬はヒトに対する安全性が確認済みであることから、承認審査にかかる時間を大幅に短縮することが可能である。ドラッグ・リポジショニングによる効能追加については、RWDの活用体制も早期に構築し、一層の迅速承認が求められる。
2)ワクチンの研究開発及び供給体制の整備
新型コロナウイルス感染症の治療薬が創出された場合であっても、社会不安を払拭するためにはワクチンが必須である。また、ワクチンを日本国民に確実に供給するためには日本国内に生産設備を整備する必要がある。具体的には下記事項の実現が求められる。
-
国際協調によるワクチン開発に積極的に参画し(研究開発に必要な情報及び検体の共有等を含む)、技術移管等を受け、日本国内でのワクチン製造体制を整備する。
-
新興・再興パンデミックなど国家の危機管理として必要なワクチンの研究開発や生産を行う製薬企業の即応体制を整備する。(設備の新設及び維持更新。または、公的汎用施設の設置等)
-
公的機関(大学を含む)の感染症の研究に必要な設備を拡充し、また、製薬企業に一部開放する。(BSL3及び4施設、スパコン等)
-
パンデミック発生時に、日本が世界に先駆けて新規技術を用いたワクチンの研究に着手できるよう、新規ワクチンの研究開発を優先して実施する企業への支援策(補助金、税制優遇等)を行う。
3) 新規治療薬(血液製剤、未承認薬を含む)の研究開発の促進
-
欧米では政府が新型コロナウイルス感染症に対する血液製剤開発の加速に向けて強力な支援を行っている。他国で採血・開発した製品は当国内の患者に優先的に提供されることが想定されるため、日本国内においても政府が中心となり、新型コロナウイルス感染症から回復した患者からの採血・開発・供給体制を構築し、日本国内の血液製剤開発・供給を支援する必要がある。
-
パンデミック発生時だけでなく、平時から感染症領域の研究開発を振興し、研究開発力を高めておく必要がある。そのためには、新型コロナウイルスを始めとする感染症(薬剤耐性を含む)治療薬・ワクチンを研究開発する製薬企業に Pull 型インセンティブを付与することが有効である。Pull 型インセンティブとしては、諸外国で検討されている事例も含め、(ⅰ)製造販売承認取得報奨制度(Market Entry Rewards)、(ⅱ)サブスクリプション方式、(ⅲ)他製品に適用できる市場独占期間の延長制度、(ⅳ)買い取り保証制度(備蓄)、(ⅴ)薬剤プロファイルに基づく薬価事前審査制度等の導入が考えられる。新興・再興感染症治療薬・ワクチンは、いつどれだけの量が必要になるかの予測が困難であることから市場性や採算予見性が低く、このことが積極的な研究開発・設備投資を阻む大きな要因となっている。この課題を直接的に解決できる点において製造販売承認取得報償制度やサブスクリプション方式はより望ましいPull型インセンティブと言える。また、医薬品はグローバルに研究開発されるため、これらのPull 型インセンティブ策は、各国の状況に則した仕組みの構築と併せて、国際的な枠組みでの制度整備が求められる。
(2)治療薬・ワクチン創出のための全体調整推進を担う司令塔機能の確立
-
海外との連携や国内での取組みを一元管理できる司令塔機能を確立し、有効で安全な治療薬・ワクチン創出のスピードを向上する必要がある。併せて、疫学情報の最新動向や菌株・ウイルスを迅速に世界で共有する仕組みの構築が必要である。
-
国内での治療薬・ワクチンの製造・供給体制を最短で構築するには、研究開発・製造技術に関連する財政的支援に加えて、承認や臨床評価ガイドラインなどの薬事規制に関する調和・緩和、海外の政府・研究機関など様々なステークホルダーとの連携・交渉が必要である。
-
過去に比べると全体的に感染症の研究開発は活発とは言えず、アカデミアにおいても感染症の研究者は少ない状況にある。今回のパンデミックで明らかになったように感染症専門家の果たす役割は大きい。疫学の専門家や感染動向を監視できる人材を含め、感染症専門家を育成する必要がある。
2.新型コロナウイルス感染症がもたらした諸課題への対応
現在、新型コロナウイルス感染症パンデミック危機の最中にあり、世界中か らその治療薬やワクチンの創出が求められるなど創薬イノベーションへの期待は一層大きくなっている。一方、医薬品の研究開発においても、新型コロナウイルス感染症により医療機関の治験の実施に支障が生じ、上市時期が遅延するとともに、医薬品の世界的なサプライチェーンが滞るおそれがあるなど、医薬品の安定的な供給のためのコスト増が見込まれる。医薬品や医療技術は、社会の重要なインフラであるとの認識の下、創薬やライフサイエンス分野の研究開発を支援する環境の整備が重要である。具体的には下記の取り組みを要望する。
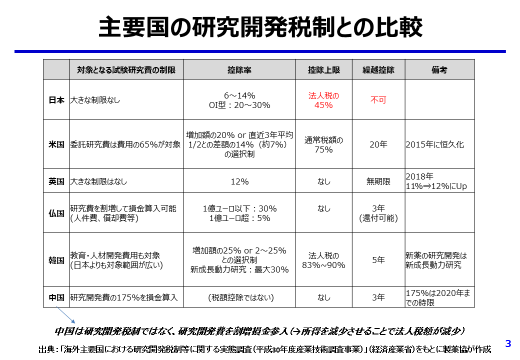
(1)税制面からの研究開発の振興【別添1参照】
日本発のイノベーション創出を一層喚起し、また、国際競争力を強化するためにも研究開発税制は大きな役割を果たしており、その維持拡充(総額型)及び手続き要件の緩和(OI型)を強く希望する。
-
総額型については、2020年度末迄の時限措置である「売上高研究開発費率が10%超の企業に対する最大10%の控除上限上乗せ措置」を2021年度以降も維持し且つ更に拡充していただきたい。また、同様に時限措置として設けられている「控除率14%」「研究開発費率10%超の追加向上率」の延長も要望する。
-
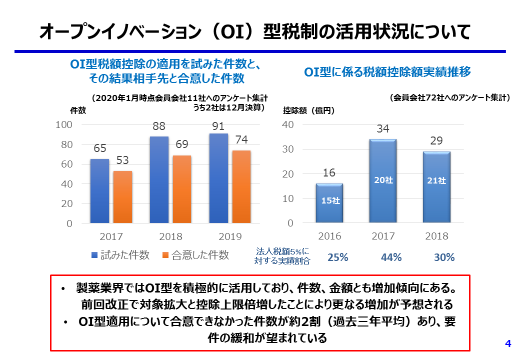
オープンイノベーション(OI)型については、手続き要件を緩和(契約書記載要件の緩和、相手先確認要件の撤廃、監査の簡略化)していただきたい。
(2)有事における医薬品産業及び医療現場の支援の在り方
製薬業界においては、新型コロナウイルス感染症に関連する物資の増産や治療薬・ワクチン等の研究・開発に迅速に取り組むとともに、すべての医薬品の安定供給の確保に注力している。また、新型コロナウイルス感染症への対応増大に伴うコストや労力など、医療現場では多大な負担を強いられており、平時とは異なる状況にあるため、必要な支援策を講じるべきである。更にこの様な中、2021年に予定されている中間年改定の実施については2023年以降に延期するべきである。
(3)医薬品の安定供給の在り方
今回の新型コロナウイルス感染症の世界的な蔓延を受け、中国をはじめとする海外からの医薬品原薬等の安定供給が懸念されている。2018年には抗菌薬セファゾリンがその原薬原材料を製造する中国の製造所からの出荷が滞る等により供給不安が問題になったが、これは感染症治療薬だけではなく医薬品全体の課題である。
-
製薬企業(製造メーカー)が、原薬等について複数の製造ルートを確保する等により、必要時に供給を容易に増やすことができる体制を整備する。(資金援助、法規制の緩和(早期製造所追加の承認許可)等)
-
緊急事態発生時に、社会的に供給継続が必要な原材料・資材等を優先的に確保することができる制度等(備蓄に対する国の助成を含む)を整備する。
-
企業は、原薬コストの削減と安定供給を両立させる必要があるが、そのためには国と企業が共に取組む必要がある。(原薬を国内生産した場合でも不採算にならない薬価の設定、重要な原薬の備蓄に関する支援等)
3.日本の創薬力を最大化するためのイノベーション基盤整備【別添2参照】
新型コロナウイルス感染症をはじめとしたパンデミック等の非常事態において、ニーズに対応した新薬を迅速に創出することの重要性が改めて認識されている。我が国において、様々な緊急事態に対応して新薬を創出して提供するためには、日頃よりその基盤づくりが重要となってくる。このため、医療情報基盤の整備と利活用、そして産学官連携による創薬基盤技術の研究開発環境の整備を実現しなければならない。日本は世界屈指の創薬国であり、優れたアカデミア、医療機関、研究開発型製薬企業が存在する。この環境を最大限活かすために、今、正に下記事項の整備に取り組んでいただきたい。
-
ゲノム医療への取り組みの加速
がんと難病のみならず、新型コロナウイルス感染症をはじめとした他の疾患にも応用可能な全ゲノムデータ等を国内に蓄積し、企業が研究開発等に利活用できる体制を構築していただきたい。そのために、全ゲノム解析等の国家戦略及びその実行に責任を持つ推進体制を整備していただきたい。ゲノムデータに加え、時系列の臨床情報を収集するとともに、質の高い生体試料を収集しオミックス解析を実施できるようにすることが重要である。 -
創薬基盤技術の高度化
医薬品開発のスピードの向上等のため、産学官連携による創薬基盤技術の高度化を一層推進していただきたい。例えば、クライオ電子顕微鏡に関しては、技術の高度化と技術者の育成についても対応が必要である。また、新型コロナウイルス感染症では、核酸などの新たなモダリティの研究開発が盛んに行われているようにモダリティの多様化に向けた取り組みや、in silicoスクリーニングによるドラッグ・リポジショニングで注目されるAI創薬の高度化などに産学官が連携して取り組まなければならない。また、研究開発を迅速に開始するあるいは長期に亘って柔軟に実施するためAMED基金の活用が重要である。 -
生活・医療に関するリアルワールドデータ利活用推進のための情報基盤整備
新型コロナウイルス感染症をはじめとした疾患に関する情報を経時的かつリアルタイムに把握でき、企業も利用可能な生活・医療情報基盤を構築していただきたい。この情報基盤は国際連携できる仕組みとすることが、感染症の世界的流行への対応には特に重要である。また、個人データの仮名化や電子的かつ単回包括的な同意取得について必要な法制化対応を行っていただきたい。さらに、治験の効率化や薬事承認申請のエビデンス等としてリアルワールドデータの利活用をより一層推進いただき、医薬品への患者アクセス向上につなげていくことが重要である。
別添1


別添2
経済財政運営と改革の基本方針2020への業界からの記載要望文言
-
ゲノム医療への取り組みの加速
2019年度の経済財政運営と改革の基本方針及び成長戦略実行計画に記載されたゲノム医療に関する取り組みをより一層加速させる。全ゲノムデータ等を国内に蓄積し、アカデミアや企業等の関係者がそれらを活用して幅広く創薬・個別化医療や早期診断の実現に向けた研究開発等を推進する体制を構築する。他国が先行する状況を鑑み、わが国において全ゲノム解析等の国家戦略をもとに計画立案および事業運営に責任を持ち強力に実行する新たな推進体制を整備の上、他国との差別化の観点からゲノム解析のみならず生体試料の収集、オミックス解析、充実した時系列の臨床情報の収集、日常生活データの収集、患者の長期のフォローアップ、他疾患への拡張性の確保を強力に実施する。同時に、個人を軸としたこれらの情報連結・マルチ情報解析の環境整備を行う。 -
創薬基盤の高度化
医薬品開発のスピードの向上等のため、産学官連携を効果的に活用した創薬基盤技術の高度化をより一層推進する。具体的には、共用体制の整備が進むクライオ電子顕微鏡に関し、今後、技術の高度化および技術者育成の取り組みを促進する。また、モダリティの多様化に向けた産学連携強化に加え、AMED基金の活用や人材交流など、官民連携の強化による研究開発も推進する。さらに、ドラッグデリバリーシステムや疾患動物モデル、AIの創薬研究への活用、データ駆動型研究環境整備等、疾患発症メカニズムの解明や予防・先制ソリューションを含む創薬研究の進展ならびに効率化・精緻化に資する、日本が高度化すべき新たな基盤技術開発体制を構築する。 -
生活・医療に関するリアルワールドデータ利活用推進のための情報基盤整備
新型コロナウイルス感染症をはじめとした疾患に関する情報を経時的かつリアルタイムに把握すること等を可能とする生活・医療情報基盤を可及的速やかに構築し、産・学・官が健康医療分野の研究開発やエビデンスに基づく医療政策の推進に資する利活用を推進する。個人の人権に配慮しつつ、電子カルテを活用したリアルタイムでのデータ収集・管理や個人データの仮名化、電子的かつ単回包括的な本人同意等の簡潔な個人データ利活用等を可能とする基盤整備や法制化を行う。医薬品等においては、開発期間の短縮や効率化を実現し、新たな治療や予防手段への患者アクセスを向上させるため、国際連携を前提としつつ、治験の効率化や薬事承認申請のエビデンス等としてリアルワールドデータの利活用をより一層推進する。
お問い合わせ先
日本製薬工業協会 広報部
- 電話
- 03-3241-0374

