トピックス 「ICHバンクーバー会合」開催される
2023年上期の医薬品規制調和国際会議(ICH)の会合が、6月9日~13日にバンクーバー(カナダ)にて開催されました。対面会議を原則に開催されましたが、新型コロナウイルス感染症(COVID-19)等の事由により渡航が難しい参加者に向けて、これまでに引き続きオンライン参加も可能として運営されました。
 全体写真
全体写真
本会合では、総会に提案し議論される内容の準備やICHの運営を担う管理委員会、全メンバーが参画する総会等が行われました。また、技術的ガイドラインについて検討する14の専門家作業部会(ワーキンググループ)の議論も同時期の6月10日~14日に並行して実施され、ICHガイドラインの作成進捗が図られました。ICH会合は、ほぼCOVID-19まん延以前の規模や運営に戻りつつあります。
バンクーバー会合の参加団体の内訳は、創設メンバーである日米EUの産官6団体※1、常任メンバー2団体、メンバー12団体※2、常任オブザーバー2団体※3、その他のオブザーバー22団体でした。現地バンクーバーには、世界各国から約450名が参加し、規模はコロナ禍後に対面会議が再開されたばかりのアテネ会合に比べ、倍の人数が参集しています。本会合には、製薬協からも32名が参加しました。
以下に、バンクーバー会合での特記事項を記載します。
-
※1米国食品医薬品局(FDA)、欧州委員会/欧州医薬品庁(EC/EMA)、厚生労働省/医薬品医療機器総合機構(MHLW/PMDA)、米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA)、日本製薬工業協会(JPMA)
-
※2ブラジル国家衛生監督庁(ANVISA)、韓国食品医薬品安全処(MFDS)、中国国家薬品監督管理局(NMPA)、シンガポール保健科学庁(HAS)、台湾食品薬物管理署(TFDA)、トルコ医薬品医療機器庁(TITCK)、サウジアラビア食品医薬品庁(SFDA)、メキシコ連邦衛生リスク対策委員会(COFEPRIS)、英国医薬品医療製品規制庁(MHRA)、バイオテクノロジーイノベーション協会(BIO)、国際ジェネリック・バイオシミラー医薬品協会(IGBA)、世界セルフケア連盟(GSCF)
-
※3世界保健機関(WHO)、国際製薬団体連合会(IFPMA)
1. 新規メンバー、オブザーバーの加入
ICHの新規メンバーとしてエジプト医薬品庁(EDA)の加入が承認され、ICHメンバーとしては初のアフリカ地域の規制当局が参画することとなりました。また、新規オブザーバーとして、ナイジェリア食品医薬品管理局(NAFDAC)の加入が承認されました。
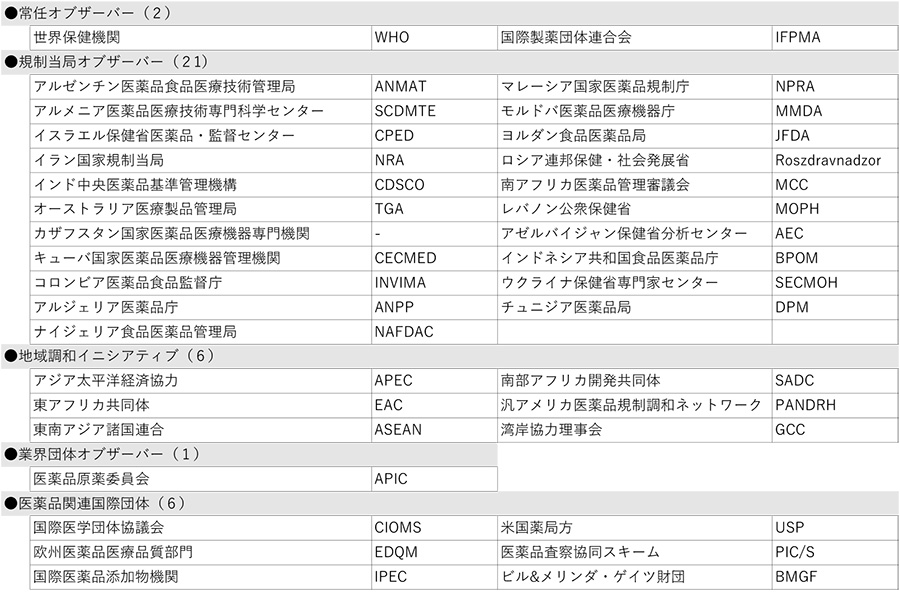
この結果、ICHメンバーは21団体、オブザーバーは36団体となり、ICHは総勢57団体の組織体制となりました(末尾の参考資料参照)。
2. 管理委員会副議長の選出
ICH管理委員会前副議長の任期途中の退任に伴い、2023年秋までの副議長任期残余期間の選挙が行われた結果、厚生労働省の安田尚之氏(現、独立行政法人医薬品医療機器総合機構執行役員)が選出されました。
3. 新規トピックの採択
バンクーバー会合では、今後、ICHで調和を図るべき3つの新規トピックが採択されました。なお、具体的な活動開始時期については、今後検討されることになっています。
| ・ | 患者選好試験に関する一般指針 |
| ・ | 核酸医薬品の非臨床安全性試験 |
| ・ | 徐放性製剤の生物学的同等性 |
4. ICHリフレクションペーパー
下記2つのリフレクションペーパーについて進捗が確認されました。
| ・ | 「医薬品の有効性に焦点を当てたリアルワールドエビデンス(RWE)の用語の国際的調和およびリアルワールドデータ(RWD)を用いた試験の計画と報告に関する一般原則の統合」のリフレクションペーパー:総会で承認され、今後ICHの公式ウェブサイトでパブリックコメントの募集が進められます。 |
| ・ | 細胞および遺伝子治療領域のリフレクションペーパー:バンクーバー会合前に承認された本リフレクションペーパーに基づいて、「細胞および遺伝子治療ディスカッショングループ」の設置が合意されました。 |
5. ICH技術トピックの動向
バンクーバー会合では、全14トピックのワーキンググループが活発な議論を行い、進捗が図られました。
会合をもったワーキンググループ
| ・ | Q1/Q5C EWG:医薬品の安定性試験ガイドラインの改定 |
| ・ | Q2(R2)/Q14 EWG:「分析法バリデーション」の改定および「分析法の開発」 |
| ・ | Q3E EWG:医薬品および生物製剤の溶出物および滲出物の評価と管理 |
| ・ | Q5A(R2)EWG:「バイオ医薬品の品質:ウイルスバリデーション」の改定 |
| ・ | Q9(R1)EWG:「品質リスクマネジメントに関するガイドライン」の改定 |
| ・ | Q13 IWG:原薬および製剤の連続生産 |
| ・ | E2D(R1)EWG:「承認後の安全性データの取扱い」の改定 |
| ・ | E6(R3)EWG:「医薬品の臨床試験の実施の基準」の改定 |
| ・ | E11A EWG:小児用医薬品開発における外挿 |
| ・ | E20 EWG:アダプティブ臨床試験 |
| ・ | E21 informal WG:臨床試験への妊婦・授乳婦の組み入れ |
| ・ | M4Q(R2)EWG:「コモン・テクニカル・ドキュメント —品質に関する文書の作成要領に関するガイドライン」の改定 |
| ・ | M13 EWG:即放性経口固形製剤の生物学的同等性試験 |
| ・ | M15 EWG:Model-Informed Drug Developmentに関する一般原則 |
今回のICH会合中にステップの移行を迎えたトピックはありませんでした。
管理委員会、総会では、全既存トピックの進捗管理等の議論も行われました。以下のトピックについては、前回のICH仁川会合以降に重要なマイルストンに到達したことが報告されています。
Step4到達
最終版(英語)が確定し、各規制当局における実装のプロセスに入ります。
| ・ | M7(R2):「潜在的発がんリスクを低減するための医薬品中DNA反応性(変異原性)・物の評価及び管理ガイドライン」およびその補遺(2023年4月) |
| ・ | S12:遺伝子治療製品の非臨床生体内分布の考え方(2023年3月) |
| ・ | Q9(R1):「品質リスクマネジメントに関するガイドライン」の改定(2023年1月) |
| ・ | E2B(R3):「個別症例安全性報告の電子的伝送に関する質疑応答集(Q&A)」の改定(2023年1月) |
Step2到達
各国・地域でパブリックコメントが実施されます。
| ・ | E6(R3):「医薬品の臨床試験の実施の基準」の改定(原則および付属文書1)(2023年5月) |
| ・ | M13A:即放性経口固形製剤の生物学的同等性試験(2022年12月) |
6. 次回ICH会合
2023年10月28日~11月1日の日程で、プラハ(チェコ)で開催予定です。次回も対面での会合を予定しています。
なおICHでは、ICH会合の成果を含め、ICHの活動に関する情報を積極的に公開し、関係者のみならず一般の方々に理解を深めていただけるようにしています。今回のICHバンクーバー会合の成果や各トピックのコンセプトペーパー、作業計画等はICHウェブサイト(https://www.ich.org/ )よりご覧いただけます。
【参考資料:ICHメンバー、オブザーバー一覧(2023年6月現在)】
表1 メンバー(21団体)
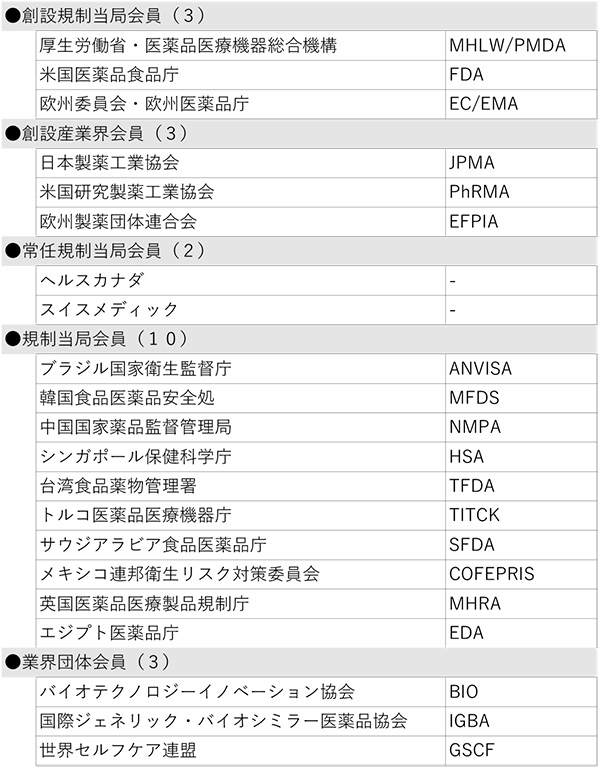
表2 オブザーバー(36団体)
(国際規制調整部長 加藤 真理子)

