トピックス 「製薬協メディアフォーラム」を開催 —ライフサイエンス分野の俯瞰から見る科学技術・イノベーションの潮流と創薬分野への示唆—
2023年2月27日、製薬協広報委員会は、室町三井ホール&カンファレンス(東京都中央区)において、国立研究開発法人科学技術振興機構(JST)研究開発戦略センター(CRDS)ライフサイエンス・臨床医学ユニットの島津博基氏による「ライフサイエンス分野の俯瞰から見る科学技術・イノベーションの潮流と創薬分野への示唆」と題したメディアフォーラムを開催しました。当日は、会場参加とオンライン参加により、17社20名の報道関係者の参加がありました。
講師の島津博基氏が所属するCRDSは、科学技術とイノベーションに特化したシンクタンクであり、国内外の研究開発動向や、海外の科学技術イノベーションに関する政策に関して広く情報を収集しています。またCRDSでは、2年に1度、「俯瞰報告書」として研究開発動向を俯瞰したレポートを発行しています。
今回の講演では、ライフサイエンス分野の俯瞰から見えてきた大きな潮流の中から、モダリティの多様化や創薬デジタルトランスフォーメーション(DX)・AI創薬をはじめ、いくつかの注目される科学技術について紹介がありました。また近年、日本の研究開発力の低下が危惧される状況において、世界の創薬分野のイノベーションシステムの潮流や、日本の創薬分野に対する示唆に至るまで、幅広い内容に関して解説がありました。
以下に、島津氏の講演内容を紹介します。
ライフサイエンス分野の俯瞰から見る科学技術・イノベーションの潮流と創薬分野への示唆
国立研究開発法人科学技術振興機構 研究開発戦略センター ライフサイエンス・臨床医学ユニット 島津 博基 氏
1. ライフサイエンス分野の俯瞰から見えてきた大きな潮流
俯瞰報告書の2021年版では、社会経済的なインパクトと科学技術的なエマージング性、定常的にウォッチしていかなければいけない基幹的な領域といったいくつかの視点から、4つの区分に分けた36の領域を選び、それぞれの領域について、国内外の研究開発動向や主要な国との研究力の比較を行いました。この36の領域を見渡し、これらをミクロな潮流として注目動向を挙げていくと、「15の注目技術、科学技術」が抽出されました(図1)。

図1 俯瞰から見えた15の注目動向

ここに挙げたような15の注目動向の多くは、スタートアップによってイノベーションが起こった、あるいは起こりつつあり、しかもその多くは、大学・国の研究機関がオリジンでした。こうした革新的な技術、あるいはイノベーションは、今の日本からは起こりにくいという課題が見えてきており、昨今、国を挙げてスタートアップに力を入れていくという流れになっています。
2. 創薬分野にかかわる科学技術の注目動向
(1)モダリティの多様化
ここから個別の注目動向をご紹介します。1つ目が、「医薬モダリティの多様化」です(図2)。1980年頃までは低分子薬が主流でしたが、その後、タンパク質・ペプチド医薬、抗体医薬といったさまざまなモダリティの薬が出てきました。業界の大きな変化の時期だったと思います。さらに最近になり、CAR-T治療のような薬が出てきたことで、薬の形としては、低分子、タンパク質、抗体、細胞といったように、基本的なモダリティとしては大体そろったのではないかと考えています。一方で、このように広いモダリティを各製薬企業や、日本の研究全体として、どのように扱っていくのかということは、今後課題になってくると思います。
図2 医薬モダリティの多様化
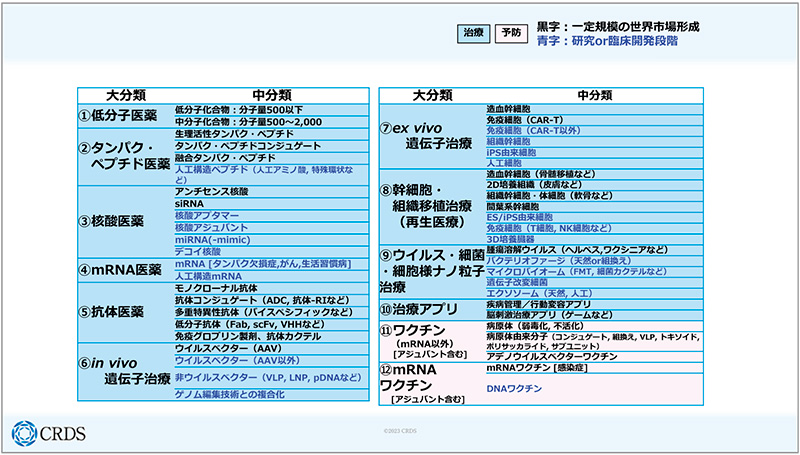
近年の画期的な創薬イノベーションの例として、「免疫チェックポイント阻害療法」「CAR-T細胞療法」「mRNAワクチン」があります。いずれも社会実装の10~15年前の時点では、ほとんどの研究者が実現不可能と思っていました。多くの有識者が難しいと言っていたことが、実際に実現するのが創薬分野なので、まさにアントレプレナーシップの象徴のような領域だと思います。
さらに、注目点をいくつか説明していきますと、以前は低分子創薬が主流でしたが、低分子は伝統的に、特定のリガンド分子が結合できるポケットをもつタンパク質を標的としてきました。つまり、標的タンパク質に小さい分子がパカッと入って、それがほかとの相互作用を阻害するといった創薬が進んできたわけです。しかしながら、それだけではターゲットにできるタンパク質に限界があり、「ターゲットが枯渇しつつある」というのが、現在の低分子薬の領域ではないかといわれています。
そこで、違った形で低分子を使う方法が研究されてきており、その1例として、ここでは「標的タンパク質分解」を紹介します。これは疾患の原因となる標的タンパク質と、そのタンパク質の分解機構に関与しているタンパク質の両方に結合できる低分子化合物を経口投与することによって、両タンパク質を近接させ、疾患の原因となるタンパク質を減少させる手法です。このような、これまでの低分子創薬ではターゲットとできなかったようなタンパク質もターゲットにすることによって、低分子薬の可能性をさらに広げていく試みがなされています。
次に、研究開発段階の新たなモダリティとして「細胞外微粒子(エクソソーム)」があります。これは、細胞から放出される膜小胞です。その中には、DNAやmRNA、タンパク質等、さまざまなものが入っており、それが体中を駆けめぐっているということが、この10~15年ぐらいでわかってきました。現在、こういった体内をめぐっているエクソソームを、ドラッグデリバリーや、エクソソームの表面に既存薬を発現させる等で、創薬に利用できないかといった研究が行われています。
3つ目は「光遺伝学」です。これは、光でタンパク質を制御する遺伝子治療の一種であり、ノーベル賞のベスト3に入る候補といわれています。光遺伝学は、実際に治療に用いられており、基礎研究の段階としては、さまざまな神経変性疾患に使える可能性があるという研究も多く行われています。
モダリティの動向の最後は、「デジタルセラピューティクス(DTx)」です。以前は、歩数カウンターのような「健康増進アプリ」が主流でしたが、2010年に初めて米国食品医薬品局(FDA)から糖尿病の治療補助アプリが承認されて以降、スマホで自分の病態を管理しながら治療していくといったDTxがたくさん出てきています。日本からもニコチン依存症の治療アプリをはじめ、高血圧や不眠症等、すでに3つが承認されています。日本の製薬企業も、DTxベンダーであるベンチャー企業と組んで、このモダリティに挑戦しています。
(2)創薬DX、AI創薬
創薬DX、AI創薬に関しては、2019年から2020年にかけて、AI創薬によって発見された化合物を前臨床に進めたという論文が出始めました。日本企業も海外のスタートアップと協業を始めた頃であり、2020年はAI創薬元年だったのではないかと思います。
注目動向としては、Googleの子会社のAlphaFold社が、タンパク質の立体構造予測を非常に高い精度でできるようになったというニュースがありました。これは2021年度のサイエンス誌のブレークスルー・オブ・ザ・イヤーにも選ばれています。この技術のすごいところは、わずか数年の間に、実際に2億個を超えるタンパク質を予測して公開しているところです。さらに面白いのは、人工のタンパク質のアミノ酸配列をコンピューターで自由に設計できるということです。こうした天然にはない「人工のタンパク質」をうまく使って創薬に活かす研究では、ワシントン大学のDavid Baker氏の研究室が非常に有名で、そこから実際に多くのベンチャー企業も生まれています。
AI創薬の進展としては、医薬品候補としてAI開発で臨床試験に入ったものが約20品目あるということが、2022年の論文で報告されました。さらに、以前は低分子をAIで見つけた、という研究が主流でしたが、今では抗体のような複雑な物質にも使われるようになり、AIを活用して新しいモノクローナル抗体、バイオ医薬品を発見する企業がいくつか出てきています。
今後、ますますAIが創薬に使われていくうえで、非常に重要となっていくのはデータの品質とサイズになってきます。これに関連して、発見の自動化・自律化についてご説明します。1つの流れとしてディスカバリー(発見)の自動化、特に自律化が、研究あるいはスタートアップの事例として出てきています。この研究では、クローズドループ※1というのがキーワードになっており、きちんとクローズドループを作ることによって、情報がフィードバックされて新しいものが見つかっていきます。キーとなるのは当然AIですが、データ生成の方法としては、ジェネレーティブAI※2の生成モデルを利用することによって、今後はさらに複雑な物質もたくさん作れるようになるかもしれません。
-
※1出力された結果が入力にフィードバック(再入力)されることで循環する制御方式
-
※2生成AIとも呼ばれ、データから学習し新しい制作物やコンテンツを、イチから創造的に生み出すことができるAI
さらに、AI創薬企業のいくつかは、AIトレーニング用の社内データの生成能力を向上させるために、社内にロボット化されたラボ施設を構築することを試みています。データがないのであればロボティクスを活用したハイスループット実験を用いて、実際にデータを作ってしまえば良いという発想です。
次に、イメージングを活用したハイスループット技術を紹介します。超解像顕微鏡というノーベル賞を取った技術がありますが、細胞の中のタンパク質がマクロにどういう構造になっているかは、現在、顕微鏡レベルで見られるようになってきています。これをAIと組み合わせることによって、たとえば、細胞を何万とプレートに並べ、どのタンパク質を見るか決めておき、それぞれ並んでいるところに違う薬剤を振りかける実験を行うことで、万単位の細胞で、しかも中のタンパク質レベルで、たくさんの情報をいっぺんに追いかけることができる、そういう取り組みが可能な時代になっています。
もう1つ先端科学技術の活用として、シングルセルオミックス解析を紹介します。昔は、がん組織を分析する際には、「がん細胞のかたまり」として分析していました。つまり、「平均値」を見ていましたが、今は、シングルセルオミックス技術が非常に発展してきて、がん細胞を取り出して、1細胞ずつ分けて特徴を見ることができ、がん細胞の微小環境についてのプロファイリングが可能になっています。
創薬というのは、本当にこのようなバイオインフォマティクス、イメージング、細胞分子生物学、ヒト遺伝学といった高度な技術の統合で行われる時代になっています。それがさらにハイスループット化によって、精度が高く、情報量が爆発する形で行われるようになってきたのが現在の状況だと思います。
今まではディスカバリー(探索)ステージでの話でしたが、もう少し創薬における後半の工程を進めていく中での研究として、臓器チップやオルガノイド※3といった技術が扱われる時代になってきています。その背景としては、1つに実験用サルの輸送制限や輸出禁止、東南アジアによる違法捕獲等の社会課題が顕在化している問題があります。2つ目には、FDAで治験の一部をこうした技術に置き換えることが認められました。
-
※3ミニ臓器とも呼ばれる。幹細胞から試験管の中等、生体外で作られる立体的な組織
このような2つの要因から、今後も治験の一部を臓器チップやオルガノイドに置き換えていくことによって、ディスカバリーの前臨床研究と、ヒトの臨床結果の接続性が良くなっていくのではないかと思います。この分野はまだ少し先が長いかもしれませんが、すでにいくつかのスタートアップ企業が誕生しています。
最後に、臨床試験等へのAIの活用として、分散型臨床研究を紹介します。患者さんをリクルートする際にAIを使う方法や、さらには治験に参加している患者さんをリモートでウォッチしたり、ランダム化比較試験の合成対象群をシミュレーションに置き換えたりといった研究がなされており、治験にもAIがさまざまなかかわりで使われようとしています。
これまで、1980年代に「バイオ医薬品」、1990年代に「ゲノミクス」と、創薬の大きなトレンドがありましたが、2010年代からの「AI・DX」というのは、これらと同じぐらい大きなトレンドとして、今後も中長期に続いていくと思います。また創薬というのは、最も知識集約型かつ異分野連携型の科学技術・産業であり、オミックス技術やゲノム編集技術、クライオ電子顕微鏡や超解像顕微鏡、さらにはAIやシミュレーション計算等、こうした技術をフル活用して取り組まねばならず、今後ますます難しい時代になってくるのではないかと感じます。
また、多くの技術が欧米発であり、日本はどうしても技術研究が軽視されがちで、なかなか異分野連携も進んでいません。さらに、本日ご紹介した先端技術は、研究コストが非常に高いのも課題で、そのような研究に今後どうやって参加していくかということも考えていかないとなりません。
(3)ヘルスケア・トランスフォーメーション
これまで治療や創薬DXの話をしてきましたが、予防や診断の部分にも、当然DXは使われてきています。大きな潮流としては、やはり治療から予防へ、さらに「画一」から「個別化」「層別化」の予防・診断・治療へという流れがあると思います。
世界ではヘルスケアのファンディング(ヘルスケア分野の投資)は、実は8兆円ぐらいありますが、そのうち8分の3くらいは、「デジタルヘルス分野への投資」になっています。世界でヘルステックや、デジタルヘルスのスタートアップが非常に多くユニコーン化しています。
日本はこの分野で遅れています。そもそもDXというのは、「AI」「クラウド」「デバイス等からのリアルワールドデータ」、この3つの技術的発展が必要です。これまで述べてきた創薬の分野というのは、企業対企業で取り引きする分野ですが、世界中でデジタルヘルスやヘルステックのスタートアップがたくさん生まれているのは、どちらかというとB to Cの分野であり、個人向けになにかサービスを提供する分野です。お金がたくさん動くことから、こういった分野が注目されています。
医療応用という点では、以前は医療機関にある医療機器から出てくるデータだけを見ていれば良かったわけですが、日常生活で用いるウェアラブルデバイス、スマートウォッチ等からデータが取れる時代になりました。さらにスマートフォンや、家の中でもモニタリングシステムを付ければ1日中データが取れる、生理行動環境データが集まる、ということで、そうしたデータを活用したサービスが注目されています。
1つ目が、予防診断に使う「リキッドバイオプシー」です。血液や尿中には、いろいろな疾患のシグナルが出ていることが研究からわかってきています。その血液や尿から、早い段階でいろいろな疾患が検出できるのではないかと考えられています。現在、臨床試験を行っているケースでは、50種類のがんを1回の採血で検出でき、しかもどのようながんなのかも含めて検出が可能であり、偽陽性率は1%未満ということです。
こういったサービスが社会に出てくると、今の社会とは少し変わってくるのではないかと思います。こうした分野にはコンパニオン診断薬※4といった活用もあるので、製薬メガファーマもかなり投資をしています。現在は、圧倒的にがん中心に進んでいますが、今後10年くらいで神経変性疾患等にも適用が進んでいき、社会実装されるのではないかと思います。
-
※4医薬品とセットで開発される、特定の治療薬専用の診断薬
次に、デジタルバイオマーカーです。一番わかりやすいのはスマートウォッチですが、それ以外にも人間の体のシグナルをモニタリングして、さまざまなデバイスで遠隔モニタリングができるようになっています。たとえば、糖尿病患者さんの持続血糖モニター(CGM)が主流になっていますが、Apple社のスマートウォッチで、実際に皮膚に針を刺さなくても、モニタリングができるようになるのでは、というニュースもありました。
さらにデジタルバイオマーカーとして、ブレイン・マシン・インタフェースの研究が進んでいます。実際に診断に使われていたり、脊髄損傷の患者さんがなにか物を考えるだけで、手足が動く、コンピューターを操作できる、といったような応用例もあります。また、治療として埋め込みデバイスを利用した報告も出てきています。
ここからまた少し話が変わりますが、DXのほかの使い方としては、医師の臨床意思決定支援(クリニカル・ディシジョン・サポート)があります。この分野が最初に進んだのは中国です。中国の平安保険グループでは、オンライン問診や、遠隔診療を用いて、診療効率化を実施しています。この背景には電子カルテを効率的にデータとして使用していることがあると思います。
ほかにも英国のバビロンヘルス社では、LINEのようなチャットボット型のアプリに、自分がこういう症状だというのを入力すると、AIが自動で回答を返してくれるサービスを提供しています。これは正式な診断ではありませんが、こういったことが可能になっています。さらに、医療記録の入力効率化ということで、MicrosoftがNuance社を2兆円で買収したりと、この分野は、今後も非常に拡大が期待されています。
最後に、GoogleやMicrosoft、Appleが、どういった領域に注目しているかというレポートでは、リモート臨床試験やデジタルバイオマーカー、あとはAI創薬といったところが挙がっています。今後、中長期的には薬による治療の一部が、こうしたデジタルバイオマーカー等の予防サービスによって代替されていくのではないかと思います。
米国のように民間の会社や保険会社を中心に、こうしたリアルワールドエビデンスが集められていく国に対して、日本はなかなかそうはなっていかないと思います。ですから、やはり国を中心になんらかのデータを社会で共有していく枠組みが必要ではないかと思います。そこで、次世代医療基盤法があるわけですが、今後もこういった部分を拡充・進化させていかなければならないことは、日本の課題だと思います。
3. 創薬分野のイノベーションシステムの潮流
バイオベンチャーと技術の歴史を簡単に振り返ってみると、1976年に世界初のバイオベンチャー「ジェネンテック社」が設立されて以来、さまざまなモダリティや技術が登場し、スタートアップの潮流がたくさん出てきました。2010年代に入って、さらにたくさんの新しい技術が出てきたことによってスタートアップの文化が根づき、現在、スタートアップが非常に盛り上がっている状況になっています。米国を例にとると、革新的な科学技術の登場と、ベンチャーやスタートアップの立ち上げが同時進行的に進んでいます。一方で、日本はそのようになっておらず、科学技術とベンチャーの立ち上げにギャップが生まれているというのが見て取れます。
図3 バイオベンチャーと技術の歴史
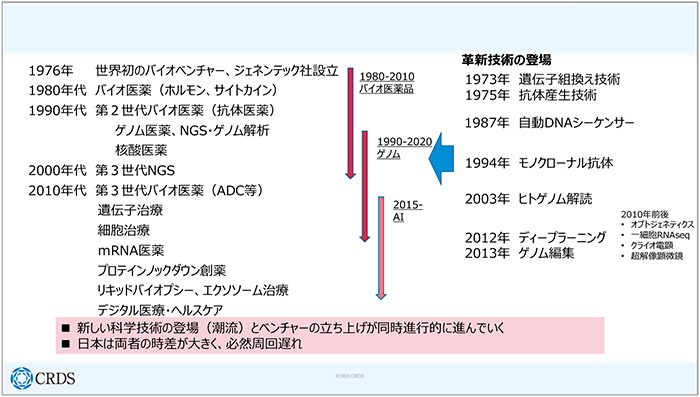
バイオ医薬品の台頭を見ていくと、2000年は、医薬品全体における低分子医薬品の割合が約8割でしたが、2020年には低分子医薬品と抗体・組み換えタンパクの割合が5対3ぐらいになっています。1976年から第1世代のバイオベンチャーが次々と誕生しました。そこから30年くらいかけて、バイオ医薬品が医薬品の半数くらいの割合になっています。今、細胞治療とか遺伝子治療、核酸医薬品というものが、少しずつ市場に出てきていますので、将来的にはこうした新しいモダリティが、医薬品全体の3割ぐらいになるといったことも、まったく不思議ではないと考えています。
このような変化の間、さらになにが起こってきたかというと、研究開発費が非常に上がってきました。1医薬品あたりの開発費で見てみると、約1000億円から3000億円になります。一方で、日本の製薬企業の上位10社の平均研究開発費は2000億円弱ですので、この問題をどう考えていくかが重要になります。
研究開発費と同時に見ていかなければならないのが、コーポレート・ベンチャー・キャピタル(CVC)※5の投資活動です。2011年以降、いわゆる世界的な製薬メガファーマのCVCが、投資件数が多かった企業ランキングにたくさん並んでいます。つまり、研究開発費だけではなく、出資という形でもオープンイノベーションがどんどん進んでいることがわかります。
-
※5事業会社(大企業)がベンチャー企業に対して、出資や支援を行うことを目的に組織したファンド
このように、イノベーションは研究開発の動向だけを見ていては判断できない状況になっています。メガファーマのM&A対象企業の約8割はスタートアップです。そのうちアカデミア発が4割近くもありました。2014年以降に、国内外の買収案件の平均額を単純にとると、一件あたり約2000億円となります。先ほど1開発品あたりの開発費が約1000億~3000億円という話がありましたけれども、こうした研究開発費、出資、買収といったさまざまな形で、非常に資本がモノをいう世界になってきている、というのが1つの問題だと思います。もう1つは、国内外で日本のベンチャー企業が買収対象となった事例がほぼないという現実です。
そのような中、2023年1月に、モデルナ社が立教大学発のスタートアップであるオリシロジェノミクス社を、約110億円で買収したというニュースがありました。これは日本の大学スタートアップあるいはバイオ分野の技術移転史/スタートアップ史において、非常に画期的な出来事であると認識しています。今まで買収があっても、おそらく10億円程度の規模でしたが、初めて日本のバイオのスタートアップで3桁億円のオーダーで買収が起こったことで、今後もこういったニュースが続いていくと良いなと感じています。
こうした背景のもと、FDAのフェーズ1に入った件数を見てみると、2011年にはスタートアップが約3割だったのが、2021年には約6割になっています。当然フェーズ1に入る前に、スタートアップを大企業が買収しているケースがあるでしょうから、実質的には6割以上がスタートアップ発になっていると思います。
これを見ると、創薬分野においては、イノベーションモデルの変化は決定的だといえます。さらに、日本は数少ない新薬創出国ではあるものの、バイオベンチャーの台頭や資本がモノをいう時代になってきていることから、残念ながら、その存在感が少しずつ低下しつつあるのではないかということが見て取れます。
4. 日本の創薬分野への示唆
これまで創薬を取り巻く状況として、ターゲットの枯渇、モダリティの多様化、DX/AIの進展といったものがありました。こうした事象を同時に考えていくと、外部環境でもあり内部環境でもあるDX/AIの存在感はますます大きくなっていくでしょう。メガファーマですら自社のリソースだけでは不十分なので、国内外のアカデミア/スタートアップとのオープンイノベーションが大前提となります。そのような中で、日本のアカデミアにどういった強みがあるかをまとめると、日本の研究者が論文で高く評価されているのは、こうした分野になると思います(図4)。
図4 日本のアカデミアの強みの例
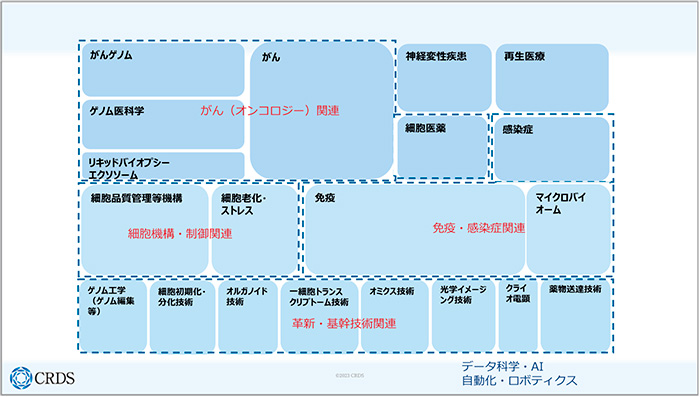
日本のアカデミアの強みは大きく分けると4つくらいになり、1つは「がん(オンコロジー)関連」の分野です。2つ目が「細胞機構・制御関連」で、オートファジーや、老化の研究でも最近目立った研究があります。3つ目は「免疫・感染症関連」で、日本は免疫の領域では以前から強いといわれてきており、最近はマイクロバイオームでも少し目立った研究が出てきています。最後に「革新・基幹技術関連」です。
このような4つくらいの日本のアカデミアの強みを、なんとか総動員して創薬に活用していければ良いと思います。一方で、データ科学やAIは最近たくさん学部ができており、これから研究者も出てくると思いますが、そうした研究者がたくさん出てくるまでの間をどうするかという課題はあります。
本日の最後に、こうした日本の強みや日本の製薬産業の状況を踏まえて、革新的な創薬につながり得る注目テーマの例とアカデミアの貢献を考えてみます。ターゲット分子や細胞を探すというところは、アカデミア/スタートアップが生命科学や医科学の分野でさまざまな発見をすることによって今後伸びていくと思います。個々の医薬モダリティは製薬企業が得意ですが、ターゲット分子と医薬モダリティの橋渡しをするケミカルバイオロジーや合成生物学といった分野は、アカデミア/スタートアップに頑張ってほしいと思っています。また、リキッドバイオプシーやAI創薬も、アカデミア/スタートアップの知見を使っていく分野であると考えています(図5)。
図5 革新的な創薬につながり得る注目テーマの例とアカデミアの貢献

(広報部長 足立 尊史)

