トップニュース 「製薬協会長記者会見」を開催 医薬品産業政策の本格的な議論に向けて:現状と課題認識
2022年1月20日、野村コンファレンスプラザ日本橋(東京都中央区)にて、「製薬協会長記者会見」を開催しました。製薬協の岡田安史会長から、「医薬品産業政策の議論開始にあたって:現状と課題認識」を中心に、約25分間の発表がありました。当日は、感染症拡大防止の観点から、Web配信の形式であったものの、40名21社の報道関係者の参加があり、活発な質疑が交わされました。以下、岡田会長の発表内容と質疑応答を紹介します。
 会見の様子
会見の様子
「令和4年度薬価制度改革」について
「令和4年度薬価制度改革」に対する製薬協の見解については、すでにステートメントを発出しています。製薬業界の主張の最も大切な点であるイノベーションの評価に一定の改善が行われたことをポジティブに受け止めています。一方で、2022年に議論される2023年の中間年薬価改定のあり方については、薬価制度の抜本改革で示された「乖離率が大きな品目について薬価改定を行う」という趣旨に立ち戻って議論したいと考えています。
医薬品産業政策の議論開始にあたって:現状と課題認識
2021年9月に、厚生労働省より8年ぶりに「医薬品産業ビジョン2021」が発出されました。国家を挙げて医薬品産業政策を講じるべきであるとの機運が高まるなか、いよいよ官民による議論が開始されます。これまでの議論の延長線上や個別各論ではなく、国家を挙げて国民の健康と、日本経済の成長を支える医薬品産業政策のあり方を議論していきたいと考えています。その議論を控え、医薬品産業とその政策を取り巻く現状と、課題認識について説明します。
 製薬協 岡田 安史 会長
製薬協 岡田 安史 会長
1. 革新的医薬品の医療への貢献
今一度、みなさんとしっかり共有したいことは、革新的な医薬品が果たしてきた貢献の大きさです。製薬産業は、「なんとか病気を治したい」という患者さんに希望をお届けし、不可能を可能にし、また健康寿命の延伸に多大なる貢献を果たしてきたと確信しています。
画期的なリウマチ薬の登場によって、リウマチ患者さんの多くの身体障害が軽減され、関節手術も大きく減少し、クオリティ・オブ・ライフ(QOL)も大きく向上しました。HIV治療薬の事例では、HIVは不治の病といわれましたが、革新的な医薬品による多剤併用療法が確立したことにより、死亡者は大きく減少しました。また感染しても長期に日常生活を送ることができ、寿命も非感染者と同程度にまでなりました。
画期的新薬が疾病治療を劇的に変えた代表例には、革新的なC型肝炎治療薬の登場があり、肝炎、肝硬変、肝がんの患者さんは大きく減少しています。
現在、日本人の死因第1位となっている「がん」についても、画期的な治療薬の開発、手術や診断技術等の医療の進歩も相まって、ステージ4となる転移性の大腸がん、乳がん、前立腺がんの患者さんの5年生存率は、いずれも年々延びています。先日、がんの専門医でもある独立行政法人医薬品医療機器総合機構(PMDA)理事長の藤原康弘氏も、抗がん剤のもたらした恩恵は非常に大きい、とお話しされていました。昔は、がんと診断された患者さんがほんの数ヵ月で亡くなってしまう場合も多かったが、今では画期的な抗がん剤の登場によって、QOLを維持しながら、大きく延命できるようになっているとのことです。
革新的新薬がもたらした恩恵には、モダリティの多様化もあります。従来の低分子化合物中心の創薬から、バイオテクノロジーの発展により抗体医薬や遺伝子治療が生まれました。また、デジタル技術の発展によるデジタルセラピューティクス(DTx)と呼ばれるデジタル医療も生まれました。2020年に承認された禁煙補助アプリはその代表例です。さらに海外では、AI等を活用して、診断から処方箋発行までを、無人で行う取り組みが始められており、今後もデジタル技術を活用した画期的な医療が進展、普及していくと確信しています。
2. トータルヘルスケアソリューション実現に向けて
新たな創薬技術を活用して革新的な新薬を生み出すためには、日本において確固たる製薬産業基盤の確立が必要です。そのためには、「ライフサイエンスクラスター」、「ビッグデータ基盤」、そして「薬価制度」の3つの歯車が、がっちりとかみ合って回ることが重要です。
製薬産業が果たすべき役割は、今や新薬創出にとどまらないと考えています。公的医療保険下での活動についても、革新的新薬の創出だけではなく、リアルワールドデータ、あるいはAI等のデジタル技術を駆使して、医療の高質化、効率化を果たしていかなければなりません。健康医療ビッグデータの利活用では、たとえば、どのような背景をもつ人が疾患にかかりやすいのか、疾病の発症前になにが起きているのか等が、詳細に解析されつつある時代になりました。今後、製薬産業は、ITデジタル企業や、データを取り扱う企業との連携によって、発症リスクの予測や、生活習慣改善アプリ等の予知・予防、予後といった領域、そして公的医療保険の外側にもおよぶソリューションの提供も視野に入れていかなければなりません。公的医療保険でカバーする領域の線の引き方は、イノベーションの推進と国民皆保険の持続性の両立という観点からも、今後の大きな論点になると思っています。
トータルヘルスケアソリューションを実現するためには、健康医療ビッグデータの利活用と、それを可能とする環境整備が非常に重要です。発症リスクの予測や生活習慣改善アプリ等の開発には、ゲノム情報や詳細な医療情報が必要であり、健康医療ビッグデータ基盤の構築とそれを利活用できる環境が整備されるよう、さまざまなステークホルダーのみなさんとの議論により、いっそう積極的に向き合いたいと考えています。
新型コロナウイルス感染症に対するワクチンのシーズが、ベンチャーやアカデミア由来であったことは象徴的ですが、今や新薬の多くがベンチャーやアカデミア由来です。言い換えれば、ベンチャーが次々と生まれてくるイノベーションエコシステムを日本に構築することが重要です。2021年度補正予算では、日本からヘルスケア領域においてイノベーションを生み出そうとする想いが強く打ち出されていました。成功例となるロールモデルを、いかに日本において作るかが重要であり、製薬産業が要の役割をしっかり果たしていきたいと強く思っています。
3. 成長する世界市場と横ばいの日本市場
医薬品市場に目を転じると、直近5年間の医薬品市場の推移において、世界市場は1.3倍に成長しています。対して、日本は微減となっています。一体、日本市場ではなにが起こっているのでしょうか。
医薬品市場構成の推移では、日本の製薬産業が長期収載品に依存するモデルから、より創薬力をもつ産業構造に転換するという基本方針のもと、長期収載品市場が大きく縮小し、後発品市場が伸びていることが明確に現れています。一方で、特許品市場は横ばいです。
特許品について、2015年以降に、売上高上位10位に該当した品目の保険収載時の薬価を100%として、その後の薬価推移を示してみると、各種再算定や薬価制度の抜本改革により、ほとんどの品目で薬価が維持されず、引き下げを受けています。上位10位に入る市場規模の大きい品目、見方を変えれば、市場での評価が高い品目の薬価を引き下げることで、特許品市場の伸びも抑えられてきました。
製薬協はさまざまな機会において、特許期間中における新薬の薬価維持を強く主張してきました。革新的新薬の価格、すなわち「新薬の価値」は、特許期間中において維持されるとのグローバルスタンダードな考え方に基づく主張です。2015年以降に、売上高上位10位に該当した品目について、代表的な先進創薬国であるドイツでは、10品目以上で100%、あるいはそれ以上の価格となっています。欧米では薬剤の価値が守られ、日本では引き下げられている実態が一目瞭然です(図1)。日本では薬価収載時に欧米と大きく乖離しない薬価が算定されたとしても、その後、特許期間中に薬価が引き下げられ、海外の価格との乖離が大きくなることがあり得ます。
図1 イノベーションの評価における世界との乖離
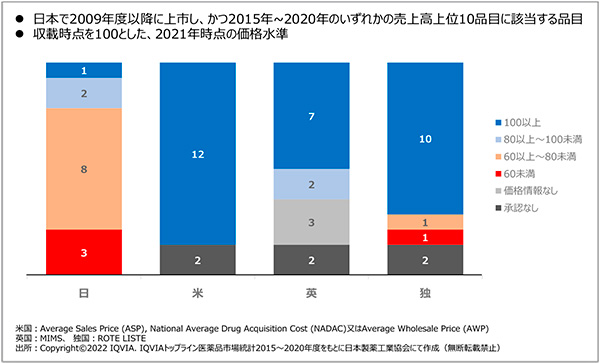
海外で販売されている一方で、日本では未承認の薬剤品目数の推移において、直近の5年間に欧米で承認された246品目のうち、日本ではその72%にあたる176品目が未承認です。特許期間中の薬価引き下げだけによるとはいえませんが、それが影響を与えている可能性があると考えています。新薬が海外のベンチャーやアカデミア発のものが多くなっており、日本では開発されていない、そもそも日本人における医療ニーズがない、といった理由もあると認識していますが、年々日本で未承認薬が増加している傾向は、日本市場の魅力が低下し、開発の優先順位が下がっていることの現れではないかと考えています。言葉を換えれば、まさに「ドラッグラグの兆し」として、強い危機感をもっています。
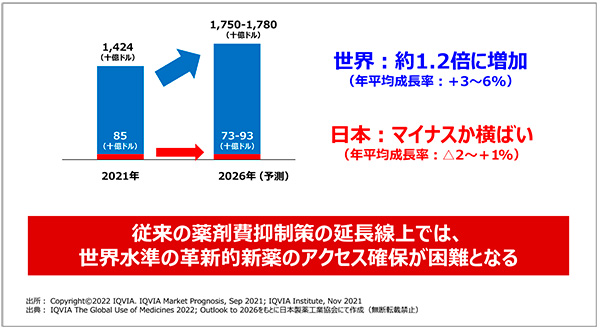
さて、今後5年間の市場予測についても少し触れたいと思います。IQVIAの予測では、世界市場は引き続き3~6%成長し、一方で日本市場はマイナスもしくは横ばいです(図2)。このような市場予測を現実のものとするわけにはいきません。従来の延長線上の薬価引き下げ策を継続することが限界を迎えていることを直視しなければいけません。
図2 この市場予測が現実化すると…
4. 世界最高水準の医療をいかにして国民のみなさんにお届けし続けるか
高齢化の進展等により、今後さらに保険財政が逼迫する中で、イノベーションと国民皆保険の両立を図るためには、これまでの枠組みを超えた議論が必要です(図3)。公的医療保険の給付範囲や、負担構造の見直しといった国民的な議論も不可欠になってきます。医薬品についても、画期的な治療効果をもたらす「新薬」から「上市以降に臨床的な位置付けが変化した薬剤」まで、すべてが公的医療保険でカバーされている現状を見直す必要も出てくると考えています。また、特許期間中の新薬、長期収載品、ジェネリックと大別すると、価格を構成する要素や役割が異なることは明らかです。その特性に合わせて、グローバルスタンダードの観点から、価格のあり方を議論することも必要と考えています。革新的新薬については、医療的な価値のみならず、労働生産性の改善等、多様な価値が評価されるべきであることは、昨今製薬協からも主張しています。一方で、新薬の中でも、さらに薬価のメリハリを強化するという議論があることも当然承知しています。
図3 世界最高水準の医療をいかにして国民のみなさんにお届けし続けるか

「医薬品産業ビジョン2021」の官民における議論には、以上ご説明した現状認識、課題認識のもとで、しっかりと向き合いたいと考えています。
主な質疑応答
 質疑応答の様子
質疑応答の様子
 |
日本において、特許期間中でも薬価が下がる状況の中、現行の制度をどのように変えていくべきか? 薬価制度と公的医療保険制度について、改善してほしい点は具体的にあるか? |
 |
改善要望の範囲を具体的にどこまで広げるかについては思案中である。医薬品市場は成長すべきだが、すべて公的医療保険でカバーされるべきだとは考えておらず、その線引きについては、従来の延長線上にない議論が必要である。 製薬協は、2021年の非常に厳しい中間年改定を受けてアドボカシー活動を強化し、さまざまな政府関係者や、政策決定に影響のある方々と議論している。社会保障については、さまざまなステークホルダーと、受益と負担に関する議論なしでは社会保障制度が立ちいかないことを共通認識できている。 医薬品市場に関して、従来の延長線上の線引きを超え、公的医療保険の枠の外の部分について議論を行わないと、日本の社会保障制度、イノベーションの推進と国民皆保険の持続性の両立は、お題目になってしまうと考えている。 |
 |
今後の政策論議のスケジュールとなる「骨太の方針」策定、中間年薬価改定、次期2024年度薬価改定等の節目の議論に向けて、どのようなアドボカシー活動や、メッセージ発信を行うのか? |
 |
議論は大きく2つあり、中間年改定や調整幅等も含めた個別各論の議論、中長期的な製薬産業の取り組みに関する議論が、並行して進むことになる。前者だけにとどまらないよう、後者の議論をしっかり行っていきたい。 ご指摘の通り、「骨太の方針」策定や2022年度の予算編成、中央社会保険医療協議会(中医協)の議論等の節目がある。その節目に応じて、製薬協として対応をしていく。そうした意味でのアドボカシー活動を今後も継続していきたい。 |
 |
「すべてを公的医療保険で行うべきでない」との発言の意図は、「公的医療保険でカバーしていない範囲を強化する」あるいは、「今まで保険でカバーされていた部分に対し、保険制度自体の枠組みを変更すべきである」のどちらの意味を示すか? |
 |
両方の意味を示す。予防と予後に関する強化として公的医療保険の外側に対するソリューションの提供はもちろんだが、公的医療保険で現在カバーされている部分についても議論しないと、医薬品市場の成長の芽であるイノベーションを削ぐことになる。 |
 |
厚生労働省による緊急時の医薬品承認制度の新設等、2022年度中にも迅速な承認の仕組みができそうである。それらに対する製薬協の見解は?承認制度に限らず、改善点や要望があれば聞かせてほしい。 |
 |
緊急承認制度については、新型コロナウイルス感染症に対する国産ワクチンの開発が遅れていることを受けて至った判断と認識しており、当局のさまざまな対応に感謝している。有効性の推定を採り入れた緊急承認の発動は、承認の選択肢が増える一方、上市後の安全性監視が非常に重要と考えている。 緊急承認制度に関する議論は、2021年12月27日の厚生科学審議会医薬品医療機器制度部会での取りまとめが公表されている。製薬業界としてもしっかり受け止め、この議論に対する予見性をもった緊急時の治療薬や予防薬の開発に取り組んでいく。 有効性については推定、安全性については十分確認することが明記されているため、これらのエビデンス創出をできる限りスピーディーに行う体制づくりに取り組む。製薬協の各委員会は、最近2年間の新型コロナウイルスへの取り組みを踏まえて、日本の製薬産業が実現可能な対応や、実現するための工夫について検討を進めている。加えて、欧米各国政府のさまざまな支援についても調べ、共有している。2021年6月に示されたワクチンに対する国家戦略を受けて、関連予算措置として、2021年度の補正予算で手当てされていることにしっかりと応えたい。国、企業、アカデミアが一緒になって取り組まなければならない。 |
 |
2020年度から新型コロナウイルス感染症関連の予算が拡充され、政府も対応に本腰を入れている印象がある。一方で、政府の対応として、薬価制度にてイノベーション評価を加えたものの、2022年度も薬価の引き下げを決定したことは矛盾しているように感じる。この点についての見解は? |
 |
ワクチン関連に対しては、さまざまな国家予算が措置されてきた。特にパンデミックや感染症対策は、国家安全保障や、その危機管理における最重要な政策課題である。その認識のもと、各企業が個別に備えるよりも、平時から国家として備えるべき課題であると捉えている。したがって、今回の予算で、政府が本腰を入れて予算を充当したことを非常にありがたく思う。また、これは産学官一体となって取り組むべき課題であると考えている。一方で、新薬の薬価について、切り込みがあったことは指摘の通りである。日本の創薬力低下を懸念される中で、国を挙げて医薬品産業政策に向けた議論もなされている。矛盾はまさにその通りで、この流れを止め、従来の延長線上にはない議論を行いたいと考えている。 |
 |
国内未承認薬の品目数の増加だけではなく、薬剤の種類も重要と考える。アンメット・メディカル・ニーズを満たす薬剤すら、承認されない実態があるならば、非常に大きな問題である。追加の分析があれば教えてほしい。 |
 |
海外の新興バイオ系医薬品企業が開発した薬剤が、日本ではまだ承認されておらず、品目としては「がん」と「感染症・ウイルス関連」が多い状況である。今後、医薬産業政策研究所と連携して分析し、結果が出たら改めて説明する。 |
 |
コロナ禍において、貧富の格差拡大が問題視されている。公的医療保険の見直しは、さらなる格差拡大を助長することにもなり兼ねない。この格差問題についての見解や製薬協内の議論について教えてほしい。 |
 |
自助・共助・公助において、どこまでを社会保障に求めるかについて、国民のみなさんも含めて議論する段階になっており、アドボカシー活動を含めた取り組みにて、国民のみなさんに課題を認識いただくことが重要であると考えている。 |
 |
発表に「医薬品産業政策の議論開始にあたって」とあったが、議論はこれまでも続いていたように思う。「議論開始」とは、どういう意図か? |
 |
健康寿命の延伸や、国の成長を支えるという大きな観点からの議論が、本当の意味では開始されていないと考えている。そのため、あえて「本格議論を開始する」と表記したとともに、これが最後のチャンスでもある、という想いをもっている。 |
 |
本日話のあった「目指す議論」について、ワーキンググループ等の設置、中長期的な検討や、その結果の発表について計画はあるか。 |
 |
中長期の議論に関しては、「医薬品産業ビジョン2021」の実現に向けて、厚生労働省の関係者と検討の進め方について意見交換している。これまで「製薬協は、現実をあまり直視せずに、自分の畑だけをなんとかしてくれ、という主張である」といった指摘も多くあったことから、現実に向き合ったうえで、政策決定に影響力のある方を含めた関係者と、議論をしていく。 |
 |
今後の政策論議については、主要方針策定等のスケジュールを踏まえて対応していくと製薬協の白石順一理事長から回答があったが、当局案に対するカウンターのみになり、防御的な提案になるのではないか? 製薬協の目指す議論案の全体像を示すプラン等はあるか? |
 |
産業政策にどのように向き合うかについては、議論を進めるにあたって、少なくとも官と十分な検討を行う。目指すべき産業像を数値的な指標も含めて示したい。 |
 |
日本の財政が厳しい現状を踏まえ、国民の理解を得るために、製薬協としてのビジョンをどのように示していくか? |
 |
研究開発型の企業で構成される製薬協だけではなく、業界団体を超えてビジョンを示す必要があるが、業界団体を超えてビジョンの合意形成をすることは、非常に難しいことだと感じている。ドラッグラグの解消や、予防への取り組みの必要性を強く感じていることから、グローバルなコンセンサスが、すぐに形成できるかは別として、日本の医薬品産業論におけるビジョンを示したいと考えている。 |
 |
現時点で、具体的な製薬産業像はあるか? |
 |
基本スタンスは、本日示した「国民の健康寿命の延伸を支え、日本経済を牽引し得る最先端の産業でありたい」である。さらに、日本経済の成長に寄与するエコシステムは、日本でイノベーションが生まれる基盤であり、エコシステム構築にしっかりと取り組まないと、「日本という国に未来はない」と考える。 最終的な薬価だけでなく、イノベーションを生むエコシステム、また、圧倒的な効率化につながる日本のデータを利活用できる環境を整備することが大きなポイントであり、これらが実現できた社会というのは、大きく様変わりしているはずである。製薬産業が中心となって、これらの議論をリードしていかなければならない、という気概をもっている。 |
 |
毎年の薬価や調整幅等を改定する現行の薬価制度に対しては、どのようなスタンスで臨むのか? |
 |
中間年薬価改定に関しては、改定の範囲や乖離率について、そもそもの議論に立ち戻る必要がある。調整幅については、現状の2%が理論的に正しいか否かの議論はあるが、経済合理的な価格のバラつきを吸収する機能として、最低限の2%が設定されており、薬剤流通の安定のために必要である。したがって、調整幅引き下げの議論に関しては、今は見直すべきではないと考えている。 |
 |
以前から日本では治験が進みにくいといわれており、新型コロナウイルス感染症に対するワクチン開発についても治験着手が遅れたことで、承認の遅れにもつながった印象である。この点に関して、どのような改善が必要だと考えているか? |
 |
日本の治験の遅れに関して、特に健康な成人が治験に参加する場合は、国民皆保険制度下で、あえて治験に参加する、という国民のモチベーションが、諸外国に比べて弱いという実態がある。日本発の薬剤については、国際協調、特にアジア諸国と治験のネットワークを広げる取り組みも必要である。日本の治験環境を、すぐさま劇的に変えることは難しいため、緊急承認制度は、日本の実態を十分理解されたうえでの検討であったと考えている。 |
 |
日本ではリアルワールドデータが十分に活用されていないことも、薬剤開発の遅れにつながっていると考えるが、そこに対してはどのような見解か? |
 |
リアルワールドデータについては、さまざまな基準や規格を揃えるための議論がなされている。これまでは、電子カルテの利活用を含め、「使わせてほしい」とのリクエストに終始していたが、現在は、具体的な基準を定めたデータの連結仕様によって、「創薬や製造販売後調査へ活用することにコミットし、ともに作っていく」段階にきており、このような議論が各所で行われていると認識している。 |
(広報委員会 メディアリレーション部会 岩田 尚之)

