政策研のページ 新薬における創薬モダリティのトレンド —多様化/高分子化の流れと、進化する低分子医薬—
近年、核酸医薬・細胞治療・遺伝子治療等、さまざまな新規モダリティによる医薬品の実用化例が増加しています。また、新型コロナウイルス感染症(COVID-19)パンデミックにおいても、mRNAワクチン・ウイルスベクターワクチンに代表されるように、新規モダリティを用いたワクチンや治療薬の研究開発が行われ、これら医薬品が世界中の人々の健康と福祉に多大な貢献を果たしていることに疑う余地はありません。そこで今回のニューズレターでは、政策研ニュースNo.64で取り上げた内容をもとに、さまざまな創薬モダリティの研究開発状況を俯瞰するとともに、モダリティの観点から今後の医薬品開発の展望について考察してみたいと思います※1。
-
※1医薬産業政策研究所「新薬における創薬モダリティのトレンド —多様化/高分子化の流れと、進化する低分子医薬—」政策研ニュース No.64(2021年11月)
はじめに
近年、多様な創薬基盤技術を用いた研究開発により、低分子医薬だけでなく、抗体医薬をはじめ、核酸医薬や遺伝子治療のようなさまざまな分子(中分子~高分子)が医薬品として実用化され始めています。昨今、世界中で大流行しているCOVID-19においても、その治療薬やワクチン開発において新規モダリティが注目を集めています。一例として、アストラゼネカ社/オックスフォード大学やジョンソン・エンド・ジョンソン社はウイルスベクターを用いたワクチンを、ノババックス社は組換えタンパクを用いたワクチンを開発しました。一方、ファイザー社/ビオンテック社やモデルナ社が開発したmRNAワクチンは、他の医薬品での実用化例のなかった新規モダリティが活用されたものであり、極めて短期間で実用化に至ったことも前例のない出来事でした。これらワクチンは従来型ワクチンとは異なり、新たな創薬基盤技術により開発されたものであり、創薬基盤技術・新規モダリティの重要性を改めて認識する事例です。
このような背景の中、2021年6月に「ワクチン開発・生産体制強化戦略」※2が閣議決定されています。ここでは、新型コロナウイルスワクチンの国内での研究開発が、欧米諸国に比べて後塵を拝している現状を踏まえ、課題の整理と解決策に関して議論が行われており、新規モダリティの研究開発をいっそう推進する必要性が確認されました。がんワクチンや遺伝子治療、核酸医薬等の新規モダリティを活用した研究開発を推進することで高い技術水準を保持し、有事の際にはこれら技術を転用して迅速な医薬品やワクチンの開発を可能とする、このようなデュアルユース生産体制構築が重要であると指摘されています。
ワクチン等感染症領域以外の医薬品においても、近年は抗体医薬をはじめとした、核酸医薬、遺伝子治療、細胞治療等の新規モダリティを用いた医薬品開発が世界的なトレンドとなってきています※3。これは従来の低分子医薬では狙うことが困難であった創薬標的に対し、それらに作用できる分子として新規モダリティが見出され、実際に医薬品として利活用されるようになった実状を反映していると考えられます。
また2021年9月13日に厚生労働省より発出された「医薬品産業ビジョン2021」※4では、日本の医薬品産業が感染症対応も含めたアンメット・メディカル・ニーズに応えられるだけの創薬力を維持・強化し、革新的医薬品を含めたあらゆる医薬品を国民に安定的に供給し続ける状態を、目指すべき姿として記載されています。そして、このビジョンを実現するための一つの要素として、多様化・複雑化するモダリティの研究開発が重要であるとされています。
このように、多様な新規モダリティが加速度的に実用化されていく状況のもとで、本稿においては承認薬におけるトレンドをモダリティの観点から概観するとともに、従来型のモダリティである低分子医薬も含めて今後の展望について考えてみたいと思います。
-
※2健康・医療戦略推進専門調査会(第28回)「ワクチン開発・生産体制強化戦略」、健康・医療戦略推進本部
https://www.kantei.go.jp/jp/singi/kenkouiryou/tyousakai/dai28/siryou1-2.pdf (2021年9月30日アクセス) -
※3医薬産業政策研究所「次世代創薬基盤技術の導入と構築に関する研究」リサーチペーパー・シリーズ No.77(2021年5月)
-
※4厚生労働省「医薬品産業ビジョン2021」
https://www.mhlw.go.jp/stf/newpage_20785.html (2021年9月30日アクセス)
新規承認医薬品におけるモダリティの動向
新規承認医薬品におけるモダリティのトレンド分析として、EvaluatePharmaを用いて、日米それぞれにおける新規有効成分(New Molecular Entity, NME)の承認品目数を調査し、モダリティ別に評価しました。NMEのモダリティ分類区分は EvaluatePharmaにおける技術分類をもとに分類し※5、FDA Approval DateおよびJapan Approval Date(indication)より抽出した日付を用いて、承認品目数の年次推移を分析しました。なお、ここでは近年注目を集めるCOVID-19ワクチン等は、ワクチン類に優先的に分類されており、組換えタンパクや遺伝子治療等に分類されていない点に留意する必要があります。
2000年以降の米国食品医薬品局(FDA)におけるモダリティ別の承認品目数を図1に、当該年度の承認品目におけるモダリティ別の占有率を図2に示しました。また同様に独立行政法人医薬品医療機器総合機構(PMDA)における承認状況を図3および図4に示しました。
図1 FDAにおけるモダリティ別承認品目数
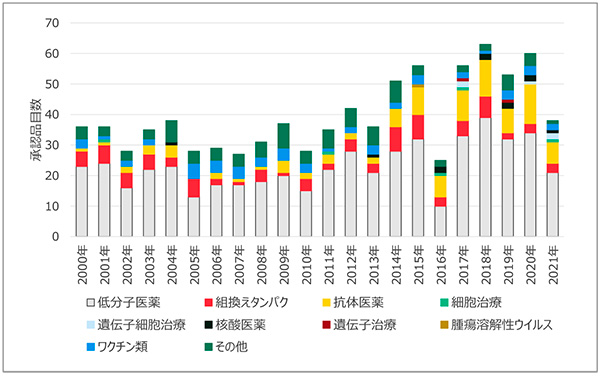
出所:EvaluatePharma(2021年8月時点)
図2 FDA承認品目におけるモダリティ別占有率
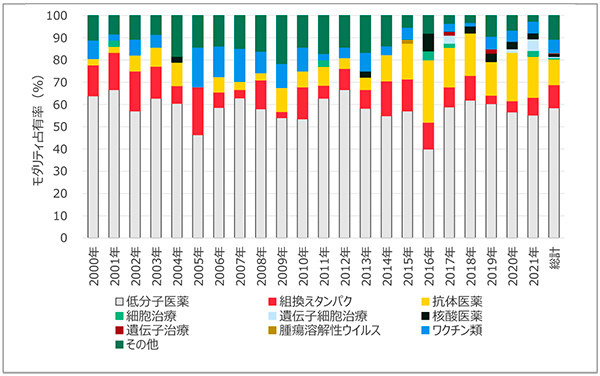
出所:EvaluatePharma(2021年8月時点)
図3 PMDAにおけるモダリティ別承認品目数
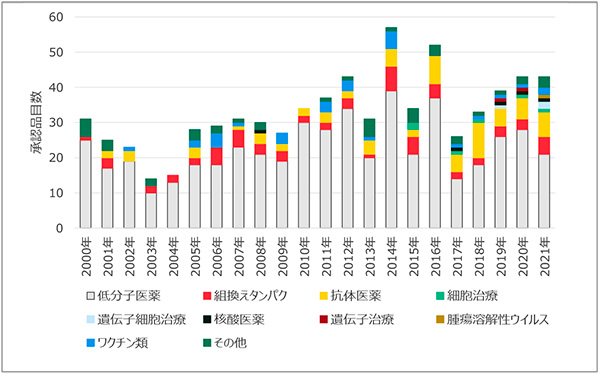
出所:EvaluatePharma(2021年8月時点)
図4 PMDA承認品目におけるモダリティ別占有率
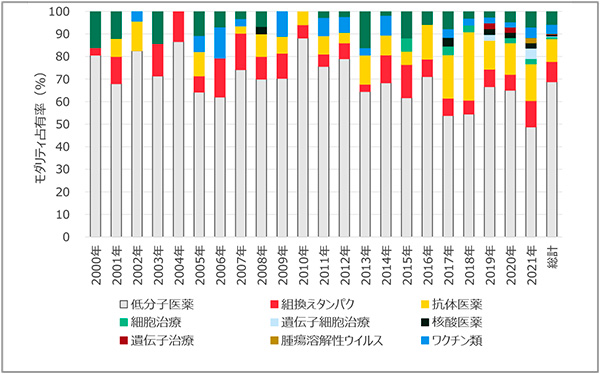
出所:EvaluatePharma(2021年8月時点)
米国での全承認品目数は、2000年代には30品目前後で推移していますが、その後、徐々に増加傾向にあり、近年では年50~60品目程度が承認されています。2000年以降では、いずれの年においても低分子医薬が最大の割合を占めるモダリティで、常時60%前後で推移しており、依然として中心的なモダリティであることが確認できます。
低分子医薬に次ぐモダリティは、2000年代初頭は組換えタンパクでしたが、その後、徐々に抗体医薬の承認品目数が増加し、2015年頃より抗体医薬が低分子医薬に次ぐ割合の大きなモダリティへと成長しています。核酸医薬、遺伝子治療、遺伝子細胞治療等の新規モダリティの承認品目数は増加傾向にあり、2015年までにそれぞれ2、0、0品目の承認実績であったのが、2016年以降にはそれぞれ9、2、5品目が承認されており、モダリティの多様化が確認できます。
日本では、2000年代初頭には低分子医薬の占める割合が80%前後であり、米国に比して大きな数値でした。日米差の主たる要因は、組換えタンパクの日本での承認件数が少ないことに起因しており、この当時、バイオ医薬品におけるドラッグラグが3~5年程度存在していたこと※6が本データからも見て取れます。直近5年間で見ると、日米ともにほぼ同様のモダリティ占有率となっており、低分子医薬が60%前後で最大であり、それに次いで抗体医薬の割合が大きい状況です。
-
※5EvaluatePharmaにおける技術分類(カッコ内に記載)をもとに、著者にて以下のカテゴリーに再分類した。 低分子医薬(Small molecule chemistryおよびChiral chemistry)、組換えタンパク(Recombinant product)、抗体医薬(Monoclonal antibodyおよびMonoclonal antibody(conjugated))、細胞治療(Cell therapy)、遺伝子細胞治療(Genemodified cell therapy)、核酸医薬(DNA&RNA therapeutics)、遺伝子治療(Gene therapy)、腫瘍溶解性ウイルス(Oncolytic virus)、ワクチン類(Bioengineered vaccineおよびVaccine)
-
※6医薬産業政策研究所「バイオ医薬品のドラッグラグに関する一考察」政策研ニュース No.60(2020年7月)
モダリティごとの作用機序のトレンド
従来は低分子医薬が医薬品の中心的な位置づけでしたが、そこから組換えタンパクや抗体医薬等、新規モダリティの実用化研究が進んだ背景には、従来型の低分子医薬ではアプローチ困難であった創薬ターゲットに対しても、ターゲットを拡大できたからだと考えられます(図5)。さまざまな新規モダリティが実用化され始めている流れは確認できましたが、一方で新規モダリティには医薬品として開発するうえでの不確実性(特に、安全性、品質管理、レギュレーション等における不確実性)があり、また新規モダリティを含むバイオ医薬品群には、製造コストの高さ等にも課題があります。そこで本稿では、近年実用化された新規モダリティを、医薬品としての実績の多い低分子医薬等によって置き換える事例や兆候がないか調査を行いました。具体的には、医薬品データベースであるPharmaprojectsを用い、(1)抗体医薬、(2)組換えタンパクおよびペプチド医薬、(3)核酸医薬、(4)遺伝子治療の4つに関して、承認済みの医薬品の作用機序(Mechanism of Action、MoA)を網羅的に調査し、当該MoAに関して複数のモダリティでの開発事例がないか調査を行いました。紙面の都合から、特に興味深いと考えられた2つの事例に関して紹介します。
図5 医薬品におけるモダリティの多様化・高分子化の変遷
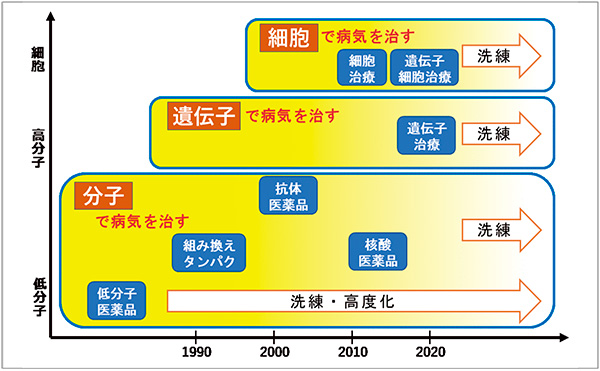
出所:研究開発戦略センター「デザイナー細胞 ~再生・細胞医療・遺伝子治療の挑戦~」を参考に、医薬産業政策研究所において作成
Calcitonin gene-related peptide inhibitorでの事例
承認済みの抗体医薬として、Calcitonin gene-related peptide(CGRP)inhibitorには4つのNME(galcanezumab、eptinezumab、fremanezumab、erenumab)が存在していますが、これらはCGRP自体を中和してシグナルを抑制するもの、CGRPレセプターに結合してシグナルを抑制するものを含んでいます。このMoAを有する医薬品は、抗体医薬以外では低分子医薬が臨床段階以降に計5品目存在しており(2021年9月時点)、開発の進んでいる米国ではrimegepant sulfate、ubrogepantおよびatogepantが承認されており、ほかではzavegepant hydrochlorideがPhase 3実施中という状況です。なお、これら低分子医薬はいずれも日本においては未承認という状況です(表1)。
表1 承認済のCGRP inhibitor
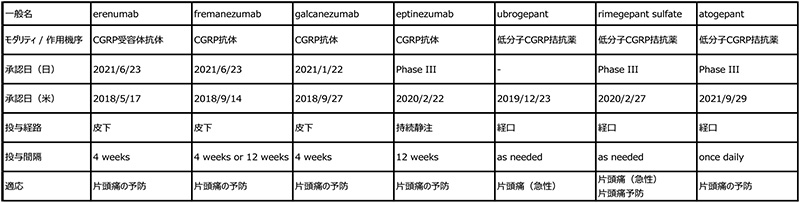
出所:各医薬品の添付文書の情報やPharmaprojectsでの検索結果等をもとに医薬産業政策研究所にて作成(2021年9月時点)
このMoAを有する医薬品の研究開発の歴史は古く、1999年に低分子医薬であるOlcegepantの臨床試験が行われ、片頭痛に対する発作頓挫作用が示されています※7。本薬は静脈内投与で臨床試験が行われており、筆者の推測にはなりますが、分子量が約870と大きいことに起因する薬物動態学的な特徴により、経口投与を選択できなかったのではないでしょうか。本薬は最終的には開発が中断されていますが、その後、複数の経口投与可能な低分子医薬が見出され、研究開発が行われました。しかし、これらの化合物についても、共通して肝毒性等に起因する安全性上の課題が生じ、研究開発は中断されています※8。その後、抗体医薬によるCGRPをターゲットにした研究開発が開始され、2018年にerenumabが承認されて以降、2020年までに計4品目の抗体医薬が承認されています。これらは、抗体医薬の標的選択性の高さに基づく安全性や長半減期という特徴を活かして、片頭痛に対して予防的に用いられており、用法は皮下投与または静脈内投与により1ヵ月に1回、または3ヵ月に1回の投与となっています。抗体医薬に実用化で先を越されたものの、低分子医薬の研究開発も進行しており、2019年に前述の課題を克服したubrogepantが低分子薬として初めて承認されています(日本ではいずれの低分子薬も未承認)。こちらは低分子医薬の特徴を活かした経口投与可能な薬剤であり、急性的な片頭痛の発作に対して頓服的に用いることが可能となっています。また、低分子薬として2番目に承認されたrimegepant sulfateは、頓服的にも予防的にも使うことができ、抗体医薬と同様の適応として使うことも可能となっています。
CGRP阻害薬が市場に登場したのはごく最近であり、今後、各々の薬剤が片頭痛の治療や予防において、どのような位置づけとなっていくのかは、まだ不透明です。しかし、モダリティの特性を活かして、薬効や安全性はもちろんのこと、用法用量や薬剤コストの差等、医薬品のもつ価値が総合的に判断され、片頭痛領域でのさまざまな医療ニーズが充足されていくことが期待されます。
-
※7Olesen J, Diener HC, Husstedt IW, et al. Calcitonin gene-related peptide receptor antagonist BIBN 4096 BS for the acute treatment of migraine. N Engl J Med. 2004 Mar 11;350(11):1104-10
-
※8柴田護「CGRP関連抗体による片頭痛の新規治療」臨床神経学 60巻、668-676、2020
脊髄性筋萎縮症治療薬での事例
脊髄性筋萎縮症(Spinal Muscular Atrophy、SMA)は、運動神経細胞生存(Survival Motor Neuron、SMN)タンパク質の欠乏・欠失によって生じる、常染色体劣性遺伝の神経筋疾患です。生後まもなく進行性の筋萎縮や呼吸障害を伴い、重篤な症例では早期に死に至る疾患です。近年、本疾患を適応にもつ画期的な新規医薬品が3剤上市され、これら医薬品によって患者さんに福音がもたらされています(表2)。この3剤の作用機序は厳密には異なるものの、SMNタンパク質の機能を補充するという点で共通したものと言えます。
表2 近年承認されたSMA治療薬
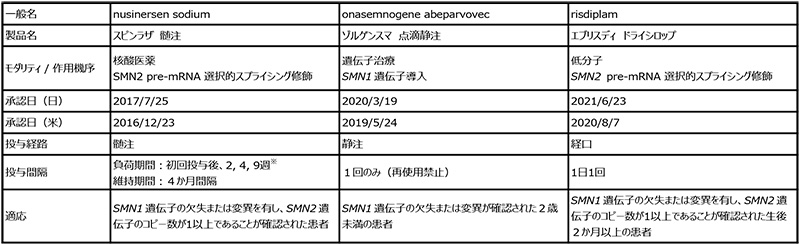
出所:各医薬品の添付文書の情報やPharmaprojectsでの検索結果等をもとに医薬産業政策研究所にて作成(2021年9月時点)
スピンラザ髄注(以下、スピンラザ)は、核酸医薬に分類され、SMN2遺伝子の発現を増強させSMNタンパク質の機能を補充することで、SMAの治療効果を有する薬剤※9です。日本では2017年に承認されました。スピンラザは、腰椎穿刺により髄腔内に投与され、乳児型の脊髄性筋萎縮症の場合には、初回投与後、2週、4週および9週に投与し、以降は4ヵ月の間隔で投与が行われます。
次に、ゾルゲンスマ点滴静注(以下、ゾルゲンスマ)は、遺伝子治療に分類される薬剤であり、AAVベクターにSMN1遺伝子を搭載しており、スピンラザ同様にSMNタンパク質の機能を補充することで、SMAの治療効果を有する薬剤です※10。ゾルゲンスマは静脈内から全身投与される薬剤として、日本では2020年に承認されました。本薬は1回のみの投与で、長期間効果が持続する薬剤です。
そして2021年には、エブリスディドライシロップ(以下、エブリスディ)という低分子医薬がSMA治療薬として日本で承認されました。エブリスディはSMN2スプライシング修飾という作用機序により、SMNタンパク質を増加させることでSMAを治療するよう設計されています※11。低分子医薬においても、新規モダリティと同様のMoAが達成されており、注目に値する事例と言えます。エブリスディは経口投与が可能であり、ドライシロップとして1日1回投与される薬剤です。
このように、SMA治療薬として近年承認された3剤は、それぞれ異なるモダリティに基づく薬剤であり、いずれも臨床試験において有用性が確認されています。この3剤はモダリティの違いに基づく用法用量の違い、薬剤費の違い等それぞれに特徴があります。将来的には、有効性や安全性のデータが蓄積・アップデートされていくとともに、有効性・安全性以外のさまざまな特徴も考慮され、アンメット・メディカル・ニーズの充足に貢献していくものと考えられます。また、これら薬剤間の併用や、切り替え効果を検証する試験も進行中であり、試験結果に期待がもたれるところです※12※13。さまざまなモダリティを駆使して特徴ある新薬を創製し、患者さんに選択肢を与えることも製薬企業の使命であるように感じます。
-
※9スピンラザ髄注添付文書 https://www.info.pmda.go.jp/go/pack/1190403A1022_1_06/
-
※10
-
※11エブリスディドライシロップ添付文書 https://www.info.pmda.go.jp/go/pack/1190029R1028_1_01/
-
※12Harada Y, Rao VK, Arya K, et al. Combination molecular therapies for type 1 spinal muscular atrophy. Muscle Nerve. 2020 Oct;62(4):550-554
-
※13Oechsel KF, Cartwright MS. Combination therapy with onasemnogene and risdiplam in spinal muscular atrophy type 1. Muscle Nerve. 2021 Oct;64 (4):487-490.
まとめと今後の見通し
モダリティが多様化、さらには高分子化することで、医薬品にさまざまな機能をもたせることが可能になってきました。一方で、低分子医薬や中分子医薬※14の存在感も高まっていることも確認できました。SMA治療薬の領域で見られたように、バイオ医薬品の機能をより小さな分子で代替することは、今後の創薬研究の一つの潮流になる可能性があります。一般的には、低分子医薬は経口吸収性の高さが特徴の一つであり、疾患や患者さんごとの症状によって異なるものの、投与の利便性に優れます。また一般論として、低分子医薬はバイオ医薬品に比して、製造コストを安価に抑えられると言われており※15、医療経済的にも恩恵をもたらす可能性があります。従来の低分子医薬ではアクセスできなかった創薬ターゲットに対しても、科学技術の発展(疾患メカニズムの解明、AIの活用やin silico技術の発展、iPS細胞やゲノム編集技術等の実験系・評価系の拡充、超ハイスループットスクリーニングの実用化、クライオ電子顕微鏡等の分析機器の高性能化、Protein degrader等の低分子医薬に基づく新技術の開発、製剤化技術の進化等)に伴い、医薬品として有望なプロファイルを有するシーズを得られるようになってきています。また、かつては“Lipinski's rule of five”に該当するような分子量500以下の分子が低分子医薬の主体でしたが、近年では分子量が1000に迫るような比較的大きな低分子医薬(Evaluate社の定義では低分子医薬品に分類されるが、これらを中分子医薬と呼ぶこともある)も散見されるようになっています。このような状況については、政策研リサーチペーパー・シリーズNo.72「創薬化学の側面から見た低分子医薬の将来像 低分子から中分子への広がり」においても詳細に考察されているので、そちらを参照ください※16。
バイオ医薬品は分子の多様化・複雑化を経ながら新規モダリティとして進化しており、今後の医薬品において非常に重要な役割を担っていくと考えられますが、一方で、低分子医薬や中分子医薬にも再度脚光が当たり始めており、モダリティの低分子量化という流れも見て取れます。医薬品にとって重要なのは、有効性や安全性はもちろんのこと、投与の利便性や価格等も含めた、医薬品の価値そのものであり、モダリティがなんであるかは大きな問題ではありません。将来的には、多様化するニーズに対して、多様なモダリティに基づく特長ある医薬品が複数創製され、患者さん自身が自分にとって最も価値の高い医薬品を選択可能になる、そのような未来が訪れることに期待しつつ、筆を置きたいと思います。
-
※14ここでは、中分子を化学合成可能な医薬品で分子量が500~2000程度のものとする
-
※15厚生労働省主催「バイオ医薬品及びバイオシミラー普及啓発等事業」講習会、「バイオ医薬品とバイオシミラーの基礎知識」 https://www.mhlw.go.jp/content/10800000/000655557.pdf (2021年9月30日アクセス)
-
※16医薬産業政策研究所「創薬化学の側面から見た低分子医薬の将来像」リサーチペーパー・シリーズ No.72(2018年5月)
(医薬産業政策研究所 主任研究員 高橋 洋介)

