トピックス 「ICH仁川会議」Web会議形式で開催される
2021年上期の医薬品規制調和国際会議(ICH)本会合は、韓国・仁川にて行われる予定でした。しかし、2020年から続く世界的な新型コロナウイルスのパンデミックの状況を鑑み、対面会合の開催を断念しWeb会議形式での実施となりました。2020年上期のバンクーバー会議、下期のアテネ会議に続き、3回連続のオンライン開催となっています。日米欧アジア各地からの参加となるため、会議開催時間帯は日本時間の夜(米国・カナダ・ブラジルは朝、欧州・アフリカ圏は昼、アジア圏は夕方から夜)に設定され、管理委員会は5月25日と6月1日に、総会は6月2日と3日に、各日2時間のプログラムとなりました。また、専門家/実施作業部会(ワーキンググループ)の議論も同時期にそれぞれ並行してWeb形式で実施され、ICHトピックスの進捗が図られました。以下に仁川会議(オンライン)での特記事項を記載します。
1. ICHメンバー、オブザーバーの承認
医薬品規制調和国際会議(ICH)の新規メンバーとして、サウジアラビア食品医薬品庁(SFDA)が承認されました。SFDAはいままでオブザーバー団体でしたが、今回メンバーへの昇格が認められました。また、新規オブザーバー団体として、アゼルバイジャン保健省分析センター(AEC)および英国医薬品医療製品規制庁(MHRA)の加入が承認されました。MHRAは従来欧州委員会・欧州医薬品庁(EC/EMA)の一員としてICH活動を推進していましたが、英国のEU離脱に伴い、独立した団体としての新たな地位を確保することが必要となりました。ICH設立時からの貢献度を鑑み、特例としてメンバー格からの参加を認めてもいいのではないか等の議論はありましたが、最終的にはICHのルールに従い、オブザーバーから参加することとなりました。
この結果、ICHメンバーは従来の17団体から1団体増加の18団体、オブザーバーは2増1減で33団体となり、ICHは総勢51団体の組織体制となりました(末尾の参考資料参照)。
2. ICH管理委員会の選挙
ICH管理委員会は、創設メンバー(規制当局3、産業界3)、常任メンバー(規制当局2)、常任オブザーバー(世界保健機関(WHO)、国際製薬団体連合会(IFPMA)、選出メンバー(規制当局4、産業界2)で構成されています。このうち、選出メンバーは3年ごとに改選が行われることとなっており、今回その選挙が行われました。その結果、下記メンバーが選出されました。規制当局の席は4つありますが、現在のところ3メンバーが就くにとどまっています。
規制当局:ブラジル国家衛生監督庁(ANVISA)、韓国食品医薬品安全処(MFDS)、中国国家薬品監督管理局(NMPA)
産業界:バイオテクノロジーイノベーション協会(BIO)、国際ジェネリック・バイオシミラー医薬品協会(IGBA)
3. ICHトピックの動向
仁川会議で対面会議が予定されていたトピックのワーキンググループ(WG)は、この期間を活用してWeb会議を精力的に実施し進捗を図りました。そのほか、管理委員会、総会で既存トピックのStep移行と、新規トピックの議論も行われました。また、この1年数ヵ月に及ぶ新型コロナウイルス感染症のパンデミックの影響を受け、検討中のトピックの進捗に関し全般的に遅れが生じている状況も共有されました。これにより、新規トピックの採択に際しても緊急性/重要性が高いものに絞ることとされました。
Step4到達
以下のトピックについて、Step4到達が報告されました。これらについては、各規制当局における実装のプロセスに入ります。
| ・ | Q3C(R8):「医薬品の残留溶媒ガイドライン」の改正 |
| ・ | M8 eCTD v4.0 Question and Answer(Q&A)Document v.1.5:「『電子化コモン・テクニカル・ドキュメント(eCTD)による承認申請について』に関する質疑応答集(Q&A)について」の改正、Specification for Submission Format for eCTD v.1.3:「ICH電子化コモン・テクニカル・ドキュメント(eCTD)に含める電子ファイル仕様」の改正、およびeCTD v4.0 Implementation Package v.1.4:「eCTD v4.0 国内実装パッケージ」の改正 |
Step2到達
以下のトピックについて、Step2到達が報告されました。今後、各国・地域でパブリックコメントが実施されます。
| ・ | S1B(R1):「医薬品のがん原性を検出するための試験に関するガイダンス」の補遺 |
| ・ | S12:遺伝子治療製品の非臨床生体内分布試験 |
新規トピックの採択
今後ガイドライン作成を行う新規WG立ち上げに向け、以下のものが採択されました。なお、採択はされたものの具体的な活動開始時期は今後検討されることとなっています。
| ・ | 「安定性」(Q1)シリーズおよび関係する「生物薬品(バイオテクノロジー応用製品/生物起源由来製品)の安定性試験」(Q5C)の更新 |
| ・ | 「新医薬品の規格及び試験方法の設定」(Q6A)および「生物薬品(バイオテクノロジー応用医薬品/生物起源由来医薬品)の規格及び試験方法の設定」(Q6B)の更新 |
| ・ | 安全性評価においてRWDを活用する薬剤疫学試験の計画・デザインに関する一般原則 |
採択済みトピックの活動開始に向けた動き
M4Q(R1)(CTD品質の改定)については、2020年のICH会議ですでに採択されていましたが、WGの設立は関連するQ13(連続生産)のStep1達成を待つこととされていました。Q13のStep1は仁川会議のアジェンダではありませんでしたが、ちょうどこの時期にそのマイルストンをクリアしたため、M4Q(R1)のチームビルディング(各団体からの専門家選定)がスタートしました。
4. 次回ICH会合
2021年11月13日~17日の日程で開催予定です。カナダ・バンクーバーで行う計画でしたが、新型コロナウイルスのパンデミックの影響を鑑みて、対面形式を断念し、ここ3回のICH会議形式にならいWeb会議形式で行うこととなりました。
なお、ICHでは、ICH会合の成果を含め、ICHの活動に関する情報を積極的に公開し、関係者のみならず一般の方々に理解を深めていただけるようにしています。今回のICH仁川会議(Web会議)の成果や各トピックの概念書、作業計画等はICHウェブサイト(https://www.ich.org/ )からご覧いただけます。
【参考資料:ICHメンバー、オブザーバー一覧(2021年7月現在)】
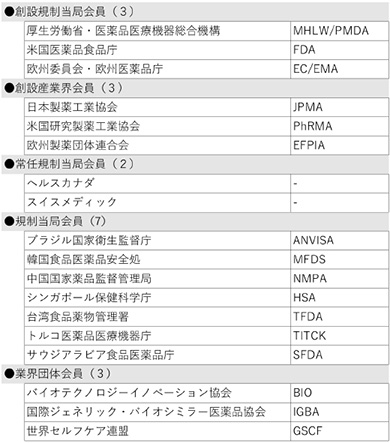 表1 メンバー(18団体)
表1 メンバー(18団体)
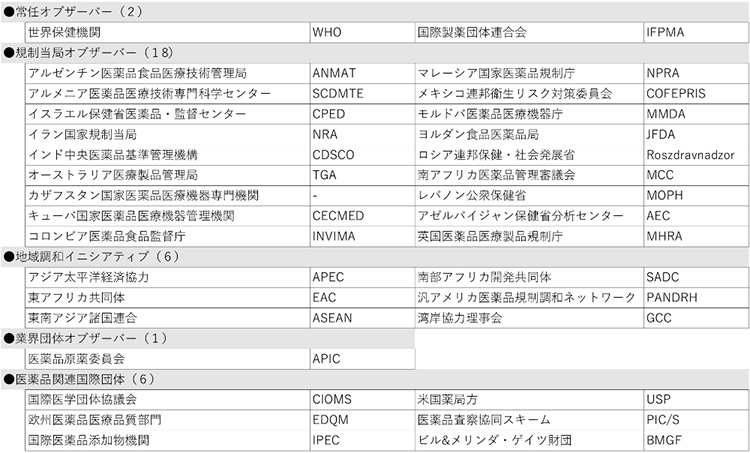 表2 オブザーバー(33団体)
表2 オブザーバー(33団体)
(国際規制調整部長 柳澤 学)

