政策研のページ
政策研の研究レポート発刊について
(1)リサーチペーパーNo.76『医薬品の社会的価値の多面的評価』
(2)リサーチペーパーNo.77『次世代創薬基盤技術の導入と構築に関する研究』
政策研では日々の調査研究の内容を公表資料として発刊しています。毎年3月、7月、11月をめどに「政策研ニュース」を定期発刊しているほか、個別の調査研究内容をまとめた「リサーチペーパー」等を発刊しています。ここでは、2021年春に発刊されたリサーチペーパーNo.76『医薬品の社会的価値の多面的評価』ならびにリサーチペーパーNo.77『次世代創薬基盤技術の導入と構築に関する研究』について、内容の紹介をさせていただきます。
(1)リサーチペーパーNo.76『医薬品の社会的価値の多面的評価』
医薬産業政策研究所 主任研究員 中野 陽介
本邦では2019年に経済的視点から医薬品の価値を評価する仕組みとして、費用対効果評価の制度が導入されましたが、医薬品のもつ多様な価値を評価するには、費用対効果の視点に加え、社会的側面といったより多様な観点からの価値についても議論・検討が成されていくことが望まれます。
そこで、本稿では医薬品の多様な価値が近い将来、考慮・評価されていくことを見据えて、多様な価値の中でも、特に社会的な価値要素に着目し、それらのアウトカム指標・測定の現状および海外(主に英国等)での評価の現状について調査しました。まず、本稿で調査対象とする社会的な価値要素については、国際医薬経済・アウトカム研究学会(ISPOR)レポートで提唱された価値12要素の中の社会的観点の9要素をベースとしつつ、英国国立医療技術評価機構(NICE)の評価事例および新型コロナウイルス感染症を契機とした英国やカナダの評価機関の動向を踏まえ、「介護負担の軽減(主に家族介護者)」「医療負荷の軽減(人的・物的負荷)」も重要な要素と考え、これらの価値要素も検討対象に加えることとしました(図1)。
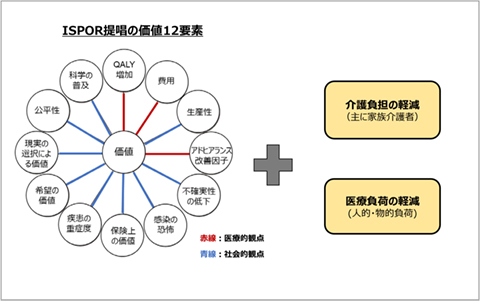 図1 調査対象とする社会的な価値要素
図1 調査対象とする社会的な価値要素
出所:鎌江伊三夫、厚生労働省新HTA制度 第7回 続・医薬経済学から見た価値と価格の関係、PMDS.50(3).135~141(2019)の図を一部改編
そして、これらの社会的な価値要素(9要素と追加2要素の計11要素)について、アウトカム指標・測定等に関する調査を行いました。調査結果として、明確にアウトカム指標やアウトカムツールが存在していたのは、「労働生産性」と「介護負担の軽減」の2要素のみでした。この2要素に関しては、英国NICE等での評価実績や臨床試験での使用報告があることが確認されました(図2)。
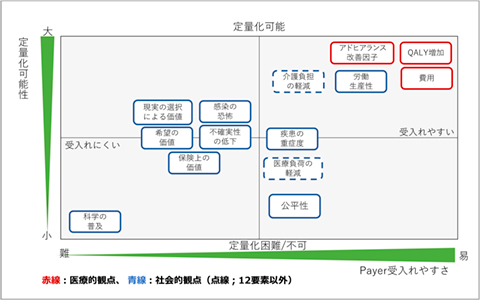 図2 社会的な価値要素を2軸(定量化可能性、Payerの受け入れやすさ)で整理
図2 社会的な価値要素を2軸(定量化可能性、Payerの受け入れやすさ)で整理
出所:著者作成
この2要素に関しては、近年の臨床試験におけるアウトカム測定の現状を把握する目的で、米国国立衛生研究所(NIH)等によって運営されている臨床試験登録システム(ClinicalTrials.gov)のデータを用いた追加的調査・考察も行い、各々のアウトカム指標が用いられた試験数の推移や対象疾患等について確認することができました。さらに、本調査の中で確認することができたアウトカムの測定結果等を活用した価値の提示あるいは評価の事例についても、定量的に考慮可能な事例と定性的に考慮可能な事例に分けて紹介しています。
調査全体のまとめとして、医薬品の価値を構成する価値要素は多様ですが、明確なアウトカム指標があり、それが定量的に測定可能な価値要素は現状では限られていました。しかし、その限られた中でも定量化可能で、評価が比較的しやすいと考えられる「労働生産性」および「介護負担の軽減」に関しては、まだ課題はあるものの、本邦においても考慮・評価の議論を進めていけるのではないかと考えられました。その他の価値要素に関しては、概してエビデンスレベルの高いデータが乏しく、定量的な評価に至らない現状でしたが、たとえば英国NICEでは、評価時に臨床専門医や患者会等からの「生の声」をもとに、見逃されている価値がないかの議論が行われ、場合によっては"意思決定時に考慮する"といった定性的考慮の対応が取られていたケースも見られました。本邦においても「定量化困難」=「評価時の考慮不要」ではなく、アウトカム測定ツール等で捕捉できる医薬品の価値に限界があることを認識しつつ、定性的な評価や考慮を検討していくような土台作りも必要ではないかと考えられました。
今後、医薬品における多様な価値評価の議論が進展していくためには、社会全体に医薬品のもつ多様な価値が広く理解されることが望まれると同時に、適切に理解していただくための企業および産業からの情報発信、ソーシャルコミュニケーションがよりいっそう必要になっていくでしょう(図3)。
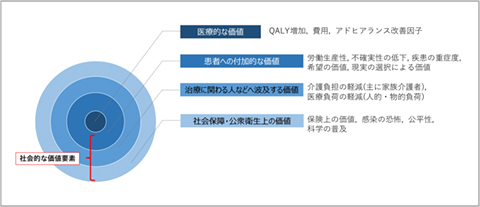 図3 補足:社会的な価値要素の類別化
図3 補足:社会的な価値要素の類別化
出所:PhRMA、Kevin Haninger、2019年度医療技術評価国際シンポジウム「医療技術評価の制度化ーその論点と今後の方向性」での講演資料の図(P4)を参照し、著者作成
-
※本リサーチペーパーは、横浜市立大学医学群健康社会医学ユニット准教授・東京大学大学院薬学系研究科医薬政策学客員准教授の五十嵐中氏、東京大学大学院薬学系研究科医薬政策学研究員の廣實万里子氏との共同研究に基づくものであり、両氏との共著である。
(2)リサーチペーパーNo.77『次世代創薬基盤技術の導入と構築に関する研究』
医薬産業政策研究所 前主任研究員 鍵井 英之
近年の医療用医薬品売上市場の推移を20年程度の期間で見ると、低分子医薬品のシェアが最も大きいのですが、その伸びは鈍化しています。また、組み換えタンパク製剤のシェアは過去20年~10年の間に増加しましたが、過去10年では縮小傾向にあります。一方、過去20年にわたり抗体医薬品のシェアが増加しており、医薬品市場全体の成長を牽引しています(図4)。2020年現在、新規モダリティ(核酸医薬品、遺伝子治療、遺伝子細胞治療、細胞治療)の占める割合はごくわずかですが、今後は成長が予想されます。
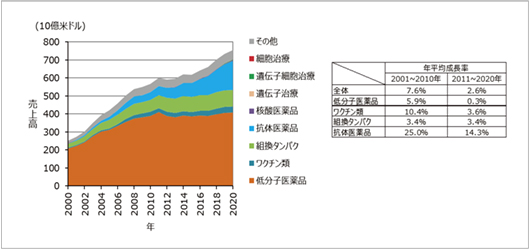 図4 医療用医薬品市場(モダリティ別)医薬品市場構成(左)とモダリティ別年平均成長率(右)
図4 医療用医薬品市場(モダリティ別)医薬品市場構成(左)とモダリティ別年平均成長率(右)
出所:EvaluatePharma社のEvaluatePharmaTMのデータを基に作成(2021年2月)
モダリティ別に医薬品パイプラインの創製企業の国籍を見ると、いずれのモダリティでも米国がリードしています。日本は、低分子医薬品で創出割合が最も高いのですが、バイオ医薬品(抗体医薬品、遺伝子治療、遺伝子細胞治療、細胞治療)では、低分子医薬品と比較して日本企業による創製割合は低くなっています(図5)。
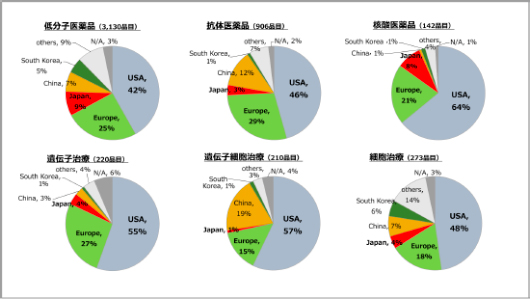 図5 開発品目のOriginator国籍内訳
図5 開発品目のOriginator国籍内訳
出所:EvaluatePharma社のEvaluatePharmaTMのデータを基に作成(2020年9月)
創製企業分類で見ると、いずれのモダリティでもバイオスタートアップ企業を中心とするBiotechnologyに該当する企業による創製割合が最も大きいが、低分子医薬品や抗体医薬品ではGlobal(世界的大手製薬企業)、核酸医薬品ではSpecialty(国内準大手~中堅の製薬企業に相当)による創製割合が高い等、モダリティによって創製企業の分類に特徴が見られます。また、Globalでは、抗体医薬品を自社創製していますが、これは過去にBiotechnologyを買収したことで獲得した創薬基盤技術が活用されたものと考えられました。
製薬企業が新規のモダリティにアクセスする主要な手段として、個別の開発パイプライン単位での導入(In-license)および企業買収(M&A)による獲得があります。それらの手段別に開発パイプラインの獲得動向を見てみると、低分子医薬品の導入において国内製薬企業群(RegionalおよびSpecialtyに該当する国内製薬企業)では、Global(武田薬品工業を含む)に比較して開発段階がより後期での導入が多く、新規モダリティの獲得数も低分子医薬品に比べて少ない等、リスクを避ける傾向が認められました。また、国内企業群が2001年以降に導入した低分子医薬品の現時点における承認割合(承認確率)は、Globalに比べて高いのですが、この理由として海外で先行開発されたパイプラインを国内に導入・開発していることが理由と考えられます(図6)。
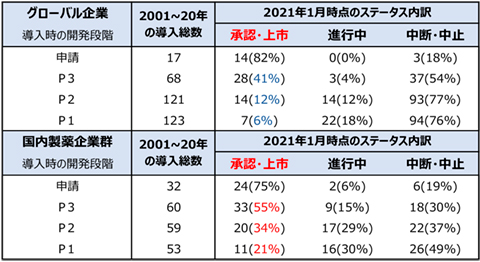 図6 低分子医薬品における過去の導入品目の契約時の開発段階と
図6 低分子医薬品における過去の導入品目の契約時の開発段階と
現在のステータス・導入企業分類別
出所:EvaluatePharma社のEvaluatePharmaTMのデータを基に作成(2021年2月)
-
※1EvaluatePharma社では、概ね1年程度の情報更新がない場合に、中断(Suspended)とラベルされる。
-
※2各ステータスの割合(%)は、各開発段階の契約数の合計(承認・上市、進行中、中断・中止を合計したもの)を母数としている。
-
※3本表のデータは、リサーチペーパー表32の一部抜粋である。
新規モダリティに関連した企業買収については、近年、Globalを中心に、Biotechnologyに対して10億米ドルを超える大型の企業買収を行っていますが、被買収企業の保有するパイプライン数は数件程度の場合もあり、そのほとんどは承認前であることから、保有品目のみならず基盤技術の獲得が主要な目的になっていると考えられました。また、これらの大型買収に先立ち、各企業は当該モダリティの導入やより小規模な企業買収を行っており、当該領域の知識を獲得していました。
医薬品に係るイノベーションの創出から実用化に至る過程では、イノベーション・エコシステムが重要な役割を果たしており、ライフサイエンスの分野では世界最大規模を誇るボストンのエコシステムから得られる示唆として、大学を中心とした各プレイヤー(大学、研究機関、スタートアップ、病院、投資家、企業)のネットワーク構築が挙げられます(図7)。現在、国内でも東京圏および大阪圏を中心としたバイオクラスター構想が進められています。
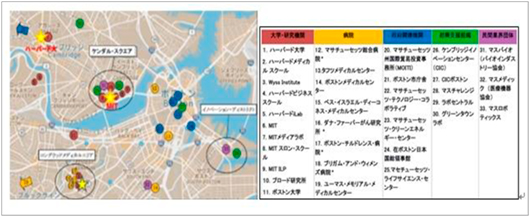 図7 ボストンのエコシステム 地理的特徴
図7 ボストンのエコシステム 地理的特徴
出所:在ボストン日本国総領事館提供
人類の新たな脅威となった新型コロナウイルスに対するワクチンおよび治療薬の開発では、新しい創薬技術の活用が進んでいます。特にワクチン開発では、実用化実績のない新しい技術であるmRNA技術が活用され、ウイルスの遺伝子配列の解読完了からわずか1年という、これまでの医薬品開発では前例のない極めて短期間で承認に至りました。この要因として、新規技術(mRNAワクチン)の技術的な優位性に加え、過去の感染症治療薬での医薬品開発経験、政府やNPOからの資金援助やノウハウの提供、量産化のための外部との協業、ITを活用した開発のスピードアップ等が挙げられます。
製薬企業が新規モダリティの創薬基盤技術を獲得するためには、多くの場合アカデミアやスタートアップとの協業が必要となります。新規技術へのチャレンジは不確実性の高い技術開発に対する投資リスクが伴いますが、それを克服するインセンティブとなるのがアカデミアの有する技術の優位性です。また、技術の実用化の過程で障壁となるのが、製造にかかわる投資や技術開発であり、これらの環境が整うことで、個々の製薬企業が特に低分子医薬品を中心とした従来の医薬品開発に偏重せず、リスクは高いが成功すれば市場で優位なポジションを確立できる可能性を有する新規モダリティの研究開発が促進されます。
これらを踏まえ、本研究では、特に国内製薬企業が新規モダリティの基盤技術を構築し実用化を進めるために有効な施策として以下を提言します。
- 政府による、新規モダリティによる医薬品開発にブレイクスルーをもたらすアカデミア研究の支援
- 個々の製薬企業による、最新の技術への長期的なフォローアップ
- 政府による、新規基盤技術の製造研究施設の確保
- 個々の製薬企業による、新規技術への研究開発投資の活性化

