トップニュース 「CMC Strategy Forum Japan 2020」が開催
2020年12月7日、8日の2日間、CASSS(California Separation Science Society)主催の「CMC Strategy Forum Japan 2020」が開催されました。2020年は新型コロナウイルス感染拡大の渦中でもあり、世界各地での渡航制限を背景に、初の試みとしてオンラインでの開催となりましたが、日本だけでなくアジア、北米、欧州から102名の参加登録があり、両日とも活発な意見交換が行われました。
CMC Strategy Forum Japan開催の経緯
CMC Strategy Forumは2002年にWCBP(Well Characterized Biotechnology Pharmaceutical)シンポジウムから独立し、米国で第1回が開催された後、2007年から欧州、2012年から日本、そして2014年からはラテンアメリカでも開催されています。CMC Strategy Forumでは、企業、アカデミアおよび規制当局の専門家がバイオ医薬品のCMC(Chemistry Manufacturing and Control)についての研究開発、製造、規制等に関する課題に関して、十分に時間をかけて議論を行い、相互理解と課題解決を促進しています。
日本でのCMC Strategy Forumは、独立行政法人医薬品医療機器総合機構(PMDA)と製薬協で準備委員会を組織し、議論テーマの選定や議論の方向性だけでなく、2020年はオンラインならではの学会運営も含め、約1年をかけて準備をしてきました。
会の開催に際し、2020年よりCASSSの代表を務めるGlobal Biotech Experts, LLCのNadine Ritter氏とPMDAレギュラトリーサイエンス(RS)センター長の新井洋由氏からのwelcome commentの後、以下のテーマで活発な議論が行われました。
 Global Biotech Experts, LLC
Global Biotech Experts, LLC
Nadine Ritter 氏
 独立行政法人医薬品医療機器総合機構
独立行政法人医薬品医療機器総合機構
レギュラトリーサイエンス(RS)センター長
新井 洋由 氏
Session 1:Recent Trends in the Regulation of Biopharmaceutical Products
Session 1では、PMDA再生医療製品等審査部の奥平真一氏とGenentech社のCecilia Tami氏の司会のもと、各国の規制当局担当者から、バイオ医薬品を中心とした最近の薬事規制動向およびCOVID-19下における臨時対応や新規のモダリティ開発について幅広い内容が紹介されました。
PMDA再生医療製品等審査部長の本田二葉氏からは、薬機法等の一部を改正する法律案の概要、先駆的医薬品の指定、条件付き迅速承認の運用、承認後変更管理実施計画書(Post-Approval Change Management Protocol、PACMP)運用、そしてCOVID-19治療薬に関する薬事審査のマネジメントについて紹介がありました。
欧州医薬品庁(EMA)のRagini Shivji氏からは、COVID-19下におけるバイオロジクス(ワクチン含む)の品質に関する考え方について紹介がありました。EMAでの、リスク・ベネフィットおよびそれに付随するデータに基づく柔軟な考え方が示されたほか、Prior Knowledge/プラットフォームデータの利用に関する議論や、リスクアセスメントによる潜在的なリスク軽減を図るための追加対応の必要性等が示されました。また、データ提出の遅延は許容できるものの、EMAより必要とみなされる品質データについては、承認後に対応する必要がある旨も留意すべき事項として触れられていました。
米国食品医薬品局(FDA)生物製品評価研究センター(Center for Biologics Evaluation and Research、CBER)のRobin Levis氏からは、製品品質を確保しながらCMC開発をどのように促進していくかについて、エボラウイルスワクチン開発にも触れながら紹介がありました。まず、申請者はワクチンの安全性および有効性を実証するための適切かつ十分に管理された研究、および一貫した製造方法で製造できるワクチンのみが承認または緊急使用許可(Emergency Use Authorization、EUA)されることが大前提として示されました。また、公衆衛生上の緊急時に安全かつ有効なワクチンを利用できるようにする取り組みが紹介され、その一環として2020年10月発行のFDAガイダンス(FDA Guidance for Industry: Emergency Use Authorization for Vaccines to Prevent COVID-19)が紹介されました。
FDA医薬品評価研究センター(Center for Drug Evaluation and Research、CDER)のMarjorie Shapiro氏からは、COVID-19下におけるCMC開発の薬事的アプローチについて紹介がありました。多岐にわたる内容でしたが、主にFDAのCOVID-19のウェブサイト紹介やコロナウイルス治療加速プログラム(Coronavirus Treatment Acceleration Program)、pre-IND/INDプロセスについて示されました。また、Phase 1 Trialにおける中和抗体に関する柔軟な考え方や、ドラッグリポジショニングについても紹介がありました。
 独立行政法人医薬品医療機器総合機構
独立行政法人医薬品医療機器総合機構
再生医療製品等審査部 奥平 真一 氏
 独立行政法人医薬品医療機器総合機構
独立行政法人医薬品医療機器総合機構
再生医療製品等審査部長 本田 二葉 氏
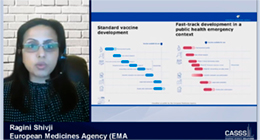 欧州医薬品庁(EMA) Ragini Shivji 氏
欧州医薬品庁(EMA) Ragini Shivji 氏
パネルディスカッションにおいては、PMDAワクチン等審査部長の荒木康弘氏および第一三共の武下文彦氏も参加し、COVID-19下における各規制当局とメーカー間でのコミュニケーションに関する取り扱いや臨時対応の状況、COVID-19ワクチンにおける本邦での国家検定の取り扱い等について活発な議論が展開されました。
 パネルディスカッションの様子(Session 1)
パネルディスカッションの様子(Session 1)
Session 2:Implementation of ICH Q12? Where Are We In Japan and Globally?
Session 2では、国立医薬品食品衛生研究所生物薬品部長の石井明子氏とRoche社のMarkus Goese氏の司会のもと、ICH Q12ガイドライン「医薬品のライフサイクルマネジメント」の実装(Step 5)に向けた幅広い内容が紹介されました。
FDA CDERのJoel Welch氏からは、ICH Q12ガイドライン実装に向けたICH Implementation Working Group(IWG)におけるTraining materialの作成について紹介されました。また、FDAにおけるICH Q12実装への準備状況と、2019年に開始されたEstablished Conditions Pilot Programについて詳細な説明がありました。このPilot Programの目的は、申請者から提案されたEstablished Conditions(ECs)を評価し、申請者とともにECsを洗練させ、承認時のECsの合意レベルを特定するための経験を得ることであり、このPilot ProgramからのLessons learnedについても紹介がありました。
中外製薬の久保寺美典氏からは、2018年から日本において試行されているPACMP pilot programをモノクローナル抗体の承認後変更(原薬の製造施設追加)に実際に使用し、PACMP品質相談、PACMP GMP相談、事後面談を経て一部変更承認申請を実施した経験が紹介され、課題やICH Q12実装に向けた提案等が示されました。
グラクソ・スミスクラインの船戸恵子氏からは、国立研究開発法人日本医療研究開発機構(AMED)のPACMP working groupにて作成中の国内申請用PACMPモックアップ文書が紹介されました。このモックアップ文書は海外のPACMPを参照しつつ日本の変更手続き制度を反映したものであり、その構成・内容についてAMED WG内での議論も踏まえた説明がありました。
PMDA新薬審査第四部の八木聡美氏からは、ICH Q12の実装に向けたPMDAの視点について紹介がありました。現在試行されているPACMP pilot programでは、その適用範囲等に制約があるものの10を超える使用例があり、そのうち約8割がバイオ医薬品(残り2割は化成品)であることが示されました。また、2021年からのPACMPの正式運用において、適用範囲等が拡大される予定である旨、具体的な方向性が紹介されました。
 国立医薬品食品衛生研究所生物薬品
国立医薬品食品衛生研究所生物薬品
部長 石井 明子 氏
 中外製薬 久保寺 美典 氏
中外製薬 久保寺 美典 氏
 グラクソ・スミスクライン 船戸 恵子 氏
グラクソ・スミスクライン 船戸 恵子 氏
 独立行政法人医薬品医療機器総合機構
独立行政法人医薬品医療機器総合機構
新薬審査第四部 八木 聡美 氏
パネルディスカッションでは、最初にEC-EUのICH Q12トピックスリーダーであるJean-Louis Robert氏から、EUにおけるICH Q12実装の進捗における法の枠組みへの適合性や課題について紹介があり、ICH Q12 IWGにて作成中のTraining materialの構成(Module)についても説明がありました。その後、各規制当局におけるICH Q12実装に向けた課題(法的な整備、ECs等)について、また、日本におけるPACMP正式運用に向けた課題について当局・企業間の活発な議論が行われました。
 パネルディスカッションの様子(Session 2)
パネルディスカッションの様子(Session 2)
まとめ
今回の「CMC Strategy Forum Japan 2020」においては、各セッション発表の後に行われるパネルディスカッションをオンライン開催でも充実した内容にすべく、事前質問、チャットを用いた即時質問、また"いいね"機能を用いた既出質問への賛同機能等、例年にはない工夫を凝らしたオンライン学会となりました。
2つのセッション終了後、Global Biotech Experts, LLCのNadine Ritter氏から、本フォーラムの総括が実施され、最後にGenentech社のWassim Nashabeh氏によるclosing remarksで閉会となりました。
 Genentech社 Wassim Nashabeh 氏
Genentech社 Wassim Nashabeh 氏
このグローバル会議が、今後も日本で継続的に開催され、バイオ医薬品の研究開発の促進とCMC領域の活性化の一助になるよう、製薬協として支援を続けていきたいと考えております。今後ともみなさまのご支援をよろしくお願いいたします。
次回の「CMC Strategy Forum Japan 2021」は、2021年12月6、7日に開催予定です。
(バイオ医薬品委員会 篠崎 真、山田 正敏、久保寺 美典、中村 奈央、赤羽 宏友、伊藤 哲史)

