トップニュース 「製薬協会長記者会見」を開催
2020年1月27日、野村コンファレンスプラザ日本橋(東京都中央区)にて、「製薬協会長記者会見」を開催しました。製薬協の中山讓治会長から、「製薬協の取り組み 進捗と今後」について説明を行うとともに、今回の会見には38名の報道関係者の参加があり、当日は活発に質疑が交わされました。
 会場風景
会場風景
発表のアジェンダ
製薬協の中山讓治会長は、「製薬協の取り組み 進捗と今後 —イノベーションの追求と社会課題の解決に向けて—」と題して、「イノベーション推進の環境整備」、ならびに「イノベーションの適切な評価」について、2019年1月に発表した「製薬協 政策提言2019」に関する取り組みを中心に、今までの進捗と今後の取り組み方針を説明しました(図1)。以下にその内容を紹介します。
 製薬協 中山 讓治 会長
製薬協 中山 讓治 会長
 図1 製薬協の取り組み 進捗と今後
図1 製薬協の取り組み 進捗と今後
I. イノベーション推進の環境整備
2020年までの進捗と今後の取り組み方針
政策提言の進捗を2019年1月に発表して以降、官民対話や参与会合等で政府と会話を続けてきました。その結果、われわれの要望が採り入れられ、骨太方針2019や次期の健康・医療戦略案に、より一層の産学官連携が期待できる施策が盛り込まれたと考えています。また、個々の取り組みについて、関連ステークホルダーと共同研究の検討も開始しています。すでに、具体性の高い研究計画を練っており、本年より実行フェーズに入りたいと思っています。
また、「ゲノム医療を推進するための実行計画」の検討が2019年に開始され、製薬協も参画してきました。その成果として、「全ゲノム解析等実行計画」の第1版が作成されました。今後もより詳細な部分を議論していく必要があり、製薬協も引き続き積極的に参画していきたいと思います。
研究開発税制については、2019年4月の改正時に業界側の要望がいくつか反映されました。拡充された税制を積極的に活用していくとともに、時限措置が2021年も延長されるよう、政府とコミュニケーションを図っていきます。
1. 製薬協 政策提言2019の進捗
政策提言は、イノベーションにより国民の健康寿命の延伸と経済成長を可能とし、それが次のイノベーションにつながるという好循環を生み出すことを目標として作成しました。われわれは、3つの課題を基に政府側や関連ステークホルダーとの協議を重ねてきました。
-
(1)予防・先制医療ソリューションの早期実用化
予防・早期介入を実現するためには、健常状態から疾患発症・回復するまでに至る一連の長期データや、健常人と患者さんとを比較して得られたデータが重要となります。そのために、製薬協では、興味がある参画企業を募り、東北大学 東北メディカル・メガバンク機構(ToMMo)や国立高度専門医療研究センター(ナショナルセンター、NC)と連携したコホート研究を計画しています。
ToMMoとは2019年、守秘義務契約を締結し、研究内容を検討してきました。まずは小規模・短期間のパイロット研究を実施しようと考えており、3月頃の契約締結を目指しています。また、NCとも別途検討を進めており、2020年度中に共同研究契約を締結予定です。アンメット・メディカル・ニーズが高い精神・神経と免疫炎症領域において実施し、今後、対象領域を広げていくことを検討します。
ToMMoは多くの健常人データを含む等の特徴を備えており、産業界も利用可能な本人の同意が取得されているため、われわれもそのデータを積極的に活用していきたいと考えています。本事業は、当初、2020(令和2)年度までの計画であり、製薬協としても事業の重要性を鑑み継続を要望していましたが、2019年開催されたゲノム医療協議会において「令和3年度からの10年間の事業として計画する」とされました。具体的な事業計画は今後議論されるものと思いますが、大規模な全ゲノム解析や長期間の経時的変化が確認できるデータの収集等、より充実したバイオバンクとなることを製薬協として切に要望しています。また、ほかのゲノム事業との連携を推進し、統合解析ができる基盤を整備いただきたいと考えています。
-
(2)健康医療ビッグデータおよびAIの開発・活用
われわれは、ゲノム情報を活用することによって、予防や個別化医療に資する研究開発ができると期待しています。いくつかのゲノムに関する政府会議にも参画し、議論をしていますが、その中でも重要施策である、「がんゲノム情報管理センター(C-CAT)が中心的役割を担う事業」と「厚生労働省が中心となって検討している全ゲノム解析の事業」に対するわれわれの要望を説明します。
まず、C-CATの事業で集積されたデータは、産業界も2021年度から利用できるよう、必要な体制について検討されています。創薬研究には、症例の蓄積と質の高い充実した臨床情報が重要です。がんゲノム医療推進コンソーシアム運営会議でも医療機関の負担軽減に配慮した臨床情報収集の効率化について議論されていますが、情報収集の効率化は充実した情報の集積に直結するため、具体案の検討と速やかな実施が必要であると、われわれも考えています。
続いて、全ゲノム解析事業についてです。2019年末、がんや難病領域の「全ゲノム解析等実行計画」の第1版を政府が策定しました。第1版では、先行解析のおおまかな数値目標が示されましたが、運営体制や産学連携体制の構築等、いくつかの重要な論点は今後検討されることになりました。製薬協も引き続き、具体的な計画が策定されるよう、議論に協力していきたいと考えています。産業界のニーズに合致したデータベースや仕組みを構築いただくことが、データ利活用の推進やそれによる利用料の確保につながります。それにより、継続的なデータの収集やさらなる利活用につながる、という好循環が極めて重要です。そのためにも、早い段階から産業界のニーズを積極的に取り込んでいただくことが重要と考えています。
-
(3)ヘルスケアイノベーション創出エコシステムの構築
2019年の参与会合で、次期の健康・医療戦略について議論され、案が公表されました。設備機器の共用やコホート研究の推進、国立研究開発法人日本医療研究開発機構(AMED)基金の設立、認知症分野における官民連携のプラットフォームの構築等、産学官連携の推進がより一層期待できる内容となっています。製薬業界も産学官連携事業に積極的に関与していきたいと考えています。
具体的なステップの一つとして、2020年4月頃に業界主導型プロジェクトを機動的に運営する法人を設立することを検討しています。政策提言の取り組みの特徴の一つは、複数の企業が1つの事業に参加することです。そのため、「資金やデータ、知的財産の集約管理」や「契約の一本化」等が必要になります。新たな法人が製薬協と連携しながら取り組むことにより、政策提言を円滑に推進できると考えています。
2. 研究開発税制
研究開発税制は、イノベーションを推進するための制度として、製薬業界にとって最も重要な税制です。2019年4月の改正では、業界側の要望も反映され、総額型の時限措置の2年延長やオープンイノベーション型の拡充等がなされました。時限措置については、2021年の4月が期限となっており、2020年はその延長等を要望していきたいと思います。
また、拡充されたオープンイノベーション型については、今後、より積極的に活用していきたいと考えていますが、その活用にはいくつかの要件があり、障害となっており利用が促進されない側面があります。規制要件の緩和について、政府側と会話していきます。
II. イノベーションの適切な評価
2020年までの進捗と今後の取り組み方針
医薬品の適正使用に向けた取り組みとしては、公益社団法人日本医師会との共催による薬剤耐性(AMR)セミナーの実施や、一般社団法人くすりの適正使用協議会と連携し、ポリファーマシーに関する国民啓発資材の作成等を進めてきました。今後、ポリファーマシーに関連するメディアフォーラムの開催等、適正使用に向けた取り組みをさらに強化・推進していきます。
薬価制度改革関連については、2020年度薬価制度改革に向けて新薬創出等加算の改善等、医薬品の医療的価値を適切に反映できる制度への見直しを要望してきました。今後、2022年度薬価制度改革に向けて「新薬の評価体系の再編」と「国民に分かり易い評価システムの確立」の検討を進めていきます。また、「全世代型社会保障が検討されるにあたっての考え方の整理」についても進めていきます(図2)。
 図2 イノベーションの適切な評価
図2 イノベーションの適切な評価
1. 適正使用推進に向けた取り組み
これまでの会見でも伝えました通り、製薬協内に「適正使用推進サブコミッティ」を設置し、検討を進めてきました。このサブコミッティで、グローバルな保健課題であるAMR問題や、ポリファーマシーや残薬問題につきまして、従来の枠を超えた適正使用の推進策の検討を進めています。適正使用の推進については、製薬協として取り組みを強化したい4つの推進課題を掲げて検討や活動を進めてきました。このうち、AMRやポリファーマシー問題への対応についての検討内容と活動内容について説明します。
-
(1)薬剤耐性(AMR)問題への取り組み
AMR問題への取り組みとしては、日本医師会との共催によるAMRセミナーを開催しました。医師や行政、製薬団体等、それぞれの立場から感染症対策に関する課題や取り組みに関して講演いただきました。また活発に議論も行っていただき、AMR対策に関する理解が深まったものと考えています。そのほかにも、クオール薬局でのAMR対策動画「STOP AMR」を映写する等、啓発活動を推進してきました。今後もAMR啓発活動をさらに推進し、効果検証を行っていきたいと考えています。
-
(2)ポリファーマシーに関する国民・患者さんへの普及活動
ポリファーマシーに関する国民・患者さんへの普及活動については、くすりの適正使用協議会と協議し、厚生労働省が策定した「高齢者の医薬品適正使用の指針」に関する国民向けパンフレットの作成を進めてきました。パンフレットは2020年2月中の完成を予定しており、3月以降はこのパンフレットを用いて啓発活動を推進していきます。また、メディアフォーラムの開催等も計画しています。さらに、ポリファーマシーに関する会員会社向けの研修資材を作成すること等により、会員会社の意識向上策も強化していきます。研修資材の作成もすでに進めており、2020年4月中の完成を予定しています。作成した資料は会員会社に配布するとともに、製薬協のウェブサイト上にも公開することで、広く活用いただくことを考えています。研修担当者向けの説明会の開催も計画しており、参加企業各社の社員の意識向上に資する取り組みを推進すべく、準備を進めています。
2. 2020年度薬価制度改革の振り返りと、2022年度の薬価制度改革に向けての検討事項
2020年度の薬価制度改革では「新薬創出等加算の改善」「新薬の加算体系の再編」「類似薬選定の基準見直し」の3点について要望をしてきました。今般、2020年度の薬価制度改革の骨子が中央社会保険医療協議会(中医協)で取りまとめられたので、各要望事項に関連する内容について、評価を述べます。
-
(1)新薬創出等加算の改善
品目要件は、医療上の必要性の高さや革新性・有用性の評価に基づいた拡充を要望し、また企業要件については、革新的新薬の開発に取り組んでいる企業であれば、企業規模によらず対象品目の薬価が維持される仕組みを要望してきました。2020年度薬価制度改革ではいずれの要件も改善方向への見直しとなったものの、その内容は限定的なものであったと考えています。本制度は真に有効な医薬品を適正に見極めてイノベーションを評価し、研究開発投資の促進を図ることが基本のコンセプトだと考えています。制度の見直しが、各企業における研究開発投資の促進に資するものかどうか、引き続き注意深く見ていきたいと考えています。
-
(2)新薬の加算体系の再編(医療的価値)
薬価収載時の評価としては、治療の質向上に資する医療的価値は、有用性加算「ハ. 治療方法の改善」に相当する事例として、同加算で評価され得ることが明確化され、われわれの要望が一定程度認められたと認識しています。今後、治療の質向上に資する医療的価値を有する医薬品の研究開発が促進されることを期待しています。
一方、薬価収載後の評価については、評価の拡充はなく、再算定の仕組みがさらに強化されることとなりました。再算定の仕組みの強化は効能追加への開発意欲低下につながることを懸念しており、革新性・有用性の高い効能追加を促進していく観点からも、薬価収載後のイノベーション評価の充実については、改善が必要であり、次期薬価制度改革に向けた検討事項と考えています。
-
(3)類似薬選定の基準見直し
制度の見直しには至らなかったものの、まず臨床的位置づけ等の医療実態が類似している事例を集積したうえで検討することとなりました。薬価算定の透明性・納得性を高めるという観点から、次期薬価制度改革に向けて業界としても事例集積には積極的に取り組んでいきます。
-
(4)2022年度薬価制度改革で実現したい事項
2020年度の薬価制度改革の内容を踏まえて、2022年度薬価制度改革で実現を目指したい事項を再整理しました(図3)。2022年度の薬価制度改革に向けては「新薬の評価体系の再編」と「新薬の評価プロセスの改善」の大きく2つの課題を掲げて検討を進めていきます。そのうち、「新薬の評価体系の再編」については、「社会的価値の評価」「収載後のイノベーションの評価」「類似薬選定の基準見直し」の3つを具体的な検討課題として検討を進めていきます。
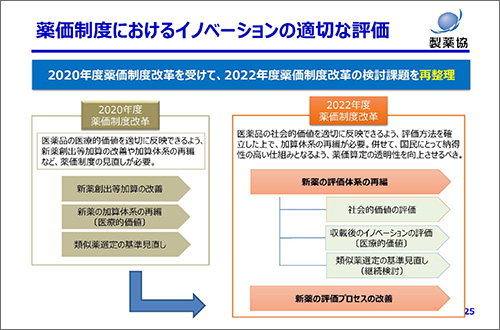 図3 薬価制度におけるイノベーションの適切な評価
図3 薬価制度におけるイノベーションの適切な評価
-
(5)「社会的価値の評価」についての検討状況
医薬品によってもたらされる社会的な波及効果は、視野を広げればさまざまにあると考えられます。医薬品によっては、経済や社会の「支える側」を増やす、あるいは医療資源消費の効率化につながることで、社会保障の持続性に寄与することができる医薬品があると考えています。そのような価値をもつ医薬品は、最終的には社会保障の持続性へと還元されるものであるため、一定の評価がされるべきであると考えています。
一方、これら「社会的価値」については、価値の定義、評価の方法等、検討すべき課題があると認識しています。そこで、まずは医薬品がもつ多様な価値の見える化を主課題とし、アウトカム指標・測定方法等に関する研究・調査を開始しています。
医薬経済学とアウトカム研究の啓発と普及を推進する国際的な学術団体である国際医薬経済・アウトカム研究学会(ISPOR)のTask forceにおいても、医薬品がもつ多様な価値に関しての報告があり、現在、ISPORで報告された価値はどのように定義されているのか等、日本の医薬品制度と照らし合わせながら整理を進めています。
-
(6)「薬価収載後のイノベーション評価」
2020年度の薬価制度改革においては、再算定の仕組みがさらに強化されることとなりました。このことは企業におけるビジネス全体の予見性を著しく低下させるとともに、効能追加への開発意欲低下につながることが懸念されます。薬価収載後に効能を追加することは、患者さんの状態に応じた薬剤治療の選択肢を増やす観点から、医療の質の向上に貢献するものです。革新性・有用性の高い効能追加を促進していく観点からも、次期薬価制度改革においては、薬価収載後のイノベーション評価の充実についての検討を進め、改善を要望していきます。
類似薬選定の基準見直しについては、類似薬を幅広く選定できるようになり、原価計算方式による算定を減らすことにつながります。また複雑なルールを用いずに算定できるようになることで、薬価算定の納得性を高めることも期待できます。2020年度の薬価制度改革では継続検討となりましたが、製薬協としても次期薬価制度での実現に向けて、より良い仕組みとなるよう、事例の集積には積極的に協力していきたいと考えています。
-
(7)新薬の評価プロセスの改善
これまでの会見でも説明しました通り、評価報告書の活用による評価システムの確立を目指したいと考えています。これは、第三者が作成する評価報告書を通じて、企業が説明する比較対象薬の選定や、医薬品の価値が客観的に評価・記載され、その内容は公表されることが前提です。この評価報告書に基づいて、薬価が算定されることになれば、新薬の薬価がどのような根拠に基づいているのか、企業の考え方も含め、さらにわかりやすくなるものと考えています。
「新薬の評価体系の再編」と「新薬の評価プロセスの改善」を実現することにより、原価計算方式による算定事例の低減や薬価算定のブラックボックス的な性格を解消することが期待できます。「国民に分かり易い評価システム」を確立することで、薬価算定に関する納得性、国民の薬価に対する信頼感を高めていきたいと考えています。
-
(8)全世代型社会保障について
次に、全世代型社会保障が検討されるにあたっての製薬協としての考え方を述べさせていただきます。大きく3点あります。
まず「持続可能な社会保障制度の構築」と「持続的な経済成長」を両立するためには、より長期的な視点で検討されることが重要と考えています。そのため、団塊世代が後期高齢者となる2022~2025年といった比較的、短期的な視点のみならず、高齢者数がピークを迎える2040年を見据えた改革となることを期待しています。
2点目としては、超高齢社会における社会保障のあるべき姿や大きなビジョンについて、国民に示していただきたいと考えています。その全体像を踏まえたうえで、各々の課題について国民的な議論が喚起されることを期待しています。
3点目は、社会保障におけるいわゆる「支える側」を増やすことについては、多くの有識者の方々がその重要性について述べられています。「支える側」を増やすための施策について、幅広く検討が進められることを期待しています。
全世代型社会保障については、2019年の12月に中間報告が取りまとめられました。取りまとめられた「基本的な考え方」や「主要な改革ポイント」の内容はいずれも人々が「健康」に働くことが大前提となります。製薬企業は「健康寿命の延伸」という形で全世代型社会保障の確立に貢献することができます。
ここに全世代型社会保障における創薬の貢献についてお示ししています(図4)。
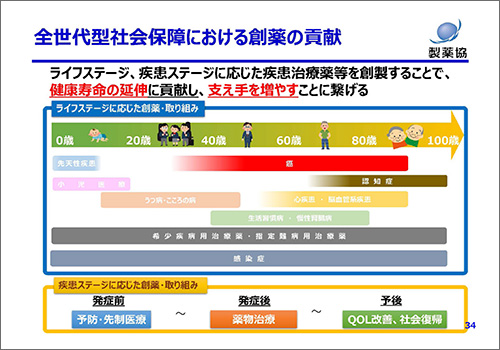 図4 全世代型社会保障における創薬の貢献
図4 全世代型社会保障における創薬の貢献
人生100年時代といわれる中、各ライフステージで問題となるさまざまな疾患があります。依然として人類の生命と健康にとって重要な問題であるがんに対する治療薬はもちろん、認知症や希少疾患等にも取り組み、各ライフステージに応じた革新的な医薬品を創製することで、健康寿命の延伸に貢献し、支え手を増やすことにつなげたいと考えています。また個別の疾患ステージにおいても、発症前の予防・先制医療から、治療予後におけるクオリティ・オブ・ライフ(QOL)の改善や社会復帰までを見据えた創薬に取り組むことによって、全世代型社会保障に貢献していきたいと考えています。
最後に
革新的新薬の恩恵を広く日本にもたらし、健康寿命のさらなる延伸を実現可能とするためには『イノベーションの創出』と『イノベーションの適切な評価』のどちらか一方ではなく、車の両輪として両方を強力に推進することが必要です。そのために必要なことを政策提言に込めました。われわれは、使命であるイノベーションの追求と社会課題の解決に向けて全力で取り組んでいきます。みなさんにおかれましては、イノベーションへのご支援、イノベーションの価値へのご理解をお願いします。
主な質疑応答
 質疑応答の様子
質疑応答の様子
Q1 2020年、今年の課題は?
研究開発税制の総額型の時限延長が大きなテーマである。研究開発投資における非常に大きな促進剤となるので、日本経済全体を考えるにあたっても、研究開発投資を進めるには効果のある制度だと思う。またオープンイノベーション型が拡充されてきたが、手続き要件が障壁となり、控除上限まで利用できていないケースも多いので、いかに簡略化、効率化していくかということを国・行政と話し合っていきたい。
薬価制度改革に向けての議論を進めていく中で、長期的には社会的価値の認識を広げたい。たとえば、ある抗がん剤が10%しか効かない場合に、この10%を見極める診断薬は極めて価値が高いことになる。このように社会保障全体に影響を与える価値があることを認識いただき、それらの価値を適切に評価することで、社会保障全体の持続性に寄与する医薬品が生み出される制度を作っていただきたい。
少子高齢化、社会保障費の増大という流れに直面していく中で、最後は国民がお金の流れについて納得する必要がある。そのために薬価算定プロセスの透明性を高め、価格の納得性が高まるような制度にしていきたい。
Q2 薬価制度だけでなく全世代型社会保障への取り組みという観点での業界の取り組みは?
議論の焦点が2022年という足元の議論になっているが、日本の社会が高齢者数のピークを迎える2040年を見据え、日本のインフラ(社会保障制度)が安定している必要がある。そのためには、2040年に若い世代が健康で活躍できる社会を実現するためのプロセスを考えていく必要がある。その視点で議論していきたいが、それには日本で良い医薬品が生まれる環境を作る必要がある。たとえば、ゲノムのデータベースの充実等のさまざまな打ち手は、ただ低減するだけではなく、良いものが評価され、海外の良いものも含めて、日本での開発が志向されるような状況にならないといけない。それは、逆に日本の医薬品が海外に出て行くことにもつながる。また、ゲノムデータベースを活用した研究開発の効率化が進めばコスト低減につながり、そこから上がる利益は日本の経済にポジティブに働く。このようなさまざまな打ち手がなされていけば、将来にとって見通しの明るい材料となり、ほかの投資より成果が期待できるものとなるのではないか。
Q3 新薬創出加算の見直しが限定的だったとのことだが、2022年度に向けての課題認識において新薬創出加算をどうしたいというのが見えにくいが?
企業要件、品目要件とも見直された内容があるものの、われわれとしてはまだ十分納得していないところがある。その点については、いくつか考え方を提示し議論していきたい。ただし、今のままで議論しても前に進まないので、医薬品の評価に関して収載後の評価も含めて、より適正にさまざまな角度から説明していきたい。品目要件については、具体的な事例を積み上げて、仮に3番手以降であっても非常に重要な薬剤が過去に生まれている等、事例を説明しながら見方を広げてもらうような努力をしていく。
Q4 薬価収載後のイノベーションの評価において、革新性、有用性の高い効能追加の評価について言及されたが、具体的な事例はあるか?
手元に具体的な事例はないが、ここで示したかったことは、これまでは再算定等、下げる評価に議論が偏っており、このままでは企業の効能追加へのモチベーションは落ちるため、プラスの評価も必要ということである。プラス評価をすれば薬価がさらに上がるという懸念もあると思うが、プラスの評価を入れても、薬価が今の水準を超えて上がるということはあり得ないと考える。あまりにも薬価が引き下がるものについて、革新性・有用性のあるほかの効能がある場合には、患者さんのメリットを考えたインセンティブを付けるべきである。それは下げ圧力を超えるような水準ではない。
Q5 保険償還の範囲について財務省が意見を出しているが、革新的新薬が次々に登場し、高額なものが出てくるという環境下で、昔からある医薬品はいつまで限りある財政下で保険償還をし続けるのかという論調があるがどうか?
保険償還の範囲は、皆保険制度の考え方に基づけば、保険者全員が承認された医薬品から受益する権利をもっている。その範囲の見直しには国民的な議論が必要である。現行の保険制度の範囲内でも、たとえばジェネリックのウエイトを高めるとかさまざまな打ち手がなされてきたが、そういったことがさらに進んだうえでの次の議論になるかもしれない。なによりも保険者の権利というものをもう一度定義したうえで議論されるべきである。また、その範囲については、医師の意見も十分反映し、患者さんを治療するうえで、どの範囲で可能かを議論する必要がある。
Q6 診療報酬改定で毎回本体部分のプラスを出すために、薬価部分で充当されているが、この点をどう考えているか?
社会保障費の増加分のほとんど、あるいはそれ以上を薬価で切り下げてきたという経緯があるので、そこは根本的に見直していくべきではないか。一方で、診療報酬が上がることについては、医療機関の経営との関係において妥当性が検証されるべきであり、薬価と直接的な比較はできないと考える。われわれとしては、医薬品の価値に対して、それが適切かどうかという論点だけで議論をしたい。
Q7 全世代型社会保障の部分は、業界内でどのように、またいつ頃までに検討して整理していくのか?
基本的には支える側と支えられる側の負担をどれくらい変えるかという議論になっていく。2040年であれば、75歳まで元気な人が働けて、76歳以上の人を支えることができれば、今と同じ水準で支える側と支えられる側とのバランスが取れるという絵が描ける。そのために75歳の人たちの健康管理に必要なものはなにかとか、その中で重要な疾病はなにかを考える必要がある。がんの死亡率等は改善しつつあるが、依然としてがん種によっては致死的な状況になることがあるので、そういう人たちを救うことで社会全体のバランスを変えることが可能であり、トータルとして住みよい社会になる。こういうことを議論してきたい。
Q8 これからのインフラを支えていくためにも、医薬品の多様な価値の見える化が必要という認識でよいか?
その通りである。国民すべてが納得しなければ世の中のお金が回っていかない。納得できれば、それをうまく使っていけるのではないか。薬価は非常に複雑なものとなっており、国民の代表である議員の先生方もすべてを理解されるのは難しい。そのような状態で社会の中心的な課題になってしまうのは問題である。薬価がどのようなプロセスで、どのように判断されているのか、それを透明化することが極めて重要と考える。
(広報委員会 政策PR部会 吉田 力)

