トピックス 電子データ申請に関するアンケートの結果報告
2013年6月の「健康・医療戦略」の発表から1年後の2014年6月20日、「承認申請時の電子データ提出に関する基本的考え方について(薬食審査発0620第6号、2019年1月24日一部改正)※1」(以下、「基本的考え方」)が厚生労働省から発出され、2016年10月から医薬品の「承認申請時の電子データ提出」(以下、電子データ提出)の受付が開始となりました。2020年3月31日までは経過措置期間として電子データ提出は任意となっていますが、2020年4月1日以降は承認申請時の電子データの提出が必須要件となります。経過措置期間の最終年度を迎え、製薬協では各社の電子データ提出経験等を調査する目的で2019年4月26日~5月17日の期間で「電子データ申請に関するアンケート」を実施しました。その調査結果の一部を報告します。
はじめに
本アンケートは製薬協医薬品評価委員会データサイエンス部会に加盟する企業63社を対象に、各社の電子データ提出経験等を調査する目的で実施しました。タスクチームでの検討の結果、内資系企業と外資系企業で大きな差異は認められなかったことから、本ニューズレターでは一部の結果を除いて全体の結果について報告します。なお、特段の記載がない集計結果については、アンケート有効回答社数である56社を対象として割合を計算しています。また、独立行政法人医薬品医療機器総合機構(PMDA)との相談区分が2019年4月より変更となり、「申請電子データ提出確認相談」に加え、「申請電子データ提出方法相談」と「申請電子データ提出免除相談」が新設されました。本アンケートでは従来実施されてきた「申請電子データ提出確認相談」について調査しました。
調査結果(1)アンケート回答状況
調査対象会社63社のうち56社から回答を得ました(回答率89%)。内訳は、国内資本(以下、内資)が42社(75%)、海外資本(以下、外資)が14社(25%)でした(図1)。また、本アンケートに回答した企業の背景情報として、日本国内の業務に従事するデータマネジャー、解析担当者、統計担当者の人数についても調査しました。1~10名が最も多く25社(45%)でした。次いで、21~50名が14社(25%)、11~20名が11社(20%)、51名以上が3社(5%)でした。日本国内の業務従事者なし(0名)の会社も3社(5%)存在しました(図2)。
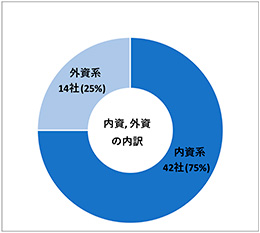 図1 アンケート回答状況(N=56)
図1 アンケート回答状況(N=56)
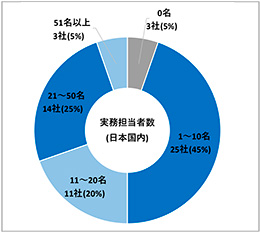 図2 日本国内の業務に従事するデータマネジャー、解析担当者、統計担当者の人数(N=56)
図2 日本国内の業務に従事するデータマネジャー、解析担当者、統計担当者の人数(N=56)
調査結果(2)日本国内申請における電子データ提出経験の有無
「提出経験あり」31社(55%)、「提出経験なし」25社(45%)となり、半数以上の企業が電子データ提出を経験しているという結果となりました(図3)。2017年12月19日から2018年1月10日の期間で実施した「PMDAへの承認申請に必要な申請電子データ提出確認相談資料記載要領(別紙8)および提出電子データに関するアンケート(調査対象63社、回答社数48社)」の結果では、「提出経験あり」18社(37.5%)、「提出経験なし」30社(62.5%)となり、今回のアンケート結果と比較すると、経過措置期間を活用し、電子データ提出経験を積んでいることがうかがえます。
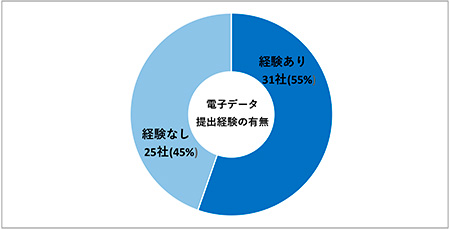 図3 日本国内申請における電子データ提出経験の有無(N=56)
図3 日本国内申請における電子データ提出経験の有無(N=56)
なお、「提出経験なし」と回答した25社を対象に、最初の電子データ提出をいつ頃予定しているかについて調査したところ、「2020年3月31日以前」8社(32%)、「2020年4月1日以降」17社(68%)という結果になりました。すでに電子データ提出を経験した企業を含め、約70%の企業が経過措置期間終了前にデータ提出を経験するという状況がわかりました。
調査結果(3)申請電子データ提出確認相談実施回数
「実施経験あり」の合計が37社(66%)で、内訳は1回が9社(16%)、2回が2社(4%)、3回が4社(7%)、4回が6社(11%)、5回が4社(7%)、6回以上が12社(21%)という結果となりました(図4)。0回と回答した会社が19社(34%)あり、この回答をした多くの会社が調査結果(2)で最初の電子データ提出を「2020年4月1日以降」と回答した会社でした。データ提出経験がない会社でも、2020年3月31日以前にデータ提出を予定している会社は申請電子データ提出確認相談を実施していることがわかる結果となりました。
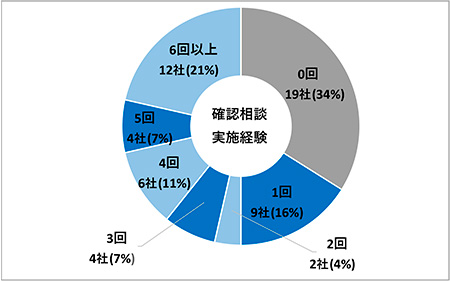 図4 申請電子データ提出確認相談の実施回数(N=56)
図4 申請電子データ提出確認相談の実施回数(N=56)
次に申請データ提出確認相談実施経験ありと回答した37社を対象に、「申請データ提出確認相談の相談内容」について調査しました(図5)。「その他」以外の回答を頻度順でみると、「SDTM(Study Data Tabulation Model)仕様」が25社(68%)で最も多く、次いで「Validation Issueの説明」24社(65%)、「ADaM(Analysis Data Model)仕様」18社(49%)、「プログラム提出」13社(35%)、「Define仕様」6社(16%)という結果となりました。
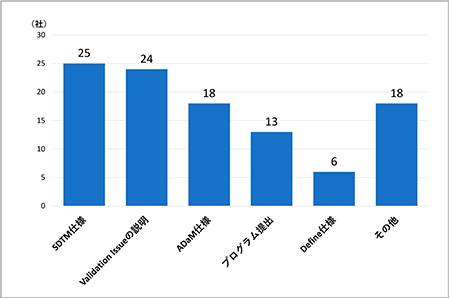 図5 申請データ提出確認相談の相談内容(複数回答可, N=37)
図5 申請データ提出確認相談の相談内容(複数回答可, N=37)
「その他」と回答した会社は18社(49%)であり、約半分の会社が今回のアンケートで事前に規定した項目以外の内容の相談を実施していることがわかりました。「その他」で多く見られた相談内容としては「Analysis Results Metadataについて」、「臨床薬理領域のデータ提出について」、「Legacy data conversionについて」がありました。
「Validation Issueの説明」以外は新設された「申請電子データ提出方法相談」(有料)で扱う内容となるので、申し込み区分について注意が必要になるかと思います。
調査結果(4)別紙8※2作成経験の有無
「あり(PMDAへの提出経験あり)」35社(63%)、「あり(PMDAへの提出経験なし)」4社(7%)、「なし」17社(30%)で、電子データ確認相談実施ありの結果(37社)とほぼ一致する結果となりました(図6)。
-
※2別紙8「申請電子データ提出確認相談資料 様式」(平成31年4月1日一部改正)
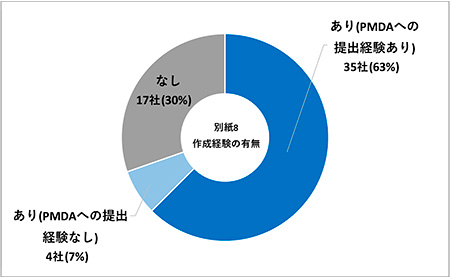 図6 別紙8作成経験の有無(N=56)
図6 別紙8作成経験の有無(N=56)
調査結果(5)申請電子データ提出について
電子データ提出経験ありと回答した31社を対象に、電子データ提出に関連する項目についてもいくつか調査を実施しました。
まず、電子データ提出の際にGateway経由で提出したかどうかについて調査しました(図7)。「TSVファイルを利用してGatewayで提出」21社(68%)、「Gatewayシステムに直接入力してGatewayで提出」16社(52%)、「Gatewayを経由せずに提出」2社(6%)という結果でした。「Gatewayを経由せずに提出」の2社の提出方法はいずれも「窓口提出」でした。なお、「TSVファイルを利用してGatewayで提出」と回答した会社のコメントとして、「薬事部門でTSVファイル仕様に従い試験データ情報を作成し、試験データ作成部門でTSVファイル情報を確認している」や「Controlled terminology等、簡単な情報はGatewayのプルダウンから直接入力、臨床薬理試験のDescriptionはTSVファイルに入力している」というコメントがありました。このように、TSVファイルの運用方法について整備を進めている会社があることがわかりました。
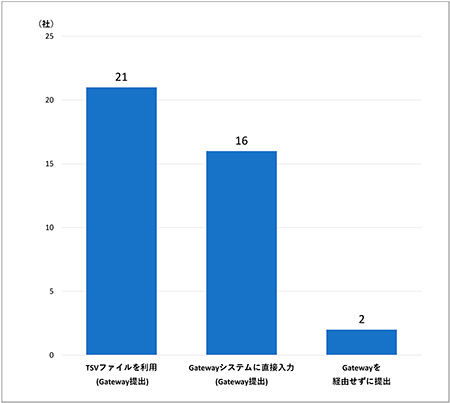 図7 Gateway経由でのデータ提出について(複数回答可, N=31)
図7 Gateway経由でのデータ提出について(複数回答可, N=31)
次に「申請予定日の何週間前にデータを初回提出したか」について調査しました。複数テーマで電子データ提出を経験している場合は最大値(早く提出したケース)での回答となります。「1週間未満」2社(6%)、「1週間以上2週間未満」3社(10%)、「2週間以上3週間未満」3社(10%)、「3週間以上4週間未満」6社(19%)、「4週間以上5週間未満」11社(36%)、「5週間」5社(16%)、未回答が1社(3%)という結果でした(図8)。3週間以上前に提出した会社が22社(70%)となっており、データ提出後のPMDAのバリデーションに要する時間や提出後の修正指示のリスクを想定し早めにデータ提出を実施している会社が多い傾向がうかがえました。
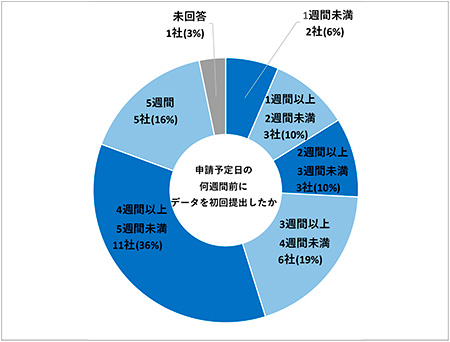 図8 申請予定日の何週間前にデータを初回提出したか(N=31)
図8 申請予定日の何週間前にデータを初回提出したか(N=31)
続いて「初回提出後、何日後に受領可・受領不可となったか」について調査しました(図9)。複数回の電子データ提出を経験している場合は最大値(より日数のかかったケース)での回答となります。「0日~3日」15社(48%)、「4日~6日」12社(39%)、「7日~9日」1社(3%)、「10日以上」1社(3%)、未回答が2社(7%)という結果となりました。0日~6日が27社(87%)と多くを占めており、PMDAが公表している「受領可・受領不可の結果入手までにかかる日数」である5営業日と一致する結果となりました。ただし、今回のアンケート実施時点では経過措置期間中ということもあり、一部の試験のみを提出したケースも本結果に含まれることが推察されます。提出対象となる試験が多く含まれる電子データ提出の場合はPMDA側のバリデーションにかかる時間も多くなることが想定されるため、可能な限り早めに電子データを提出することが望ましいと考えられます。
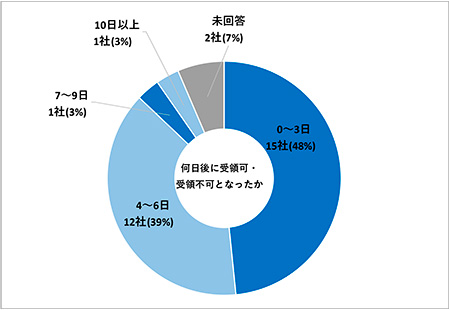 図9 初回提出後、何日後に受領可・受領不可となったか(N=31)
図9 初回提出後、何日後に受領可・受領不可となったか(N=31)
次に電子データの再提出に関して「初回提出後、受領可となるまで何回提出したか」について調査しました。複数回電子データ提出を経験している場合は最大値(より多く再提出をしたケース)での回答となります。「0回(再提出なし)」12社(39%)、「1回」10社(32%)、「2回」8社(26%)、未回答が1社(3%)で半数を超える企業が再提出を経験しているという結果となりました(図10)。
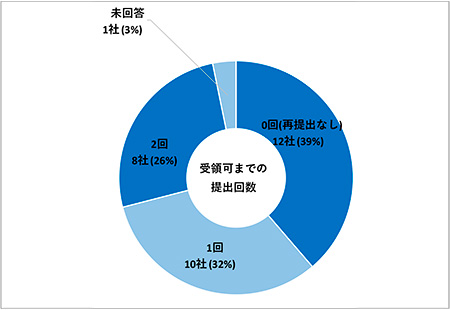 図10 初回提出後、受領可となるまでの電子データ提出回数(N=31)
図10 初回提出後、受領可となるまでの電子データ提出回数(N=31)
また、再提出を経験した18社を対象に「初回提出から受領可となるまでにかかった期間」について調査しました。「1週間未満」5社(28%)、「1週間以上2週間未満」4社(22%)、「2週間以上3週間未満」3社(17%)、「3週間以上4週間未満」「4週間以上5週間未満」「6週間以上」がそれぞれ2社(11%)でした(図11)。
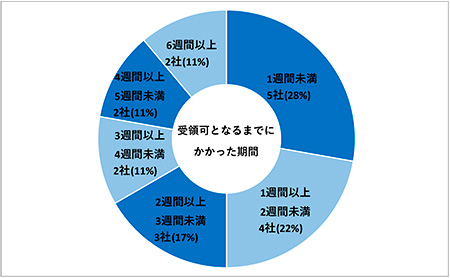 図11 初回提出から受領可となるまでにかかった期間(N=18)
図11 初回提出から受領可となるまでにかかった期間(N=18)
再提出には「指摘事項の修正」、「Gatewayでのデータ再提出」、「PMDA側のバリデーション」に時間を要するため、再提出のリスクの観点からも電子データ提出を申請日より余裕をもって(申請予定日の5週間前から電子データの提出が可能)実施することが推奨されます。
調査結果(6)バリデーションに使用しているツールについて
使用しているツールを個別で見ると、「Pinnacle 21 Community Edition v2.1.3(PMDA採用21E 3.0.5対応)」が最も多く39社(70%)、次いで「Pinnacle 21 Enterprise Edition」が19社(34%)という結果となりました(図12)。なお、使用しているツールを組み合わせでみると、「Pinnacle 21 Community Edition v2.1.3(PMDA採用21E 3.0.5対応)とPinnacle 21 Enterprise Editionの併用」が13社(23%)で最も多い結果となりました。一方で「Pinnacle 21 Community Edition v2.1.3(PMDA採用21E 3.0.5対応)」のみをバリデーションツールとして使用していると回答した会社も22社(39%)あり、PMDAバリデーションルールのチェックという観点ではCommunity Edition(無償版)でも対応可能ということがうかがえます。しかしながら、「PMDAのバリデーション結果と自社の結果に差異があったか」についても調査したところ、Community Editionでは検出できないViolationに起因する差異があったとの回答もいくつか見られました。これらの情報は「申請時電子データ提出にかかる実務担当者のためのワークショップ」でも共有されることがあるので、過去の開催資料とあわせて最新の情報を確認する必要があると考えられます。
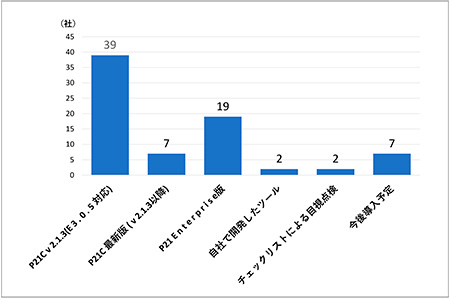 図12 使用しているバリデーションツール(複数回答可, N=56)
図12 使用しているバリデーションツール(複数回答可, N=56)
調査結果(7)電子データ提出にかかるその他事項
CDISC(Clinical Data Interchange Standards Consortium)運用における課題についての調査結果です。回答の多かった上位5つは「人的リソースの確保」42社(75%)、「申請・承認タイムラインへの影響」40社(71%)、「管理体制(メタデータガバナンス、バージョンコントロール等)」と「追加で発生する費用」がそれぞれ30社(54%)、「専門家の育成」28社(50%)という結果となりました(図13)。2017年1月と2017年12月に実施した同内容のアンケートでも、上位5つは同じ項目でした(順位の変動はあり)。特に「人的リソースの確保」や「追加で発生する費用」については、CDISCの実装や電子データ提出について、いかに効率的なプロセスを構築するかが課題解決の鍵になると考えられますので、経過措置期間終了後も各社で引き続き検討していくことが重要になると考えられます。
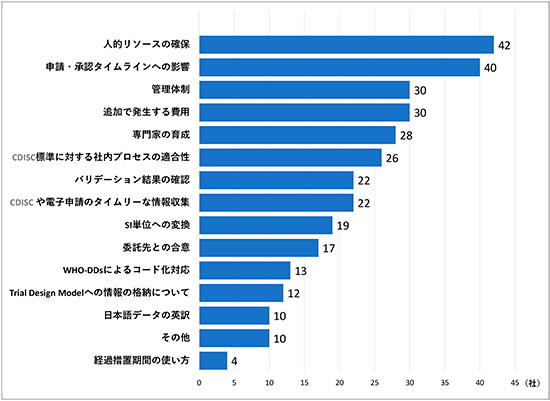 図13 CDISC運用における課題(複数回答可, N=56)
図13 CDISC運用における課題(複数回答可, N=56)
次に電子データ提出を経験して感じたメリットについて調査しました(図14)。「社内プロセスの見直しを行った」35社(63%)、「部署間で理解が深まった」23社(41%)、「照会事項が変化した」2社(4%)、「照会事項で集計する機会が減少した」3社(5%)、「特になし」7社(13%)という結果でした。多くの会社で社内体制の構築という観点でメリットを感じていることがうかがえます。
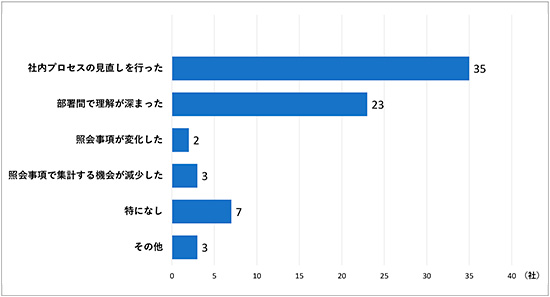 図14 電子データ提出を経験して感じたメリット(複数回答可, N=56)
図14 電子データ提出を経験して感じたメリット(複数回答可, N=56)
以降、自由記述として収集した設問となります。はじめに「電子データ提出の経験を踏まえてのPMDAへの要望」(表1)の調査結果です。ここではコメント内容をカテゴリに分類したうえで、多く挙がったコメントについて報告します。
 表1 電子データ提出の経験を踏まえたPMDAへの要望
表1 電子データ提出の経験を踏まえたPMDAへの要望
カテゴリ別で多かったコメントは、FDAとの要件の統一に関するコメントでした。「要件の違いにより社内プロセスの構築に影響をおよぼすため」といった意見があり、各社で対応に苦慮していることがわかりました。Legacy data conversionについては「試験の位置づけに応じたリーズナブルな対応をしていただきたい」、「Legacy data conversion実施時、Rejectが避けられない場合があり、Rejectがあっても受け入れ可としていただきたい」という要望が挙がりました。
最後に「経過措置期間終了後の電子データ提出に対する懸念点」ですが、挙げられたコメントが多岐にわたることから、編者にて内容のわかるものについて下記の通りコメント概要としてまとめました(表2)。「Legacy data conversionがどこまで必要か」、「新相談区分(有料)にかかる費用」といったリソースおよび費用面に加え、品質や審査期間への影響に関する懸念点が挙がりました。
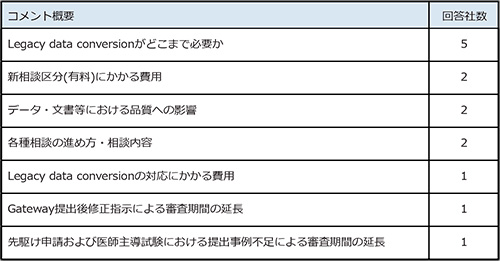 表2 経過措置期間終了後の電子データ提出に対する懸念点
表2 経過措置期間終了後の電子データ提出に対する懸念点
おわりに
データサイエンス部会では円滑な承認申請時の電子データ提出実施をサポートすべく、電子データ提出にかかる成果物の作成や「申請電子データ利用体制構築に向けたSWG(サブワーキンググループ)」を通じて、より良い利用体制構築に向けてPMDAと協議を進めてきました。また、その活動の中で経過措置期間の有効活用についても推進してきました。本アンケートは経過措置期間の終了年度に電子データ提出に関する各社の状況を把握し、今後の製薬協の活動の指針とする目的で実施しました。アンケートでは半数以上の企業が電子データ提出を経験しているという結果となり、多くの企業が経過措置期間を通じて着実にデータ提出経験を積んでいることがわかりました。また、データ提出を経験することで「社内プロセスの見直し」や「部署間での理解の推進」が進んだというメリットがあったという声がありました。しかし、その一方で「人的リソース確保」、「追加で発生する費用」等、コストに関する課題や、「承認・申請タイムライン」に関する課題を依然として多くの企業が抱えているということも明らかになりました。また、PMDAとFDA間での電子データ提出にかかるプロセスや要求事項の違いの解消を求める声も根強くあります。さらに、2019年4月より新設された「申請電子データ提出方法相談」や「申請電子データ提出免除相談」の運用についても各社で検討が必要になると考えられます。
製薬協としては、これらの課題の解決の一助となるような成果物の作成や提言を今後も継続して行っていきます。また、申請電子データ利用体制構築に向けたSWGを通じて、PMDAとFDAの要求事項のギャップの軽減の模索と提案に向けてPMDAや関係するステークホルダーと引き続き協議をしていきたいと思います。本アンケートでも挙がった「申請時電子データ提出にかかる実務担当者のためのワークショップ」の継続開催についても、開催形式を含めて検討していきたいと考えています。
謝辞
アンケート調査にご協力いただいた多くの企業のみなさんに深く感謝いたします。
(医薬品評価委員会 データサイエンス部会 坂上 拓、日比野 翔、小泉 慶一)

