政策研のページ 近年の国際共同治験の参加国の分析 臨床試験登録システムClinicalTrials.govを基に
医薬産業政策研究所(政策研)では過去に国際共同治験の実施状況に関する調査結果をいくつか報告してきましたが、日本で国際共同治験の治験計画届数が急速に増加した2012年以降について同様の調査は行っていませんでした。そこで今回、ClinicalTrials.govに登録されている臨床試験を対象に、近年の日本の国際共同治験への参画状況について調査し世界主要国と比較しましたので、紹介します。
政策研ニュースNo.57では、世界の売上高上位300製品の日米欧の上市状況をもとにドラッグ・ラグが近年改善されつつあること※1を報告しました。その要因として、日本では、独立行政法人医薬品医療機器総合機構(PMDA)の審査期間が米国食品医薬品局(FDA)と同様の水準まで短縮されたことのほか、日本で国際共同治験が実施されるようになったことを挙げています。2007年に厚生労働省から「国際共同治験に関する基本的考え方」が発出されて以降、日本で実施される国際共同治験数は増加を続けており、2018年度には治験計画届764件中、国際共同治験に係るものは389件(50.9%)と過半数を占めるにいたっています(図1)※2。
-
※1医薬産業政策研究所「世界の売上高上位300製品の上市状況の日米欧比較 —ドラッグ・ラグの解消は進んでいるのか—」政策研ニュース No.57(2019年7月)
-
※2独立行政法人医薬品医療機器総合機構 平成30事業年度業務報告書 Accessed on Sep 30, 2019
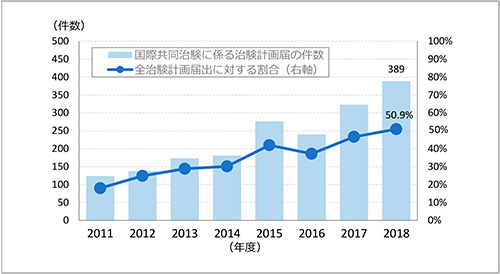 図1 国際共同治験に係る治験計画届件数の推移
図1 国際共同治験に係る治験計画届件数の推移
出所:独立行政法人医薬品医療機器総合機構 事業年度業務報告書をもとに作成
政策研では過去に、製薬企業へのアンケート調査をもとにした日本の国際共同治験の実施状況と症例数分析※3やClinicalTrials.govに登録された試験を対象とした国際共同治験数の日本と世界各国との比較※4を行っています。しかし、国際共同治験の治験計画届数が急速に増加した2012年以降について日本と世界各国との国際共同治験数の比較は行っていませんでした。
-
※3医薬産業政策研究所「新薬の国際共同治験実施状況と症例数 —新薬の臨床開発と承認審査期間調査より—」政策研ニュース No.48(2016年7月)
-
※4医薬産業政策研究所「国際共同治験の実施状況 —実施試験数による分析—」政策研ニュース No.41(2014年3月)
今回、2012年以降における日本および世界各国の国際共同治験への参画状況を分析する目的で、各国における国際共同治験の実施試験数を調査しました。調査は、米国国立衛生研究所(NIH)等によって運営されている臨床試験登録システム(ClinicalTrials.gov)を用い、同システム内で登録されたInterventional Studies(Clinical Trials)のうち、PhaseがPhase 2またはPhase 3で、Funder TypeがIndustryと登録されている試験を対象としました(2019年9月5日時点)。なお、本調査では実施国が2ヵ所以上登録されている試験を国際共同治験、実施国が1ヵ所の試験を単一国試験と定義しました。
ClinicalTrials.govに登録された試験数の年次推移
ClinicalTrials.govに登録された試験(Phase:Phase 2またはPhase 3、Funder Type:Industry)について、それぞれの試験開始年ごとに試験数の推移(2000~2018年)を図2に示します。
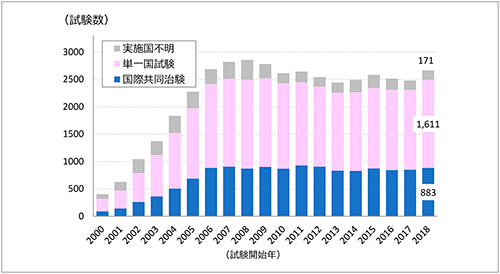 図2 ClinicalTrials.govに登録された試験数の年次推移(国際共同治験/単一国試験)
図2 ClinicalTrials.govに登録された試験数の年次推移(国際共同治験/単一国試験)
出所:ClinicalTrials.govをもとに作成
国際共同治験、単一国試験ともに、2000~2006年にかけ試験数が急増し、その後2018年まで、国際共同治験が800~900試験、単一国試験が1400~1600試験といずれも大きな変動はなく、横ばいで推移していました。
2000年のヘルシンキ宣言の改訂(臨床研究結果の公表義務化)、2004年の国際医学雑誌編集者会議(ICMJE)声明※5(被験者のエントリー開始前に公的な臨床試験公表データベースに未登録の研究は、Lancet誌等ICMJEに加盟している医学雑誌への掲載を認めない)に加え、1997年、2007年のFDA改正法※6により、FDAへ治験許可申請(IND)を提出して実施する試験はClinicalTrials.govへ事前登録することが義務化されたことから、米国をはじめとして世界中より試験の登録が増加したと考えられます。一方、試験登録が定着した2006年以降は全体の試験数自体は変わっていないことから、Phase 2またはPhase 3の試験数自体は、2006年以降大きく変わっていないと考えられます。
-
※5Clinical trial registration: a statement from the International Committee of Medical Journal Editors. Ann Intern Med. 2004;141:477-478.
-
※6公益社団法人日本医師会 治験促進センター「2007年FDA改正法(Food and Drug Administration Amendments Act of 2007)成立に伴う米国における臨床試験登録および結果開示への影響 Accessed on Oct 3, 2019.
国別の国際共同治験/単一国試験の試験数
国別に国際共同治験/単一国試験の試験数(2000~2018年の累積試験数)を算出し、国際共同治験、単一国試験、試験総数別に上位30ヵ国を表1に示します。
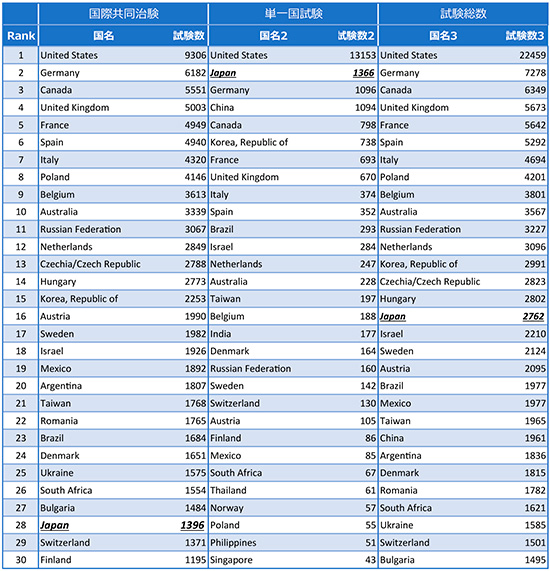 表1 国際共同治験/単一国試験の実施試験数の上位30ヵ国
表1 国際共同治験/単一国試験の実施試験数の上位30ヵ国
出所:ClinicalTrials.govをもとに作成
国際共同治験の実施試験数は、米国、ドイツ、カナダ、英国、フランス、スペイン、イタリアの順に多く、米国・カナダの北米2ヵ国およびオーストラリアを除き、欧州の国(主要5ヵ国のほか、ポーランド、ロシア、チェコ、ハンガリー等の東欧諸国も上位)が上位を占めていました。それに対し、アジアは韓国の15位が最上位で、台湾が21位、日本は1396試験で28位であり、中国は867試験で40位と上位30位に入っていませんでした。
一方、単一国試験については、米国が1万3153試験と圧倒的に多く、2位の日本の10倍程度でした。米国のほかでは、日本、ドイツ、中国、カナダの順に多く、6位は韓国であり、米国以外の国ではアジアの各国が比較的多い傾向を示しました。試験総数(国際共同治験+単一国試験)で見ると、国際共同治験、単一国試験ともに多かった米国に続いて、国際共同治験の試験数が多かった欧州各国(ドイツ、英国、フランス、スペイン、イタリア)やカナダが上位であり、日本は16位、中国は23位でした。
米国では、国際共同治験の試験数に比べて単一国試験数が極端に多い点が米国以外の国際共同治験上位国である欧州各国と比べて特徴的です。欧州各国における単一国試験が米国(FDA)への申請を前提とした試験でなく、米国の臨床試験登録システムであるClinicalTrials.govにわざわざ登録していない可能性はあるものの、欧州は各国間の距離が近く、かつ同じ経済区域(欧州連合)にあることや、欧州医薬品庁(EMA)による中央審査方式が採用されていること等から、欧州の2ヵ国以上の国で試験を実施、いわゆる"欧州共同試験"が多く実施されている可能性が考えられました。それに加え、国際共同治験が世界で多く実施されるようになった2000年代前半より、米国の大手開発受託機関(CRO)が中心となり、ポーランド、チェコといった東欧諸国での試験実施(症例獲得)を強力に推し進めたことも要因の一つと考えられました※7。なお、日本も、韓国、台湾、シンガポール等アジア各国と共同したアジア共同試験を実施することが多いのですが、その数自体は欧州と比較して少ないものと考えられました。
-
※7"Central and Eastern Europe Triples Global Trial Participation" The CenterWatch Monthly:Volume 15, Issue 6(2008年6月)
主要国の国際共同治験の試験数年次推移
主要国別の国際共同治験の試験数の年次推移を図3に、全体に占める割合を図4に示します。米国は、ClinicalTrials.govへの登録数の増加に合わせて、2000~2006年に急激に増加し、2006年は549試験、それ以降は少しずつ上昇し、2018年は684試験でした。これはClinicalTrials.govに登録されているすべての国際共同治験のうちの77.5%を占めていました。ドイツ、フランスについては、2006年以降は増加傾向がなくなりドイツが年平均400試験(全体の45%程度)、フランスが320試験(全体の35~40%)で推移していました。しかし、ドイツもフランスも、米国との国際共同治験に参加している試験数は年々増加してきており、一方で欧州の国のみで実施する国際共同治験の試験数は減少傾向でした。英国は、2006~2011年は300試験程度(全体の30%程度)で推移していましたが、2012年以降は350試験程度(全体の40~45%)に微増して推移していました。一方、日本は、2006年は19試験であったが、それ以降増加を続け、2018年には年間174試験(全体の19.7%)と約10倍まで増加していました。中国は2006年の57試験から、2018年は83試験(全体の9.4%)と増加していましたが、日本ほど国際共同治験の参加が増えていませんでした。しかし、中国では「審査承認制度改革深化と医薬品医療機器イノベーション推奨に関する意見」(庁字[2017]42号)として、臨床試験審査手順の最適化(IND提出後の一定期間に中国当局から否認されなければIND承認とみなす)、優先審査、海外データの受け入れ等を含む薬事規制改革に関する意見が、2017年10月に中国中央弁公庁および国務院弁公庁共同で出される等、急速に新薬開発促進の動きが活発化しており、国際共同治験についても今後中国の参加が増えてくる可能性があると考えます。
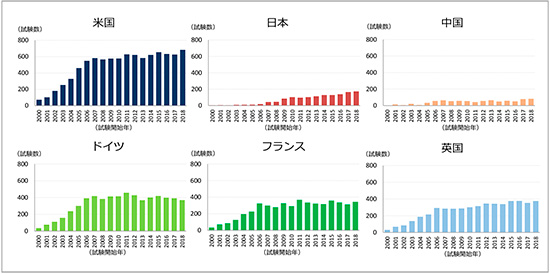 図3 主要国の国際共同治験試験数の年次推移(試験開始年:2000~2018年)
図3 主要国の国際共同治験試験数の年次推移(試験開始年:2000~2018年)
出所:ClinicalTrials.govをもとに作成
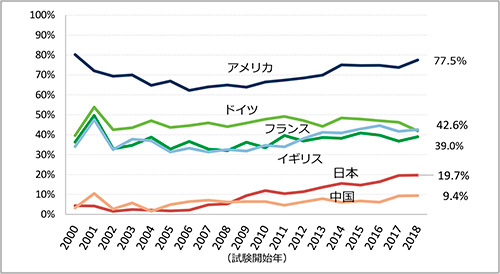 図4 主要国の国際共同治験に参加する割合
図4 主要国の国際共同治験に参加する割合
出所:ClinicalTrials.govをもとに作成
日本で実施される国際共同治験の実施企業の国籍の分析
前項で抽出した日本で実施される国際共同治験1396試験(試験開始年2000~2018年)を対象に、これらの試験をどの国籍の企業が実施しているかに関して、ClinicalTrials.govに登録されている"Sponsor/Collaborators"の情報をもとに調査しました(図5)。その結果、日本企業が海外企業との共同試験も含め、国際共同治験のSponsor/Collaboratorsとなった試験の割合は全体のわずか13.8%でした。また、年次推移で見た場合も、日本で実施される国際共同治験の試験数は増えているものの、その中で日本企業が関与している試験の割合は10~20%と大きな変化はなく、主にグローバルメガファーマを中心に海外企業が実施する国際共同治験への日本の参加が増えてきていることが、日本の国際共同治験実施数増加の主な要因でした。
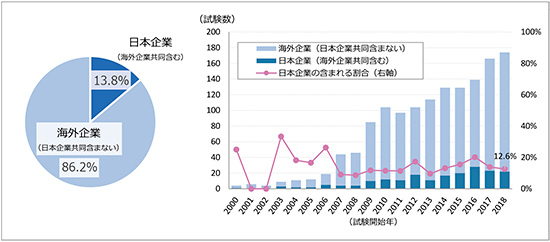 図5 日本で実施される国際共同治験のSponsor/Collaboratorsの企業国籍
図5 日本で実施される国際共同治験のSponsor/Collaboratorsの企業国籍
出所:ClinicalTrials.govをもとに作成
まとめ
近年、日本で実施される国際共同治験が増加してきていることは報告してきましたが、今回、ClinicalTrials.govに登録された臨床試験をもとに新たに調査した結果、2014年以降も引き続き日本で実施される国際共同治験の試験数は増加していること、ほかの主要国と比較しても増加傾向は顕著で、現在では世界で実施される国際共同治験の約20%に参加するまでになったことを明らかにしました。
日本で実施される国際共同治験が増えることに伴い、革新的な医薬品が日米欧で同時に申請が行われるケースが増えることは、日本の患者さんにこれらの医薬品が1日でも早く届くという点で望ましい傾向といえます。一方で、これらの国際共同治験は欧米のグローバルメガファーマを中心に実施されているのが現状であり、日本の企業が今後さらに成長していくためには、日米欧の同時開発を視野に入れ、積極的に国際共同治験を進めていくことが重要であると考えます。
(医薬産業政策研究所 主任研究員 粟村 眞一朗)

