トピックス 臨床試験における症例データ記録・収集業務の効率化を目指して —HL7 FHIR等電子カルテデータの標準化を基盤としたデータ連携の活用—
臨床試験における症例データの転記作業やデータ照合といった業務の負荷軽減・効率化に、電子カルテとのデータ連携の活用が期待されています。また、医療機関等の間で、診療等で必要な医療情報の電子的な共有・閲覧がいつでも可能となるよう、ウェブで一般的に使用されている技術を基盤としたデータ交換方法が厚生労働省における保健医療情報分野の新たな標準規格として採用される等、標準化の動きが活発化しています。これらの動向を調査し、有識者から得た知見を基にまとめた成果物※1について、その概要を紹介します。また、臨床試験における症例データ記録・収集業務の効率化を目指して、電子カルテとのデータ連携の実現に向けた課題解決アプローチを提案します。
-
※1HL7 FHIRを軸とした医療情報標準化と、電子カルテ-EDC等データ連携による効率的な臨床試験に向けた課題と展望(2023年6月製薬協医薬品評価委員会データサイエンス部会から発出)
https://www.jpma.or.jp/information/evaluation/results/allotment/DS_202306_DM-evol_FHIR.html
臨床試験における症例データの記録・収集に関する現場の課題
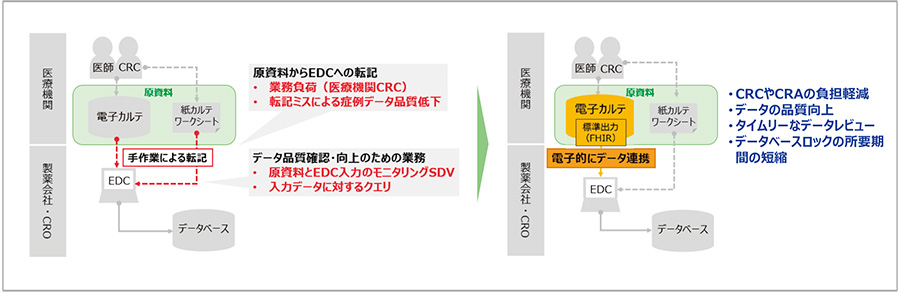
現在、臨床研究・試験において、参加者の症例データは電子カルテや紙カルテ、ワークシートといった医療機関が作成・保管する臨床データ(以下、原資料)を基に、臨床試験データを電子的に取得するシステム(Electronic Data Capture、EDC)へ、治験コーディネーター(Clinical Research Coordinator、CRC)が手作業で転記・入力することで記録、収集されています。この転記作業、つまりデータの二重入力により医療機関に大きな負荷がかかっており、手作業のため転記ミスが発生することもあります。
一方で製薬会社では、臨床開発モニター(Clinical Research Associate、CRA)が、多大な時間と労力をかけて、原資料上のデータとEDCに入力されたデータ間の整合性確認(Source Data Verification、SDV)を実施しています。
このように、臨床試験における症例データはCRCやCRAをはじめとした関係者の手作業により記録・収集されており、現状、大きな負担と多くの時間を要しています。これらの負担が、結果として臨床開発コストの増大や新薬の開発スピードの加速を妨げる一因となっています。
電子カルテ-EDC等のデータ連携への期待と実状
電子カルテ-EDC等データ連携とは、臨床研究・試験において、医療機関の電子カルテから臨床データを製薬会社が保有するEDC等へ転送する仕組みです。データが直接転送されることにより、電子カルテからEDCへの転記といった医療機関における業務負荷、および製薬会社によるSDVが削減できます。また、転記ミスによる症例データ品質低下を回避できることから、臨床試験データ収集プロセスを効率化する方法として、近年注目されています。「電子カルテ等から症例報告書へ自動転記されるシステムを利用する場合」については、2021年7月のGCPガイダンス改正※2にて要件が追記されています。
臨床試験業務の効率化、品質向上により、臨床試験に参加いただく患者さんへのケアにより注力が可能になると期待されるとともに、医薬品開発のコスト低減、さらには新薬の早期開発や医薬品産業の国際競争力の向上も期待されます。しかし、2022年1月時点で日本における臨床研究・試験への電子カルテ-EDC等のデータ連携の活用は限定的であり、製薬会社50社のうち導入済み企業は1社のみでした※3。その理由として、データ連携するためのセットアップ工数の増加、導入コストの増加、および医療機関のインフラも十分に整備されていない、といった課題が挙げられました。
現在の電子カルテの多くは医療機関ごとにカスタマイズされており、医師による自由記載データも多く、各医療機関に独自に適応するように開発されてきました。さらに、電子カルテはデータを標準に合わせて出力することよりも、入力の利便性に重きが置かれてきたため、臨床試験の目的に合致したデータを効率的に抽出することが難しく、電子カルテ-EDC等のデータ連携の導入および普及が進んでいませんでした。
-
※2薬生薬審発 0730 第3号
https://www.pmda.go.jp/files/000236359.pdf -
※3DDC/EHRデータ連携の現状と課題(2022年8月製薬協医薬品評価委員会データサイエンス部会から発出)
https://www.jpma.or.jp/information/evaluation/results/allotment/DS_202208_DDC_EHR_b.html
図1 電子カルテ-EDC等のデータ連携を活用した症例データの記録・収集 現在(左)と将来像(右)
医療情報交換の標準規格を活用した効率的なデータ連携の将来像
ウェブで一般的に使用されている技術を基盤としたデータ交換方法が厚生労働省における保健医療情報分野の新たな標準規格として採用されました。また、政府の医療DX推進本部が2023年6月に提示した工程表では「電子カルテ情報の標準化等」が施策として提言される等、標準化の動きが活発化しています。
日本ならびに諸外国では医療機関等の間で相互に医療情報を電子的に共有・閲覧できるネットワークの整備が進む中、医療情報交換の標準規格としてHL7 FHIRの活用が始まり、今後利用が拡大する見込みです。こうした流れにより医療データの交換がさらに促進され、初めての医療機関を受診する場合も、医師が患者さんの過去の医療情報を見て診察することが可能となる等、患者さんや医療従事者にとって利便性が高まります。
FHIR(Fast Healthcare Interoperability Resources)とは、HL7 Internationalによって作成された最新の標準規格であり、医療関連情報の交換を可能にするよう設計されています。FHIRは実装が容易なこともあり、諸外国では積極的に活用されており、国内でも健康診断結果報告書等の医療情報交換標準規格として2022年3月に採択され、今後FHIRを用いたデータ交換が進むと期待されています。
医療機関ごと・電子カルテごとにデータ形式や内容が異なると、医療機関から受け取ったデータをEDCへ連携できる形式へ1つずつ変換する必要があります。今後、電子カルテにFHIRによる標準出力が基本機能として実装されると、図1に示すように臨床試験でもFHIR形式のデータを利用した、製薬会社のEDCへの効率的なデータ連携が期待できます。また、標準化されたデータ構造をもつFHIR形式のデータが利用可能になると、複数の医療機関や電子カルテから同じ形式でデータを受け取ることができ、アプリケーション連携が非常にしやすいFHIRの特徴も活かし、データ連携を容易にします。
一方でFHIRを使用するか否かにかかわらず、臨床試験でのデータ活用には患者氏名の試験参加者識別コードへの変換等による匿名化や、臨床試験で求められるデータ項目を選択して抽出することが求められる等、いくつかプロセスの確立も必要です。
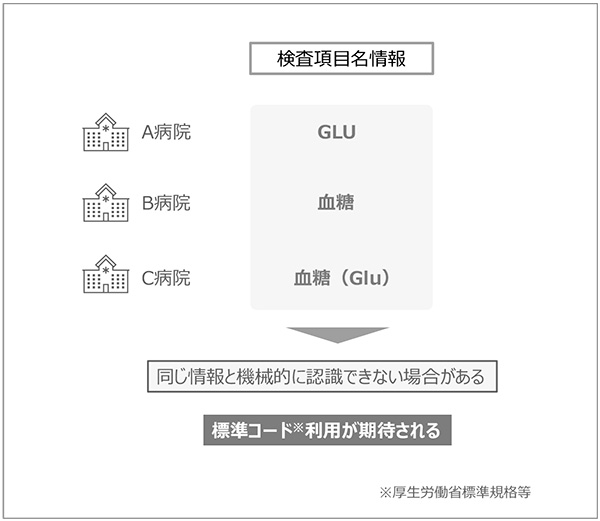
患者背景や検体検査のように一般診療下で電子カルテに記録される情報はデータ連携が実現しやすい項目です。しかしながら図2に示すように、検査項目名情報は医療機関ごとに異なる場合があり、そのままではデータ連携できないため、厚生労働省が採用している標準コード等に付け替えて出力する仕組みを実装する必要があります※4。
病期分類といった疾患領域特有の情報や、治療経過/結果、有害事象といった治験薬の評価に欠かせない情報は、フリーテキストで記載されることが多いため、医師や医療機関によって記載内容がばらついたり、電子カルテに記載されなかったりします。また、傷病名や処方については電子カルテに記載されますが、処方したものの服用しなかった薬剤は除く等、医師判断による臨床試験データの特定が必要なケースもあり、そのままでは活用が困難なケースも存在します。このような利用しづらい情報や、臨床試験特有の情報についても効率良くデータ連携を実現するには、入力データを定義した電子カルテテンプレート等の入力機能を用いて、データをあらかじめ定めた構造に整形されたかたちで記録する必要があります。
このように標準化されたデータ構造をもつFHIR形式のデータ、および電子カルテテンプレート入力機能や標準コード等を利用し、統一したフローでデータ収集・記録が可能となることで、効率的なデータ連携の実現が期待されています。
-
※4データ連携構想 ~医療及び治験の現場からの提言~
https://www.jpma.or.jp/information/evaluation/results/allotment/DS_202308_labemrtoedc.html
図2 複数医療機関のデータ連携における課題
将来像実現へ向けた、関連ステークホルダーの連携による課題解決アプローチの提案
治験の空洞化、ドラッグロスが懸念される中、国民の新薬へのアクセスを確保することが重要です。医療業界で電子カルテの標準化、医療情報交換が今後進む中で、臨床試験においてもそれらの技術を用いた電子カルテ-EDC等データ連携の普及が見込まれます。
その実現のためには、電子カルテデータの標準化において、厚生労働省標準規格として採用されているコード等を使用することが重要です。しかしながら、多くの医療機関では厚生労働省標準規格ではない保険請求に結び付くコードやローカルコードが使われており、標準コードを入力または変換する負担が生じます。可能な医療機関(例:臨床試験を多く実施している医療機関)からでも、率先して標準コードを使用いただく仕組み(電子カルテへの標準装備や使用に関するインセンティブ等)が期待されます。
また、通常診療では電子カルテに記録されない、あるいは文章としてつづられている、あるいはデータの定義にばらつきがある等、データとして活用しづらいことがあります。今後は電子カルテにおいても構造化データとして記録・活用する仕組み(電子カルテテンプレートを用いた入力等)が導入されることが期待されます。
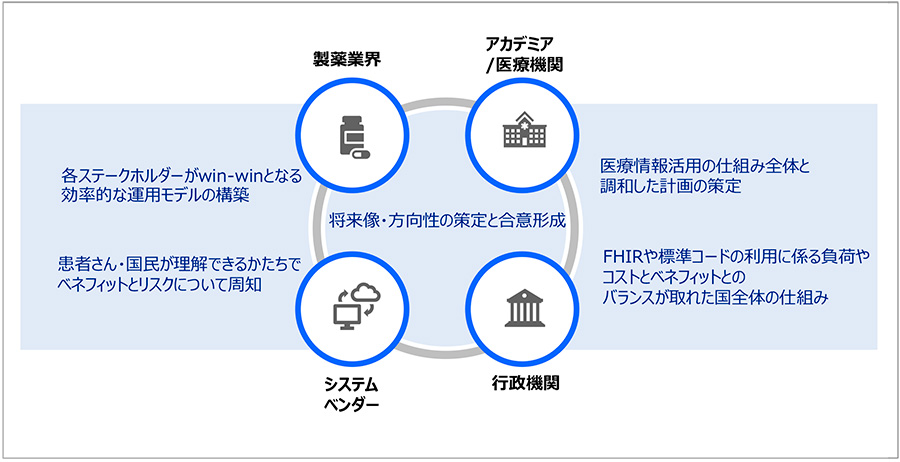
加えて、電子カルテ-EDC等データ連携が可能になれば、臨床試験での症例データの転記作業やデータ照合による業務負荷軽減・効率化ならびにデータ品質向上が期待できます。将来像実現へ向けた課題解決には図3に示したアプローチ等が期待され、製薬業界だけでなく、行政機関、アカデミア/医療機関、システムベンダー等、多岐にわたるステークホルダー間での合意形成が不可欠です。将来像の実現という同じ目的に向かって、ステークホルダー間で一緒に取り組んでまいります。
図3 将来像実現へ向けた、関連ステークホルダーの連携による課題解決
製薬協医薬品評価委員会データサイエンス(DS)部会は、各ステークホルダーと連携しながら、電子カルテ-EDC等のデータ連携の普及・発展につながるような活動を行っていきます。本記事にてわれわれの活動に興味をおもちいただき、ご質問・ご提案等がございましたら、製薬協のお問い合わせ窓口(https://www.jpma.or.jp/inquiry/ )までご一報ください。
(医薬品評価委員会 データサイエンス部会 伊藤 義典、大畠 梨菜、釜萢 宏史、渋澤 絵美、日比野 翔)

