Points of View 費用対効果評価の学術研究結果の解釈
医薬産業政策研究所 主任研究員 岡田法大
要約
昨年のBMJ(British Medical Journal)に掲載された費用対効果評価に関する調査を起点として、データベース等に由来する既知の情報を利用して行われる研究結果の解釈に影響を与える要素を調査した。本邦での費用効果分析に関する学術論文のシステマティックレビューの結果には、「研究実施の目的」「論文化の意思決定」「系統的な分析結果の差」の3つの要素が影響する可能性が示唆された。費用効果分析は近年論文が増加してきた研究分野であり、業界として、実施した研究の結果を、世間に正しく解釈してもらうための活動を継続していく必要がある。
1. はじめに
費用対効果評価は医療費の最適化を図るための研究として近年注目されており、その結果は複数の国で保険償還の判断や薬価の調整にも活用され始めている。本邦においても、2019年から費用対効果評価制度の運用が開始されており、費用対効果評価の結果が薬価の価格調整に用いられている1)。費用対効果評価では、研究の実施時点までに集積、報告されている情報を利用して分析を行うため、分析に用いるパラメータの情報源の選択や数値の精度によって結果に不確実性が生じることが知られている。本邦の費用対効果評価制度の中でも、医薬品の承認申請のように企業が提出した資料を評価するだけでなく、企業が提出した結果を踏まえて専門組織が再分析を行う手順となっていることからも、単一の分析結果を導くことが難しく、分析の内容によって分析結果が変わり得ることが分かる。
費用対効果評価に関する学術論文数も増加しており、臨床研究で実施されるようなシステマティックレビューによって、これまでに実施された費用対効果評価の結果を統合し、ワクチン接種や意思決定支援システム使用の費用対効果評価の結果について、系統的に評価を行う研究も始まっている2)3)。昨年の6月には、代表的な医学誌の一つであるBMJにヘルスケア領域の費用対効果評価研究における、業界のスポンサーシップと評価結果に関する調査が報告された4)。調査では1976年から2021年の間に報告された学術論文を対象に、費用効果分析の結果を統合しており、企業が支援する研究において推定されたICER(増分費用効果比: Incremental cost-effectiveness ratio)は、支援されていない研究のICERと比較して約33%低いという結果が示された。このような結果が導かれる要因としては、以下の3要素が影響している可能性が考えられる。
- 1.研究実施の目的
- 2.論文化の意思決定
- 3.系統的な分析結果の差
1と2は公表される結果の有無に影響を与えるものであり、個別の評価の結果の解釈に影響は与えない。3は実際の分析内容に影響するため、個別の評価結果の解釈にも影響を与える。製薬業界としては、多くの費用や時間を費やして実施した研究の結果を、世間の方に正しく解釈を行ってもらうための活動を継続していく必要がある。学術論文として公表されている費用対効果評価の結果の正しい解釈に繋がるための情報として、本邦での費用効果分析の学術論文としての情報公開の現状把握を中心に課題を整理する。本稿では、上述の1と2に関しては学術論文を基にした考察、3に関しては本邦での費用対効果評価制度の報告書を基にした考察を行う。これらの情報を示すことで、本邦における費用対効果評価の学術論文としての公表方法に関する議論を進めるための一助としたい。また、ここで示した3つの要素は、過去に取得された情報を使用する後ろ向きのデータベース研究において発生し得る課題と類似しており、費用対効果評価に関する論点だけでなく、広くデータベース研究にも関わる問題として考えていきたい。
2. 調査方法
2-1. 学術論文調査
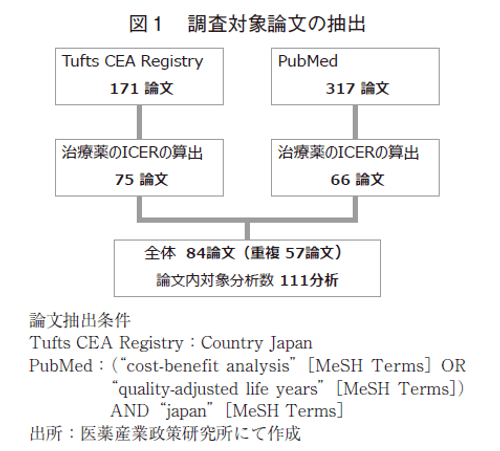
「1.研究実施の目的」「2.論文化の意思決定」に関する考察を行うために、学術論文調査を行った。医薬品(ワクチンを除く)を研究対象の医療技術とした費用効果分析の結果が示されている学術論文を対象として、Tufts Medical Centerが公開するCEA Registry又はPubMedに収載されている2015~2022年に出版された論文を調査対象とした。費用効果分析は費用対効果評価で利用される分析の一つで、本邦の費用対効果評価制度における分析手法としても採用されている5)。それらの論文から、本邦の医療制度を想定し、QALYを効果指標として実施された費用効果分析の結果が示されている論文を抽出した。既報のレビュー論文でも一般的に用いられるCEA Registryに加えてPubMedも利用することにより、一定の網羅性が確保できていると考えられる。調査の中では、論文単位の集計と、論文に含まれる分析単位の集計を行った。分析単位の調査では、論文の中で主要な結果に対する分析(感度分析やシナリオ分析を除く)のみを対象とし、単一の論文に複数の主要な結果(複数の分析の立場、対象集団、薬剤等)が含まれている場合には、結果に与える相関を考慮し、論文の結論に最も影響の与える2つの分析までを集計対象とした。
2-2. 費用対効果評価制度の調査
「3.系統的な分析結果の差」に関する考察を行うために、費用対効果評価制度の調査を行った。本邦において、2019年に運用が開始された費用対効果評価制度では、分析結果の詳細な報告書が一般に公開されている6)。費用対効果評価制度では製造販売業者となる企業が費用対効果評価を行った後に、公的分析として国立保健医療科学院や大学等で企業が実施した分析のレビューと再分析が実施される。本稿では、制度開始から2023年9月までに公開された報告書を基に、製造販売業者による分析と公的分析の双方で、費用効果分析が行われた対象集団を対象として結果の傾向を調査した。
3.結果
3-1. 論文調査の背景情報
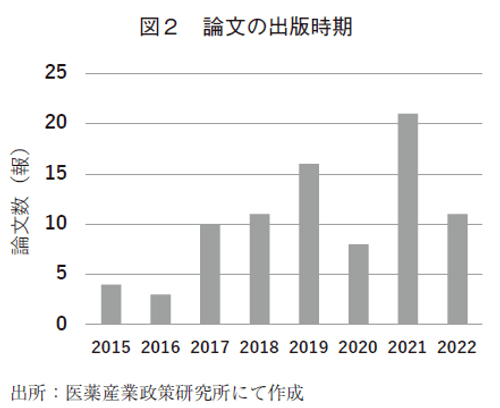
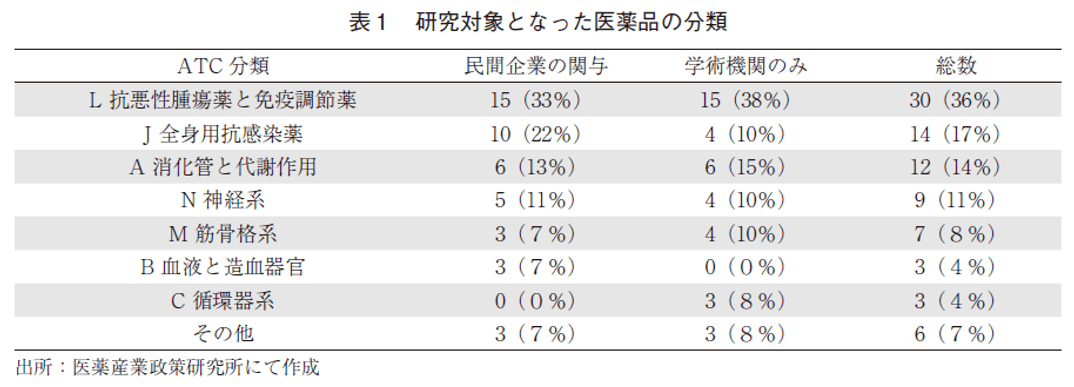
今回の調査対象として抽出された論文は84論文であった(図1)。本邦において医薬品を対象とした費用効果分析が行われた論文は2017年以降、年間10報程度で推移している(図2)。研究の対象となっている医薬品の分類(ATC分類)を表1に示す。本稿では、企業が関与する研究としていない研究で分類した情報を中心に考察を行うため、参考として、企業の関与の有無で分類した集計も示す。最も多いのは、L分類の抗悪性腫瘍薬と免疫調節薬であり、該当する30論文中の22論文が抗悪性腫瘍薬を対象とする研究、7論文が免疫抑制薬を対象とする研究であった。それに続くJ分類の全身用抗感染薬では、14論文中11論文がC型肝炎の治療薬で、残りの3論文はインフルエンザの治療薬を対象とした研究であった。次のA分類の消化管と代謝作用では、2型糖尿病の治療薬と抗悪性腫瘍剤投与に伴う消化器症状の治療薬に関する論文がそれぞれ12論文中4論文であった。
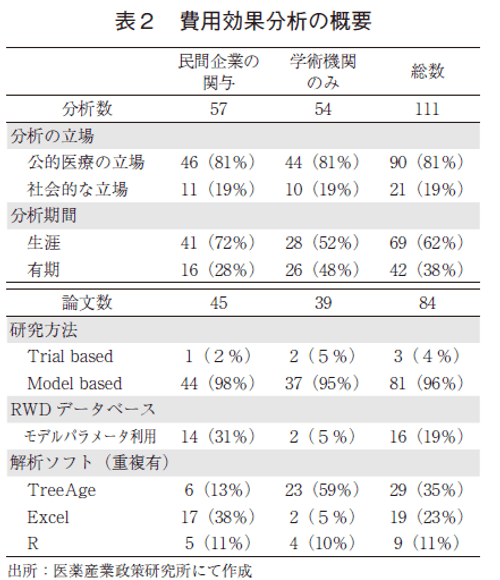
費用効果分析の概要を表2に示す。各論文から抽出した分析数は111となり、集計は分析単位の集計と、同一論文内の分析で条件が同等となる設定は論文単位で集計を行った。企業の関与は、論文中の資金提供の項目に企業からの助成金を受けたことが明記されている論文又は著者に製薬企業の社員が含まれる論文を、企業が関与した論文と定義した。企業が関与する研究は全体の54%で、その内訳は67%が外資系企業、33%が内資系企業となっており、外資系製薬企業の本邦の費用対効果分析への学術的な貢献は大きい。分析の立場は公的医療保険制度の範囲で実施された分析を「公的医療の立場」と定義した。介護等その他の費用が含まれる場合はすべて「社会的な立場」に分類して集計を行った。全体の81%の研究で公的医療の立場から分析がなされており、社会的な立場からの分析は相対的に少ない。モデルに利用するパラメータの情報源として、レセプト情報等のリアルワールドデータ(RWD)のデータベースを利用する割合に関しては、研究体制によって若干の差が見られた。
3-2. 研究実施の目的
先述の業界のスポンサーシップと評価結果に関する調査の結果の解釈に最も大きく影響すると考えられる要素として、研究実施の目的が挙げられる。費用対効果評価の研究実施には相応の費用や時間を要するため、上市されている全ての医薬品に対して、学術論文として投稿可能な質を維持した研究を実施することは難しい。研究が実施される背景には、新たに上市された新薬の費用対効果に関する情報を周知することを目的とした研究と、市販後に費用対効果の是非が議論されるような社会的課題の解決を目的とした研究に大きく分類される。前者の研究には、上市された新薬の情報を市場に提供するために製薬企業が関与する場合が多く、後者の研究は学術機関が主導して実施される場合が多いため、この研究目的に対する実施機関の役割の違いがシステマティックレビューにおけるICERの差に影響を与えている可能性がある。
日本の医療制度を想定した費用効果分析の結果を含む論文のレビューから、上記の仮説を確認する調査を行った。論文内での記載のみから正確な研究の目的を推察することは難しいため、今回は医薬品の対象適応承認日から論文掲載までの期間を代替指標として確認する。84論文において研究対象となっている医薬品の対象適応承認日から論文掲載までの期間の中央値は4.5年であり、4.5年で区分した際の研究体制の分布を図3に示す。仮説の通り、承認から間もない新薬を対象とする研究は、製薬企業が関与する割合が多く、承認から長期間経った後に実施された研究は、製薬企業の関与の割合が相対的に少なかった。この結果から、研究の目的と研究の実施体制には一定の関連性が存在していることが推察される。
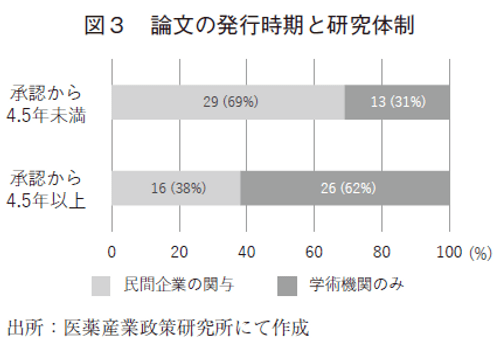
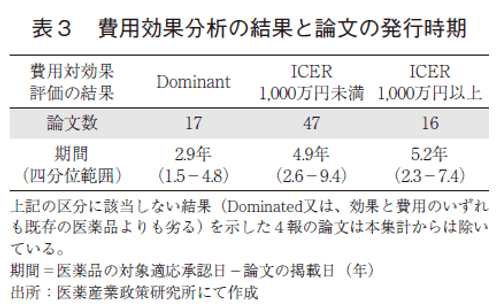
次に、各研究の費用効果分析の結果と医薬品の対象適応承認日から論文掲載までの期間との関連を確認した。研究対象の医薬品が既存の医薬品よりも極めて優れる結果(Dominant:評価対象の医薬品が比較対照の医薬品と比して費用が安く効果も同等以上)を示す論文と、極めて劣る結果(ICER1,000万円以上)を示す論文を特定し、それぞれの論文の公表時期を集計すると、Dominantと結論付けられた研究は、承認から公表までの期間の中央値は2.9年であり、その他の文献の期間の中央値の5年程度と比較して、承認後の早い時期に公表されることが多くなっていることが分かった(表3)。研究の新規性や学術論文としての採択確率への影響を考えると、研究対象となる医薬品を検討する際に、承認後に長期間に渡り費用対効果が優れていることが公知となっている医薬品は研究の対象となりづらいことも想像に難くなく、費用効果分析の結果と承認日からの期間の関連性も妥当な結果であると考えられる。以上の結果からも、費用対効果に関する学術研究では産学が異なる役割を担っており、その研究目的と費用対効果評価の結果に相関が生じている可能性が示唆される。すべての医薬品に対する評価の実施が現実的でない現状では、このような解釈に影響を与え得る相関が研究体制による要因以外でも生じている可能性がある。本項で提示した仮説は、個別の評価の結果の解釈に影響を与えるものではないが、複数の論文を統合して解析を行う際には、結果の傾向に影響を与えるため、解釈に注意が必要となる。
3-3. 論文化の意思決定
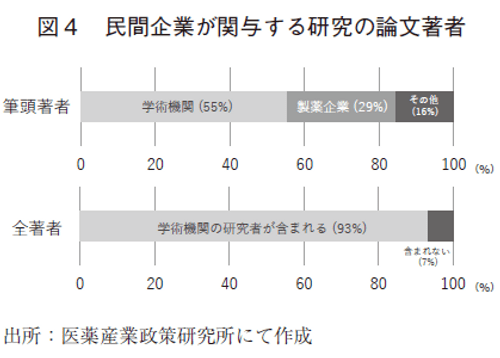
研究実施の目的と類似した事項として、研究実施後の論文化の意思決定がある。特に製薬企業では、医薬品の上市前後に社内資料として費用対効果評価が実施されることも少なくないが、多くの場合は社内的な参考資料であり、評価の観点や研究の質が学術的な研究とは異なる。このような情報を社内情報として留めて論文化が行われていない医薬品も存在する一方で、学術的な論文として費用対効果評価の結果を公表している医薬品も存在しており、これらの情報公開に関する扱いの差が発生することの是非は業界として検討する必要があるかもしれない。今回の論文調査の対象とした論文中の企業が関与した45論文において、外部の研究者の関与を調査するために、論文の著者の特徴を図4に示す。学術論文となっている費用効果分析の93%には学術機関の研究者が著者に含まれており、製薬企業の社員だけで実施された分析は論文化されることが少なく、学術機関の研究者の参加と論文化の意思決定には一定の関連がある可能性が高いと推察される。
費用対効果評価は一般的にデータベース等の既存の情報を利用するため、データベース研究と類似した研究として分類されることも多い。製薬協の医薬品評価委員会メディカルアフェアーズ部会からも、データベース研究のパブリケーションバイアスを避けるための方向性が示されており、対策として研究実施前のjRCTやUMINへの研究登録が提案されている7)。研究実施後に論文化の検討がなされることはデータベース研究と同様に望ましいことではなく、公表されている研究の結果に偏りをもたらし、3-2で示した研究実施の目的と同様に、複数の論文を統合して解析を行う際に、結果の傾向に影響を与える。費用対効果評価は社内で一般的に実施されることも多く、研究としての新規性が不明瞭な場合もこれらのデータベース研究と同じような論文化による情報公開の方針とすることが望ましいのかに関しては、業界として検討を進める必要があるだろう。
3-4. 系統的な分析結果の差
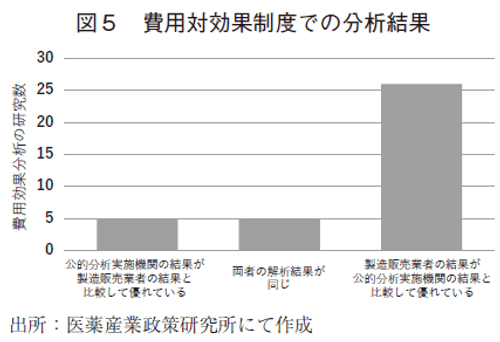
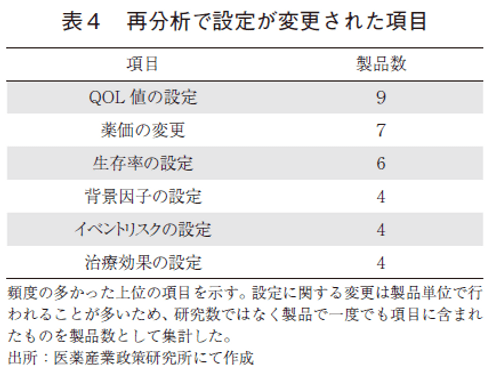
前項までは、学術論文として公開されている費用対効果評価に関して調査を行ってきた。研究実施組織の系統的な分析結果の差を調査するためには、同一の研究対象に対して複数の機関で分析を行った情報が必要となるが、学術論文ではそのような事例は稀であるため、3-4では本邦の費用対効果評価制度の事例を基に検討を行う。費用対効果評価制度は製造販売業者となる企業が費用対効果評価を行った後に、公的分析として国立保健医療科学院や大学等において企業が実施した分析のレビューと再分析が実施される。本稿では、製造販売業者の分析結果と公的分析による再分析の結果を比較した。2019年の制度化以降、医薬品に対しては20製品の53の対象集団における費用対効果分析の報告書が公開されている。初めに、その中で双方の機関における費用効果分析の結果(費用最小化分析を除く)が公開されている36の対象集団において、どちらの機関の分析結果の点推定値がより優れた費用対効果を示したかの分布を図5に示す。費用効果分析の性質上、結果の差が生じることは自然であるため、ここでは、結果における差の有無ではなく、生じた差の傾向に偏りが存在していないかという観点で確認を行った。研究の実施機関による系統的な差が生じていない場合は、両者の解析結果の差は0を中心とした対称性のある分布になることが想定されるが、現時点では公的分析実施機関の算出するICERは製造販売業者の算出の値よりも大きくなる傾向にあることが分かる。これらの結果の相違の理由も報告書内で報告されており、大別したものを表4に示す。最も多かった相違点は、QOL値の設定に関する事項であり、外挿するパラメータの情報源の選択が異なることが要因であった。その他の事項も、大半の相違点はモデルのパラメータの設定方法となっている。これらの相違点を擦り合わせるための活動も製薬協で行われており、過去の指摘事項をまとめた報告書が作成されている8)。この結果は、製造販売業者となる企業が費用対効果評価を行った後に、公的分析によるレビューと再分析が実施されるという制度の仕組みや分析結果を薬価の調整の評価に用いるという特別な状況によって生じている系統的な差である可能性もあり、これらの少ない事例から学術研究において類似した差が発生していると結論付けることは難しい。しかしながら、このような事象が学術論文として公開されている研究の結果においても発生している可能性は否定できない。本邦の医療制度を想定して実施された医薬品の費用効果分析の学術論文での結果公表が、現時点では限られた数であることを踏まえると、経験の蓄積によりこれらの差は縮まっていく方向に進むことが想定される。また、前項で紹介したメディカルアフェアーズ部会の資料においても、データベース研究における信頼性の確保の方向性が示されており、これらのプロセスの標準化の動きと共に解消に向かうことが想定される7)。
また、現在実施されている中央社会保険医療協議会の費用対効果評価専門部会の中では、費用対効果制度における分析結果の論文化の可否が議論されている9)。本制度の対象となっている医薬品の費用対効果評価の結果が英語の学術論文となっている事例は少ない。費用対効果評価自体もMEDLINEを中心とした文献の情報を基に成り立っていることからも、これらの情報から得られた結果を学術的なコミュニティに還元する仕組みも検討が必要であると考える。
4. まとめ・考察
本邦における費用対効果評価の学術論文の現状と費用対効果評価制度の事例をまとめ、特に費用効果分析に関する学術論文のシステマティックレビューの結果の解釈に影響を与えると考えられる3つの要素について考察を行った。今回の調査では、限られた事例数であったものの、当初想定していた「研究実施の目的」「論文化の意思決定」「系統的な分析結果の差」の全ての要素が結果に影響を与えている可能性が示唆された。特に、費用対効果評価の研究の実施や論文化には相応の費用や時間を要するため、研究結果の公表には制約があり、これらの現状の背景と実施目的を理解して、論文の結果が解釈されることが望ましい。並行して、製薬業界としては、実施した研究の結果をより解釈しやすい形で提供していく必要がある。本稿で示した事項に関しては既に製薬協の各委員会等で検討が進んでいることが確認されており、より研究の透明性が増していくことが期待される。
費用対効果評価の研究の実施や論文化に限界がある中で、本邦における医療費の最適化を図るためには、製薬業界と学術機関が実施する研究の双方が異なる役割を果し、情報を蓄積していくことも重要となる。製薬業界が実施する臨床試験では、健康関連のQOL指標を測定する機会が徐々に増加しており、モデル分析実施のための情報の提供にも貢献している。既存の情報を利用する研究の実施には情報を相互利用できる環境とすることが重要であり、臨床試験、費用対効果分析それぞれの結果を適切に公表していくことで、研究領域としての総合的な発展に繋がると考える。
既報の数値を研究に利用する費用効果分析の研究も含めて、既存のデータを利用するデータベース研究は、研究実施の前から得られる結果の傾向の予見性が高く、研究を実施するか否かの意思決定の時点で、それらの要素を完全に排除することは困難である。そのような制約の中で、製薬業界では様々な観点で、研究の透明性を高める検討が進められており、このような新たな分野においても一定の指針が作られ、実施した研究結果の信頼性を確保していくことが期待される。
-
1)
-
2)Rosettie, Katherine L., et al. Cost-effectiveness of HPV vaccination in 195 countries: A meta-regression analysis. PLoS One, 2021, 16.12: e0260808.
-
3)Lewkowicz, Daniel; Wohlbrandt, Attila; Boettinger, Erwin. Economic impact of clinical decision support interventions based on electronic health records. BMC Health Services Research, 2020, 20.1: 1-12.
-
4)Xie, Feng; Zhou, Ting. Industry sponsorship bias in cost effectiveness analysis: registry based analysis. bmj, 2022, 377.
-
5)
-
6)
-
7)
-
8)
-
9)

