Topics ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?
医薬産業政策研究所 主任研究員 吉田 昌生
医薬産業政策研究所 元主任研究員 澁口 朋之
医薬産業政策研究所 統括研究員 飯田真一郎
要旨
欧米で既に承認されているが日本では薬事承認されていない「国内未承認薬」が増加している。2010年代後期、欧米で承認された新有効成分含有医薬品に対する国内未承認薬の割合は経時的に増加し、欧米承認薬の国内での承認率が低下していた。しかしながら、未承認薬の増加は示されたものの、それら薬剤がアンメット・メディカル・ニーズに応えうるかの調査はなされていなかった。本稿では、国内未承認薬には多くのアンメット・メディカル・ニーズに応えうる臨床的に重要な薬剤が含まれていることを明らかにした。特に、オーファン薬や抗悪性腫瘍剤、全身性感染症薬、神経系用剤の未承認薬数が増加しており、それら対象領域において臨床的に重要な薬剤の比率は高かった。さらに、国内開発情報のない未承認薬においても高い割合で臨床的に重要な薬剤が残っており、日本において新薬へのアクセスに課題となることが示唆された。このことから、国内未承認薬の拡大はドラッグ・ラグが進んでいる現象と捉える必要があり、最新医薬品へのアクセスの促進・確保に向けた政策対応を考える必要がある。
1. 序論
2018年度に行われた薬価制度の抜本改革における新薬創出・適応外薬解消等促進加算制度の見直しや、2021年度の中間年改定の実施等薬価をめぐる環境は年々厳しくなっており、日本の医薬品市場の魅力度低下に伴う「ドラッグ・ラグ」の再燃を危惧する声が多くなっている。医薬産業政策研究所では、2021年7月の政策研ニュース第63号1、2)にてドラッグ・ラグの近年の状況について報告し、①日本で発売されている医薬品については欧米との上市時期の差は短縮している傾向が見られる、②他の国では承認されているのに日本では承認されていない「国内未承認薬」については拡大の兆候が見られることを示した。本報告以降、多方面にてドラッグ・ラグについての論説を目にする機会が増え、この問題への日本社会の関心の高さが伺える。
ドラッグ・ラグは、海外で既に承認されている薬が日本国内での薬事承認を得るまでに長い年月を要するという問題のことであり、2つの側面を有する1、2)。1つは、日本で発売されてはいるものの発売までに要した期間が他の国よりも長かったという「ラグ(遅延)」についてであり、もう1つは他の国では承認されているのに日本では承認されていないという「国内未承認薬」の問題である。前者については、国と製薬産業が課題解決に取り組んだ結果、日本を含む国際共同治験の増加3)、日本の審査期間短縮・安定化4)、薬事・薬価制度の環境整備等がその短縮要因となり、近年改善されつつあることを澁口および粟村が報告している2、5)。
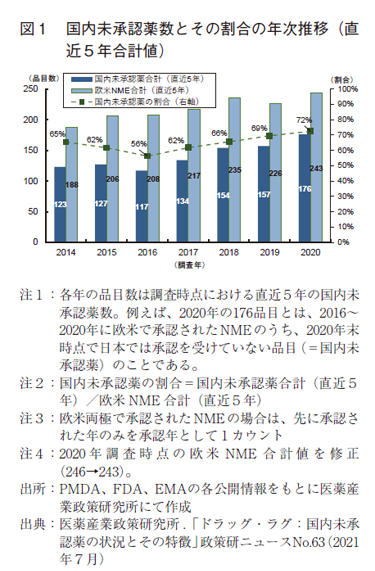
一方、後者の「国内未承認薬」の問題については、2010年から2020年に日米欧各極にて新有効成分含有医薬品(New Molecular Entity:NME)として承認された品目について、欧米NME数に対する国内未承認薬数の割合を算出し経時変化を追った結果、2010年代後期に未承認薬数およびその割合が増加していることを報告した(図1)1)。同時に、欧米で承認されたNMEについて日本国内での累積承認率の動向に関するパネルデータを作成し、欧米NMEの初承認年からの経過年数と国内承認率との関係を分析することで、2010年代前期と比較し2010年代後期に欧米NMEの国内での承認率が低下していることを示した1)。また、国内未承認薬の拡大の要因の1つとして、開発活動の自立化が進む新興バイオ医薬品企業群により創製された薬剤の欧米での承認が増加しており、それら企業が日本国内に開発法人を持たず、国内開発がなされていない状況があることを示した。このため、これら日本国内に開発拠点を持たない新興バイオ医薬品企業をどのように国内に呼び込むかが課題であることを報告した1)。
なお、前回の報告では調査上の限界を提示していた。それは、前回の報告は日米欧各極にて承認されたNMEの承認数や開発状況の観点からの分析であり、それらNMEがアンメット・メディカル・ニーズ(未充足医療ニーズ)に応えうる臨床的に重要な薬剤かどうかを考慮した調査ではなかったという点である。国内未承認薬の拡大の問題を国民への新薬アクセスの問題6)として捉えるには、未承認薬の中に臨床的に重要な薬剤がどれだけ含まれているかの視点が必要である。そこで今回、国内未承認薬の拡大が国民への新薬アクセスの問題となるかの精査をおこなうため、増加している未承認薬が国内のアンメット・メディカル・ニーズに応えうる薬剤群なのかを臨床的な重要度の視点を加え調査した。
2. 研究方法
本調査の対象は、前回のニュース1)において未承認薬割合の底となっていた2016年調査時点の未承認薬117品目、および、直近の2020年調査時点の未承認薬176品目とした(図1)。2016年の117品目とは、2012年から2016年の5年間に欧米で承認されたNMEのうち2016年末時点で日本では承認を受けていない品目(=国内未承認薬)のことであり、2020年の176品目とは、2016年から2020年の5年間に欧米で承認されたNMEのうち2020年末時点で日本では承認を受けていない品目(=国内未承認薬)のことである。
本稿で使用する以下の用語を定義した。アンメット・メディカル・ニーズは、「いまだ満たされていない医療ニーズ、つまり、いまだ有効な治療法がない疾患に対する医療ニーズ」7)のことであり、予測患者数や市場規模、メーカーのビジネス上の優先順位や経済合理性等は加味していない。
また、アンメット・メディカル・ニーズに応えうる臨床的に重要度が高い薬剤を「既存治療より有用性が明らかに上回る、又は、治療選択肢のない患者への効果を有する薬剤」と定義し、U.S. Food and Drug Administration(FDA)のFast Track、および、Breakthrough Therapy指定品目を指標とした。FDAの公開情報によると4、8)、FDAのFast Track(FT)には、重篤な疾患に対してアンメット・メディカル・ニーズを満たす、あるいは既存薬がない、既存治療を上回る可能性のある新薬が指定され、Breakthrough Therapy(BT)には、FTより更に本質的革新をもたらすような画期的新薬の可能性があるものが指定されるとあり、本定義と合致する。なお、国内での承認に至っていない未承認薬それぞれについて、日本国内の情報を用いて臨床的重要度がどの程度であるかを明確にするデスクリサーチ調査には限界があった。そのため、世界的に販売されている新薬の80%以上が承認・上市されている米国9)での新薬承認時の薬事上の特別措置指定(FTおよびBT指定)の情報を、新薬の40%程度が承認・上市されている日本9)に外挿することとした。また、European Medicines Agency(EMA)のPRIME指定品目4、10)についてもここでの臨床的に重要度が高い薬剤の定義に合致するため集計すべきとも考えられる。ただし、EMAにてPRIME指定品目が初めて承認されたのは2018年であり、それまでは類似の指定が存在しなかったことから、2010年代前半と後半の比較をする上で公平を期すため、集計対象からはずしている。
3. 国内未承認薬の臨床的重要度
国内未承認薬にアンメット・メディカル・ニーズに応えうる臨床的に重要な薬剤がどれだけ含まれているかを確認するため、調査対象の2016年調査時点での未承認薬117品目、および、2020年調査時点の未承認薬176品目について、薬事上の特別措置指定数(FDAのFTおよびBT指定を受けたNME数)とその割合を調査した(図2・左)。なお、FTとBTの両方で指定を受けた薬剤については、FT指定品の数には含めずBT指定品としてカウントした。
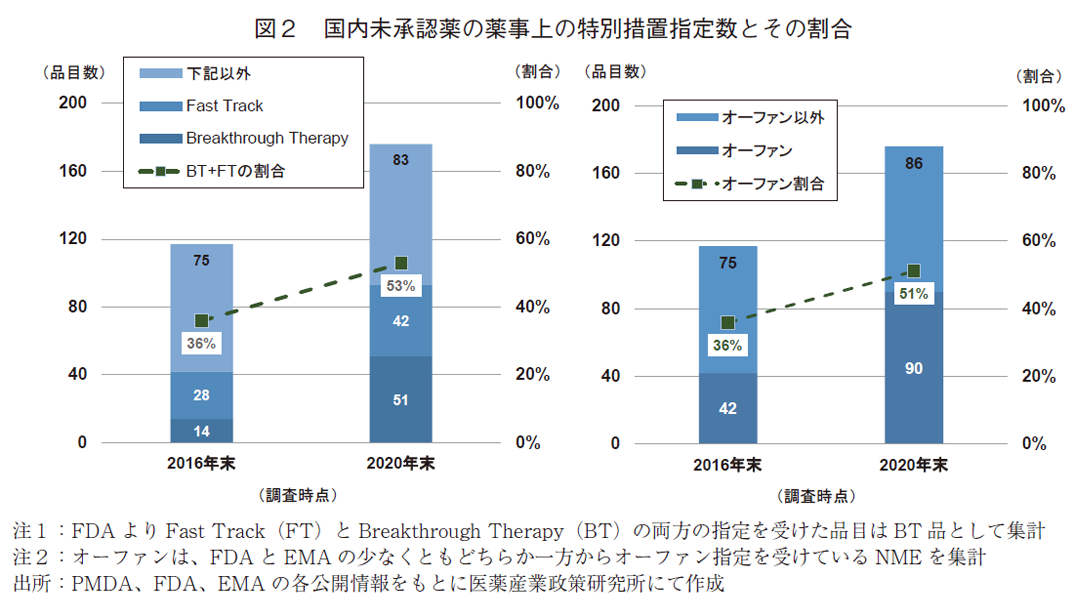
2020年調査時点での未承認薬176品目のうち、FDAよりBT指定を受けたNMEは51品目、FT指定は42品目あり、臨床的に重要な薬剤であるBT指定とFT指定の合計数は93品目と未承認薬全体の53%にのぼった。2016年時点の未承認薬では、臨床的に重要な薬剤(=BT指定品+FT指定品)は42品目で全体の36%であり、2020年調査時点では数およびその割合が拡大したことがわかった。
比較として、FDAから承認されたNMEにおけるBTとFTの割合を調査した。2016年調査時点、および、2020年調査時点の未承認薬と対象期間を揃えるため、2012~2016年にFDAで承認されたNME、および、2016~2020年にFDAで承認されたNMEについて分析をおこなった。結果としては、2012~2016年にFDAで承認されたNMEのうちBTまたはFTを受けた承認品目の割合は44%、2016~2020年では55%であった。このことから、この期間での未承認薬においては、FDAの承認NME全体の動向と同じくあるいはそれ以上に、臨床的に重要な薬剤の割合が増えていたことがわかった。
4-1. 国内未承認薬:オーファン指定品目
アンメット・メディカル・ニーズを考える上で、いまだ有効な治療法がない疾患の代表例として希少疾病が挙げられる。ここでは国内未承認薬のうち、FDAおよびEMAでオーファン指定を受けた薬剤がどれだけ含まれるかを確認するために調査をおこなった(図2・右)。なお、日米欧のオーファン指定基準の違いについては、過去の政策研ニュースを参照いただきたい4、11)。
2020年調査時点での未承認薬176品目のうち、FDAまたはEMAにてオーファン指定を受けたNMEは90品目あり、未承認薬全体の51%を占めた。2016年時点の未承認薬では、オーファン指定を受けたNMEは42品目で全体の36%であったことから、2020年調査時点では数およびその割合が拡大したことがわかった。
比較として、FDAから承認されたNMEにおけるオーファン指定割合を調査した。2012~2016年にFDAで承認されたNMEのうちオーファン指定を受けた承認品目の割合は40%、2016~2020年では50%であり、未承認薬におけるオーファン薬の割合は、FDAの承認NME全体におけるオーファン薬指定割合の増加と、ほぼ同等の増加があったことが確認された。
4-2. 国内未承認薬:オーファン指定品目の臨床的重要度と国内開発情報を用いた分析
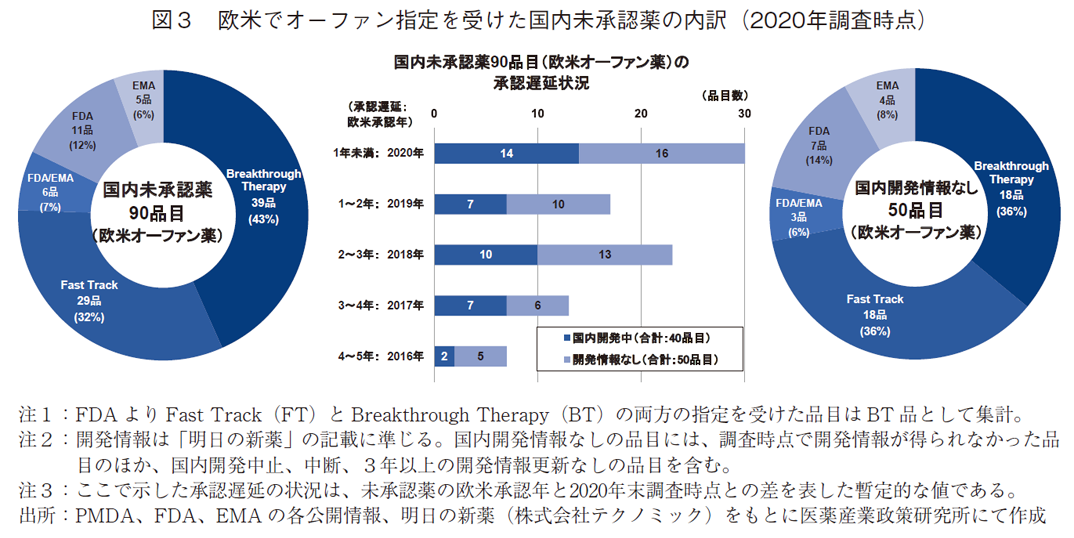
国内未承認薬のうち欧米でオーファン指定を受けた品目について、FDAのFTおよびBT指定の状況および国内開発情報を調査した。対象は、調査時点での国内開発情報を取得できた2020年調査時点の90品目とした(図3)。
オーファン指定を受けている国内未承認薬90品目のうち、FDAよりBT指定を受けたNMEは39品目、FT指定は29品目あり、臨床的に重要な薬剤であるBT指定とFT指定の合計数は68品目、対象の未承認薬全体の75%を占めた(図3・左)。この割合は、3章で示した2020年調査時点の未承認薬176品における臨床的に重要な薬剤(=BT指定品+FT指定品)の割合53%を20ポイント以上も上回る結果であった。
次に、欧米でオーファン指定を受けた国内未承認薬90品目について、2020年末時点で国内開発情報が得られた40品目と開発情報が得られなかった50品目を欧米承認年ごとに区分けし、欧米承認年と2020年調査時点との暫定的な国内承認遅延状況を示す(図3・中央)。オーファン指定品の未承認薬90品目のうち、半数近くの43品目(48%)は2020年調査時点で2年以上の承認遅延(=ラグ)が生じていた。また、未承認薬の半数以上(50品目)が国内で開発されておらず、そのうち24品目は2018年以前に欧米で承認された品目であった。開発情報が得られた40品目については、約半数を占める19品目に2年以上のラグが生じており、開発情報が得られた未承認薬においても多数の品目で承認遅延が既に生じていることがわかった。
最後に、欧米でオーファン指定を受けた国内未承認薬のうち国内開発情報のなかった50品目について薬事上の特別措置の指定状況(FTおよびBT指定の状況)を見ると、FDAよりBT指定およびFT指定を受けたNMEはそれぞれ18品目ずつあり、臨床的に重要な薬剤であるBT指定とFT指定の合計数は36品目、対象の未承認薬全体の72%を占めた(図3・右)。
5-1. 薬効分類別に見た国内未承認薬
2010年代後半での国内未承認薬増加の状況を把握するため、2016年時点の国内未承認薬117品目、および、2020年時点での国内未承認薬176品目について、薬効分類12)ごとに比較調査した(図4)。
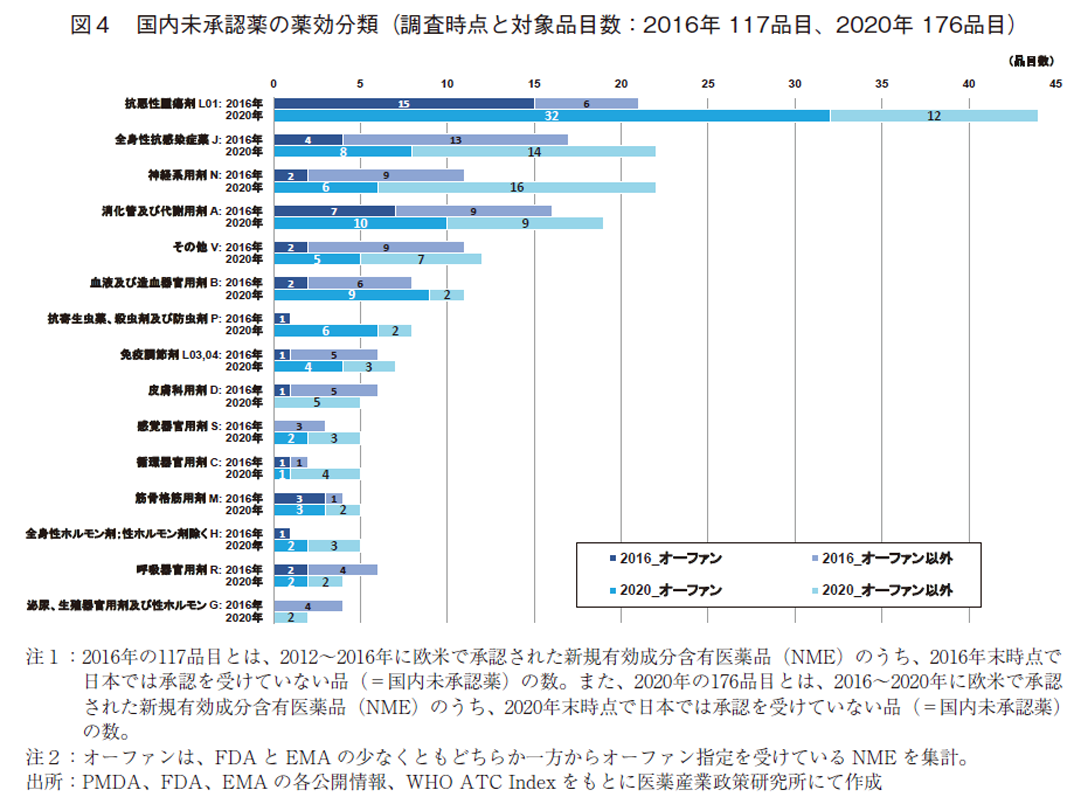
2020年調査時点の国内未承認薬を薬効分類別に見ると、抗悪性腫瘍剤(L01)が44品目と全体の25%を占め最も多かった。国内未承認薬が10品目以上ある薬効分類を並べると、全身性抗感染症薬(J)22品目(12.5%)、神経系用剤(N)22品目(12.5%)、消化管及び代謝用剤(A)19品目(11%)、その他(V、診断薬等)12品目(7%)、血液及び造血器官用剤(B)11品目(6%)と続いた。また、抗悪性腫瘍剤(L01)、全身性抗感染症薬(J)、神経系用剤(N)の上位3領域が未承認薬全体の半数88品目を占めることがわかった。
次に、2020年調査時点と2016年調査時点のデータを比較する。大きな違いとしては、抗悪性腫瘍剤について、2016年時点では21品目であったが、2020年時点では44品目と倍以上の未承認薬数の増加が見られた。また、神経系用剤についても2016年の11品目から2020年の22品目へと倍増していた。
続いて、4章で取り上げた欧米でオーファン指定を受けた未承認薬について薬効分類別に見てみる。2020年末調査時点のオーファン指定の未承認薬90品目のうち、抗悪性腫瘍剤(L01)が32品目と最多であり、消化管及び代謝用剤(A)10品目、血液及び造血器官用剤(B)9品目、全身性抗感染症薬(J)8品目、神経系用剤(N)6品目、抗寄生虫薬、殺虫剤及び防虫剤(P)6品目と続いた。特に、抗悪性腫瘍剤や血液及び造血器官用剤については、対象領域の未承認薬の7割以上をオーファン指定品目が占めていた。他方、全身性抗感染症薬や神経系用剤の領域では未承認薬に占めるオーファン指定品目の割合は4割以下であった。
最後に、欧米オーファン指定品の未承認薬について、2020年調査時点と2016年時点の薬効領域別データを比較する。抗悪性腫瘍剤では、2016年が15品目、同薬効領域内のオーファン品の割合は71%、2020年は32品目、73%となっており、数では倍以上の増加、割合では微増となっていた。所謂、希少がんや希少セグメントを適応対象とするNMEがどちらの時点においても高い割合で未承認薬として残っていたことがわかる。また、2020年時点では未承認薬に占めるオーファン指定品目の割合が4割以下であった全身性抗感染症薬8品目(36%)や神経系用剤6品目(27%)では、2016年時点の品目数と割合が、全身性抗感染症薬4品目(24%)、神経系用剤2品目(18%)となっており、どちらの薬効分類においても未承認薬の数および割合ともに大きく増加していた。
5-2. 国内未承認薬:抗悪性腫瘍剤領域の分析
薬効分類別でのより詳細な分析をおこなうため、調査時点での国内開発情報を取得できた2020年時点での国内未承認薬のうち、未承認薬の半数を占める抗悪性腫瘍剤(L01)、全身性抗感染症薬(J)、神経系用剤(N)の上位3領域について、疾患分類、臨床的重要度、開発情報を組み入れた調査を実施した。
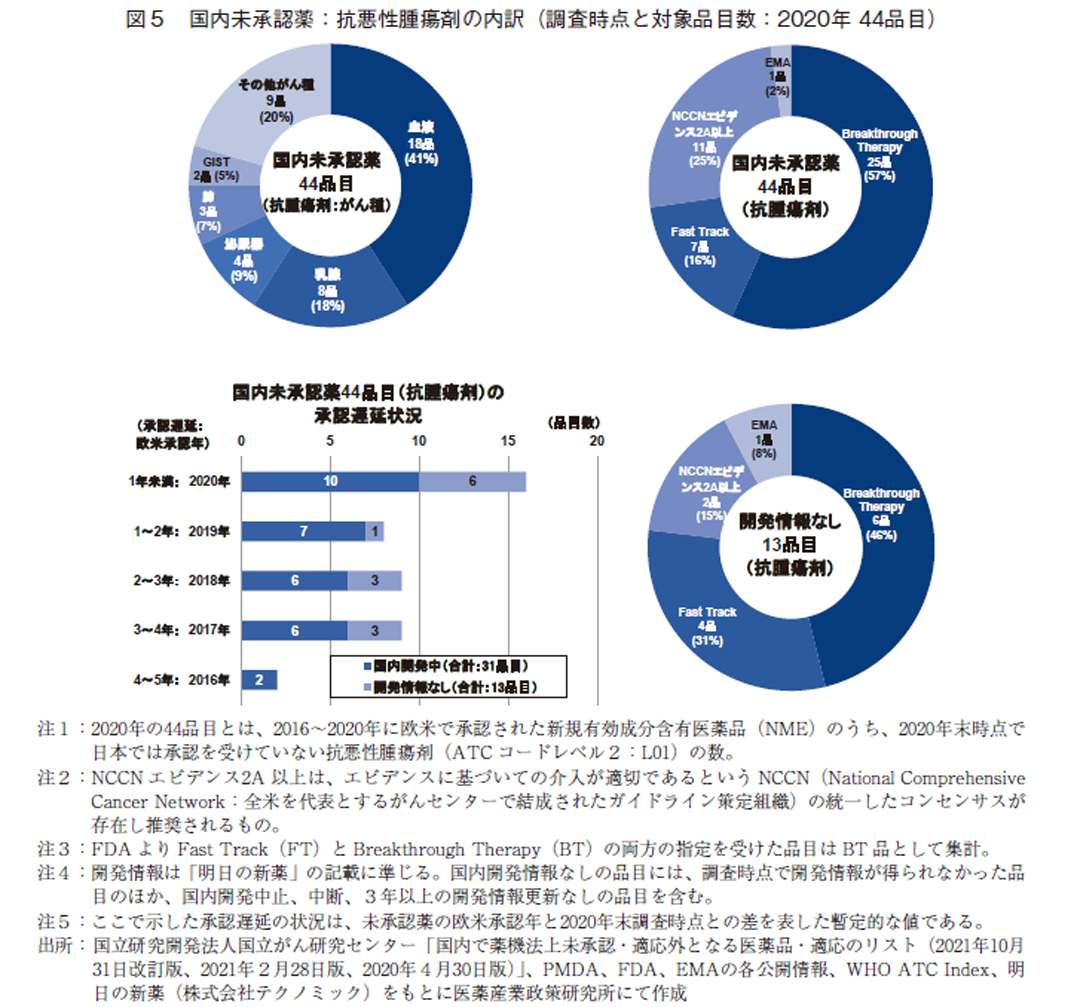
国内未承認薬の最多数を占める抗悪性腫瘍剤44品目については、国立研究開発法人国立がん研究センターで公開されている「国内で薬機法上未承認・適応外となる医薬品・適応のリスト(2021年10月31日改訂版、2021年2月28日版、2020年4月30日版)」13)をもとに、薬剤のがん種情報、NCCN(National Comprehensive Cancer Network:全米を代表とするがんセンターで結成されたガイドライン策定組織)ガイドラインのエビデンス情報13、14)を踏まえた分析をおこなった。分析で用いたNCCNエビデンス2A以上とは、エビデンスに基づいての介入が適切であるというNCCNの統一したコンセンサスが存在し推奨された薬剤であることを示すものである(図5)。
最初に、がん種別に未承認薬の内訳を調査した。希少がんとして知られる「血液がん」を適応としたNMEが18品、41%を占め最多であり、乳腺8品(18%)、泌尿器4品(9%)、肺3品(7%)、GIST(消化管間質腫瘍)2品(5%)と続いた(図5・左上)。5-1章で示したように、血液がんやGIST等の希少がんや希少セグメントを適応対象とするオーファン指定のNMEは32品目(73%)にのぼる。
次に、未承認薬44品目がアンメット・メディカル・ニーズに応えうる薬剤であるかどうかを調べるため、臨床的な重要度をFDAのFT、BT指定情報をもとに分析した。結果、FDAよりBT指定を受けたNMEは25品目、FT指定は7品目あり、合計32品目、73%を占めた。加えて、それ以外の未承認薬についてもNCCNガイドラインのエビデンスレベル2A以上のNMEが11品目含まれていた(図5・右上)。
続いて、抗悪性腫瘍剤の未承認薬44品目について、2020年末時点で国内開発情報が得られた31品目と開発情報が得られなかった13品目とに区分けし、欧米承認年と2020年調査時点との暫定的な国内承認遅延状況を示す(図5・左下)。未承認薬44品目のうち、20品目(45%)は2020年調査時点で2年以上の承認遅延(=ラグ)が生じていた。なお、本薬効領域については、31品目(70%)の未承認薬について国内での開発が進んでいたが、そのうち14品目は2018年以前に欧米で承認された品目であった。また、国内開発情報のなかった13品目のうち、6品目についても2年以上のラグが生じていた。
最後に、国内開発情報のなかった13品目について薬事上の特別措置の指定状況(FTおよびBT指定の状況)を見ると、臨床的に重要な薬剤であるFDAよりBTまたはFT指定を受けたNMEは10品目あり、対象の未承認薬の77%を占めた(図5・右下)。
5-3. 国内未承認薬:全身性抗感染症薬
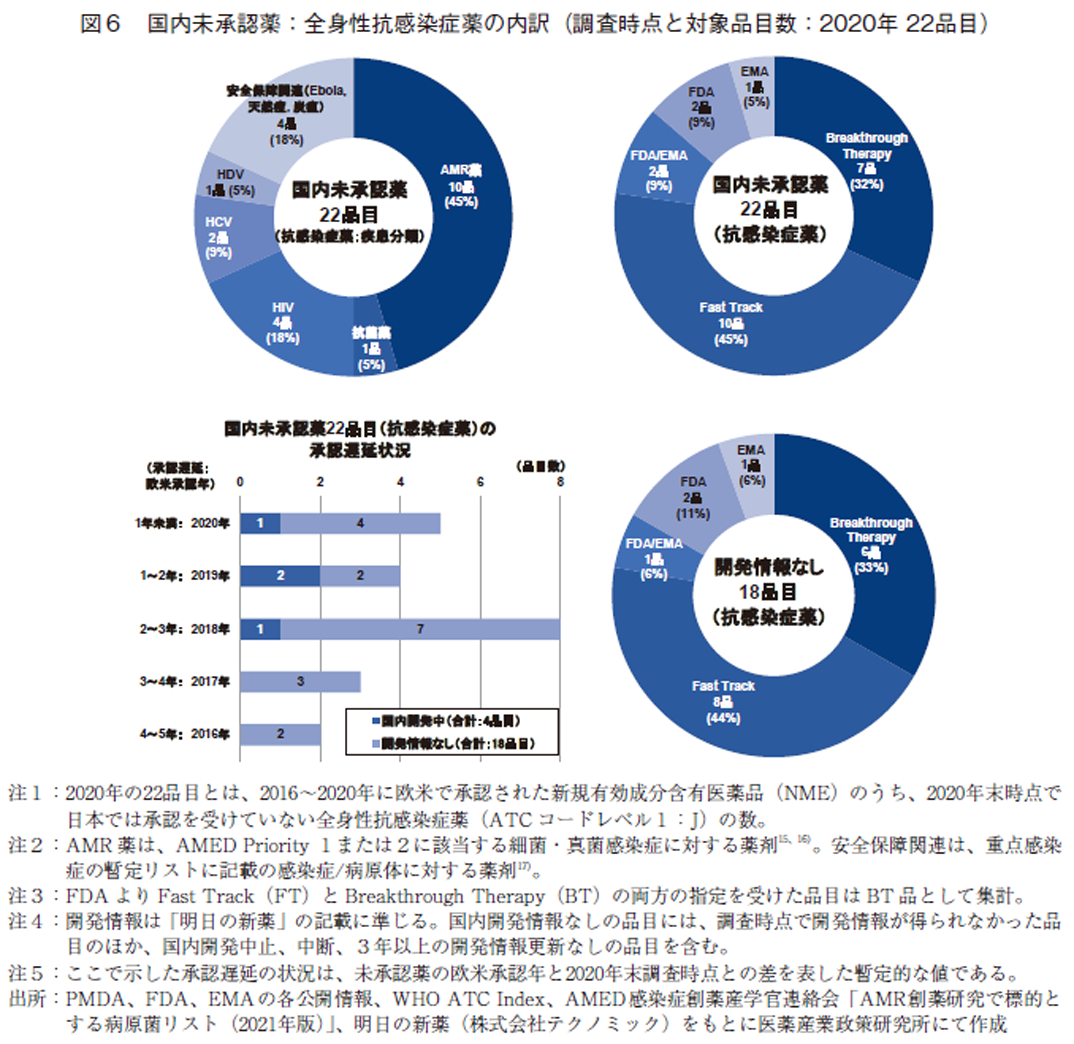
2020年調査時点の国内未承認薬上位3薬効分類に含まれる全身性抗感染症薬22品目について、疾患分類、臨床的重要度、開発情報を組み入れた調査を実施した(図6)。本領域のうち、AMR(Antimicrobial Resistance)薬を含む抗菌薬については、2022年3月の政策研ニュース第65号15)にて、湯淺らによる詳細な分析がおこなわれているので参照いただきたい。
全身性抗感染症薬の疾患分類を示す(図6・左上)。AMRを適応対象とした抗菌薬のNMEが10品、45%を占め最多であり、その他の抗菌薬1品を含めると全体の半数を占めた。続いて、抗ウイルス薬であるHIV4品、HCV2品、HDV1品の合計7品目(32%)、Ebola、天然痘、炭疽などの安全保障・公衆衛生危機管理の関連で承認されていると考えられる薬剤が4品目(18%)と続いた。本薬効分類については、国内外において既存薬での対応が難しくなりつつあり新薬が望まれているAMR薬15、16)や、安全保障・公衆衛生危機管理17)に関わるNMEが未承認薬として多数含まれていることがわかる。
次に、未承認薬22品目の臨床的な重要度をFDAのFT、BT指定情報をもとに見ると、FDAよりBT指定を受けたNMEは7品目、FT指定は10品目あり、合計17品目、77%を占めた(図6・右上)。
続いて、全身性抗感染症薬の未承認薬22品目について、2020年末時点で国内開発情報が得られた4品目と開発情報が得られなかった18品目とに区分けし、欧米承認年と2020年調査時点との暫定的な国内承認遅延状況を示す(図6・左下)。未承認薬22品目のうち、半数を超える13品目(59%)は2020年調査時点で2年以上の承認遅延(=ラグ)が生じていた。また、本薬効領域については、未承認薬の18%(4品目)が国内開発されているのみであり、前回のニュース1)においても述べたが、未承認薬の7割は開発中であった抗悪性腫瘍剤領域とは状況が異なることが再度確認された。開発情報が得られた4品目については、2018年以降に欧米で承認を受けたNMEであり、AMR薬やHIV薬が含まれていた。
最後に、国内開発情報のなかった18品目について薬事上の特別措置の指定状況(FTおよびBT指定の状況)を見ると、臨床的に重要な薬剤であるFDAよりBTまたはFT指定を受けたNMEは14品目あり、対象の未承認薬の77%を占めた(図6・右)。
5-4. 国内未承認薬:神経系用剤
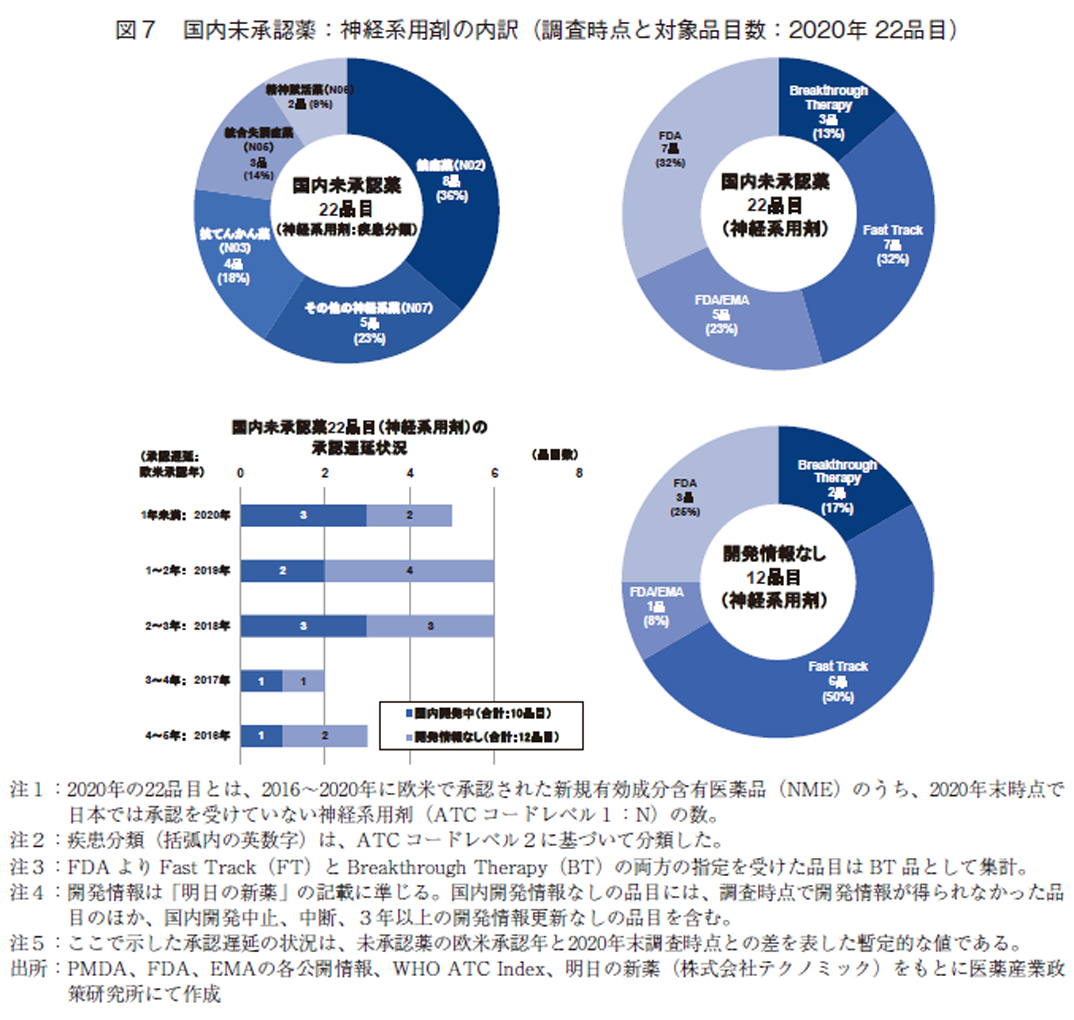
調査の最後として、2020年調査時点の国内未承認薬上位3薬効分類に含まれる神経系用剤22品目について、疾患分類、臨床的重要度、開発情報を組み入れた調査を実施した(図7)。
神経系用剤の疾患分類を見ると、鎮痛薬(N02)が8品、36%を占め最多であった(図7・左上)。この中には、2018年から2020年にかけて欧米で多数の品目が承認された抗片頭痛製剤が7品目含まれていた。続いて、その他の神経系薬(N07)5品目(23%)、抗てんかん薬4品目(18%)、統合失調症薬3品目(14%)、精神賦活薬(N06)2品目と続いた。
次に、未承認薬22品目の臨床的な重要度をFDAのFT、BT指定情報をもとに見ると、FDAよりBT指定を受けたNMEは3品目、FT指定は7品目あり、合計10品目、全体の45%を占めた(図7・右上)。
続いて、神経系用剤の未承認薬22品目について、2020年末時点で国内開発情報が得られた10品目と開発情報が得られなかった12品目とに区分けし、欧米承認年と2020年調査時点との暫定的な国内承認遅延状況を示す(図7・左下)。未承認薬22品目のうち、半数の11品目(50%)は2020年調査時点で2年以上の承認遅延(=ラグ)が生じていた。また、本薬効領域については、未承認薬の45%(10品目)が国内開発されていた。ただし、図4にて示した神経系用剤の未承認薬において欧米にてオーファン指定を受けていた6品目のうち、5品目については開発情報がなかった。開発情報が得られた10品目については、図中には示していないが、抗片頭痛製剤が6品目、抗てんかん薬が3品目を占め、国内開発されている品目の疾患分類に偏りが見られた。また、欧米での承認から2年以上のラグが生じている2018年以前に欧米にて承認されたNMEが5品目と半数を占めていた。
最後に、国内開発情報のなかった12品目について薬事上の特別措置の指定状況(FTおよびBT指定の状況)を見ると、FDAよりBTまたはFT指定を受けたNMEは8品目67%を占めており、アンメット・メディカル・ニーズに応えうる臨床的に重要度が高い薬剤と判断された品目が多く残っていることがわかった。(図7・右下)。
6. まとめと考察
本稿では、政策研ニュースNo.631)にて示した国内未承認薬の拡大(図1)が国民への新薬アクセスの問題6)となるかの精査をおこなうため、増加している未承認薬がアンメット・メディカル・ニーズに応えうる臨床的に重要な薬剤群なのかを、FDAのBTとFTに指定されているNMEの数および割合を指標に調査してきた。ここからは、調査分析した内容をもとに、国内未承認薬の拡大が国民への新薬アクセスの問題となるかを考察する。
本稿3章にて、2020年調査時点の国内未承認薬に含まれる臨床的に重要な薬剤の数およびその割合が、2016年時点と比較して拡大していることを示した(図2・左)。2020年調査時点での国内未承認薬176品目の中には米国にてFTまたはBT指定を受けた薬剤が半数以上の53%含まれ、2016年時点の36%と比較して17ポイント増加していたが、このことはFDAで承認されたNME全体のFT、BT指定の動向とほぼ同じであったことを述べた。つまり、2016年および2020年の両調査時点において、FDAで指定された臨床的に重要なNMEとそれ以外のNMEで国内未承認薬となる割合に大きな違いはなく、臨床的な重要度というのは、それだけでは国内で開発を開始する上での大きなインセンティブとはなっていないことがわかる。そして、これら臨床的に重要なNMEが未承認薬として残っていくことは、国民にとって新薬アクセス上の問題となると考えられる。
本稿4章では、アンメット・メディカル・ニーズを考える上で重要であり、未だに有効な治療法がない疾患の代表である希少疾病を適応とする欧米のオーファン指定を受けた国内未承認薬について調査し、未承認薬数およびその割合について拡大していることを示した(図2・右)。また、2020年時点のオーファン指定を受けた国内未承認薬90品目のうち、米国にてFTまたはBT指定を受けた臨床的に重要な薬剤の割合は75%を占めた。なお、オーファン指定を受けた未承認薬の半数以上が国内で開発されておらず、開発情報のない未承認薬50品目の72%は臨床的に重要な薬剤であった(図3)。
開発情報が得られなかった品目については、製薬企業等が調査時点で国内開発を実施していないことから、日本でのアンメット・メディカル・ニーズに応えうる薬剤ではないと判断された品目も含まれる可能性はあるが、世界的に販売されている新薬の80%以上が承認されている米国9)において臨床的に重要度が高いと判断された品目が7割以上も含まれていることから、日本においても開発がおこなわれれば臨床的に重要な薬剤となりうる品目が多数含まれると考えられる。また、開発進行中の薬剤40品目については、製薬企業等により国内市場に投入する価値があると判断されたNMEであると考えられるが、48%の品目は欧米の承認から2年以上のラグが生じていた(図3)。追加として2021年末時点での国内承認状況を調査したところ、欧米でオーファン指定を受けた未承認薬90品目のうち14品目は2021年に国内承認を受けていた。他方、2021年に承認されなかった76品目については図3中の暫定的な承認遅延の数値より更に1年加わったラグが生じていることになる。
このように、希少疾病を対象とした国内未承認薬について薬剤の臨床的な重要性や国内開発情報を詳細に見ていくと、未承認薬の中には国内においてもアンメット・メディカル・ニーズに応えうる薬剤が多数含まれていると考えられ、それらが開発されない、もしくは、開発されても数年のラグが生じることにより、未だに有効な治療法がない患者さんにとって必要な新薬へのアクセスの遅れが生じていると考えられる。
本稿5章では、国内未承認薬の薬効分類別調査を実施した。2020年時点の国内未承認薬のうち、抗悪性腫瘍剤、全身性抗感染症薬、神経系用剤の上位3領域の未承認薬で全体の半数を占め、特に、抗悪性腫瘍剤や神経系用剤の未承認薬数は2016年時点と比較して倍増しており、この期間の未承認薬拡大に影響したと考えられた(図4)。
次に、未承認薬の半数を占める上位3領域を比較することで、疾患領域による未承認薬の状況の違いについて考察する。抗悪性腫瘍剤領域の未承認薬44品目においては、血液がんやGIST等の希少がんや希少セグメントを適応対象とするオーファン指定を受けた品目の割合が73%、米国にてFTまたはBT指定を受けた臨床的に重要な薬剤の割合も73%にのぼっており、アンメット・メディカル・ニーズに応えうる薬剤が多数国内未承認となっていることが示された。また、抗悪性腫瘍剤領域の国内未承認薬の数は他の薬効分類と比較して多いが、未承認薬の70%(31品目)は国内開発が進んでいることもわかった。しかし、開発情報のなかった未承認薬13品目についても希少がんを適応とした薬剤を9品目(69%)、臨床的に重要な薬剤を10品目(77%)含んでおり、これらNMEが未承認薬として残っていくことは、未だに有効な治療法がない患者さんにとって新薬アクセス上の問題となる。
一方、全身性感染症薬の未承認薬22品目においては、米国にてFTまたはBT指定を受けた臨床的に重要な薬剤の割合が77%にのぼっていたが、国内開発が進んでいる薬剤は2割弱のみであった(図6)。未承認薬22品目の疾患分類を見ると、新規抗菌薬や安全保障・公衆衛生危機管理に関わる薬剤が68%含まれ、これら薬剤群については国内での開発が積極的に実施されていないことがわかる。例えば、新規抗菌薬については国立研究開発法人日本医療研究開発機構(AMED)が「AMR創薬研究で標的とする病原菌リスト(2021年版)」16)を公開し対策の強化を訴えているが、AMR感染症例を臨床試験に組み入れることの困難さ、抗菌薬の収益性の低さ、などの理由により開発が困難であることが数多く議論されており、大きな問題となっている15)。つまり、本領域については、アンメット・メディカル・ニーズに応えうる臨床的に重要な薬剤が多数未承認薬として残ってはいるが、治験成立の困難さ、市場規模の小さ、収益性の低さ、現時点での患者数の少なさなどによる開発の困難さが付き纏い、未承認薬として残っていると考えられる。社会一般に臨床的に重要な未承認薬の必要性が認識されるのは、新型コロナ感染症のように爆発的に患者数が増えた際であろうが、その際には国内で承認されていないため迅速に薬剤を使用できないという、緊急時には重大な新薬アクセス問題となりうると考えられる。
また、神経系用剤の領域では、未承認薬の半数弱が国内開発されていたものの、開発されている品目の対象疾患に偏りが見られた。また、開発情報のない品目の67%はFDAよりBTまたはFT指定を受けた品目であることから、米国にて臨床的に重要度が高い薬剤と判断されたアンメット・メディカル・ニーズに応えうる薬剤が多数国内未承認となっていることが示された(図7)。本薬剤領域では、臨床的に重要な薬剤であっても、臨床開発による有効性の検証が著しく難しく治験成功確率が低いことによる開発躊躇が推測される。そのため、市場の大きい薬剤の開発は優先されるが、臨床的な重要度だけでは開発のインセンティブになりづらいことが考えられる。
7. おわりに
今回、国内未承認薬の拡大が国民への新薬アクセスの問題6)となるかを調査分析してきた。結論としては、現状の国内未承認薬には多くのアンメット・メディカル・ニーズに応えうる薬剤が含まれており、日本において新薬へのアクセスに課題となることが示唆された。感染症領域のように、一見すると新薬アクセスの問題とはならないように見える領域もあるが、国民全体のリスク管理の問題として政策対応を考えるべき必要もある。
ドラッグ・ラグの最大の問題は、既存治療より有用性が明らかに上回る、又は、治療選択肢のない患者への効果を有する臨床的に重要な薬剤が国内に入って来ず、患者さんにとって新薬アクセス上の問題となることである。国内開発がおこなわれている薬剤については、海外との承認および上市時の「ラグ(遅延)」ができるだけ短くなることが望ましいものの、将来的には国内において患者さんがその薬剤にアクセスできる可能性がある。しかし、国内での開発がなされていない薬剤については、海外では利用できるが国内では待てども薬剤が使えないことを理解しておく必要がある。
最近、台頭著しい海外の新興バイオ医薬品企業をはじめとする外資系企業により、日本で薬剤の開発着手すらされずに素通りされている現状を新たなドラッグ・ラグと捉え、「ドラッグ・ロス」と呼称する有識者が増えてきている。国内未承認薬の拡大はドラッグ・ロスが進んでいる現象と捉え、本ニュースで飯田らが報告した未承認薬増加の詳細な要因分析結果18)はもとより、弊所以外から公表されているドラッグ・ラグの状況や要因分析の結果も組み合わせ、国民へ適切な新薬が欧米に遅れることなく提供される状態を構築できるよう、国全体で政策対応が取られることを期待したい。
-
1)医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュースNo.63(2021年7月)、及び、製薬協ニューズレター 政策研のページ「ドラッグ・ラグ:国内未承認薬の状況とその特徴」2021年9月号 No.205
-
2)医薬産業政策研究所「ドラッグ・ラグ:国内NME承認品目の上市状況-米国・欧州との上市時期比較-」政策研ニュース No.63(2021年7月)
-
3)医薬産業政策研究所「近年の国際共同治験の参加国の分析 臨床試験登録システムClinicalTrials.govを基に」政策研ニュース No.58(2019年11月)
-
4)医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較-COVID-19ワクチンの事例も踏まえた日本の課題-」政策研ニュース No.64(2021年11月)
-
5)医薬産業政策研究所「世界の売上高上位300製品の上市状況の日米欧比較-ドラッグ・ラグの解消は進んでいるのか-」政策研ニュース No.57(2019年7月)
-
6)国内未承認薬の拡大が引き起こす「新薬アクセスの問題」とは、欧米では有用な新薬が承認され必要な人々に行き届く状態となっているにもかかわらず、国内では未承認であるため国民に適切な新薬が提供される手段がなく、そのような状況の新薬が年々増加しているため国民の不利益が拡大している問題を指す。
-
7)
-
8)
-
9)
-
10)
-
11)医薬産業政策研究所「希少疾病用医薬品(Orphan drug)の開発動向-FDAで承認されたOrphan drugの日本での開発状況の分析-」政策研ニュース No.59(2020年3月)
-
12)薬効分類はWHOの下記webサイトを参照し、各品目のThe Anatomical Therapeutic Chemical code(ATC code)をもとに行った。また、ATC codeが付与されていない品目については類縁医薬品から予想されるものを採用した。
ATC/DDD Index 2022 -
13)
-
14)
-
15)医薬産業政策研究所「日本と欧米の抗菌薬開発の状況と課題」政策研ニュース No.65(2022年3月)
-
16)
-
17)
-
18)医薬産業政策研究所「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」政策研ニュース No.66(2022年7月)

