Opinion 医療分野における「患者・市民参画」(Patient and Public Involvement)を考える
医薬産業政策研究所 主任研究員 田村浩司
1.はじめに
患者中心の医療、シェアード・ディシジョン・メイキング1)、バリュー・ベースの評価、リアル・ワールド・データを活用した医薬品の安全性モニタリングや改良など、医療現場や医薬品の創薬・育薬などにおいて、患者満足度の評価をはじめとする需要者(生活者)基点の考え方の認識が高まる中、患者・市民参画、PPI(Patient and Public Involvement)という言葉が日本でも耳目を集めつつある。このような社会環境の変化や、精密(プレシジョン)医療 / ヘルスケアやデジタル・セラピューティクス(DTx)などに関する技術進歩と実装進展に伴い、製薬産業・企業ではイノベーションやバリューの考え方を、モノとしての医薬品の開発・提供からソリューションとしての治療ツール/モダリティの開発・提供へと変えていく必要性を認識しており、バリューの最終提供先である患者のニーズや満足度を正しく把握しながらの患者視点での創薬・育薬が必要になっている2)、3。
本稿では、PPIに関する日本での最近の動向を紹介し、期待や課題などについて考えてみたい。
2.PPI(Patient and Public Involvement)とは
PPIは英国で最初に採り入れられた考え方で、「患者・市民のために、または患者・市民について研究が行われることではなく、患者・市民と共に、または患者・市民によって研究が行われること」という定義がある4)。加えて最近では、研究分野(医学研究や臨床試験など)に限らず医療政策の全般において、その意思決定の場に患者・市民の関与を求めるというように考え方が広がっている。本稿では対象範囲を研究分野中心にしつつも、医療政策の全般における意思決定等の場に患者・市民が関与していく方向性を踏まえ、より広義にPPIを考えることにする5)。
3.「患者」「市民」の対象と、参画の「段階」
日本医療研究開発機構(AMED)では「医学研究・臨床研究における患者・市民参画とは、医学研究・臨床試験プロセスの一環として、研究者が患者・市民の知見を参考にすること」としており、ここでは患者・市民を「患者、家族、元患者(サバイバー)、未来の患者」と想定している6)。英国National Institute for Health Research(NIHR)では誰しも研究への参画の対象になりうるとし、「患者、介護者、(ヘルスプロフェッショナルではない)市民、コミュニティ グループ、元患者・サバイバー、慈善事業者、患者支援グループ、家族、学校」などが例示されている。いずれも、「当事者性」は異なるものの患者以外のさまざまな支援者を幅広く含めた捉え方をしており、誰しもいつかは患者になるという意味もあわせて、(広義の)PPIの当事者は(広義の)医療の受益者であると考えて大きな間違いではないだろう。
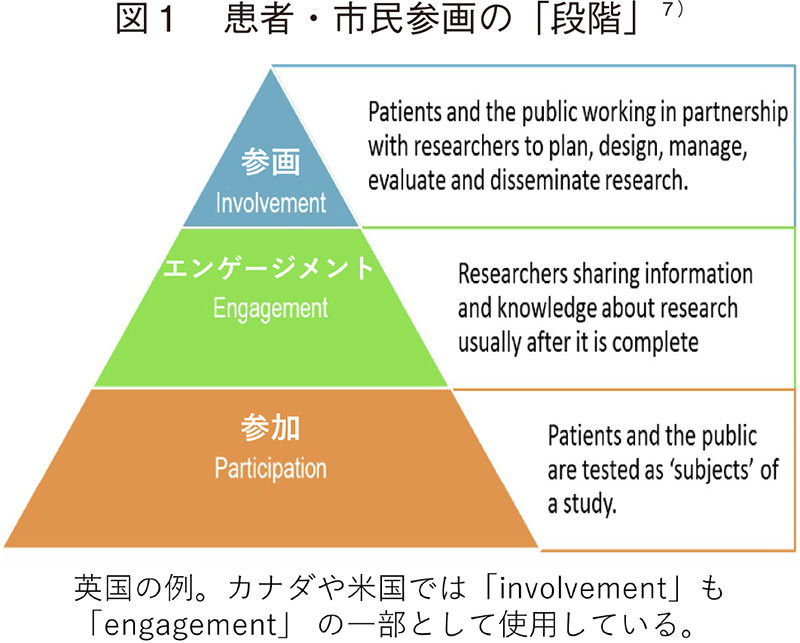
PPIについては到達目標に至るまでの「段階」(ステップ)があるとされている7)(図1)。研究分野の例では、第一段階が「患者・市民が研究参加者になること」で、治験の被験者になる場合などがこれに当たり、これを「参加」(Participation)と呼ぶ。第二段階が「研究終了後に研究者が研究結果の情報や知識を社会と共有すること」で、治験結果などの情報が事後的に被験者や患者団体等へ提供される場合などが該当し、これを「エンゲージメント」(Engagement)と呼ぶ。第三段階が「参画」(Involvement)で、患者・市民が「研究パートナー」として研究計画、デザイン、管理、評価、結果の普及に関与することを意味する。研究分野以外での、医療の実践におけるさまざまな課題の解決策の検討や、医療関連政策等の立案・モニター・評価等における、ステークホルダーとしての能動的関与も、「参画」に位置付けられるであろう。
4.日本における最近の関係者動向
国内ではPPIの重要性が一部関係者で認識され、取り組みの機運が徐々に高まりつつあるものの、ごく一部における自主的試行レベルに留まっているのが実情である。
-
(1)政府方針等
第3期がん対策推進基本計画(平成29(2017)年10月24日閣議決定)において今後取り組むべき施策として「AMEDは、海外の研究体制と同様、我が国でも患者やがん経験者が研究のデザインや評価に参画できる体制を構築するため、平成30(2018)年度より、患者、がん経験者の参画によって、がん研究を推進するための取組を開始する。また、国は、研究の計画立案と評価に参画可能な患者を教育するためのプログラムの策定を開始する」とされ、また、厚生労働科学特別研究事業「アレルギー疾患対策に関する研究基盤の構築」研究班による「免疫アレルギー研究10カ年戦略策定に資する報告書」(平成30(2018)年3月30日)では、「患者を含む全国民が参画し、その一人一人の貢献を重要視する免疫アレルギー疾患の国際的研究開発基盤の確立」の達成に向けたアクションプランの一つとして「Patient Public Involvement(PPI)の推進に関する研究」が提示されている。ただし、関連する法令・指針、公的な研修制度などについては、まだ整備に至っていない。
-
(2)日本医療研究開発機構(AMED)
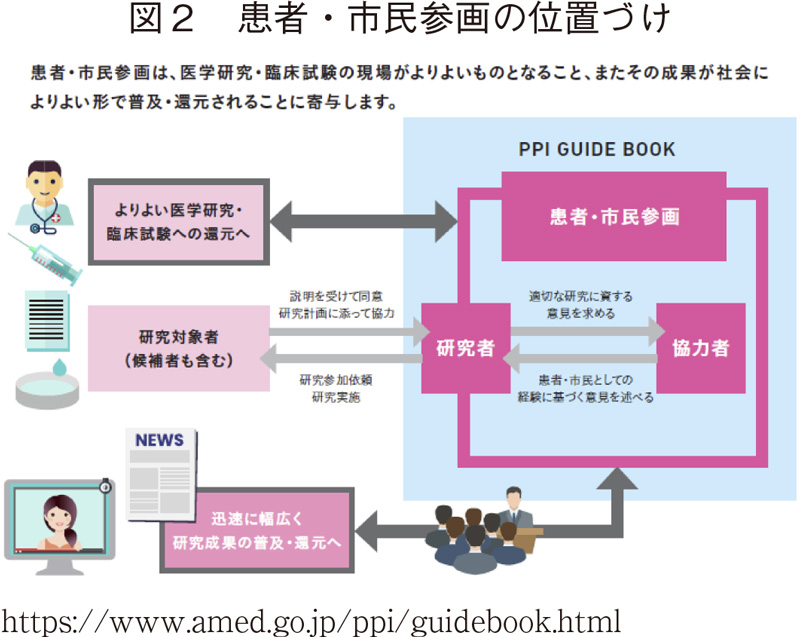
AMEDでは、医療における研究開発の推進における必須の概念としてPPIが位置づけられている(図2)。
AMEDによるPPI推進の後ろ盾の一つが、平成26(2014)年7月22日に内閣の健康・医療戦略推進本部が決定した「医療分野研究開発推進計画」(2017年2月17日・一部変更)である。この中では「患者との連携及び国民への啓発活動等への取組」の重要性が指摘され、「臨床研究及び治験の実施に当たっては、その立案段階から被験者や患者の参画(←当初の「連携」から変更)を促進する」ことの必要性が明記されている。
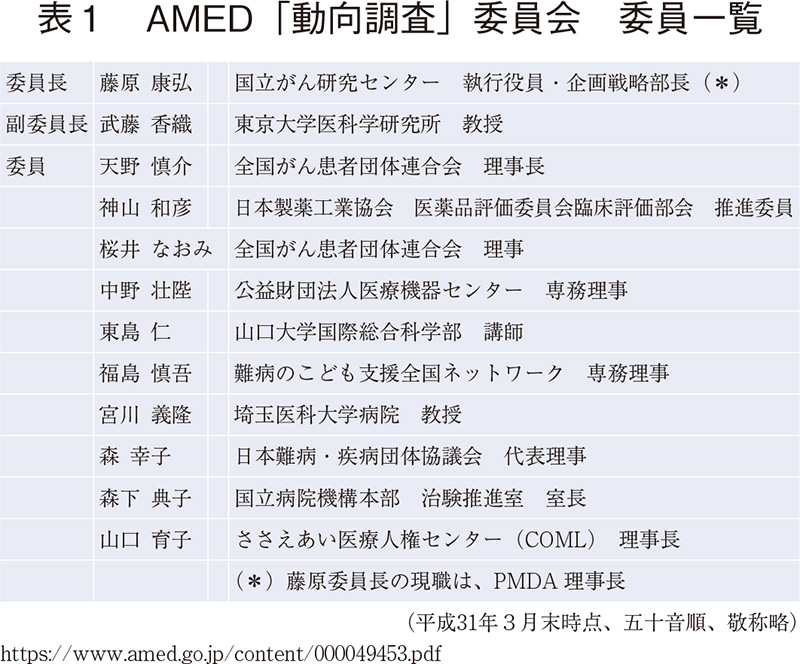
AMEDはPPIに関するホームページ8)を構築し、「患者さん一人一人に寄り添い、その「LIFE(生命・生活・人生)」を支えながら、医療分野の研究成果を一刻も早く実用化し、患者さんやご家族の元に届けることを目指し、医学研究・臨床試験における患者・市民参画(PPI)の取組を促進します。」と宣言している。2017年には研究者や患者団体代表者等で構成される「臨床研究等における患者・市民参画に関する動向調査」委員会を立ちあげ(表1)、2019年3月に「臨床研究等における患者・市民参画に関する動向調査」報告書を取りまとめるとともに、研究者向け冊子「患者・市民参画(PPI)ガイドブック」とリーフレット「医学研究・臨床試験における患者・市民参画(PPI)について」が作成された。また2019年度分の公募から研究開発提案書に(現時点では任意ながら)PPIの取り組みに関する記載を求めるようになっている。
-
(3)医薬品医療機器総合機構(PMDA)
前記のAMED「臨床研究等における患者・市民参画に関する動向調査」委員会の委員長だった藤原康弘氏が今年4月にPMDA新理事長に就任し、4つの「F」(First)9)に率先して取り組むべく、最初に掲げる「Patient First」活動の一環として「患者参画検討WG」が今年5月に組織された。ここでは「患者参画や患者との協同に向けたPMDAの取組みとして、患者向け広報のあり方の検討や、患者活動とPMDAのかかわりのガイダンス作成等を行う」とされている。現時点で具体的な活動状況について公表されていないが、「経営企画部、国際部、審査関係各部、安全対策関係各部、研究支援・推進部等」と、多くの関連部署名が挙げられており、上記に限らずさまざまな観点から積極的に検討が進められるものと期待したい。
-
(4)患者・市民参画コンソーシアム(PPI Japan)
医療・医薬品の開発に関心を寄せる患者・市民とアカデミア・製薬業界関係者が共に協議し、医療・医薬品開発に関する考え方やそのプロセス、また倫理性、透明性の高い関係者間の協業のあり方などに関する情報発信をするためのプラットフォームとして、2019年7月1日、「患者・市民参画コンソーシアム(Patient and Public Involvement Consortium in Japan)」が設立された10)。同コンソーシアムは、「医療・医薬品開発に不可欠なステークホルダーである患者団体、患者支援団体、一般市民及び産官学の相互理解と協働を推進し、関係者のニーズを掘り起こしながら、丁寧なコミュニケーションのもとで活動方針・活動計画を策定し、真の「産患官学」連携を実現する母体となることを目指す」としている。
活動内容としては、「医療・医薬品開発に不可欠なステークホルダーの相互理解を推進する上で最もニーズが高いのは、患者・市民向けの医療・医薬品開発に関する教育である」との認識から、第一歩としてEuropean Patients' Academy on Therapeutic Innovation(EUPATI)11)、12とのパートナーシップによる日本での活動運営母体の構築と実践的運営を進めるとのことである。そして次のステップとして、対話を促進するフォーラムやワークショップの企画、患者・市民との連携に関心をもつ産業界と医療・医薬品の開発に興味を持っている患者や市民がコミュニケーションできる機会の創出、それらをコーディネートする人材の育成、関係するルール作りなどに関する活動を行っていくとされている。同コンソーシアムには患産学官民各々からの発起人が名を連ねており(表2)、PPI発展普及に向けた共創・協奏の場(プラットフォーム)としての発展が期待される。

-
(5)アカデミアや民間における取り組み(例)
日本癌治療学会における活動を端緒に、一部の致死性疾患関連学会等でPPI関連活動が始められているものの、他の疾患分野では一部の自主的取り組みを除いて、取り組みは多いとはいえない。
診療ガイドライン作成への患者・市民参画に関しては、公益財団法人 日本医療機能評価機構のEBM普及推進事業(Minds)患者・市民専門部会が2016年11月15日に『「診療ガイドライン作成への患者・市民の参加」の基本的な考え方』を公開している13)。ここでは「基本的な考え方」として、診療ガイドラインを「患者の価値観・希望と医療者の医学的判断に基づいた意思決定のための推奨を提示する文書」としている。なおMinds版から遡ること約10年前にも、厚生労働科学研究班が患者・支援者が診療ガイドライン作成に参加する際の手続きや支援策をまとめた「診療ガイドライン作成過程への患者・支援者参画のためのガイドライン(PIGL)」を開発しており、日本患者会情報センターが同研究班に参加していた14)、15。
民間では上記のほか、認定NPO法人ささえあい医療人権センター(COML)が人材養成講座として、基礎コース「医療をささえる市民養成講座」およびその全回修了者を対象とするアドバンスコース「医療関係会議の一般委員養成講座」を設けて、審議会等で十分な役割を担える人材を育成している16)。アドバンスコース修了者で一定の要件を満たした方は一般委員候補者バンクへの登録資格が付与されるとのことである。
5.製薬協における取り組み(例)
製薬協では「製薬協 産業ビジョン2025」(2016年1月発表)において、患者参加型医療の実現を目指すと謳っている。患者団体連携推進委員会のアドバイザリーボードからの意見や提言等も参考に、同委員会および医薬品評価委員会臨床評価部会を中心に、製薬企業の医薬品開発でより患者の声を活用することを目指し、製薬企業が患者団体とPatient Centricity活動を推進するための課題抽出、情報収集への取り組みが進められている。
医薬品評価委員会臨床評価部会では、全ての製薬企業における患者の声を活かした医薬品開発の実装を最終的な目標として「患者の声を活かした医薬品開発(Patient Centricity)」をテーマに2016年度より取り組みが進められている。2018年6月には、「患者の声を活かした医薬品開発—製薬企業によるPatient Centricity—」報告書を公表した17)。本報告書では製薬企業での医薬品開発に焦点を絞り、日米欧におけるPatient Centricity活動の規制当局及び官民連携組織の動向、臨床評価部会所属各社へ実施したアンケート結果、各社による同活動の事例、同活動を普及するための提案や効果、日米欧の患者団体による同活動の調査及び日本の患者団体の代表者とのインタビューの結果について纏められている。2019年9月には、各企業における同活動の実装がより一層進むよう、各企業より同活動の事例を収集し、各事例の具体的な内容、実装手順、効果、実績、実施時の留意点等を纏めた報告書「製薬企業がPatient Centricityに基づく活動を実施するためのガイドブック—患者の声を活かした医薬品開発—」、および、関係各社がこれまで得た知見や経験を基に、患者団体とのコミュニケーション方法について協働を進める段階毎にまとめた報告書「患者の声を活かした医薬品開発:製薬企業が患者団体とPatient Centricityに基づく活動を推進するためのコミュニケーションガイドブック」を作成、公表した18)、19。
6.おわりに
日本におけるPPIに関する取り組みは、図1で示した「段階」になぞらえれば、まだ「エンゲージメント」まで手が届いていないかもしれない。一般的にはまだまだ認知度が低い現状を踏まえれば、まずはその啓発から着実に進めていく必要があるだろう。その一方、研究論文の投稿に際してPPIに関する情報を求める学術雑誌もあるようであり、国際的な動向に鑑みれば日本でも先進諸国に遅滞なきよう各側で協調しながら適切に取り組みを進める必要もあるだろう。ELSI(Ethical, Legal and Social Issues:倫理的、法的、社会的課題)については関係者間で理解が進み、多くの研究施設で研究倫理委員会等が設置され機能していると思われるが、基礎的研究から社会実装までの過程全体を通じて、多様なステークホルダーが参画し社会のニーズや期待に合致するような形で科学技術を推進するための取り組み、RRI(Responsible Research & Innovation:責任ある研究・イノベーション)という考え方も、有効な社会実装のためには必要となるだろう20)。
最後に、AMED「臨床研究等における患者・市民参画に関する動向調査」委員会の議論のとりまとめ21)にある「今後の取組への期待」に関する記載部分から課題と対策に関する主な内容を抜粋・整理し紹介することで、本稿を終えたい(表3)。

参考
-
武藤香織「医学研究・臨床試験における患者・市民参画(PPI)について」
-
武藤香織「臨床試験への患者・市民参画「PPI」日本における取り組み」(週刊医学界新聞 第3132号 2015年07月06日)
-
山口育子「患者・市民参画(PPI)の動きが高まっています」
- 「末松理事長インタビュー、2019年度から患者・市民参画の取り組みを記載へ」(日経バイオテクオンライン、2019年8月21日)
-
「医療分野における患者・市民参画(Patient and Public Involvement)について」
JPMA NEWSLETTER No.194(2019年11月) -
医療と薬剤 —患者中心の医薬品開発— 2019年秋」(薬事日報 2019年10月07日)
PPIの取り組みが活発化-東京大学医科学研究所教授 武藤 香織氏に聞く
市民参加型の医薬品開発が必要-東京大学大学院薬学系研究科特任教授 今村 恭子氏に聞く
医薬品開発の課題と展望-キャンサー・ソリューションズ社長 桜井 なおみ氏に聞く
EUPATI教育ツールを日本で展開-ユーシービージャパン副社長 三木 敏氏に聞く
患者の声を医薬品開発に反映-製薬協がガイドブック作成
研究者、患者団体の経験事例-AMEDまとめ「PPIガイドブック」より
-
1)協働意思決定。医学的な意思決定プロセスに患者と医師の両方が対等に参加し、患者の選好を踏まえた治療法などの選択決定を支援するプロセスを指す。(参考)https://www.pmda.go.jp/files/000221675.pdf、https://www.england.nhs.uk/shared-decision-making/
https://www.nice.org.uk/about/what-we-do/our-programmes/nice-guidance/nice-guidelines/shared-decision-making -
2)
-
3)
-
4)
-
5)PPIの類義語として、Patient Engagement、Research Advocacyなどがある。これらは患者側に立った意味で使われるが、Patient Centricityは日本ではどちらかといえば、医療提供者側からみた表現といえるかもしれない。
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)革新的治療のための欧州患者アカデミー。現在第2期の活動であり、パートナーのうちEFPIA関係企業からの拠出(資金、現物供与)が6割以上とのこと。なおEFPIA Japanでは、患者団体支援プロジェクトとして2017年に「PASE(Patient Advocacy Support by EFPIA Japan)」を設立した。
-
12)
-
13)
-
14)厚生労働科学研究補助金 医療技術評価総合研究事業「根拠に基づく診療ガイドライン」の適切な作成・利用・普及に向けた基盤整備に関する研究:患者・医療者の参加推進に向けて(主任研究者 中山健夫 京都大学大学院医学研究科)
-
15)
-
16)
-
17)
-
18)
-
19)
-
20)
-
21)

