トピックス 「ICHプラハ会合」開催される
2023年下期の医薬品規制調和国際会議(ICH)の会合が、10月28日~11月1日にプラハ(チェコ共和国)にて開催されました。今回も対面会議での参加が原則とされましたが、渡航上や健康上等のやむを得ない事情に備え、これまでに引き続きウェブ会議の設置は継続して運営されました。
 全体写真
全体写真
本会合では、総会に提案し議論される内容の準備やICHの運営を担う管理委員会、全メンバーが参画する総会等が行われました。また、技術的ガイドラインについて検討する16の専門家作業部会(ワーキンググループ)の議論も同期間に並行して実施され、ICHガイドラインの作成進捗が図られました。
プラハ会合の参加団体の内訳は、創設メンバーである日米EUの産官6団体※1、常任メンバー2団体(ヘルスカナダ、スイスメディック)、メンバー13団体※2、常任オブザーバー2団体※3、オブザーバー21団体でした。現地プラハには、世界各国から500名以上が参加し、製薬協からも専門家作業部会の専門家を含め35名が現地参加しました。
以下にプラハ会合のICH管理委員会、ICH総会を踏まえた特記事項を記載します。
-
※1米国食品医薬品局(FDA)、欧州委員会/欧州医薬品庁(EC/EMA)、厚生労働省/独立行政法人医薬品医療機器総合機構(MHLW/PMDA)、米国研究製薬工業協会(PhRMA)、欧州製薬団体連合会(EFPIA)、製薬協(JPMA)
-
※2ブラジル国家衛生監督庁(ANVISA)、韓国食品医薬品安全処(MFDS)、中国国家薬品監督管理局(NMPA)、シンガポール保健科学庁(HSA)、台湾食品薬物管理署(TFDA)、トルコ医薬品医療機器庁(TITCK)、サウジアラビア食品医薬品庁(SFDA)、メキシコ連邦衛生リスク対策委員会(COFEPRIS)、英国医薬品医療製品規制庁(MHRA)、エジプト医薬品庁(EDA)、バイオテクノロジーイノベーション協会(BIO)、国際ジェネリック・バイオシミラー医薬品協会(IGBA)、世界セルフケア連盟(GSCF)
-
※3世界保健機関(WHO)、国際製薬団体連合会(IFPMA)
1. 新規メンバー、オブザーバーの加入
今回新規ICHメンバーへの昇格を申請する団体はありませんでしたが、新規ICHオブザーバーとして、香港規制当局(香港薬剤業および毒薬管理局、PPBHK)の加入が申請され、ICH総会にて承認されました。
この結果、ICHメンバーは21団体、オブザーバーは37団体となり、ICHは総勢58団体の組織体制となりました(末尾の参考資料参照)。
2. ICH技術トピックの動向
プラハ会合では、全16トピックのワーキンググループが活発な議論を行い、進捗が図られました。
会合をもったワーキンググループ
| ・ | Q1/Q5C EWG:「医薬品の安定性試験ガイドライン」の改定 |
| ・ | Q2(R2)/Q14 EWG:「分析法バリデーション」の改定および「分析法の開発」 |
| ・ | Q3E EWG:医薬品および生物製剤の溶出物および滲出物の評価と管理 |
| ・ | Q5A(R2)EWG:「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品等のウイルス安全性評価ガイドライン」の改定 |
| ・ | Q9(R1)IWG:「品質リスクマネジメントに関するガイドライン」の改定 |
| ・ | E2B(R3)EWG/IWG:「個別症例安全性報告(ICSR)のデータ項目とメッセージ仕様」の改定 |
| ・ | E6(R3)EWG:「医薬品の臨床試験の実施の基準」の改定 |
| ・ | E11A EWG:小児用医薬品開発における外挿 |
| ・ | E20 EWG:アダプティブ臨床試験 |
| ・ | E21 EWG:臨床試験への妊婦・授乳婦の組み入れ |
| ・ | M1PtC WG:ICH国際医薬用語集(MedDRA) |
| ・ | M4Q(R2)EWG:「コモン・テクニカル・ドキュメント —品質に関する文書の作成要領に関するガイドライン」の改定 |
| ・ | M11 EWG:電子的に構造化・調和された臨床試験実施計画書 |
| ・ | M12 EWG:薬物相互作用試験 |
| ・ | M13 EWG:即放性経口固形製剤の生物学的同等性試験 |
| ・ | M15 EWG:Model-Informed Drug Developmentに関する一般原則 |
プラハ会合において、Q2(R2)「分析法バリデーションガイドライン」、Q14「分析法の開発ガイドライン」およびQ5A(R2)「ヒト又は動物細胞株を用いて製造されるバイオテクノロジー応用医薬品等のウイルス安全性評価ガイドライン」の3つが、ICH総会で承認され、それぞれICHにおける重要なマイルストンであるStep 4に到達しました(Step 4到達とは、最終版である英語版ガイドラインが確定し、今後各規制当局における実装プロセスに入ることを意味します)。
3. ICHアワード
「ICHアワード」は、ICHガイドラインの検討においてリーダーシップを発揮し、多大な貢献をした専門家に授与されます。2022年に発足し、2回目にあたる今回は、各団体からの推薦に基づき6名の専門家が受賞しました。日本からは当局側1名、業界側1名の2名が受賞しています。業界側からは、製薬協安全性領域専門家の久田茂氏(元 医薬品評価委員会所属)が受賞し、ICHの専門家作業部会における重要なリーダーシップや持続的な貢献が認められました。
4. ICH総会/管理委員会 議長・副議長選挙
ICH総会および管理委員会の議長・副議長の任期満了に伴い、プラハ会合では選挙が行われました。選挙の結果、PMDA執行役員の安田尚之氏がICH管理委員会の副議長として再選されました。
| ・ICH総会: | 議長 Lenita Lindström 氏(EC) 副議長 Gabriela Zenhaeusern 氏(スイスメディック) |
| ・ICH管理委員会: | 議長 Theresa Mullin 氏(FDA) 副議長 安田 尚之 氏(MHLW/PMDA) |
5. 次回ICH会合
2024年6月1日~5日の日程で、福岡にて開催予定です。
なおICHでは、ICH会合の成果を含め、ICHの活動に関する情報を積極的に公開し、関係者のみならず一般の方々に理解を深めていただけるようにしています。今回のICHプラハ会合の成果や各トピックのコンセプトペーパー、作業計画等はICHウェブサイト(https://www.ich.org/ )よりご覧いただけます。
【参考資料:ICHメンバー、オブザーバー一覧(2023年11月現在)】
表1 メンバー(21団体)
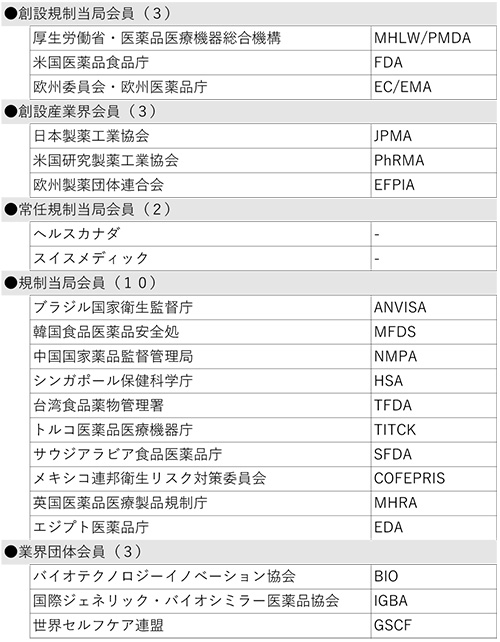
表2 オブザーバー(37団体)
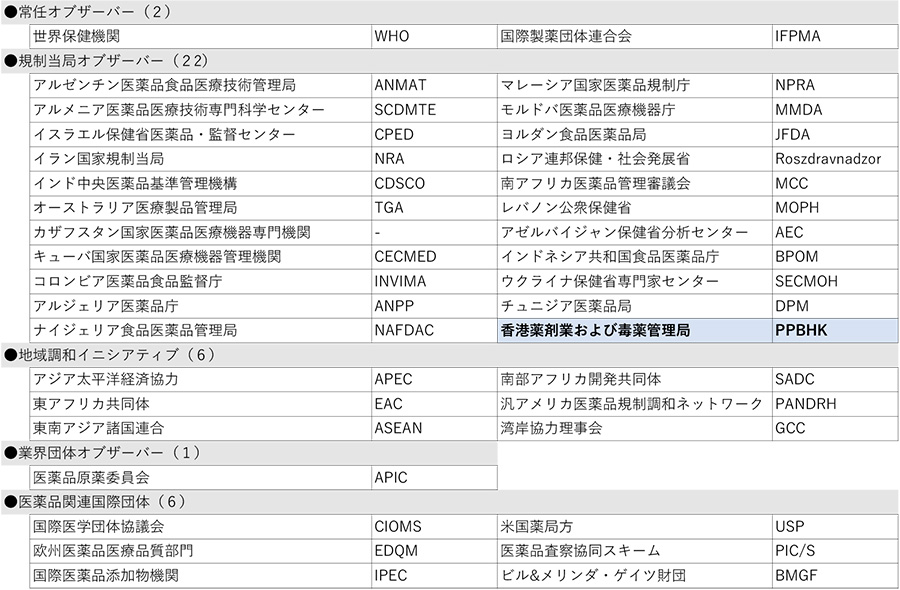 ※網掛け箇所、ICHプラハ会合で追加
※網掛け箇所、ICHプラハ会合で追加
(国際規制調整部長 加藤 真理子)

