解説 Risk Communicationを考える —Risk Communicationの概要と同意説明文書のあるべき姿—
製薬協 医薬品評価委員会 データサイエンス部会 2021年度タスクフォース5-2/2022年度継続タスクフォース5-2
エーザイ 酒井 弘憲、ファイザー 小宮山 靖、エーザイ 高麗 浩、中外製薬 上田 正倫
Risk Communication(RC)は、一般にリスクに関して個人・集団間での情報や意見を交換する相互作用過程であり、専門家と非専門家間でやり取りされることが多いことから、わかりやすいメッセージの発信を心がけることが肝要である。臨床試験参加の同意取得にあたり、患者さんに試験概要やリスクを明示する同意説明文書について、RCの観点から患者さんや、患者さんとともに内容を確認する治験コーディネーターの意見を聴取した。その結果や添付文書等のほかの医薬品関連文書の調査結果をまとめた成果物の概要を紹介する。本稿が医薬品開発および育薬でのRC議論の端緒となることを望む。
なぜRisk Communicationが必要か?
患者中心の医療、患者さんの声を活かした医薬品開発は今や世界の潮流である。医薬品規制調和国際会議(ICH)では、四半世紀ぶりのGCP(Good Clinical Practice)の大きな改定となるGCP Renovationにおいて、医薬品評価への患者さんの声の反映が重要なテーマの一つと位置付けられている。また、別途、患者中心の医薬品開発に関する議論が続けられている。
製薬業界にとって、本来、患者さんは最終顧客であり、医薬品開発から市販後まで続けられる育薬のパートナーである。しかし、科学的アプローチ、商業主義、規制へのコンプライアンスが重視されると患者さんに真摯に向き合うことが二の次とされる状況が生まれる。
医薬品のプロファイルの中でベネフィットは、なにをもって評価するかが特定されており、患者側の要因、環境要因によってベネフィットの大小はあり得るが、比較的容易に説明できる。しかし、リスクについては多種多様な事象が対象となり、医薬品と事象の因果関係評価、これに関連するエビデンスの重みの評価も伴い、コミュニケーションは難しい課題となる。
患者さんを中心に据えた医薬品開発、育薬あるいは販売活動を実現するためには、患者さんの声を聞き、それを研究や活動の計画、実施や運用に反映させることが重要であるが、患者さん(患者個々人あるいは患者さんの意見を代表する患者団体)とのコミュニケーションがその礎となるはずである。
Risk Communicationとはなにか?
まず一般的な用語としてのリスク(Risk)は、Oxford英語辞典の定義によると、将来のいずれかのときにおいてなにか悪い事象が起こる可能性をいう。 医療や研究開発の領域でリスクは、大きくは2つの意味で用いられている。
| (1) | GCPにおけるRisk proportionate approachあるいは臨床試験/臨床研究の品質マネジメントで使われているリスク。 |
| (2) | 治療の受け手となる患者側にとってどのような悪い事象が生じ得るかのリスク。 |
本稿が焦点をあてるのは(2)である。
リスクは、ある事象が生起する可能性と、それが起きたときの重大性の組み合わせ、定量的なアプローチで対処しようとする場合には積で定義される。
患者さんとのRCにおいては、集団としてのリスクを伝えようとしているのか、患者個人としてのリスクを伝えようとしているのかを明確にすることが重要である。そうでなければ、患者個人にとってはぴんとこないかもしれないし、双方向型のコミュニケーションは難しくなる。
医薬品の患者さんにとってのリスクは相対的な概念である。期待されるベネフィットが生存時間の延長や、重篤な症状の緩和なのか、生命や生活には大きな影響がない症状の改善なのかによって、同じ事象(たとえば嘔吐、頭痛等)であっても重大性が異なり、その結果としてリスクの大小も変わってくる。個々の患者さんによっても可能性(確率)の捉え方も異なる。10人に1人発生する副作用のリスクを受け入れるかどうかは、患者さんによって異なるであろう。たとえその事象の生起が個人にとって大変な不幸と考えられようとも、慎重で理性的な人々でさえも、その確率がゼロであるかのように行動できる低頻度の確率も存在する。
RCの概念の原点は、1989年のNational Research Council(NRC)の報告書「Improving Risk Communication」※1に求められるであろう。NRC報告書では、RCとは「リスクについての個人、機関、集団間での情報や意見を交換する相互作用過程」であると定義されている。さらにRCとは、民主的な対話のプロセスであり、その中で扱われる内容は、リスクに関する科学的・技術的情報や専門的見解だけでなく、リスク管理のための措置・施策・制度とそれらの根拠の説明と、これに対する関係者の見解、リスクに対する個人的な意見や感情表明も含まれるとされている。つまり、RCとは、社会の各層が対話し、ともに考え、協働することを通じて、リスクとベネフィット、さらにはそのガバナンスのあり方に関する多様な情報および味方の共有、信頼の醸成を図る活動であるといえる。
RCでは、7つの要素が挙げられる※2。
-
※1https://www.nap.edu/catalog/1189/improving-risk-communication (2023年9月19日 最終アクセス確認)
-
※2https://www.fao.org/3/a0822e/a0822e00.htm FAO/WHO Food Safety Risk Analysis(2005)(2023年9月19日 最終アクセス確認)
| (1) | 多様な価値観や立場のステークホルダーの中で行われる |
| (2) | リスク管理と連関して進められる |
| (3) | やり取りされる情報は、科学的に評価されるリスク情報だけでなく、リスクやリスク管理のあり方、リスクと引き換えに得られるベネフィット、リスクを伴う行為や技術の利用を行う目図に対するステークホルダーの意見や感情的表明も含まれる |
| (4) | リスク管理措置に関するコミュニケーションでは、措置を決定した科学的根拠に加えて、決定の際に考慮したほかの要因も説明する責任を負っている |
| (5) | 情報や意見は一方的だけでなく互いの価値を認めつつ双方向にやり取りされ共有される |
| (6) | 信頼が要となる |
| (7) | 現代社会のRCは「システミックリスク」 |
(7)のシステミックリスクとは、リスク同士およびさまざまな背景要因同士の間の相互依存性が高いリスクを指す。つまり、現代のリスクとは、複合的なリスクであり、単独のリスクとその因果関係だけを考えるのではなく、社会的な要因・影響まで含めた包括的な観点からの分析と、政府、産業界、学界、市民社会にまたがる包摂的なガバナンスが求められるのである。
RCは、専門家と非専門家の間で行われることが多い。専門家は、一般の人たちが科学技術やそのリスク、リスク管理について専門的内容を理解していないため、それらに対して感情的で主観的な捉え方をすると考えることが多い。したがって、正しい知識をわかりやすく伝え理解してもらえれば不安や抵抗は解消されると考えがちである。
このように、一般の人たちは知識が欠けており、それを専門家が補ってあげなくてはならないという考え方が「欠如モデル(deficit model)」と呼ばれる。しばしば、欠如モデルは役に立たないばかりか、人々の不満や不信を増幅しかねない危険性をはらむ。そのため、国際的動向として、欠如モデルに依拠したスタイル(公衆の科学理解)から対話や協働、政策決定への市民の参加等へ移行してきている。今日では、双方向的・相互作用的な「科学技術への公共的関与(Public Engagement with Science and Technology)」が重視されている。
RCの基本はコミュニケーションであり、正しいコミュニケーションについての理解なしに適切なRCは実施し得ない。リスクの判断や決定は不確実な状況下で行われるが、すべての多様な状況に対して情報を収集し、分析するには多大なコストがかかる。そのため、必ずしも正確な判断や決定とはならないが、ヒューリスティック(不確実な状況下で判断や決定を行うために用いる簡便で直感的な方略)を用いて大まかな判断を行うことはしばしば認められる。
RCにおいては、わかりやすいメッセージの発信を心がけることが肝要である。そのためには、言語だけでなく映像やイラストを利用することや、専門用語やカタカナ語を控え平易な表現とする等、非専門家が相手であることを常に念頭に置くことが大切であろう。不確実さや見解の相違がある情報については、根拠を受け手が検証できるようにする(文部科学省 安全・安心科学技術及び社会連携委員会 2014)ことも重要である。そのためにもリスク情報の根拠や検討過程、情報の修正・更新履歴の迅速な情報公開を積極的に行うことである。確率情報の提示に関する検討や工夫として、確率の数値表現は一般の人たちにわかりやすくする工夫が必要である。たとえば、「今後30年間に震度6以上の地震が発生する確率は1%」というと、ほとんどの人は「ほぼ起こらない」と認識するだろうが、実際、地震は発生する。このような場合、身近な事象の発現率を比較提示することが有益であろう。交通事故による死亡0.2%、台風罹災0.5%、空き巣被害3.4%等の数値を並べて提示することによって、地震発生は交通死亡事故に遭遇する確率よりも高いことが認識される。
また、コミュニケーションの形態とそれぞれに応じたメディアの利用を考慮する必要がある。
RCといえども、通常のコミュニケーションの一つであるため、普段のコミュニケーションがうまく行えていなければRCだけがうまくいくはずがない。コミュニケーションがうまくいくためには普段からの信頼関係が不可欠である。
米国環境保護庁(U.S. Environmental Protection Agency、EPA)が以下のようにRCの基本ルールを示している※3。
-
※3The EPA's Seven Cardinal Rules of Risk Communication
https://www.orau.gov/hsc/ercwbt/content/ERCcdcynergy/Content/activeinformation/resources/EPA_Seven_Cardinal_Rules.pdf
(2023年9月19日 最終アクセス確認)
| (1) | 人々を真のパートナーとして受け入れ、不可欠のパートナーとして巻き込む |
| (2) | 人々の声に耳を傾ける |
| (3) | 正直、素直、オープンである |
| (4) | 信頼できるほかの組織と協働する |
| (5) | メディアのニーズに対応する |
| (6) | わかりやすい言葉で明確に、思いやりの心をもって話す |
| (7) | 周到に計画し結果を評価する |
RCのみならず、コミュニケーション一般においてもこれら7つの項目が理解され、共有されていれば、とかくシステマティックで無機質に陥りやすい同意説明文書等も患者さんに対して心の通った文書になるのではないだろうか。
RCの要点は、
| (1) | 情報の両面開示(透明性、公平性) |
| (2) | 情報の双方向性(信頼と責任) |
| (3) | 効果性の評価(信頼性の醸成) |
| (4) | 価値観 |
であり(1)~(4)すべてに流れる基本精神は
| “公平性:fairness” |
| “信頼と責任:trust and responsibility” |
| “信頼性:reliability” |
である。
図1は、医薬品のリスクマネジメントの概略を示したものである。ICH Q9におけるRCのように、当初RCは、リスクの特定や評価等、独立した要素の一つと考えられていた※4。しかし現在は、リスクマネジメントの各要素の基盤としてRCがあると考えるべきである※2。
-
※4藤田利治、酒井弘憲、小宮山靖、椿広計「医薬品のリスクマネジメント」
統計数理研究所リスク解析戦略センター打ち合わせ資料(酒井(2005)を藤田が改変(2006)したものをさらに酒井が改変(2022))
図1 医薬品のリスクマネジメント
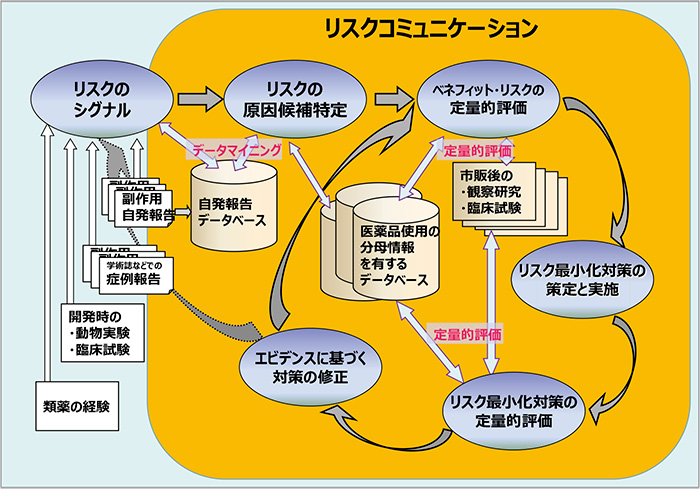 出所:藤田・酒井・小宮山・椿(2006)統計数理研究所リスク解析戦略センター打ち合わせ資料を改変
出所:藤田・酒井・小宮山・椿(2006)統計数理研究所リスク解析戦略センター打ち合わせ資料を改変
Risk Communicationの観点からの同意説明文書(ICF)
RCの観点から事例としてICFを取り上げ、ICFの現状を分析するため、公開されているICFテンプレートに着目し考察した。加えて、治験コーディネーター(Clinical Research Coordinator、CRC)および患者団体へのインタビューを実施し、そこから得られた気づきを紹介した後、本タスクチームのICFに関する提言をまとめた。
ICFテンプレートの事例
公開されているICFテンプレートから多くの気づきを得ることができる。治験用および臨床研究用のテンプレートには、「医薬品の臨床試験の実施の基準に関する省令」のガイダンス(以下、GCPガイダンス)※5および人を対象とする生命科学・医学系研究に関する倫理指針(以下、指針)※6がそれぞれ規定するICFの記載項目が網羅されている。これらのテンプレートを用いて作成されたICFは規制要件を満たすものの、テンプレートに記載されている事例と医師やCRCの説明があれば良いというものではなく、理想的なRCに向けて改善の余地がある。
一部の製薬企業間では統一したICFひな形の普及を推進している。2021年に実施したICFに関する実態調査結果から、ひな形のニーズはあると考えられるものの、ひな形作成過程における患者目線の重要性も不可欠である。
-
※5「医薬品の臨床試験の実施の基準に関する省令」のガイダンスについて」の改正について(令和3年7月30日、薬生薬審発0730第3号)
-
※6「人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス」の一部改訂について(令和4年6月6日、事務連絡)
CRCの視点から見たICFのPros/Cons
ICFを題材として、文書同意を取得する際の患者さん等への説明方法や、課題と考えている点、あるいはより良いRCを目指す際の着眼点等について、CRC5名と意見交換を実施し、有益な提案をいただいた。
複数の方が繰り返し述べていたことは「規制要件で求められる事項を羅列することはせず、ICFの内容にメリハリをつけたほうが良い」との提案であった。重要なことは、治験依頼者側や説明者側の考える“患者さんが知りたいこと”ではなく、実際の患者さんが知りたいことはなにか? を正確に把握することである。また、リスクとして説明(共有)しなければいけないレベルについて、患者さん/説明者/治験依頼者の間で十分なコンセンサスを図ることがRCには不可欠である。
患者さんが知りたいことはなにか? を正確に把握するうえで、治験参加後のストーリーをイメージできるようなICF作成を心がけると良い。また、患者さんは知識だけを知りたいわけではないかもしれず、治験依頼者側や説明者側の考える“患者さんが知りたいこと”に基づきICFを作成するのではなく、患者さんが本当に知りたいことはなにか? を十分議論することが重要である。
患者さんの中には「わからないことがわからない」ため、「わからないことはありませんか?」と聞かれても「今はないです」と回答する場面がしばしば見受けられる。そのため、読み手にとってわからないことをICFによって明確化していく、との視点を持ちながらICFを作成することは有益である。
患者さんの視点から見たICFのPros/Cons
ICFを中心として、治験または臨床研究で患者さん等への説明方法や、課題と考えている点、あるいはより良いRCを目指す際の着眼点等について、患者会等の代表者4名と意見交換を行い、意見をいただいた。
疾患に応じて患者さんの年齢層は異なり、たとえば多発性骨髄腫の場合は高齢者が多い。一方、非高齢者や若年層に特有の疾患もあり、読み手を想定せずに作成したICFは「患者(研究参加者)」と「医療従事者」の対話を促進する文書として適切とはいい難い。どのような患者さんを対象とした治験または臨床研究であるかを十分把握し、どのような読み手(誰)をターゲットに書くか(前述のRCの基本ルール(6))を考えるだけでも良いICF作成につながるかもしれない。また、年齢以外の要素を考慮することも必要である。初診後まだ時間が経過しておらず、思ってもいなかった病気との向き合い方について考えや気持ちが整理できていない人もいれば、たとえば10年以上治療を継続している人もいる。同じ治験であっても、患者さん一人ひとりの多様性や治験参加に対する期待の大きさを鑑みて、それぞれに応じたICFを作成することには無理がある。しかしながら、Patient centricityが重視されている今、この課題に取り組むことは、治験実施に携わる製薬企業および医療従事者が今後の治験を計画するうえで最優先事項に位置づけて良いであろう。
医師と患者さんのコミュニケーションは、治験や臨床研究に限らず日常診療においても非常に大切であることはいうまでもない。しかしながら、日常診療のやり取りに比べて、治験に参加するかどうかを患者さんが考える場面で、医師とのコミュニケーションはさらに充実したものでなければならない。
医師が患者さんとうまくコミュニケーションが取れていると考えている場合であっても、特に高齢患者とのコミュニケーションでは意思疎通が十分ではないことがある。患者さんは、うまくコミュニケーションを取りたい、医師と良い関係を保ちたいという思いで、医師に対しては本音を伝えづらいことがある。医師と患者さんの間にギャップが存在しているケースにおいては、CRCにそのギャップを埋めることが期待されるため、CRCの役割や存在意義は大きいといえる。
治療の選択肢をわかりやすく示すことは治験参加前も参加中も同様に必要であるが、治験参加前の説明にはよりいっそうの慎重さが求められる。
ICFは持ち帰って時間をかけて読んで理解できるため、患者さんにとってありがたい存在であることは確かである。患者さんが理解できるような説明であることがとても大切であり、説明する医師やCRCの力量が問われるとともに、患者さんが自分で繰り返し読むことができるICFの内容は非常に重要となる。
リスク/ベネフィットの伝え方には工夫の余地がある。伝えたい内容は同じであっても、書き方で読み手の印象は異なる場合がある。過大評価や過小評価はいずれも避ける必要があるものの、一律にリスク/ベネフィットのどちらに比重を置くかという問題ではない。リスク/ベネフィットを数値化することは難しいことが多いが、できるだけわかりやすくICFに記載し、その内容を踏まえて説明する努力が説明者に求められる。また、CRC経験者から「ICF作成者はリスクのことを考え過ぎているのではないか? ベネフィットに関する内容が少ないため、治験参加は怖いという印象が残りやすい」との意見をいただいた。治験依頼者の考えるリスク(訴訟にならないようなリスクヘッジ)と医療従事者が「患者さんに理解してほしいと考えるリスク」に違いがあるかもしれない(リーガルの視点が入るとページが増加傾向になりやすい、文章が硬くなり読みにくい等)。ICF作成者はリスク/ベネフィットの項目で伝えるべき内容を、RCの送り手の心理的義務※7に配慮しながら関係者と十分議論することが必要である。
-
※7吉川肇子「リスク・コミュニケーション」保健物理 2000;35(4):485-90
最後に
2019年にICH E6(R2)がStep 5となり、国内実装された。E6(R2)では新たに品質マネジメントにかかわる記載が追加され、ガイダンス別添として治験の品質マネジメントシステムにおいて必要な取り組みとして、以下の7つの項目が挙げられた。すなわち、(1)重要なプロセスおよびデータの特定、(2)リスクの特定、(3)リスクの評価、(4)リスクのコントロール、(5)リスク・コミュニケーション、(6)リスク・レビュー、(7)リスク報告である。
これらはそれぞれが独立の概念ではなく、相互に強い関連がある。特にこれらの項目すべてにかかわる基盤となるものがRCであるが、残念ながら、ガイドラインの記載通りに「感知したリスク情報を的確にステークホルダーに伝えることである」という単純な理解をしている人たちが少なからずいるようである。
末筆ながら、通常業務の中ではなかなか聞くことのできない貴重な生のご意見をうかがわせていただいたCRC、患者団体代表のみなさんに深く感謝申し上げる。

