トピックス 「日本感染症学会/日本化学療法学会 合同学術集会との共催シンポジウム」が開催 日本発の抗菌薬を再び世界へ!産学官の連携による創薬エコシステムの構築
2023年4月の「AMR(薬剤耐性)対策アクションプラン2023-2027」の発出、5月の「G7広島サミット/長崎保健大臣会合」の開催等、AMR感染症対策に関連するさまざまな動きがある中、4月28~30日の会期で「第97回 日本感染症学会総会・学術講演会、第71回 日本化学療法学会学術集会 合同学会」が開催されました。製薬協は合同学会と共同で「日本発の抗菌薬を再び世界へ!産学官の連携による創薬エコシステムの構築」と題した共催シンポジウムを開催し、産学官それぞれの立場から、創薬促進に向けた取り組みを紹介し、パネルディスカッションでは、新規抗菌薬の創薬研究の促進、そのために必要な産学官の連携に関して議論しました。
 パネルディスカッションの様子
パネルディスカッションの様子
シンポジウム開会にあたって
東邦大学 医学部 微生物・感染症学講座 教授 舘田 一博 氏
薬剤耐性(AMR)の課題に対して、真剣に向き合い、議論し、そして実行に移すべき時期にきています。改めてAMRに関する取り組みの重要性を認識し、産学官、そして市民が結集してこの問題に取り組んでいかなければなりません。「AMR対策アクションプラン2023-2027」では、抗菌薬の創薬促進を継続できる仕組みの構築が採り上げられ、その中でプル型インセンティブの導入がキーワードとして議論されるようになりました。しかし、プル型インセンティブ導入だけでは、抗菌薬開発を持続するのは難しいことも認識する必要があります。これらの課題への取り組みとして創薬エコシステムの構築という考え方があることが紹介され、本シンポジウムのテーマとして議論したいと説明がありました。

■基調講演
薬剤耐性問題のオーバービューと新規抗菌薬の必要性
国立研究開発法人 国立国際医療研究センター 国際感染症センター長 大曲 貴夫 氏
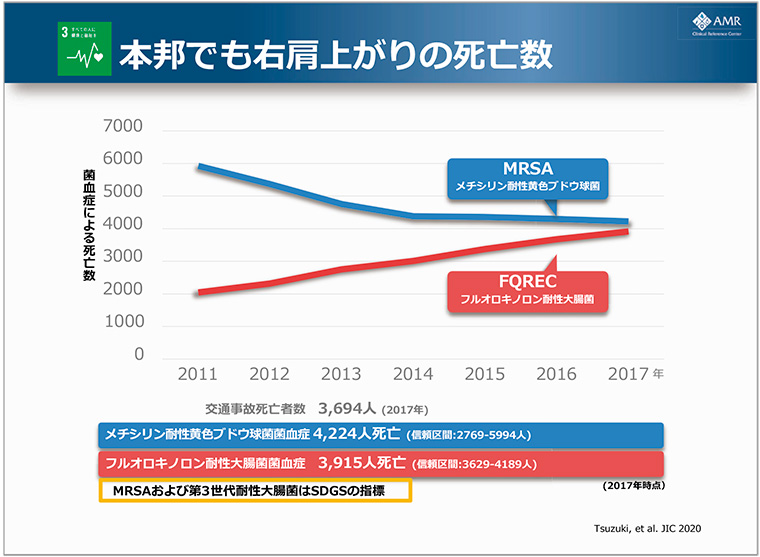
AMRをめぐる世界的な課題、そして政府を中心とした取り組みといった視点で基調講演がありました。2019年の全世界の死亡者数を見ると、「悪性新生物」「虚血性心疾患」「脳卒中」に次いでAMRが原因となっており、ヒト免疫不全ウイルス(HIV)/後天性免疫不全症候群(AIDS)、マラリアをしのぐ死亡者数となっています。日本でもメチシリン耐性黄色ブドウ球菌(MRSA)およびフルオロキノロン耐性大腸菌(FQREC)感染症だけで、死亡者数が年間8000名を上回っています(図1、図2)。

図1 全世界の疾患別死亡者数
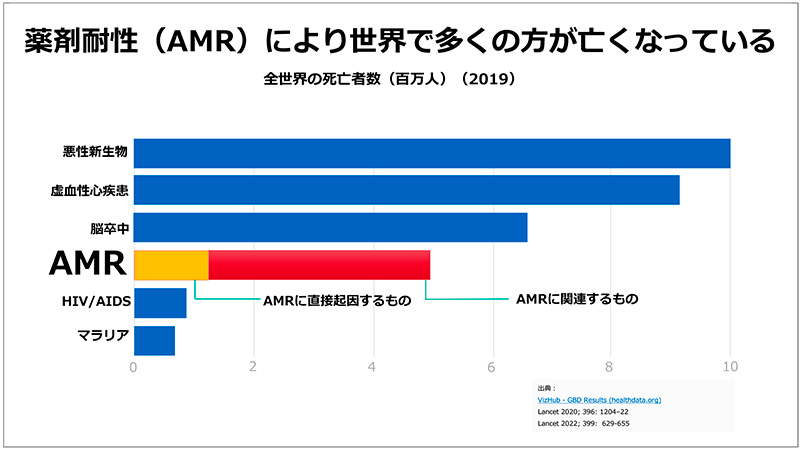
図2 本邦における菌血症による死亡者数の推移
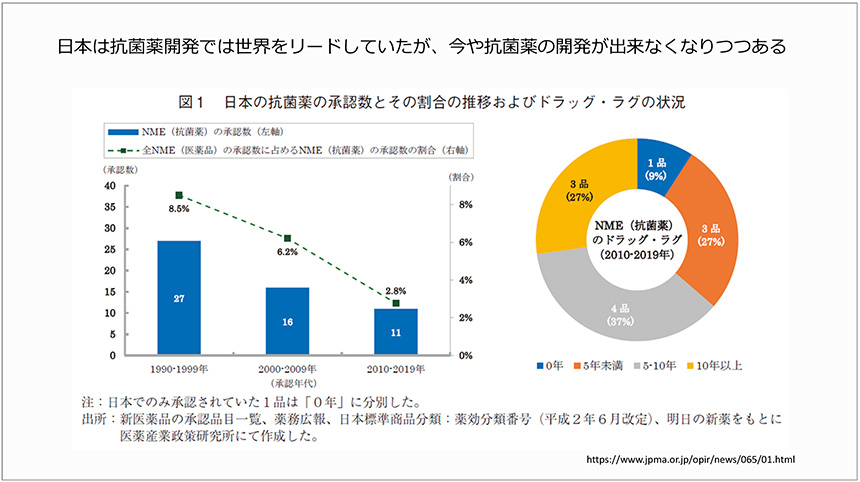
さらに、日本では、AMRと戦うための新規抗菌薬の承認数が減少傾向にあること、世界的に承認・使用されている抗菌薬が日本では承認されていない、いわゆるドラッグ・ラグが生じており、将来のAMR感染症治療における懸念が示されました(図3)。
図3 日本における抗菌薬の承認数とドラッグ・ラグの状況
実際のAMR感染症患者の臨床症例も交え、新型コロナウイルス感染症(COVID-19)で経験したような「治療薬がない状態で感染症を診療することの怖さ」が紹介され、サイレントパンデミックといわれるAMRの対策はすぐにでも講じることが重要であるとの指摘がありました。また、「AMR対策アクションプラン2023-2027」における「抗微生物薬の持続的な開発、安定供給の強化」の概要が紹介され、同アクションプランを着実に実行することで抗菌薬の持続的な開発、安定供給の強化をはかることが重要であると強調しました。
■講演1
薬剤耐性菌(治療薬)の研究
藤田医科大学 医学部 微生物学講座・感染症科 教授 土井 洋平 氏
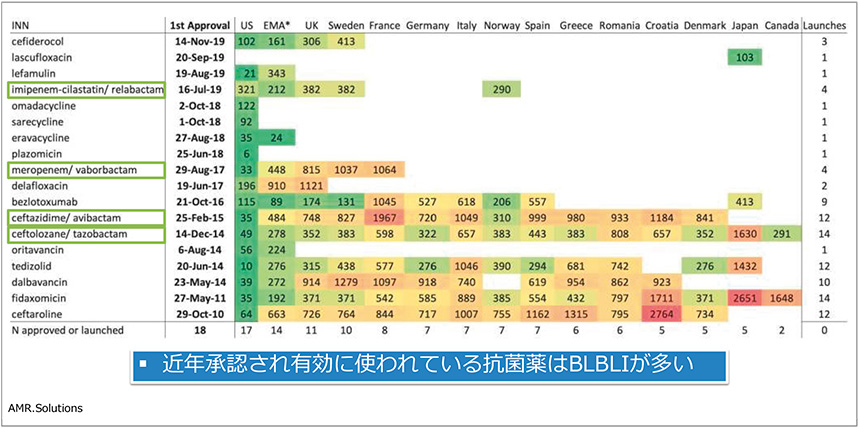
薬剤耐性菌治療薬に関する米国研究室での取り組みについて紹介されました。この50年間、グラム陰性菌に対する新規クラスの抗菌薬は開発・実用化されておらず、最近承認された抗菌薬はβラクタム薬とβラクタマーゼ阻害薬の組み合わせ(BLBLI)が多い傾向にあります(図4)。そこで、BLBLI以外のメカニズムで耐性機序の解除を目指せないかとの発想のもと、今も広く使用されているホスホマイシンに着目し、その不活化酵素阻害剤の探索研究に取り組みました。ほかの研究室および研究者と共同で、さまざまな菌種の遺伝子シークエンスを解析し、結果、標的遺伝子の配列が特定され、阻害剤の活性部位の構造解析までに至りました。

図4 近年承認され実用化されている抗菌薬
次なるステップとして、リード化合物の最適化や大規模のハイスループットスクリーニング(HTS)を実施したいと考え、米国国立衛生研究所(NIH)やCARB-X※1に研究費助成を申し入れましたが、実現には至らず、創薬研究を進めるにあたってボトルネックがあったことが実際の体験として紹介されました。特に会社を作ってデータの蓄積を求められる場面に直面することがあり、実際には研究者が会社を作ることは非常に負担が大きいことが述べられました(図5)。
-
※1薬剤耐性菌感染症の革新的なアプローチの研究・開発を促進するための国際的官民パートナーシップ
図5 米国で経験した創薬研究におけるボトルネック

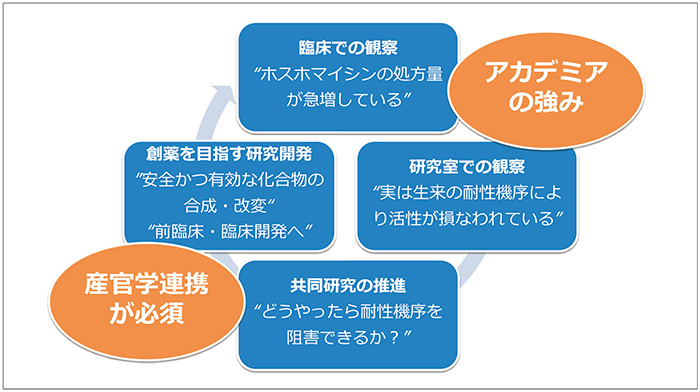
臨床現場や研究室での知見によりシーズやアイデアを生み出すことができるアカデミアの強みを活かすことは、創薬において有効な手段と考えられます。探索段階から創薬に向けた次への段階に進むためには、医薬品としての可能性を有する候補化合物について、産学官の連携という支援の枠組みを活かしながら強力に押し進める流れが必要であり、日本でもこのような取り組みが主流になることを望んでいると期待が述べられました(図6)。
図6 アカデミアの強みを活かした産学官連携システム
■講演2
創薬ベンチャーエコシステム強化事業について
国立研究開発法人 日本医療研究開発機構 実用化推進部 研究成果展開推進課 課長 伊藤 哲也 氏
国立研究開発法人日本医療研究開発機構(AMED)の沿革、活動について紹介した後、同機構が提供する創薬ベンチャーエコシステム強化事業について説明がありました。ベンチャーの新薬開発において果たす役割は周知のところですが、創薬分野での研究開発は長い時間と多額な研究開発費用を要し、かつ相応のリスクを伴うため、ほかの分野に比べてベンチャーとしての事業化はハードルが高いのが現状です。
特に日本のエコシステムでは資金調達・供給がスムーズに行われていない面があります。その問題に対処しようと立ち上げたのがこの事業です。AMEDが認定するベンチャーキャピタル(VC)が補助対象経費の1/3以上を出資する創薬ベンチャーに対して、医薬品の実用化開発にAMEDが2/3相当の補助金を交付します(図7、図8)。

図7 創薬ベンチャーエコシステムについて
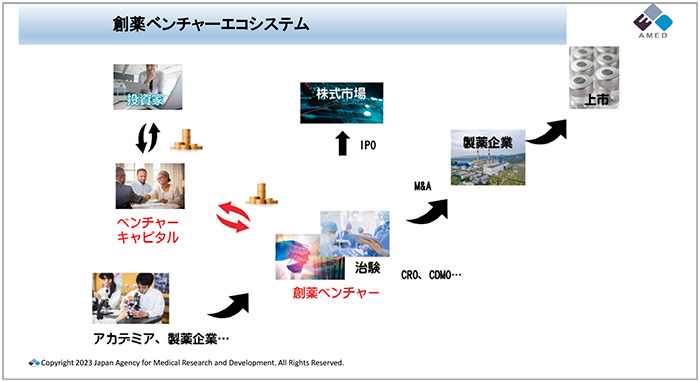
図8 創薬ベンチャーエコシステム強化事業の概要
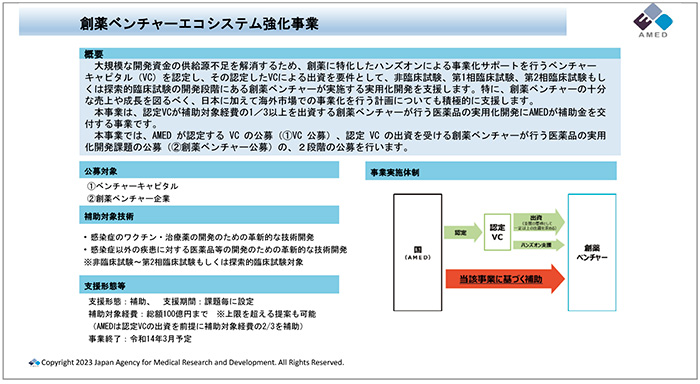
令和3年度補正予算の中で、ワクチン戦略事業の一つとして500億円の予算措置を実施することで立ち上げ、さらに2022年度補正予算において、対象分野を拡大する形で創薬全般を対象にして3000億円の基金が用意されました。リソースを多くもたないベンチャー企業が、アカデミア等から見出されたシーズから創薬する事業を支援することで、日本のベンチャー企業の育成とともに創薬力強化が期待されます。このような支援事業を展開するにあたり、AMEDでは各種の相談窓口を用意しているので活用してほしいと要望がありました。さらに、さまざまなメディアを通じて情報発信していることが紹介され、そのアクセス情報が共有されました(図9)。
図9 AMEDからの情報発信(アクセス情報)

■講演3
創薬エコシステム構築に向けた製薬業界の取組み
製薬協 国際委員会 AMRアドボカシータスクフォース 俵木 保典 リーダー
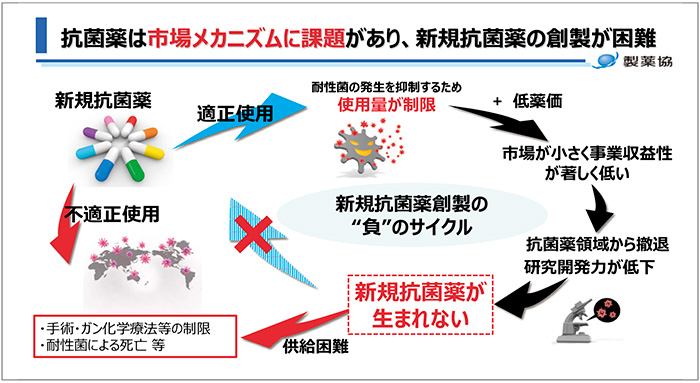
製薬協では、重要なグローバルヘルス課題の一つであるAMRについて、各国の製薬団体と協力して対策に取り組んでいることの紹介がありました。続いて、企業が直面している問題として抗菌薬の市場メカニズムに重大な課題があり、新規抗菌薬の創製が困難となっていることが指摘されました(図10)。

図10 新規抗菌薬創製の“負”のサイクル
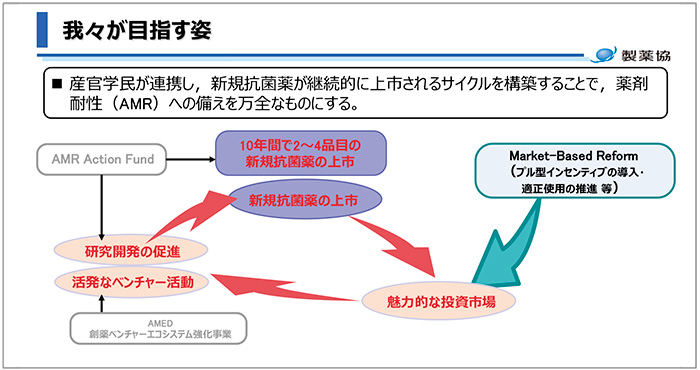
この課題への対策として、研究開発支援を主とするプッシュ型インセンティブと上市後の採算性を高めるプル型インセンティブがあることの説明がありました。プッシュ型インセンティブとしては、2020年に世界の製薬企業20数社が約10億ドルを出資してAMRアクション・ファンドを立ち上げ、ベンチャー企業支援を通して、今後10年間で2~4品目の新規抗菌薬の上市を目指していることが紹介されました。プル型インセンティブについては、各国政府によって導入が検討、またはすでに導入されていることが示され、抗菌薬適正使用による使用量制限と持続可能な抗菌薬開発を両立させるマーケットベースリフォームを実現させることで、魅力的な投資市場が形成され、ベンチャー活動の活性化にもつながることが理想的な姿であると述べました(図11)。
図11 創薬エコシステムが目指す姿
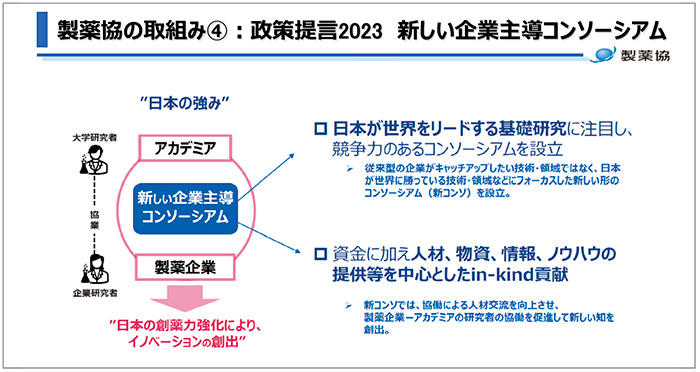
また、研究の初期段階に対する製薬協の取り組みとして、アカデミアをパートナーとした新しい企業主導コンソーシアムの形成について提言が紹介されました(図12)。
最後に、内閣府、厚生労働省、経済産業省において、創薬促進のためのさまざまな施策が行われていることを挙げ、業界としてもこれらの事業への協力をコミットし、産学官が密接に連携して持続的な起業・成長を支える仕組みに発展させたいとの期待を示しました。
図12 新しい企業主導コンソーシアム
■パネルディスカッション
パネリスト
厚生労働省 医政局 医薬産業振興・医療情報企画課 ベンチャー等支援戦略室 室長 山本 剛 氏
パネルディスカッションでは、「新規抗菌薬の実用化に向けた切れ間のない産官学の取り組みのために」をテーマに、産学官それぞれの立場から議論されました。
厚生労働省における取り組み
山本氏から、厚生労働省におけるベンチャー支援に向けてさまざまな取り組みが紹介されました。また、AMRに対する抗菌薬の開発におけるインセンティブのあり方については、日本国内だけで考えられるものではなく、世界的な視野をもって各国と協調しながら進めていく必要性が示されました。

創薬促進に関与するアカデミアの課題とその取り組み
土井氏より、創薬促進支援のためのさまざまな枠組みが用意されていることは承知しているものの、どのようにその一歩を踏み出して良いのかわからず、その枠組みにたどりつくまでに苦労することが多いとの課題が示されました。また、基本的な疑問(たとえば、どのレベルまでのデータを用意すべきか等)に答えてくれるサポートを提供してほしいとの要望がありました。
ベンチャー企業支援の枠組みは準備されているものの、研究者がベンチャー企業を立ち上げるまでの支援が不足していることが改めて共有され、研究者を支援する仕組みが必要であることが認識されました。また、製薬協が提案しているアカデミアも参画し得るコンソーシアムの設立により、産業側がもつ医薬品開発に必要な規制や知財への対応等が共有できると、アカデミアの創薬への関与が、よりしやすくなるのではないかと期待を示しました。
フロアからも同様に、研究者がベンチャーを立ち上げることが大変であることに共感し、コンソーシアムの立ち上げに期待する発言がありました。
創薬ベンチャーエコシステムへの期待
抗菌薬の場合は創薬まで至る可能性が低く、資金支援に手を挙げるVCが果たして現れるのか、また、どの程度まで失敗が許容されるのか等、創薬ベンチャー起業の難しさについて問題提起がありました。
伊藤氏より、海外ではVCが中心になって企業を起こす取り組み(CVC)が始まっていることが紹介され、そのようなVCに相談をもち掛ける方法もあると説明されました。また、大きな市場が見込めない、あるいは研究開発が困難であるというテーマについてもAMEDの事業は支援するものであることが改めて表明されました。
俵木氏からは、VCの関係者から出口戦略が見えないプロジェクトには投資しにくいと明言されていたことが紹介され、プル型インセンティブを国として制度化することで出口戦略が明確となり、VCも投資がしやすくなるのではないかとの見解が示されました。さらに、創薬エコシステムに関しては、厚生労働省の相談事業やAMEDのさまざまな相談窓口の開設等、産学官の関係者が一堂に会して、成功事例を紹介する等の情報共有・発信が有益ではないかとの意見がありました。さらに、製薬協はそのような機会を設定することが可能であり、その活動を通してアカデミアの先生方に国の制度を使いやすく知ってもらうことができるのではないかとの期待が示されました。
山本氏からは、製薬企業の研究開発やアカデミアにおける研究に係るコストをどのように投資回収するのか行政としても悩んでいることが紹介されました。1つの方向性として、日本だけではなくグローバルに広く展開し投資回収する等、世界と協調して考えていくことも視野に入れるべきであるという認識が改めて示されました。
アカデミアへの対応ということでは、医療系ベンチャートータルサポート事業(MEDISO)というベンチャーやアカデミアの先生方を支援する事業を展開しており、無料で薬事、知財等の戦略に関するアドバイスを実施しているので活用いただきたいと紹介がありました。
フロアからは、国際医療福祉大学教授で日本化学療法学会理事長の松本哲哉氏より、本シンポジウムでの議論を通じて、産学官連携の取り組みによる解決策が見えてきたこと、そして、日本が国を挙げて国内の製薬産業の研究開発を後押しする施策をいっそう期待したいとの発言がありました。
■総括
東邦大学 医学部 微生物・感染症学講座 教授 舘田 一博 氏
5月にはG7広島サミット2023が開催され、そこではパンデミックとしてCOVID-19とともに、サイレントパンデミックとしてAMR問題も採り上げられると期待しています。2023年のG7で日本がどのようにリーダーシップを発揮していくか、そして感染症対策の方向性がどのように示されるか注視していかなければなりません。
2016年のG7伊勢志摩サミットの際に、第1期のAMR対策アクションプランが出され、そして、2023年の4月に第2期アクションプランが発出されました。そのプランの中では、プル型インセンティブの導入についても触れられています。大変重要な課題であり、英国、スウェーデン、米国でもプル型インセンティブの導入に向けた対応が進んでいることを踏まえ、学会としても、日本におけるインセンティブ制度のあり方について議論するとともに、産学官の連携の中で新たな創薬促進のための仕組みを考えていくことが重要であり、引き続きみなさんとともに検討していきたいと感じました。
最後に
本共催シンポジウム開催にあたり、休日中ご登壇の労を賜りました先生方に改めて感謝を申し上げます。AMRに対する抗菌薬の開発は、産学官が連携して取り組むべき課題です。製薬協は新たな知見も積極的に採り入れながら、今後もAMRの問題解決に向けてさまざまな活動を進めていきます。
(国際委員会 グローバルヘルス部会 感染症グループ AMRアドボカシーTF 薄井 滋、尾崎 昭夫)

