医薬品評価委員会
医薬品開発におけるリアルワールドデータの活用
①外部対照群を用いた承認申請への第一歩
②リアルワールドデータを承認申請へ
③製薬企業におけるRWDの活用促進に向けて
臨床評価部会
2020年5月
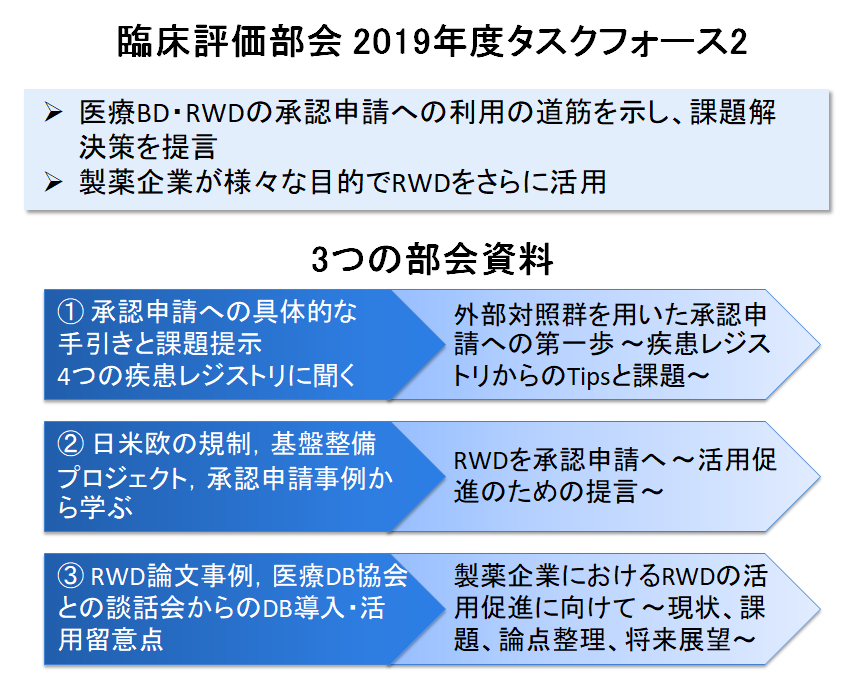
医薬品開発における医療ビッグデータ(BD)およびリアルワールドデータ(RWD)の活用は、製薬企業にとっての効率化だけではなく、無作為化比較試験の実施が困難な希少疾病、難病、小児などの領域で開発が促進され患者さんの新薬へのアクセスが向上する、二次利用データの活用により医療施設側の負担が軽減されるなど、様々な立場でのメリットが期待されます。臨床評価部会2019年度タスクフォース2では、医療BD・RWD活用促進のため、以下の3つの部会資料を作成しましたので、ご活用いただければ幸いです。
① 外部対照群を用いた承認申請への第一歩 — 疾患レジストリからのTipsと課題 — (894KB)
治験の外部対照群としてレジストリのデータを活用する場合を取り上げ、承認申請でやるべきこととその課題をできる限り具体的に提示した。本検討には国内の代表的なレジストリである、SCRUM-Japan、Remudy、難病プラットフォーム、およびC-CATにご協力いただいた。
② リアルワールドデータを承認申請へ — 活用促進のための提言 — (1.6MB)
日欧米各極のRWDに関する規制や基盤整備プロジェクト、ならびに各国でRWDを活用した承認申請事例について調査した結果を紹介する。また、これら調査結果に基づき、国内でRWEを承認申請する際の課題とそれに対する提言をまとめた。
③ 製薬企業におけるRWDの活用促進に向けて — 現状、課題、論点整理、将来展望 — (1.7MB)
製薬企業がRWD導入の検討に際して確認する情報や、より発展的な活用の提案について、リソースやベネフィット、リスクに着目してまとめた。また、一般社団法人医療データベース協会にご協力いただき、DB導入・活用時に製薬企業が留意すべき事項などについて紹介する。