目で見る製薬産業 CDMO利用環境に関する日本の状況
医薬産業政策研究所 主任研究員 吉浦知絵
要約
- 本稿では、Evaluate社のデータベース(CDMO IntelligenceⓇ)を用いて、主要な創薬国に事業所を置くCMDO企業数を調査した。
- 自国内に事業所を置くCDMO企業数は、米国、ドイツ、中国、フランス、イギリス、日本、スイス、韓国の順となり、日本国内に事業所を置くCDMO企業数は他の主要創薬国より少なく、特に外資CDMO企業数が他国より少なかった。
- 前臨床段階、臨床段階のCMC業務受託サービスを提示するCDMO企業数についても同様であり、日本は他国より少なく、特に抗体やADCの受託可能企業数が少なかった。
1.はじめに
医薬品開発においては、臨床、非臨床データの集積とともに、製品の製造に関する技術開発が重要である。近年のモダリティの多様化に伴い、医薬品企業が自社内で製造、技術開発する以外の選択肢として医薬品開発製造受託機関(Contract Development and Manufacturing Organization、以下CDMO)との協業が重要になってきている。昨今議論されることが多い創薬エコシステムの話題においてもCDMOは重要な一要素と位置付けられており、製品開発におけるCDMOの利用環境を他国と比較することで課題感の把握や目標設定の一助となると考えらえる。
今般、Evaluate社よりCDMOの情報を集約したデータベースであるCDMO IntelligenceⓇが発売され利用可能となったことから、日本におけるCDMO利用環境についての解析を試みた。
なお、本稿では各CDMO企業数をベースに解析対象とした国別の状況を図示したが、各企業の製造キャパシティについては未解析であるため、各国の直接的な医薬品製造能力を示すものではない点はご留意いただきたい。
2.調査方法
本稿では、Evaluate社のデータベースであるCDMO IntelligenceⓇから、2025年7月時点で収載されていたCDMO1,183社について本社所在地、事業所所在地や受託サービス等の情報を抽出した1)。3-1では、本社所在地国籍別及び従業員規模別のCDMO企業数を示した。3-2では、主要創薬国として日本、米国、中国、ドイツ、フランス、イギリス、スイス、韓国の8か国に着目し、これらのうちいずれかの国内に事業所を置くCDMO企業数及び従業員規模別のCDMO企業数を示した。3-3以降では、3-2で集計したCDMOについて、各企業が提示する受託サービス別にCDMO企業数を集計した。製造や技術開発などに関するCMC関連業務(以下、CMC業務)のうち、3-3では前臨床段階の品目を対象として受託可能とするCDMO企業数を、3-4では臨床段階の品目を対象として受託可能とするCDMO企業数を集計し、また受託可能とするモダリティ別に集計したCDMO企業数についても合わせて図示した。
3.結果
3-1.本社所在地国籍別CDMO企業数
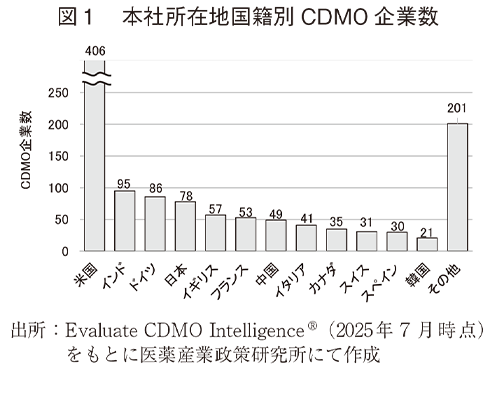
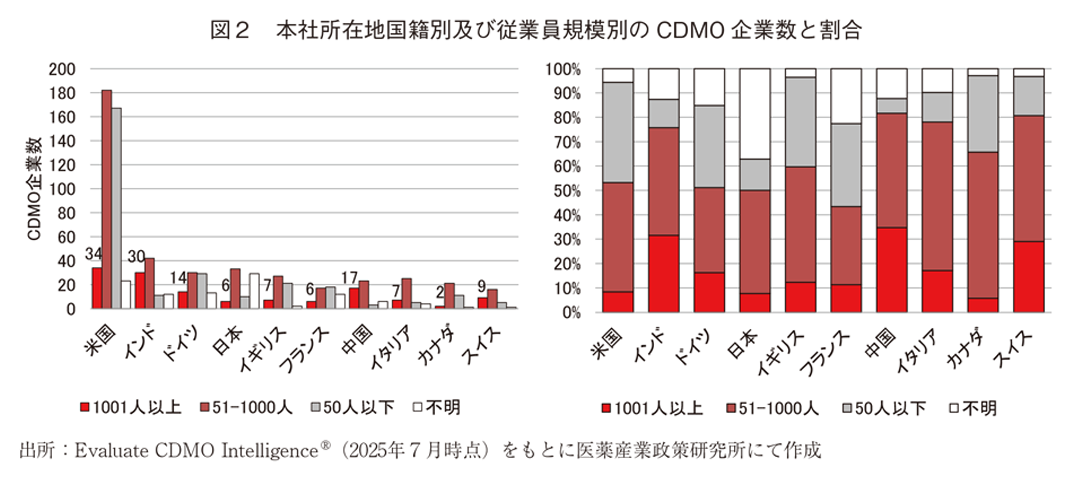
本社所在地国籍の情報が記載されたCDMO1,183社について、本社所在地国籍別CDMO企業数を図1に、従業員規模別のCDMO企業数を図2に示した。図1の本社所在地国籍別CDMO企業数では米国が400社超で最多であり、次いでインド、ドイツ、日本が続いた。また、図1に示した上位12か国に本社を置くCDMO企業数は、CDMO IntelligenceⓇから抽出したCDMO企業数の8割以上を占めていた。続いて、これら12か国について本社所在地国籍別及び従業員規模別CDMO企業数とその割合を図2に示した。米国に本社を置くCDMOのうち半数近くは従業員50人以下の企業であった。ドイツ及びイギリスも同様であり従業員50人以下企業の割合が比較的多かった。一方、従業員1,000人超のCDMOの本社所在地国籍別企業数については米国、インド、中国の順に多く、特にインドと中国では国内CDMO企業数の3割以上を従業員1,000人超の大型企業が占めていた。
3-2.主要創薬国に事業所を置くCDMO企業数
CDMO IntelligenceⓇに収載される各事業所所在地データによると、主要な創薬国の複数に事業所を持つ国際展開の進んだCDMOが多く見られた。また、本社を米国に置く日系企業や中国系企業も確認された。このため、3-1で示した本社所在地国籍別のCDMO企業数がすなわち当該国内におけるCDMOの利用しやすさには直結しないと考えた。製品及び治験薬の製造や技術開発業務のCDMOへの委託を考える際に、国内に事業所があるCDMOであれば技術面を中心により綿密なコミュニケーションをとれる委託先として検討できると考え、3-1で示した本社所在地国籍別とは別に、主要な創薬国内に事業所を置くCDMO企業数を国別にカウントした。
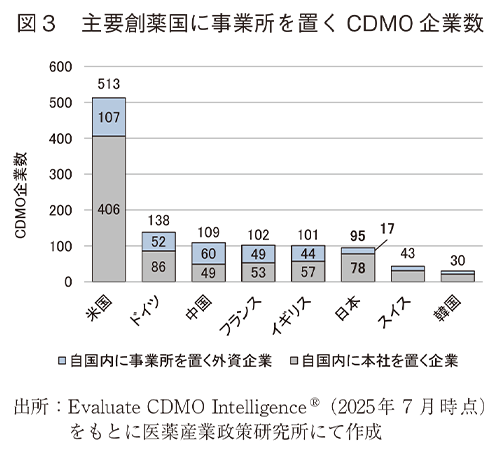
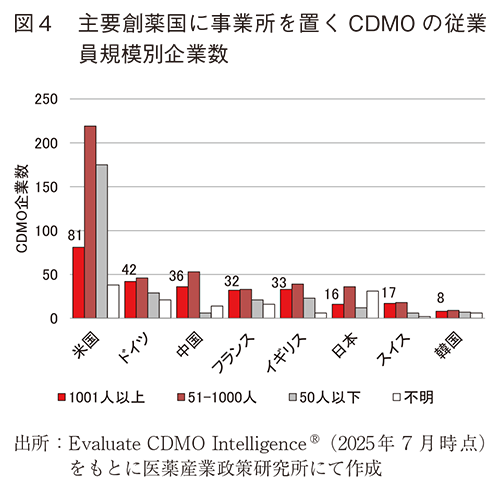
図3では主要な創薬国8か国のいずれか国内に事業所を置くCDMO企業数のうち、自国内に本社を置く企業と、自国内に本社以外の事業所を置く外資企業(本社所在地は自国外)を分けて図示した。図4では、従業員規模別のCDMO企業数を示した。その結果、自国内に事業所を置くCDMO企業数の多い主要創薬国は、米国、ドイツ、中国、フランス、イギリス、日本、スイス、韓国の順となり、日本国内に事業所を置くCDMO企業数は他の主要創薬国より少なく、特に外資CDMO企業数が他国より少なかった。従業員規模別では、米国、ドイツ、中国、フランス、イギリスに事業所を置く従業員1,000人超の大型CDMOが30社以上であるのに対し、日本は16社であった。
3-3.前臨床段階の製造、技術開発研究等業務を受託するCDMO企業数
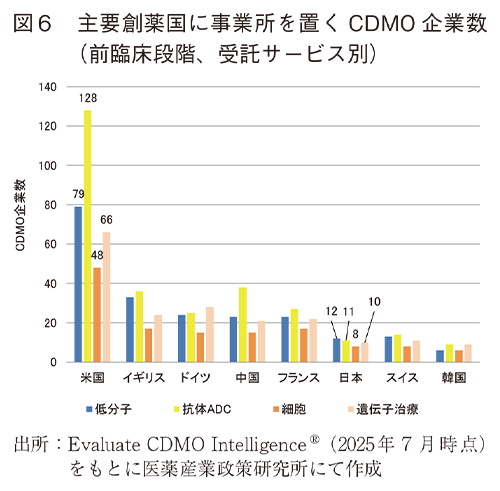
CDMO IntelligenceⓇにはCDMO各社の公開情報をもとに受託サービスについて情報が記載されており、さらにその情報をもとに開発段階別、モダリティ別のフラグが付与されている。3-2で示した主要創薬国のいずれかに事業所を置くCDMOについて、その受託サービスの特徴について概況するため、ここでは前臨床段階の品目を対象としたCMC業務を受託サービスとして提示するCDMO企業数を各国別に図5に示し、モダリティ別に集計したCDMO企業数を図6に示した2)。また、米国のCDMO企業数に対する各国企業数の割合を図7に示した。
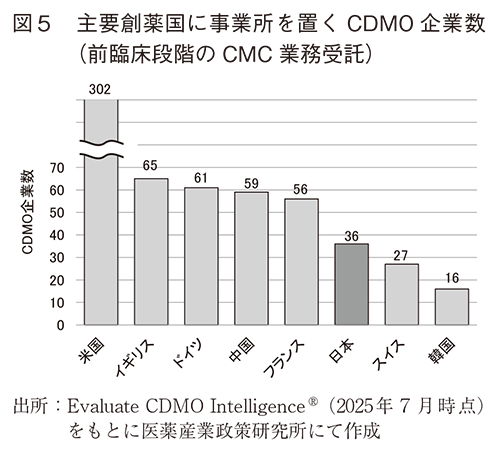
その結果、前臨床段階のCMC業務を受託する国別のCDMO企業数は、米国に次いでイギリス、ドイツ、中国、フランスと続き、日本はこれらの国より20社ほど少なかった。受託可能なモダリティについて低分子、抗体またはADC、細胞医薬品、遺伝子治療をカウントしたところ、日本はいずれも10社程度であった。圧倒的に企業数の多い米国に対する割合で見ると、日本国内で低分子と細胞医薬品、遺伝子治療関連を受託する企業数は米国に対してそれぞれ15%程度あったが、抗体またはADCは10%以下(8.6%)であった。

3-4.臨床段階の治験薬製造等業務を受託するCDMO企業数
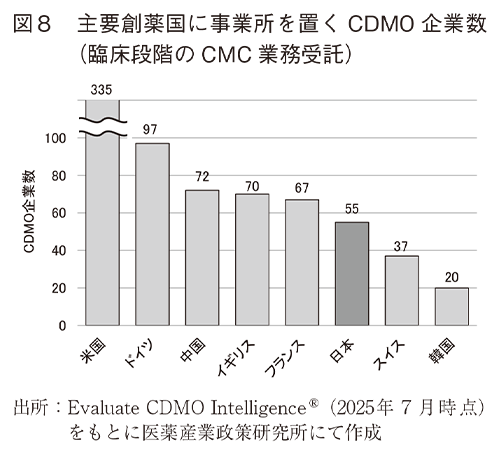
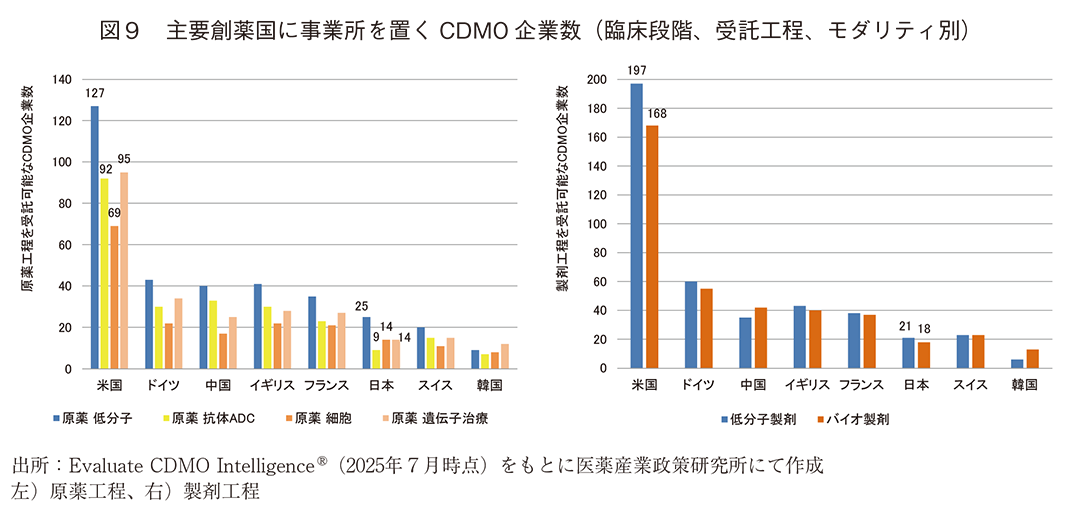
次に、主要創薬国に事業所を置くCDMOのうち、臨床段階の品目を対象とした治験薬製造等のCMC業務を受託サービスとして提示するCDMO企業数を図8に、原薬/製剤工程別、モダリティ別の企業数を図9に示した3)。米国のCDMO企業数に対する各国企業数の割合を図10に示した。
その結果、臨床段階のCMC業務を受託サービスとして提示するCDMO企業数は、多い順に米国、ドイツ、中国、イギリス、フランス、次いで日本となった。米国内のCDMO企業数に対する割合で見た場合、日本国内に事業所を置くCDMOのうち低分子原薬製造及び細胞原薬製造を受託する企業数は20%程度ある一方、低分子医薬品とバイオ医薬品の製剤工程や抗体またはADCの原薬製造を受託するCDMO企業数は米国の10%程度であった。

4.まとめ、考察
本稿では、Evaluate社のデータベース(CDMOIntelligenceⓇ)を用いて各国のCDMO企業数と各企業が提示する受託サービスを図示し、日本と他の主要な創薬国におけるCDMOの利用環境について考察を試みた。冒頭で言及したとおりCDMO企業数が直接的な製造能力を示すわけではないため、各国の製造能力については本稿では議論しない。一方、製造や技術開発を委託する側の立場では、CDMO企業数が多いほど委託先を検討する際の選択肢が多くなることから、本稿では企業数をベースに分析、考察した。
3-1で示したとおり、本社国籍別のCDMO企業数は米国が最多であった。中には米国に本社を置く他国由来の企業も見られ、創薬の中心地は米国であるという状況がCDMO企業数からもみられた。
3-2では、主要な創薬国として米国、ドイツ、中国、フランス、イギリス、日本、スイス、韓国の8か国について自国内に事業所を置くCDMO企業数を国別にカウントしたところ、日本は6番手であり欧米各国や中国より少なかった。本稿では各CDMOのもつ各製造施設の立地条件については考慮しておらず、また通常は外国のCDMOへのCMC業務委託も一般的である。このため本稿の集計結果が直接的に良し悪しを示すものではないが、自国内に事業所を持つCDMOが相手であれば細やかな相談がしやすいなど、自社内に製造関連リソースを持たない企業による医薬品開発や、新規モダリティに初めて参入するような医薬品開発において有利な点は多いと考えられるため、国別でのCDMO利用環境を比較する指標になると考えた。3-2の結果からは米国が圧倒的に有利であると考えられた。米国と同水準にすることは難しいとしても、日本の創薬力向上のためには米国以外の競合国以上にCDMO企業数を増やすような投資がなされるよう期待したい。また図3に示したとおり、日本では外資CDMO企業数が他国と比較して少なかった。従業員1,000人超の大型CDMOの本社国籍所在地は図2のとおり米国、インド、中国に集中していたが、各国に事業所を置くCDMO企業数としてはドイツ、フランス、イギリスなど欧州の主要な創薬国で30社以上となり、大規模CDMOがこれらの国に事業参入していた。日本に事業所を置く大規模CDMO企業数は16社であったが、うち6社は本社を日本に置く企業であり、外資企業の参入は現状少ない。外資CDMOの窓口拠点だけでも日本国内に誘致できれば、外国の製造拠点へのアクセスも向上すると考えられるため、外資企業の誘致も有用と考えられる。
3-3および3-4では各企業が提示する受託サービス別のCDMO企業数を示した。製造関連の技術開発研究や治験薬製造といった前臨床段階および臨床段階のCMC業務受託について、日本国内に事業所を持つCDMO企業数は他の主要創薬国に劣り、特に前臨床段階のCMC業務をサービスとして提供している企業は少なかった。前臨床段階では米国についでイギリスが多く、これらの国々の創薬ベンチャーの活躍への寄与が示唆された。さらに抗体やADCについては前臨床段階の業務を受託する企業が日本国内には相対的に少なく、日本におけるCDMO利用環境の課題点と言えるだろう。
臨床段階のCMC業務受託企業については前臨床段階に比べて主要創薬国との企業数の差は小さいものの、日本国内に事業所を置くCDMOは55社と少なかった。特に製剤工程を受託する企業や、抗体またはADC原薬のCMC業務を受託するCDMOが相対的に少なく、米国の10%程度であった。ドイツ、中国、イギリスには抗体またはADC原薬のCMC業務を受託するCDMOとして30社以上が事業所を置いているが、ドイツ、中国、イギリスに本社を置く企業としても各国10社程度あった。これらの国々と比較しても、抗体またはADC原薬については、この分野に対する日本全体としての支援が特に必要であると考えられる。
CDMO委託を検討する際は、必要な設備の有無、製造スケールが適切であること、必要な時期に製造できること、品質担保の能力ほか様々な要素を勘案する必要があり、一方で各CDMOの提供するサービスは各社各様であることから、委託先選定にあたって選択肢は多い方が望ましい。本稿の分析で日本国内に事業所を置くCDMO企業数が他国より少ないことがわかり、自社に製造設備を持たない場合は海外CDMOへの委託を検討せざるを得ない状況が主要な創薬競合国より多いと考えられた。新規モダリティへの参入時や、ベンチャー企業などでCMC開発に関する設備や人材などのリソースが十分揃わないケースでは、製品開発を進める際の通常の課題に加えて海外企業への業務委託に伴う課題が追加されることになり、医薬品開発全体の計画遅延につながるなど日本は不利な環境にあると言えるのではないか。創薬エコシステムの一環として、CDMOの利用環境の補強が強く望まれる。
5.おわりに
本稿ではCDMO企業数をもとに、CMC業務委託先となるCDMOの利用環境について考察した。その結果、日本国内に存在するCDMO企業数は他の主要な創薬国と比較して少なく、特に抗体またはADCに関わるサービスを提供する企業数が主要創薬国と比較して少なかった。バイオ人材の育成など課題認識とその対応は着々と進められているところではあるが、本稿でも改めて現状を示すことができたと考えており、今後の動向に注視したい。
-
1)本稿の分析にはCDMO Intelligence Ⓡ内の以下のパラメータを用いた。本社所在地国籍:HQ Country、従業員規模:Company Size(Employees)、前臨床段階または臨床段階の受託可否:Development Phase Focus、モダリティ別:Product Modality/Technology、原薬工程、製造工程の受託サービス区分:Service Offered Level 1
-
2)3-3では、CDMO Intelligence Ⓡ内の以下のパラメータを用いた。-“Development Phase Focus”:Preclinical-モダリティの分類は“Product Modality/Technology”に記載されたフラグのうち下記のとおり抽出し、集計した。Small Molecule:低分子、Antibody Drug Conjugate(ADC), Bispecific Antibody, Fusion Antibody, MonoclonalAntibody, Recombinant Antibody:抗体ADC(抗体またはADC)、Cell Therapy:細胞(細胞医薬品)、Gene Therapy,Genome Editing, Viral Vector:遺伝子治療
-
3)3-4では、CDMO Intelligence Ⓡ内で付与されたフラグのうち以下を集約して図示した。-“Development Phase Focus”:Clinical-モダリティの分類は3-3と同様。-“Service Offered Level 1”に記載されたフラグを抽出し、下記のとおり分類した。Manufacturing - Chemical API:低分子原薬、Manufacturing - Chemical Drug Product:低分子製剤Manufacturing - Biologics API:別途抽出したモダリティの分類に従い、原薬 抗体ADC、原薬 細胞、原薬 遺伝子治療 を抽出した、Manufacturing - Biologics Drug Product:バイオ製剤

