目で見る製薬産業 日米欧の新薬承認状況の比較(2024年)
医薬産業政策研究所 主任研究員 富樫満里子
要約
- 2024年に日米欧で承認された新医薬品の承認品目数、薬事上特別措置件数及び審査期間について調査した。
- 2024年の国内の全承認品目数は153品目、NME数が63品目であった。米国では全承認品目数が107品目、NME数が49品目であった。欧州では全承認品目数が161品目、NME数が37品目であった。
- 日本で承認されたNME63品目中、優先審査(希少疾病用医薬品を含む)は20品目、希少疾病用医薬品は18品目、迅速審査(優先審査を除く)3品目と2023年と比較して増加に転じた。
- 日本の審査期間の中央値は全承認品目で9.9か月、NMEで10.0か月であり、欧米と比較して最小であった。
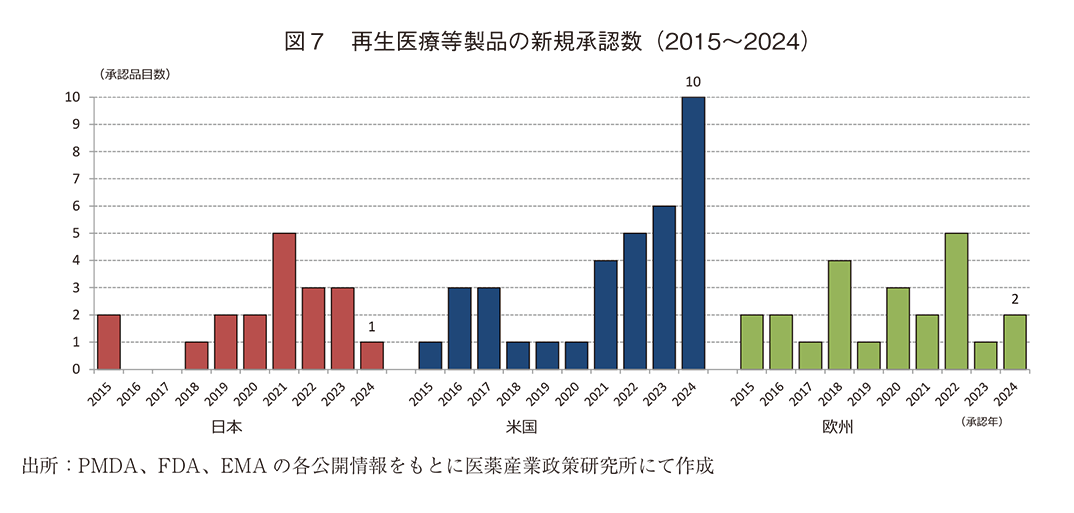
- 2024年に新規に承認された再生医療等製品の数は日本1品目、米国10品目、欧州2品目であり米国の承認数が突出していた。
1.はじめに
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U. S. Food andDrug Administration(FDA)及びEuropean MedicinesAgency(EMA)がホームページ等で公表する情報をもとに継続的に収集、分析している1)。政策研ニュース第68号2)では2022年に日本で承認された医薬品情報に関する分析結果を、政策研ニュース第70号3)では2022年の承認実績を中心に日米欧の新薬承認状況と審査期間の比較分析結果を、政策研ニュース第73号4)では2023年に日本、米国、及び欧州で承認された新薬の承認数、薬事上特別措置件数及び審査期間を報告した。本稿では、継続調査として2024年の日米欧の新薬承認状況について報告する。
2.調査方法
日本の調査対象はPMDAホームページの「新医薬品の承認品目一覧」5)に掲載されている医薬品とし、品目数は審査報告書毎にカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。日本承認品目におけるNew Molecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。各品目の承認情報は、審査報告書、添付文書、「新医薬品の承認品目一覧」及び薬務公報から抽出した。申請日は審査報告書に記載される申請日とし、承認日は「新医薬品の承認品目一覧」に記載された承認日とした。
米国の調査対象は、FDAホームページの「CDER Drug and Biologic Approvals for Calendar Year」6)に掲載されているNew Drug Application(NDA)及びBiologic License Application(BLA)に該当する医薬品とした。NMEの集計は、「CDER New Molecular Entity(NME) and Original Biologic Approvals Calendar Year」7)に掲載されている医薬品を対象とした。各品目の承認情報は、FDAホームページ内の各品目情報から抽出した。申請日は各品目のApproval Letterに記載された申請書提出の日付とし、承認日は各品目情報に記載されたApproval Dateとした。
欧州の調査対象は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」8)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。各品目の承認情報は、EMAホームページ内の各品目情報から抽出した。申請日は各品目のAssessment Reportに記載された申請書提出の日付とし、承認日は各品目情報に記載されたMarketing authorization issuedの日付とした。
薬事上の特別措置として、日本では優先審査、希少疾病用医薬品、先駆的医薬品指定制度(先駆け審査指定制度)、条件付き承認制度、迅速審査を、米国ではPriority Review、Orphan、Fast Track、Breakthrough Therapy、Accelerated Approvalを、欧州ではAccelerated Assessment、Orphan、Priority Medicine(PRIME)、Conditional Approval、Exceptional Circumstancesを対象に集計した。
審査期間については、標準的な統計解析ソフトStata/IC 14.2 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、申請日から承認日までの期間を“審査期間”として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
本稿における日本及び米国の承認数の集計対象は上記のとおりであり、再生医療等製品については対象外である。一方で欧州の集計対象には再生医療等製品に相当する品目も含まれる。再生医療等製品の承認数の推移を見るため、新規に承認された再生医療等製品数については以下を対象に別途集計した。日本は、PMDAホームページの「新再生医療等製品の承認品目一覧」9)に掲載されている品目のうち承認・一変別が「承認(条件及び期限付承認を含む)」または「新規」として記載された品目を対象とした。米国は、FDAホームページの「Approved Cellular and Gene Therapy Products」10)に掲載されている品目を対象として初回の承認を受けた年を承認年として集計した。欧州は、ATMP(Advanced therapy medicinal products)指定11)を受けて承認された品目に加え、日米の上記集計に該当する品目を対象とした。
3.結果
(1)国内新医薬品の承認品目数とその内訳
① 新医薬品の承認品目数とその内訳(承認年毎;2015~2024年)
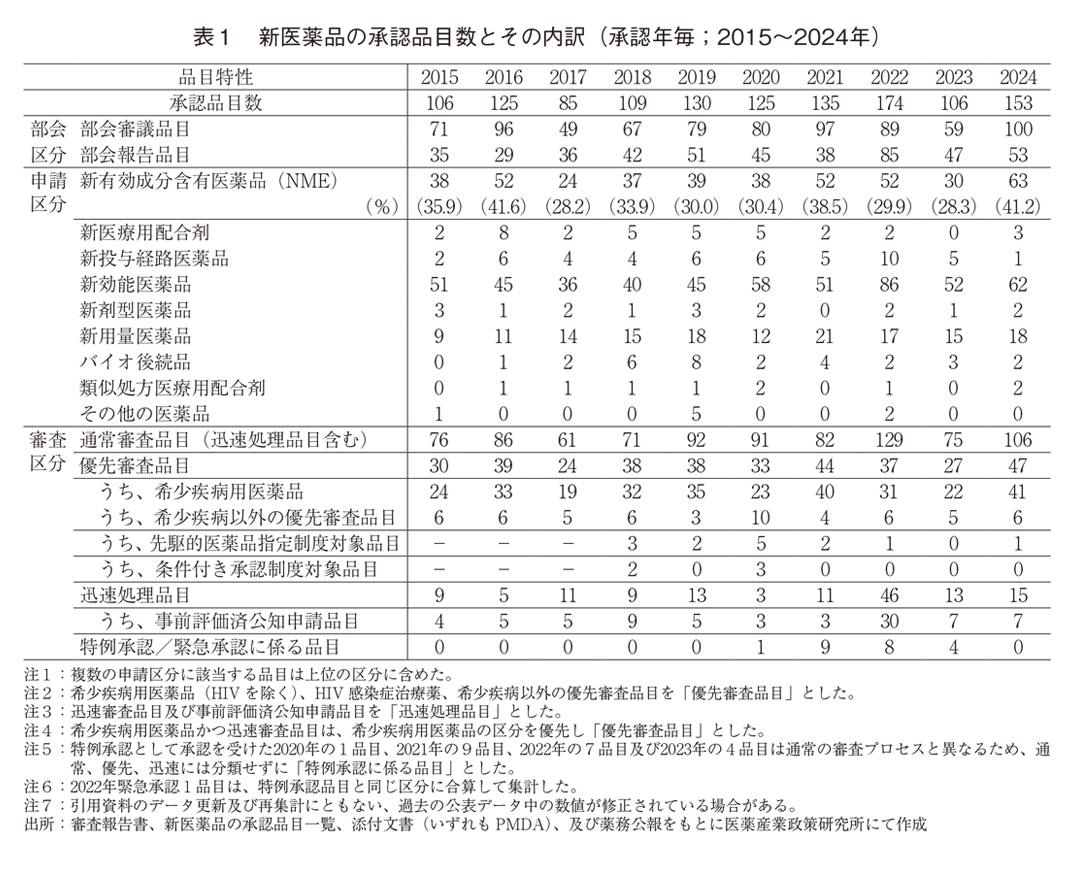
2015~2024年の間に日本で承認された新医薬品の承認品目数の年次推移、及び品目の内訳を表1に示した。2024年には153品目が承認され、そのうち新有効成分含有医薬品は63品目と過去最高値であった。
新有効成分含有医薬品以外の申請区分別の内訳では、新効能医薬品が62品目、新用量医薬品が18品目、新医療用配合剤が3品目、新剤形医薬品、バイオ後続品及び類似処方医療用配合剤がそれぞれ2品目、新投与経路医薬品が1品目であった。
審査区分別の内訳では、通常審査品目が106品目、優先審査品目は47品目であった。優先審査品目のうち、希少疾病用医薬品は41品目で大半を占め、2022年、2023年は減少が認められていたが、2024年は増加に転じ、これまでの集計期間内で最多の承認数であった2021年の40品目を超えた。先駆的医薬品指定制度対象品目は1品目で、2019年に「再発又は難治性の抹消T細胞リンパ腫」を予定される効能・効果として先駆け審査指定制度の対象品目となっていたバレメトスタットトシル酸塩:エザルミア錠50mg、同錠100mgに対する再発又は難治性の末梢性T細胞リンパ腫を効能・効果とする追加適応の承認であった。条件付き承認制度対象品目の承認数は0品目であった。迅速処理品目の承認数は15品目あり、このうち事前評価済み公知申請品目数は7品目であった。2024年の特例承認及び緊急承認数は0品目であった。
② 希少疾病用医薬品の承認品目数とその内訳(承認年毎;2015~2024年)
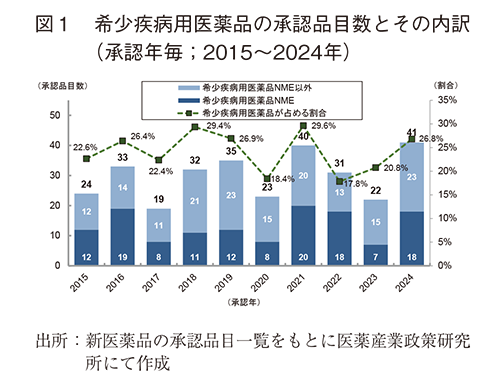
2015~2024年の間に日本で承認された新医薬品のうち、希少疾病用医薬品の承認品目数の年次推移を図1に示した。希少疾病用医薬品の2024年承認品目数は41品目(うちNME18品目)であり過去最高値であった。集計期間における割合は17.8%~29.6%の範囲で増減しており、NMEとそれ以外の割合に一定の偏りや傾向は認められなかった。
③ 薬効分類別承認品目の割合
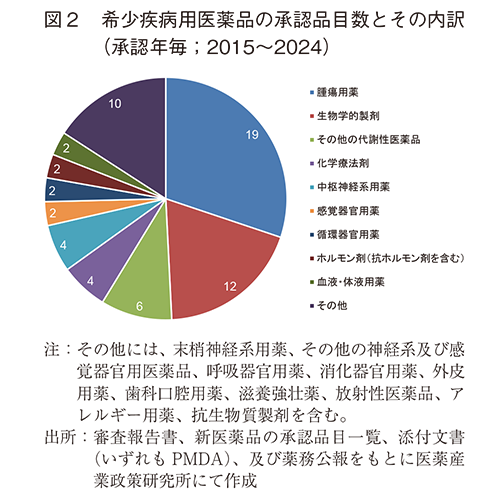
2024年に日本で承認された新医薬品の薬効分類別の承認品目数を図2に示した。腫瘍用薬が最も多く19品目(30.2%)を占め、次に生物学的製剤12品目(19.0%)であった。そして、その他の代謝性医薬品6件(9.5%)、化学療法剤及び中枢神経系用剤がそれぞれ4件(6.3%)と続いた。
(2) 新医薬品の承認品目数の日米欧比較
① 日米欧の承認品目数
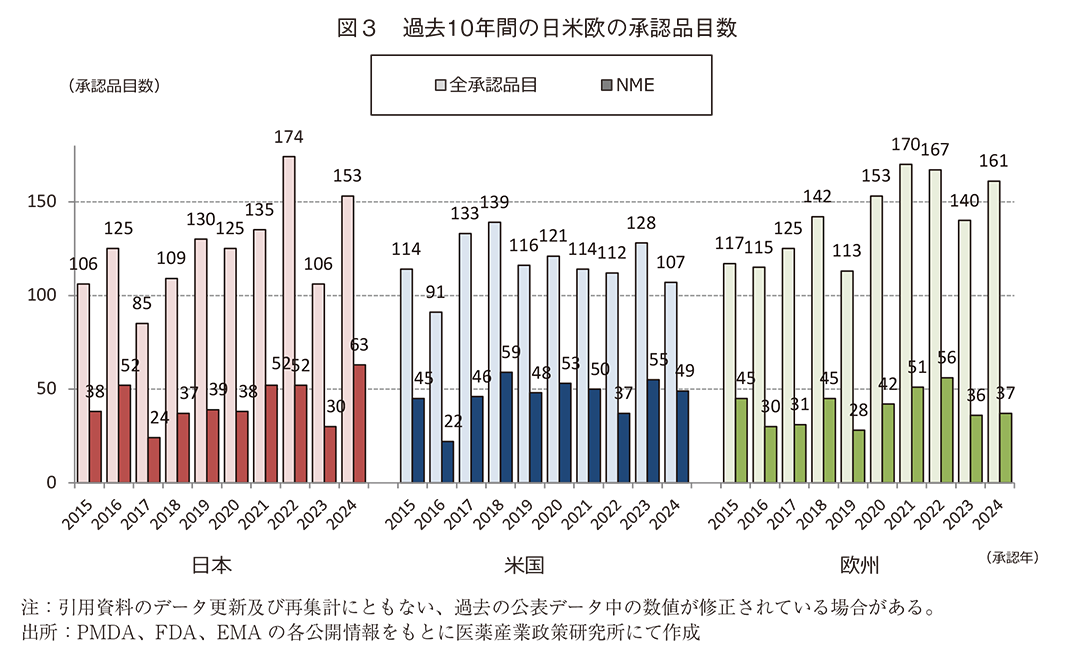
過去10年間(2015~2024年)の日本、米国、及び欧州で承認された新医薬品の承認品目数を図3に示した。日本における承認品目数は⑴国内新医薬品の承認品目数とその内訳で示した通りである。米国では2024年に107品目が承認され、そのうちNMEは49品目であった。欧州では161品目が承認され、そのうちNMEは37品目であった。米国の2024年のNME数は2023年に比べて6品目減少し、全承認品目数も減少したが、日欧では2023年に比べてNMEがそれぞれ33品目、1品目増加し、全承認品目数も増加した。
② 薬事上の特別措置を受けたNME承認品目数
日米欧で過去5年間(2020~2024年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数を図4に示した。
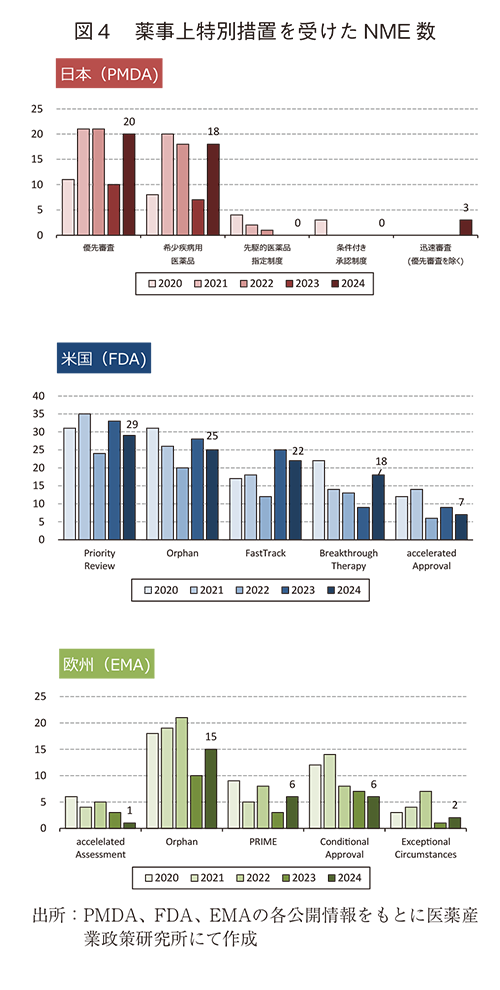
2024年に日本で承認されたNME63品目中、優先審査(希少疾病用医薬品を含む)は20品目(31.7%)、希少疾病用医薬品は18品目(28.6%)と2024年のNME数は2023年より増加したことに連動してか、優先審査、希少疾病用医薬品に該当するNME数も2023年と比較して増加に転じた。過去4年間0品目であった迅速審査(優先審査を除く)も3品目認められた。
米国では、2024年に承認されたNME49品目中、Priority reviewは29品目(59.2%)、Orphan指定品目は25品目(51.0%)、Fast Track指定品目は22品目(44.9%)、Breakthrough Therapy指定品目は18品目(36.7%)、Accelerated Approvalは7品目(14.3%)であった。2024年の米国NME数は2023年より減少し、薬事上特別措置を受けたNME数もほとんどの措置で減少が認められたが、Breakthrough Therapyは2023年より増加が認められた。
欧州については、2024年に承認されたNME37品目中、Accelerated Assessmentは1品目(2.7%)、Orphan指定品目は15品目(40.5%)、PRIME指定品目は6品目(16.2%)、Conditional Approvalは6品目(16.2%)、Exceptional Circumstancesは2品目(5.4%)であった。欧州の2024年NME数は2023年から1品目のみの増加であったが、薬事上特別措置を受けたNME数はOrphan指定品目、PRIME及びExceptional Circumstances指定品目で増加が認められ、Accelerated Assessment及びConditional Approvalでは減少が認められた。
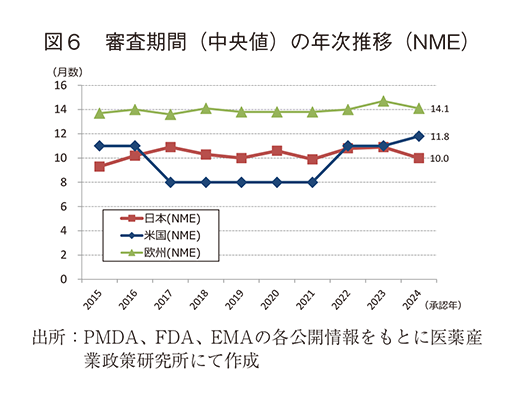
③ 審査期間の中央値の年次推移
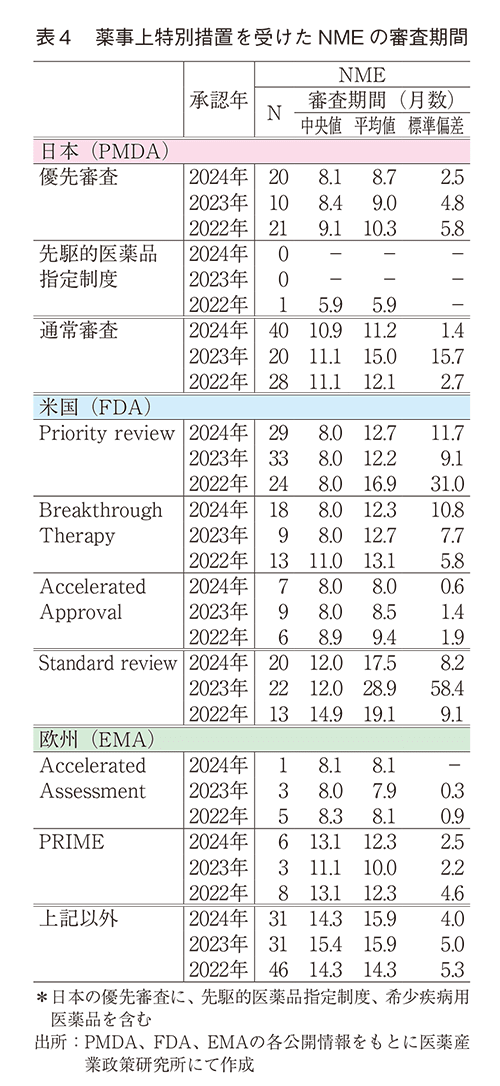
過去10年間(2015~2024年)の日本、米国、及び欧州で承認された医薬品の承認年毎の審査期間、中央値、平均値、標準偏差を表2に、NMEの審査期間、中央値、平均値、標準偏差を表3に、それぞれの審査期間中央値の年次推移を図5、図6に示した。NMEのうち審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆的医薬品指定制度、米国:Priority review、Breakthrough Therapy、欧州:Accelerated Assess-ment、PRIME)を受けた品目の審査期間については表4に示した。
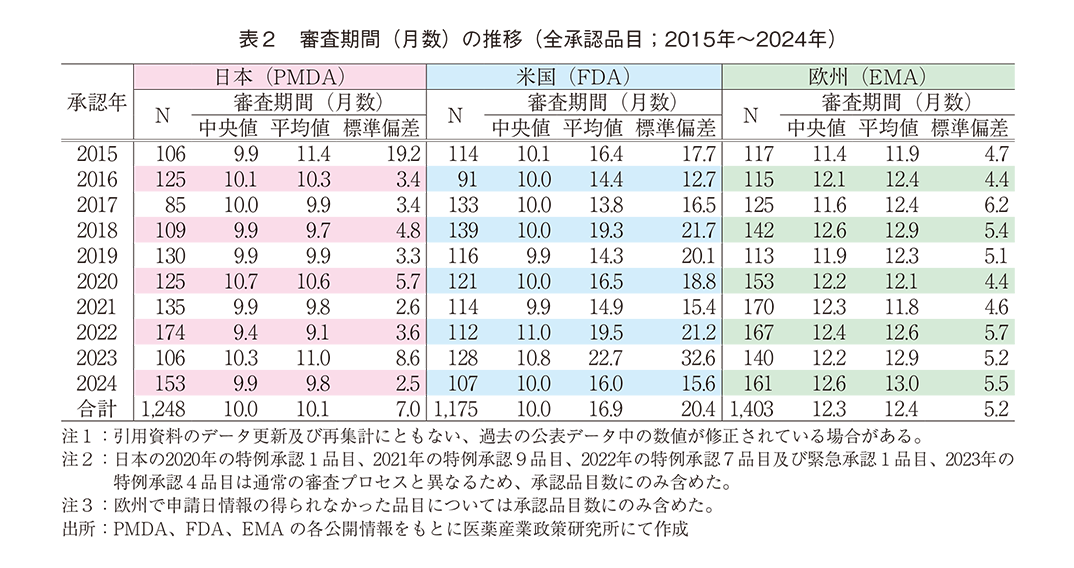

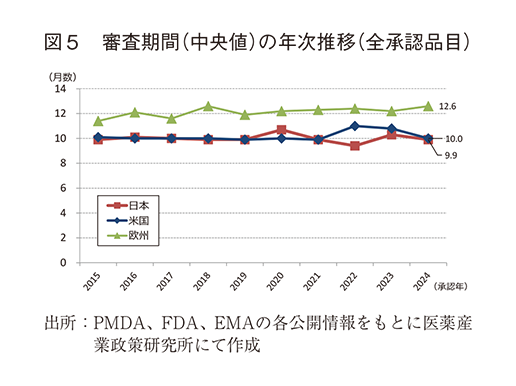
調査対象の全期間における審査期間の中央値は、日本10.0か月、米国10.0か月、欧州12.3か月であった。2024年は日本9.9か月、米国10.0か月、欧州12.6か月であり、さらに平均値で見ると日本9.8か月、米国16.0か月、欧州13.0か月と日本が最小値を示し、標準偏差が小さく安定的な審査期間となっていた(表2)。年次推移では図5のとおり調査期間内に大きな変動はなく、日本における審査期間の中央値は概ね10か月程度で、米国と同等の期間で維持されていた。
NMEについて調査対象の全期間における審査期間の中央値は、日本10.2か月、米国9.9か月、欧州14.0か月であった。2024年の審査期間の中央値は、日本10.0か月、米国11.8か月、欧州14.1か月であり、平均値では日本10.2か月、米国14.7か月、欧州15.3か月とNMEについても値は日本が最小で標準偏差が小さく安定的な審査期間を示し、全承認品目とNMEでほぼ差がない数値であった(表3)。年次推移では図6のとおり日米欧ともに調査期間内に大きな変動はないといえるが、直近3年間の日本の審査期間は米国よりも短い数値を示した。
表4のとおり、日本での2024年の優先審査品目におけるNME承認数は20品目と2023年より増加した。審査期間の中央値、平均値はそれぞれ8.1か月、8.7か月であり、どちらも直近3年間で最も短い数値であり着実な短縮が認められた。また、審査期間の標準偏差が非常に小さく安定していた。先駆的医薬品指定制度指定品目のNME承認は直近2年間で存在しなかった。米国での2024年のPriority review指定品目のNME承認数は29品目で2023年から減少した。審査期間(中央値)は8.0か月と直近3年で変化なく維持されていた。Breakthrough Therapy指定品目は18品目、Accelerated Approval指定品目は7品目で、審査期間(中央値)はどちらも8.0か月とPriority reviewと同様の数値であった。欧州では、2024年のAccelerated Assessment指定品目は1品目で審査期間(中央値)は8.1か月と、指定を受けていない品目と比較して約6か月短かった。また、PRIMEの指定品目は6品目で、審査期間(中央値)は13.1か月であった。薬事上の特別措置を受けた品目の審査期間は、通常審査品目と比較して顕著に短縮していた。
(3) 再生医療等製品の承認数の日米欧比較
日本、米国、及び欧州で承認された再生医療等製品に相当する製品の新規承認数(2015~2024年)を図7に示した。日本では2024年に新規承認を得た品目は1品目、サンバイオのアクーゴ脳内移植用注(外傷性脳損傷)で、日米欧比較において日本が先行して承認国となった品目であり、条件及び期限付承認の適用を受けている。また、欧州では2品目が承認を受けたが、米国で既に承認を受けている品目であった。米国では2024年に新たに10品目の承認を受け新規承認数は突出していた。このうち1品目は日本で、2品目は欧州で既に承認を受けており、他7品目は米国で先行して承認を取得した品目であった。
近年は日米欧いずれの国においても新規に承認を受けた品目数が増加している傾向が認められていたが、2024年は日本、欧州における明確な増加は認められず、一方で米国では昨年の過去最多承認数を大きく超える増加が認められた。
4.まとめ・考察
本稿では、日本、米国、及び欧州で2024年に承認された新医薬品の承認品目数、薬事上特別措置件数及び審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。
日本の2024年の承認品目数は、全承認品目数とNME数のいずれも過去10年間で最多であった2022年の数値と比較して全承認品目数としては下回ったものの、NME数としては過去最多の数値(63品目)となった。希少疾病用医薬品の承認数も過去最高値(41品目、うちNME18品目)を示した。政策研ニュース第75号の報告では小児適応に対する新医薬品の国内承認件数も2024年に大きく増加していることが確認12)され、医薬品開発中の小児用医薬品開発計画策定の義務化や小児・希少疾病などに対する薬価加算適用等の新たな審査、薬価制度等各種対応による効果が追い風となる可能性も考えられ、今後の推移に注目したい。
日本におけるNME品目の薬効分類を見ると、腫瘍用薬19品目(30.2%)が突出して多かった。がんは依然として日本における主要な死因となっており13)、アンメット・メディカル・ニーズの高さが窺われる。また、患者特性に合わせた治療薬が多くみられ、近年の個別化医療の進展による影響が反映されたものと考えられた。次に生物学的製剤12品目(19.0%)が多く、うち8品目がワクチンであり、COVID-19パンデミック以降、様々な感染症、あるいは予防医療への関心の高まりが見て取れる。
米国、欧州の承認数については、欧州は昨年から1品目の増加が見られたが、米国については全承認品目数、NME数のいずれも2023年を下回った。薬事上の特別措置を受けたNME数についても、NMEの全体数の推移と同様に日本と欧州では2023年に比較して全体数は増加し、米国では減少した。日本においては、優先審査(希少疾病用医薬品を含む)に該当するNME承認数は20品目あったものの、迅速審査が3品目、先駆的医薬品指定制度及び条件付き承認制度は昨年度に続きいずれも0品目であった。特別措置を受けている品目の割合から、米国では指定の割合が大きく、また、欧州では幅広い制度が活用されていることが分かる。日本においても欧米に匹敵する各種特別措置が設計、施行されている一方で、指定数からは十分な制度の活用がなされていないといえる。
審査期間については、全承認品目とNMEのいずれも平年並みであり、各極ともに10~15か月であった。本稿で分析した審査期間は申請資料提出日から承認日までとしており、日米欧の各当局から発行される各種レポートにおける審査期間とは一部異なり、当局からの照会事項に対応する時間も含めて審査期間としている。本稿の分析において2024年の日本の審査期間の標準偏差は非常に小さく、審査期間の中央値は日米欧で最小であった。世界初承認を受ける事例が多い米国では申請から承認までの期間が長くなる可能性があるが、2~3番手に申請する事例が多い欧州と日本の比較でも日本の審査期間の方が短かった。薬事上特別措置を受けたNME品目の審査期間を見ると、日本の優先審査品目の審査期間は欧米における特別措置品目に対する期間と同等のレベルに短縮された(約8か月)といえる。一方で、日本の通常審査品目の審査期間についても優先審査品目との差は2~3か月程度であり、欧米の通常審査品目の審査期間との比較では1~3か月程度短い期間で承認されていた。また、2024年のNME数が調査期間である過去10年間で最多となっているにも関わらず、審査期間を延ばす方向への影響は見られなかった。これらのことから、日本では特別措置品目に対しては欧米と同等以上に審査期間が短くなってきており、加えて通常審査においても欧米以上の短期間、そして安定的に当局の設定する目標期間14)内に審査完了が見込めるという点は、新薬上市に向けた開発タイムライン上の予見性も高まることから、日本の審査制度の優れた点であると言える。
2024年に新規に承認された再生医療等製品数は、米国で10品目と急激な増加が認められた。一方、日本は1品目、欧州は2品目となっており日本での開発の遅れが懸念される。再生医療等製品となることが見込まれる加工細胞等に係る治験を実施しようとする場合、その計画を届け出なければならないことが規定されており15)、この届出の年次推移を図8に示す。

この推移からは、治験計画届出数は順調に増加傾向が認められると言えるが、一方で治験中止届や開発中止届出数も2021~2022年頃より増加している状況が見られる。この傾向の意味するところは推測の域を出ないが、日本における再生医療等製品開発の厳しさを示唆するものと言える。再生医療等製品特有の各種課題解決に向けた対策が進められることを期待する。
日本で2024年に承認された品目は、再生医療等製品における条件及び期限付承認の適用品目であり、これまでに条件及び期限付承認が適用された製品は累計5品目となった。再生医療等製品に対する条件及び期限付承認制度は、治療を待つ患者に製品を早期に届けることを目的として設立された承認制度16)であり、安全性が確認され、有効性が「推定」される再生医療等製品に対して、市販後調査等の一定の条件と原則7年以内の期限を付けて承認が与えられるものである。製造販売後調査等の結果に基づき、期限内に改めて申請をすることで製造販売後承認条件評価が行われることが前提となっている。2024年には本制度適用品目のうち2品目において承認の取り下げが認められた。両品目ともに期限を迎えた時点で正式な承認申請が行われたが、1品目は、市販後調査において国内第III相臨床試験成績を再現できなかったこと17)により承認を取り下げており、もう1品目は、使用成績調査等の結果を再生医療等製品・生物由来技術部会で審議した結果、条件及び期限付承認時に設定した達成基準を満たさず、正式に承認することは適切ではないと判断され18、19)承認取り下げに至った。これらの事例は、「条件及び期限付承認制度」が適切に機能していることを示す一方で、革新的技術の社会実装における症例収集、調査設計、有効性検証、医療現場等への説明責任、保険収載など複数の現実的な課題を浮き彫りにした。この事例を受けて厚生労働省は、条件及び期限付承認制度の適用に係る予見性を高め、再生医療等製品の更なる開発の促進に資することを目的として、「再生医療等製品にかかる条件及び期限付承認並びにその後の有効性評価計画策定に関するガイダンス」を発出20)し、保険適用の在り方についても、次期診療報酬改定に向けて、議論を深める方向性を示している21)。
この経験は、有効性検証の重要性を再認識させるとともに、今後の開発・承認プロセスにおける倫理的配慮や情報公開の在り方を再考する上で、重要な示唆を与えるものである。しかしながら、本事例をもって日本における特別措置の活用を回避する理由とすべきではなく、むしろ得られた教訓を踏まえた制度設計や運用への適切な反映が求められる。すなわち、こうした革新的医療の早期提供と社会的信頼の確保の両立を可能とする制度設計の洗練が、今後の大きな課題であるといえる。
5.おわりに
2024年は日本においてNME承認数が過去最多を記録し、特に希少疾病や小児適応などの領域で承認数の増加がみられた。また、審査期間については日米欧で最短かつ安定した水準を維持しており、新薬開発の予見性を高める環境が整いつつあることが確認された。一方で、特別措置制度の活用が限定的であることや、再生医療等製品における承認取り下げ事例は、制度運用上の課題を顕在化させた。しかし、これらは制度そのものの否定ではなく、今後の改善につながる貴重な経験と捉えるべきである。革新的医療の早期提供と科学的・倫理的妥当性の両立を図るためには、産官学が一体となって制度設計の洗練と透明な運用を進めることが求められる。日本が引き続き国際的な新薬開発の重要な拠点となるために、本稿で得られた知見が今後の議論と取り組みに活かされることを期待したい。
-
1)医薬産業政策研究所、「日本における新薬の臨床開発と承認審査の実績」、リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所、「日本で承認された新医薬品とその審査期間 -2022年承認実績と経年動向調査-」、政策研ニュース No.68(2023年3月)
-
3)医薬産業政策研究所、「日米欧の新薬承認状況と審査期間の比較」、政策研ニュース No.70(2023年11月)
-
4)医薬産業政策研究所、「日米欧の新薬承認状況の比較」、政策研ニュースNo.73(2024年11月)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)医薬産業政策研究所、「小児用医薬品の国内承認及び収載に関する最新動向」、政策研ニュースNo.75(2025年7月)
-
13)厚生労働省、令和6年(2024)人口動態調査(確定数)の概況
-
14)
-
15)令和2年8月31日付け薬生発0831第7号厚生労働省医薬・生活衛生局長通知「加工細胞等に係る治験の計画等の届出等について」
-
16)医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律 第二十三条の二十六(条件及び期限付承認)
-
17)
-
18)
-
19)
-
20)令和6年3月29日付け医薬機審0329第3号厚生労働省医薬局医療機器審査管理課長通知「再生医療等製品に係る条件及び期限付承認並びにその後の有効性評価計画策定に関するガイダンスについて」
-
21)

