Points of View Patient-Reported Outcome(PRO)の最新動向 -臨床試験登録データベースを用いた調査・分析-
医薬産業政策研究所 主任研究員 吉野九美
医薬産業政策研究所 主任研究員 白石隆啓
医薬産業政策研究所 主任研究員 椿原慎治
要約
- ClinicalTrials.govに登録されたPRO関連臨床試験数、割合は、過去15年(2009~2023年)で増加傾向であるが、2020~2023年は同程度で推移した。
- 疾患カテゴリー別でみると、PRO関連臨床試験数ではPathological Conditions, Signs and Symptoms、Neoplasms が上位だが、割合としてはMusculoskeletal Diseasesが多かった。
- 試験Phase別(Phase1~4)でみると、Phase3で最もPRO関連臨床試験の割合が高かった。
- 国・地域別でみるとJapanのPRO関連臨床試験数についてはUnited States、Europe各国に比べて少ないが、増加比はUnited States、Europe各国と同程度であり、その割合も他の国・地域と比べ大きな差はなかった。一方、Chinaは割合が他の国・地域に比べ低い傾向が見られた。
1.はじめに
PRO(Patient-Reported Outcome、患者報告アウトカム)は、「被験者の症状やQOLに関して、自分自身で判定し、その結果に医者をはじめ他のものが一切介在しないという評価方法」としてFDAのガイダンス1)において定義される臨床アウトカムの一つである。PRO尺度を大きく分類すると、一般的な健康状態を包括的に評価する包括的尺度(SF-36、EQ-5D等)と、特定の疾患やそれに伴う特定の症状の程度を評価する疾患・症状特異的尺度(疼痛に用いられるVAS、関節炎・腰痛に用いられるWOMAC等)に分類することができる2)。PROは患者自身の症状や印象の変化が重要な疾患が対象であり、すべての疾患が該当するものではない。「痛み」や「痒み」、「眠気」のような患者の主観以外に信頼性の高い適切な評価方法がないものが想起されやすいが、そうした疾患に対し、これまでわが国ではPROを「利用せざるを得ない」とする消極的な活用がなされていた。しかし、近年は医師による評価が可能なものであっても、患者が直接評価することで同等あるいはそれ以上に意義のある評価が得られる場合に、PROを積極的に活用するようになりつつある3)。
また、前報の「FDA公表データからみたPatient-Reported Outcome(PRO)の使用状況」4)でも記載のとおり、2021年9月には、PMDAより「独立行政法人医薬品医療機器総合機構患者参画ガイダンス」5)が発行され、その中で、「PROは、審査において患者のBenefitを評価するための有用なツールであり、これを活用することは、臨床的意義が患者に支持される医薬品等の効率的な開発に資すると考えられる」と記載されている。こうした状況において、PROを評価項目の一部とした治験の結果を含む承認申請が日本でも増加することを想定し、これまで過去のニュースにおいても、PRO関連臨床試験数の推移を報告してきた6、7)。
本稿では、臨床試験における医薬品の評価において、PRO関連情報が現状どの程度用いられているかについて、最新の動向を把握するため、臨床試験登録データベース(ClinicalTrials.gov)を用いた調査・分析を行った。過去の2報の政策研ニュースのデータとも比較しつつ、最近の傾向を報告する。
2.調査方法
臨床試験登録データベースClinicalTrials.govを用いて、PROに関連した臨床試験がどの程度実施・計画されているかを調査・分析した8)。なお、ClinicalTrials.govは、米国国立衛生研究所(NIH)等によって運営されている臨床試験登録システムである。米国の登録システムではあるものの、各社の情報発信目的など企業戦略の観点等により米国が参加しない臨床試験情報も登録されている9)ことなどから、米国以外の国・地域も含めた世界的な医薬品開発状況を調査するために着目すべきひとつの代表的なデータベースと判断した。データベースにおける検索条件は以下のとおりである。
a)2009年1月1日から2023年12月31日*までに新規に登録された試験計画書の中で、Interventional Study(介入試験)で、かつ介入の対象としてDrugあるいはBiologicalと記載があるもの(Device、Behavior、Radiation等は除外)。a’)一部、介入の対象としてGeneticと記載があるものも調査した。
b)PROに関連し得る検索用語として、Patient Reported、Patient self-reported、Patient Handling Questionnaire、Patient Satisfactionとし、これらのうちいずれかの用語が、評価項目(Outcome Measures)に記載されているもの。
c)疾患カテゴリー別の調査:各試験に関連ワードとして記載されているMeSH(Medical Subject Headings、医学件名標目表)を抽出し、その上位語C01~C26で分類した。上位語はNational Library of MedicineのサイトのMeSH Browser内にあるTree View10)をもとに判断した。1つの試験に複数のMeSHが記載されていたり、複数の上位語に紐づくMeSHが記載されていたりする場合は重複してカウントした。
d)Phase別の調査:ClinicalTrials.govに登録されたPhaseごと(Phase1、Phase2(Phase1/2を含む)、Phase3(Phase2/3を含む)、Phase4ごと)の試験数と割合を調査した。Early phase1(以前はPhase0とされていた試験)、NA(FDAが定義するPhaseがない試験)についてはPhase別の調査においては、調査対象外とした。
e)地域別の調査:ClinicalTrials.govの定義に従い、実施された国・地域別にカウントした。複数地域で実施されている試験は両方で(重複して)カウントした。
-
※本検索条件は、あらゆるPRO評価ツール(VASやEQ-5D等)を具体的に規定して検索できていないため、網羅性には限界がある。また、評価手法の解説として直接評価、患者満足といった表現を用いただけの試験(本来のPROには該当しない)も、PRO関連臨床試験として抽出されていることに留意する必要がある。
また、ClinicalTrials.govでの登録内容は各臨床試験の進行状況などに応じて変化する場合があり、その可能性はデータ取得日に近いほど高いことが、過去の政策研ニュースで指摘されている11)。したがって、2024年分のデータについては調査可能であったものの、直近のデータは情報量が少ない懸念が大きいと判断し、今回は調査対象としなかった。また、過去に報告済みの期間においても、調査時期によって総臨床試験やPRO関連臨床試験の数に変動がある可能性が高いため、臨床試験の実数の比較は同一調査内でのみ行った。
3.結果
3-1.PRO関連臨床試験数の推移
検索条件a)にて抽出された臨床試験(対象期間、介入方法が一致する全ての臨床試験:以下、総臨床試験と略す)は、トータルで168,262試験あった。その中で、検索条件b)でヒットした試験(以下、PRO関連臨床試験)は、6,273試験であった(表1)。なお、期間を5年間で区切って比較すると、直近5年間のPRO関連臨床試験数は10~15年前と比較して3.7倍、5~10年前と比較して1.6倍に増え、総臨床試験におけるPRO関連臨床試験の割合も1.9%、3.7%、5.1%と経時的に増加していた。
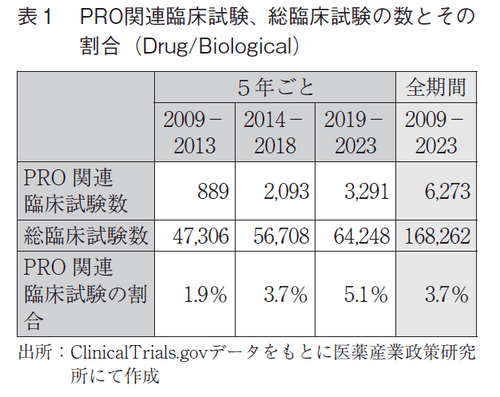
また、過去のニュースでは調査していないが、近年は遺伝子治療に関する製品も増加していると考えられることから、遺伝子治療関連の試験におけるPRO関連臨床試験の動向を確認する目的で、検索条件a’)についても調査した。その結果、トータルは2,398試験、PRO関連臨床試験は77試験であり、期間を5年間で区切ったときの総臨床試験におけるPRO関連臨床試験の割合は1.2%、2.9%、4.6%であった(表2)。検索条件a)(DrugあるいはBiological)と同様の傾向を示しており、遺伝子治療関連の試験においてもPROの活用が進んできていることが伺われたが、数の影響は少ないと判断し、以降の調査にはGeneticは含めないこととした。
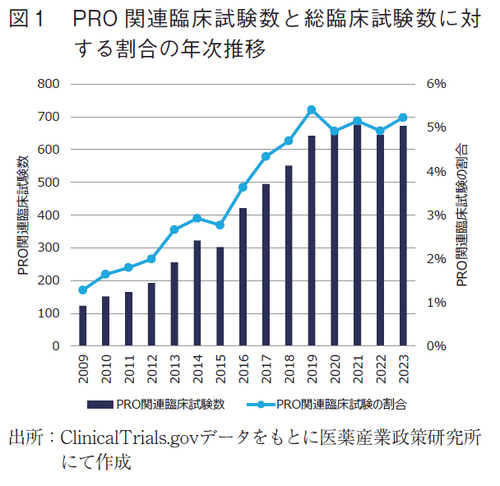
また、年次推移を見ると、2019年のニュース、2022年のニュースと同様、2019年まではほぼ右肩上がりに増加する傾向がみられたが、2020年から2023年までは、PRO関連臨床試験数も割合もほぼ横ばいであった(図1)。
3-2.疾患カテゴリー別
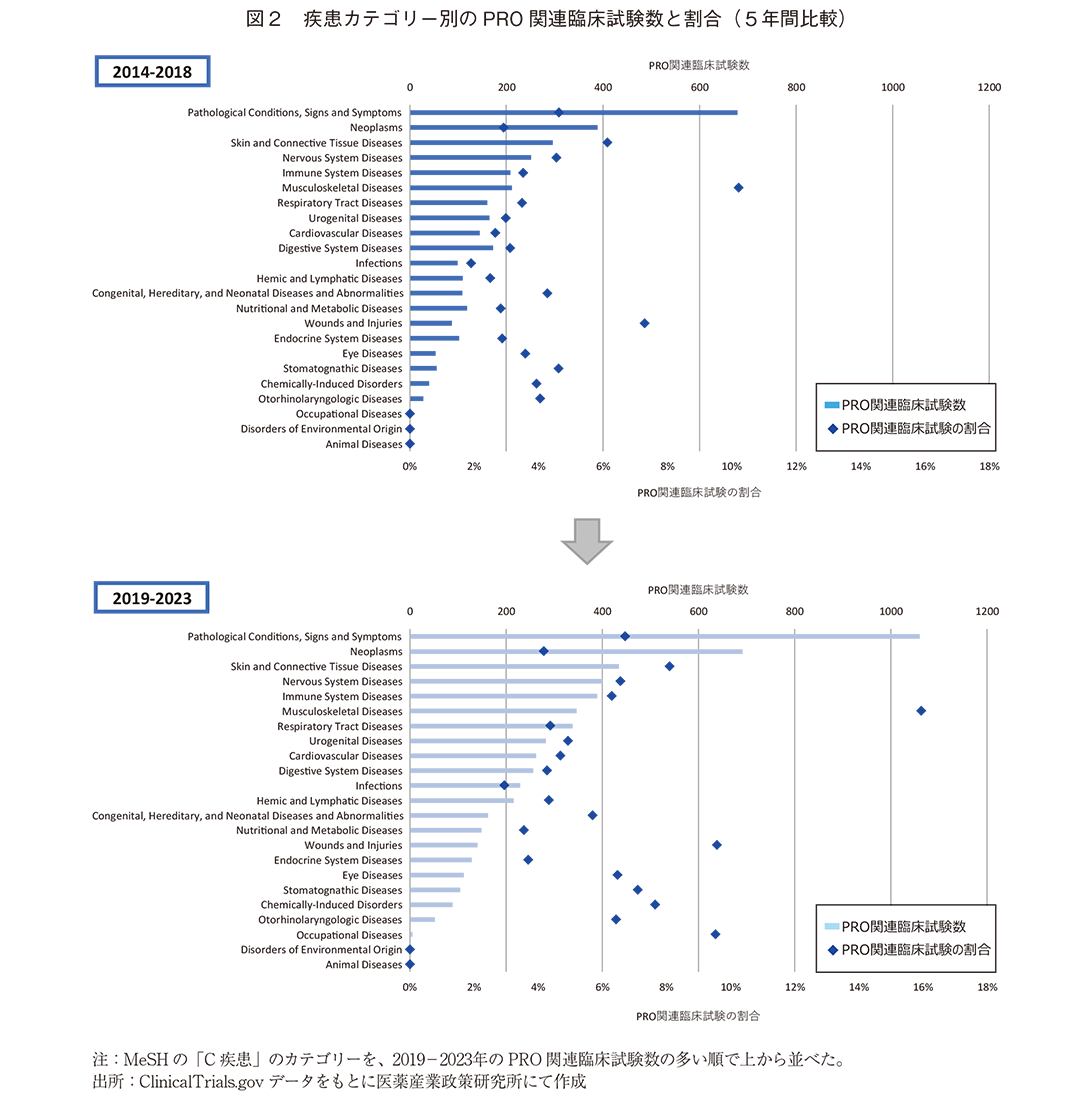
次に、疾患カテゴリー別のPRO関連臨床試験数について、過去10年間について5年ごとに分け、前後で比較した。ClinicalTrials.govのサイトの様式変更があったと思われることから、過去の調査とは完全に同一の手法ではないが、過去2報と同様にPRO関連臨床試験数はいずれの5年間においてもPathological Conditions, Signs and Symptoms(病理学的状態、症状、徴候)が最も多く、Neoplasms(腫瘍)が次いで多かった(図2)。一方、PRO関連臨床試験の割合でみるとMusculoskeletal Diseases(筋骨格系疾患)がいずれの5年間でも最も高く、試験数で1位、2位であったカテゴリーはいずれも低い順位であった(2014-2018年、2019-2023年の順位は、PathologicalConditions, Signs and Symptomsはそれぞれ4位、7位、Neoplasmsはそれぞれ15位、18位)。
-
※この疾患カテゴリーはClinicalTrials.govの各試験に関連ワードとして記載されたMeSHを上位カテゴリーに分類したものであり、ClinicalTrials.govの独自カテゴリーを用いて調査した過去の政策研ニュースとは調査方法が同じでない点に留意する必要がある。なお、過去と同様、1つの試験が複数の疾患カテゴリーに属する場合などは、重複して試験数をカウントしている。
3-3.試験Phase別
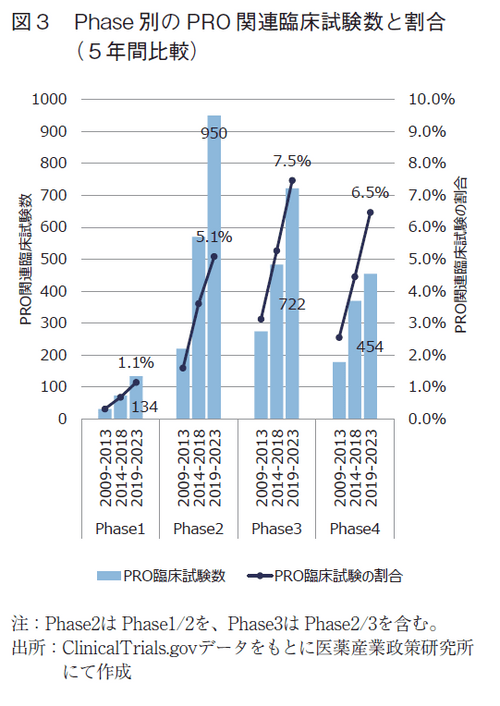
続いて、試験Phase別のPRO関連臨床試験数について以下に示した。まず、各Phaseの総臨床試験に対するPRO関連臨床試験の割合はPhase3(Phase2/3含む)で最も高く、次いでPhase4が高かった(図3、棒グラフ)。これは過去2報と同じ傾向である。
次に、PRO関連臨床試験の割合を5年間比較でみると、全てのPhaseにおいて直近5年間での割合が増加していた(図3、折れ線グラフ)。また、Phase3の直近5年間ではPRO関連臨床試験の割合が7%を超えていたことも過去の政策研ニュースと同様である。
3-4.国・地域別
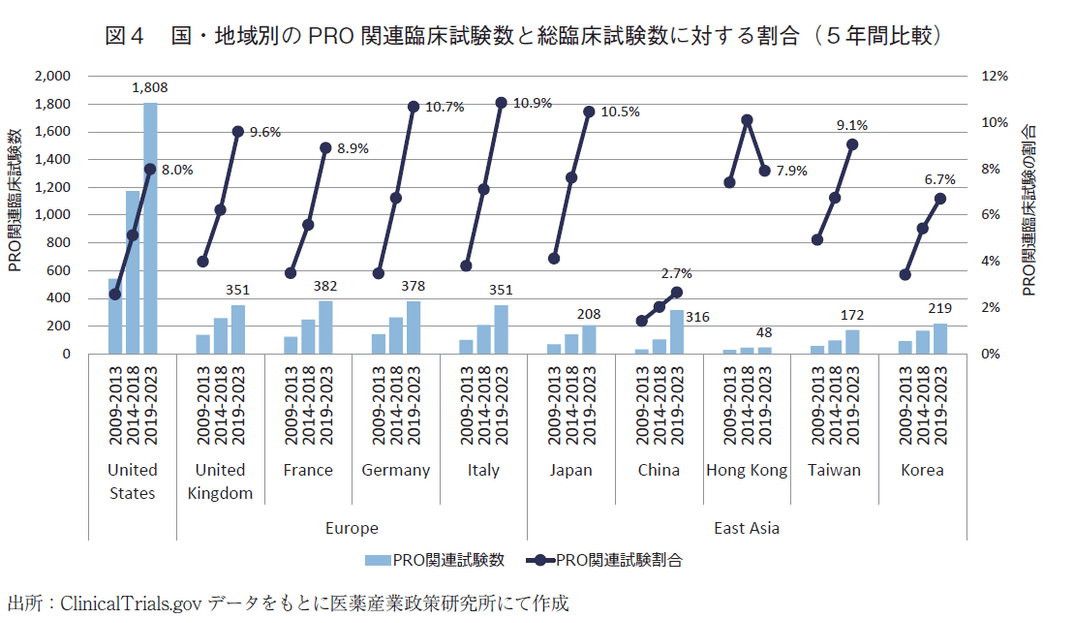
最後に国・地域別の変化を図4に示した。調査対象は、United States、そしてEuropeの国として、United Kingdom、France、Germany、Italy、さらにEast Asiaの国・地域として、Japan、China、Hong Kong、Taiwan、Koreaとした。5年間区切りで比較したところ、どの国・地域でもPRO関連臨床試験数(図4、棒グラフ)は増加していた。直近5年間(2019~2023年)の試験数において、Japan(208試験)は、突出して高いUnited States(1,808試験)や、Europe各国(351~382試験)と比べて少ない状況ではあるが、2014~2018年の5年間に対する直近5年間(2019~2023年)の増加比で見ると、Japan(1.5倍[208試験/141試験])は、United States(1.5倍[1,808試験/1,173試験])、Europe各国(1.4~1.7倍[351~382試験/209~264試験])と同程度であった。一方、ChinaのPRO関連臨床試験数は316試験でEurope各国並みとなっており、増加比としては3.0倍と大きく伸長していた。
また、総臨床試験に対するPRO関連臨床試験の割合(図4、折れ線グラフ)については、直近5年間(2019~2023年)でJapanは10.5%であり、他の国・地域と同程度であったが、Chinaは2.7%と顕著に低かった。
なお、図3に示した通り、PRO関連臨床試験の割合はPhase3で最も多く、また、医薬品の承認により深くかかわるのもPhase3であることから、Phase3に限定した国・地域別の調査も行った。その結果、すべてのPhaseでの調査(図4)に比べて全体的に割合が5ポイント程度高くなったが、国・地域間で傾向に大きな差は見られず、Chinaのみが10%を切る結果であった(2019~2023年の割合は、United States:12.9%[457試験/3,533試験]、Europe各国:14.2~16.2%、Japan:15.2%[159試験/1,046試験]、China:7.5%[158試験/2,117試験]、その他のEast Asia:13.7~16.7%、図なし)。
4.まとめ・考察
臨床試験における医薬品の評価において、PRO関連情報がどの程度用いられるようになっているのか、過去15年間の調査・分析を行った。PRO関連臨床試験数とその総臨床試験数に対する割合は、5年間区切りで見ると順調に伸長していたが、年次推移でみると、2020年以降で一定になりつつある傾向が見られた(図1)。この期間は、COVID-19の流行期と一部重なっており、COVID-19関連の疾患以外においては新たな臨床試験の開始や進行中の臨床試験を休止・中断する状況があったと推察され、そうしたなか、PROを利用した臨床試験の計画・実施が困難であったことが重要な原因となっている可能性がある。
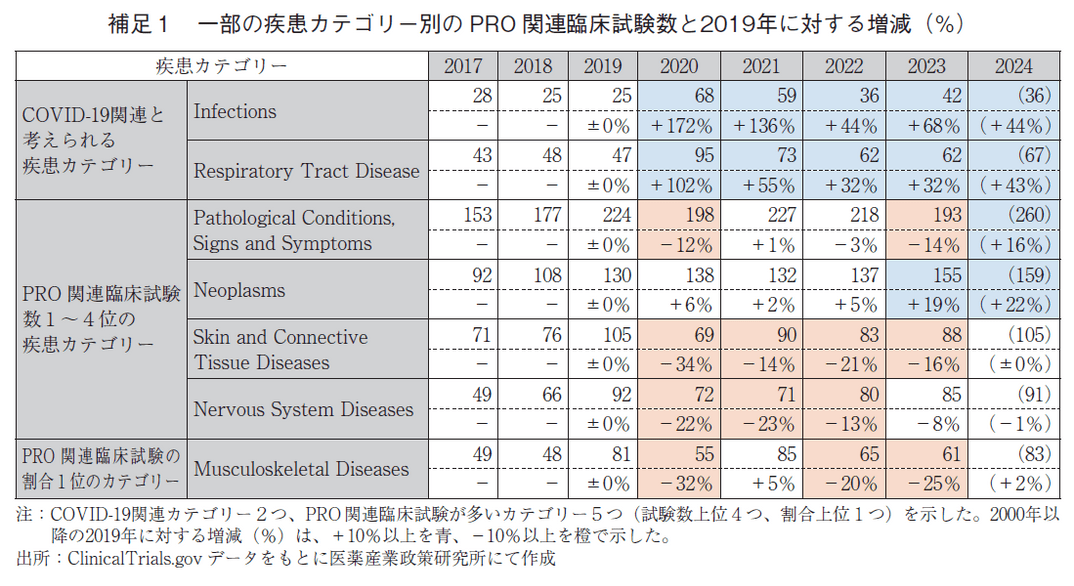
実際に、疾患カテゴリー別のPRO関連臨床試験数を確認すると、この期間はCOVID-19に関連すると思われる疾患カテゴリーInfections(感染症)、Respiratory Tract Diseases(呼吸器疾患)では2019年に比べて2020年以降で顕著な増加が見られる一方で、PRO関連臨床試験数が多いカテゴリーであるPathological Conditions, Signs and Symptoms、Neoplasm、Skin and connective Tissue Diseases(皮膚および結合組織疾患)、Nervous System Diseases(神経系疾患)やPRO関連臨床試験の割合が高いカテゴリーであるMusculoskeletal Diseasesにおいては2019年より減少した時期が散見された(補足1)。また、全カテゴリーにおける総臨床試験数においても、2020年以降は伸びていない(2020年:13,329、2021年:13,115、2022年:13,093、2023年:12,845)。なお、今回は調査対象としていないものの、2024年はPRO関連臨床試験数(774試験)、総臨床試験数(13,904試験)ともに伸びが見られていることから、今後は回復基調となる可能性も考えられるが、PRO関連臨床試験数の伸び率が鈍化している可能性も否定はできず、今後の動向については注視が必要である。
疾患カテゴリー別、試験Phase別の調査については、上述の通り、前回までのニュースと比べて大きな傾向の変化は認められなかった。しかし、いずれの疾患カテゴリー、PhaseにおいてもPRO関連臨床試験の割合が増加する傾向が見られており、全体的なPROへの関心の高まりは伺われた。直近5年間での目立つ変化としては、疾患カテゴリーのうち、Occupational Diseases(職業病)においてPRO関連臨床試験の割合が0%から9.5%に増加し、3番目に多い割合となった(図2)。ただし、実数としては多くなく、総臨床試験63試験中、PRO関連臨床試験が6試験であった。総臨床試験数が少ない疾患カテゴリーではPRO関連臨床試験数の多少の増減による割合への影響が大きいと考えられ、この傾向が継続するかどうかは今後の動向を見る必要がある。
国・地域別においては、5年間区切りで見ると、どの国・地域においてもPRO関連臨床試験数は増加傾向であった(図4)。つまり、今回調査した国・地域においては、臨床試験でその国・地域の患者・被験者の声が考慮される傾向が高まってきていることが伺われる。PRO関連臨床試験数はUnited Statesが突出しており、次いでEurope各国で多かった。これは、United States、EuropeにおいてPROに関連する各種ガイダンス等の環境の整備が進んでいることによる可能性が推察される。
Chinaに関しても直近5年間ではPRO関連臨床試験数がEurope各国並みとなり、近年急速に伸びてきていた(図4)。この背景としては、2022年1月に「患者報告アウトカム(PRO)を医薬品の臨床試験に応用するガイドライン」が発表12)され、PROは患者のQOLや臨床的価値の向上を反映する指標とされているなど、PROへの関心の高まりと環境整備があった可能性が考えられる。一方、PRO関連臨床試験の割合自体は顕著に低く他の国・地域と比べても3~4倍の開きがあった(2019~2023年:2.7%、図4)が、Phase3に限定すると他の国・地域と同様に5ポイント程度高くなり(2019~2023年:7.5%、図なし)、他の国・地域との開きも2倍程度に縮小した。以上より、Phase3におけるPRO関連臨床試験の割合は他のPhaseに比べるとChinaとその他の国・地域で差が小さいことが示唆された。
Japanについては、Europe各国と比べてPRO関連臨床試験の割合としては同程度となっている(図4)ことから、こうした試験を実施する為の臨床試験の実施能力・環境は整っていると考えられる。
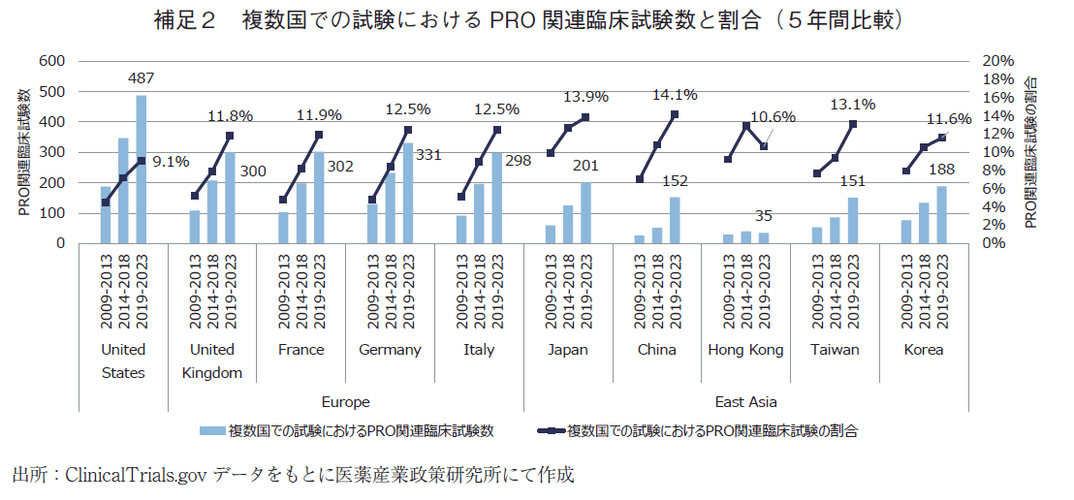
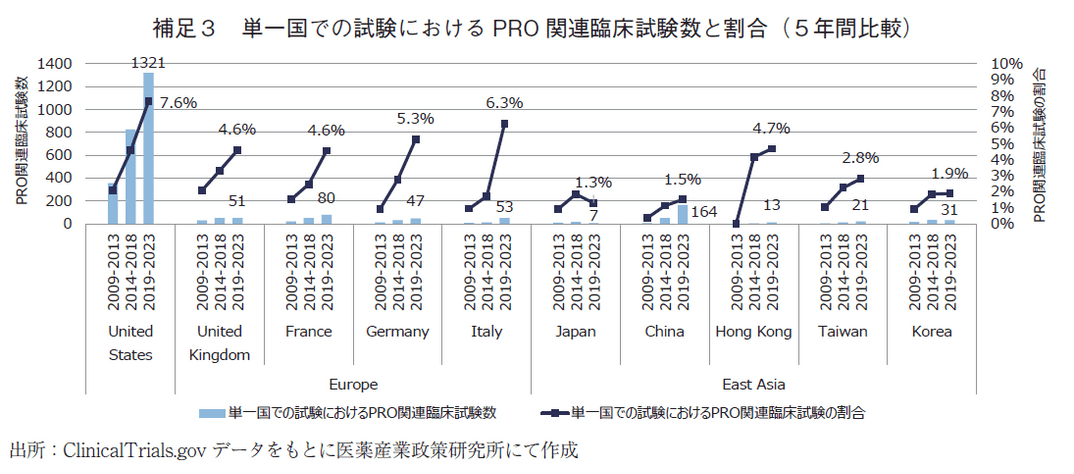
なお、複数国で実施された臨床試験でのPRO関連臨床試験の割合は、China含めて国・地域の間で大きな差はなかった(補足2)ことから、複数国で試験を実施することで、PROの意識浸透が先行する国・地域に合わせてPROが取り入れられやすくなる可能性が考えられる。一方、単一国でのみ実施された試験におけるPRO関連臨床試験の割合は国・地域によってばらつきが見られた(補足3)。その要因については、各国・地域のPROに対する意識や環境整備、承認への活用状況の違いが影響した可能性や、臨床試験が実施されやすい疾患カテゴリーに各国・地域で違いがある可能性など、様々なものが想定されるが、詳細な調査を行っていないため今後の調査課題としたい。各国・地域でPRO関連臨床試験の割合をより高めるためには、複数国での試験を増加させるとともに、単一国での試験へのPROの浸透を加速させる方策の検討が重要な要素になると考えられる。
5.おわりに
本稿での調査の結果、各国・地域においてPRO関連臨床試験数や割合が増加傾向であることがわかったが、Japanは全体としてのPRO利用率はUnited States、Europe各国並みであるものの、単一国での試験での利用率等に課題が残ることが示唆された。今後、日本においては、患者参画ガイダンス5)でも、「国内外での使用実績等の観点に留意しつつ、その取扱いについて検討する」旨の記載がなされており、2023年6月には「関連学会の取組と連携したPROガイドラインの作成」13)も報告されていることを受け、PROを評価項目の一部とした臨床試験の結果を含む承認申請が更に増加することが想定される。更なるPROに対する意識の向上やその実施と結果活用への環境整備が進むことによってPRO関連臨床試験数が増加していくことを期待し、引き続き動向を注視していきたい。
-
1)Food and Drug Administration, Guidance for industry: patient-reported outcome measures: use in medical product development to support labeling claims. 2009.
-
2)
-
3)
-
4)医薬産業政策研究所、「FDA公表データからみたPatient-Reported Outcome(PRO)の使用状況」政策研ニュースNo.75(2025年7月)
-
5)
-
6)医薬産業政策研究所、「Patient Reported Outcome(PRO)の最新動向—臨床試験登録データベースを用いた調査・分析—」政策研ニュースNo.57(2019年7月)、2009年1月1日から2018年12月31日までの10年間データを2019年5月21日時点で検索したもの。
-
7)医薬産業政策研究所、「PRO(Patient Reported Outcome)の最新動向—臨床試験登録データベースを用いた調査・分析—」政策研ニュースNo.65(2022年3月)、2012年1月1日から2021年12月31日までの10年間データを2022年1月12日時点で検索したもの。
-
8)2025年3月26日時点でClinicalTrials.govのウェブサイトに登録されているデータを基に調査した。
-
9)
-
10)
-
11)医薬産業政策研究所、「近年における国際共同治験の動向調査—2023年までの動向とアジア地域について—」政策研ニュースNo.73(2025年11月)
-
12)
-
13)

