Points of View
FDA 公表データからみた
Patient-Reported Outcome(PRO)の使用状況
医薬産業政策研究所 主任研究員 椿原慎治
医薬産業政策研究所 主任研究員 白石隆啓
医薬産業政策研究所 主任研究員 吉野九美
要約
- 近年、医薬品開発における患者参画の重要性を産官学それぞれの立場から発信している。
- 製薬協は「PPI/E(Patient and Public Involvement/Engagement:患者・市民参画)、患者とのCo-creation(共創)」を促進し患者・市民参加型創薬の実現を目指すとしている。
- 患者を中心とした創薬研究やPPI/Eの重要性が唱えられている中、積極的に患者自身による健康評価ツール「患者報告アウトカム(Patient-Reported Outcome,PRO)」を臨床試験に実装することの関心が高まっている。
- このような背景を踏まえ、本稿ではFDAが2021年に公表した、種々の疾患/症状に対して使用されたPRO等の評価ツールの情報を一元化した『CLINICAL OUTCOME ASSESSMENT(COA)COMPENDIUM』を分析した。
- 173の疾患/症状、296の試験薬の臨床試験において、PROの使用数は216であり、その数は臨床医による評価(ClinRO)数の9割弱であった。
- 疾患/症状毎にみると、リウマチ性関節炎と類縁疾患、喘息等の慢性呼吸器疾患、女性の性機能障害で疾患特異的PROの使用が充実しており、各種疼痛疾患では、主にNRSやVASといった基礎的なPROが活用されていた。
- 排便機能障害と各種てんかん症状においては、Diary(日誌)を利用したPROが中心であった。
- これら『COA COMPENDIUM』の分析から、PROの使用と開発における今後の課題に関し若干の考察をする。
1.はじめに
2025年に日本製薬工業協会(以下、製薬協)が公表した「政策提言2025」、「産業ビジョン2035」では、患者個々人のニーズを一層満たすことができる創薬イノベーションのためには患者の方々に積極的に研究に参画してもらうことが極めて重要と捉え、製薬協として創薬の研究開発における生産者の視点から患者・市民の視点へこれまで以上にシフトし、「PPI/E(Patient and Public Involvement/Engagement:患者・市民参画)、患者とのCo-creation(共創)」を促進することで患者・市民参加型創薬の実現を目指すとしている1)。その方法の一つとして、「患者報告アウトカム(Patient-Reported Outcome,以下、PRO)」と「リアルワールド・データ(Real World Data,以下、RWD)」の活用を掲げている。PROとは臨床アウトカム評価(Clinical Outcome Assessment,以下、COA)の一つで、患者の健康状態に関して患者本人から直接報告される情報に基づく尺度であり、FDAによる定義では「患者の回答について、臨床医や他の誰の解釈も介さず、患者から直接得られる患者の健康状態に関するすべての報告」とされている2)。
PROによる測定もしくは評価の対象とする概念は、①疼痛、掻痒、息切れ等、患者のみが認知できる主観的感覚や経験、②患者の日常生活におけるあらゆる種類の機能または活動、③医療技術がもたらす治療や機能に対する患者の満足度もしくは不満足度、④疾患による複数の症状がもたらす日常生活への影響の程度が主とされている2)。
医薬品開発における患者参画の促進に関する近年の動きとして、政府からは2019年厚生科学審議会 臨床研究部会より『臨床研究・治験の推進に関する今後の方向性について』の中間とりまとめが公表され、臨床研究・治験の推進に係る基本的考え方のひとつに「国民・患者の理解や参画促進」が掲げられている3)。同年、国立研究開発法人 日本医療研究開発機構(以下、AMED)は「臨床研究等における患者・市民参画に関する動向調査」を経て、『患者・市民参画(PPI)ガイドブック』(図1)を公表している4)。本資料でのPPIは、AMEDの定義として「医学研究・臨床試験プロセスの一環として、研究者が患者・市民の知見を参考にすること」とあり、医学研究・臨床試験に患者・市民の視点を取り入れる意義について、研究者と患者・市民双方の理解を進める目的で作成されている。ここでの重要なポイントは、「研究者が持つ“専門知”では解決できない課題や見出せない視点に対して、患者・市民が持つ“経験知”によって、新しい研究の可能性を見出すことができるかもしれない」という医療技術開発の進歩に向けた相互作用への期待である。2021年には独立行政法人医薬品医療機器総合機構(以下、PMDA)は『PMDA患者参画ガイダンス』を公表5)し、PMDA及びその役職員が参照すべき患者参画の推進に向けた活動指針を取りまとめたガイダンスを作成し、患者の声等を積極的に収集し“Patient First”の取り組みを実現することを目標としている。
アカデミアにおいては、2020年よりPROの系統的研究が厚生労働科学研究の行政政策研究分野研究班によって開始され、2023年6月に『関連学会の取組と連携したPROガイドラインの作成』が研究成果として報告された6)。この報告では、欧米では2005年ごろから臨床試験や臨床実践におけるPRO使用に関するガイドラインが各規制当局から発出されてきたが、日本ではPROやQOL評価に関する基礎・応用研究は海外に劣らずに行われてきたにも関わらずPRO使用ガイダンスは発表されなかったとし、研究班の考察として、日本は主観的健康観の定量的な評価結果をevidenceとして医療に生かすことの重要性の認識が欧米と比較して20年遅れてきた、としている。その主な背景として同研究班は、日本は欧米先進国と比較して人権意識が「必ずしも」高くない点と、患者を含む一般国民は医療における意思決定に主体性が高くない点があるのではないかと推察している。その後これらの研究成果は、PROを臨床研究等に実装する際の国内初の公的ガイダンスとなる『患者報告アウトカム(PRO)評価関連 特設ページ』サイトとして結実し公開された7)。これは今後新医薬品の国際共同臨床試験の増加に伴って、国内でも実装する機会が増えるであろうPROによる有効性・安全性評価の使用指針となるものである。当サイトにはPRO使用のガイダンスという位置づけのみならず、欧米におけるPROの概念の推移、PRO使用ガイダンスの推移、PROの尺度開発の流れ等、網羅的に記載されており、詳細についてはご参照頂きたい。
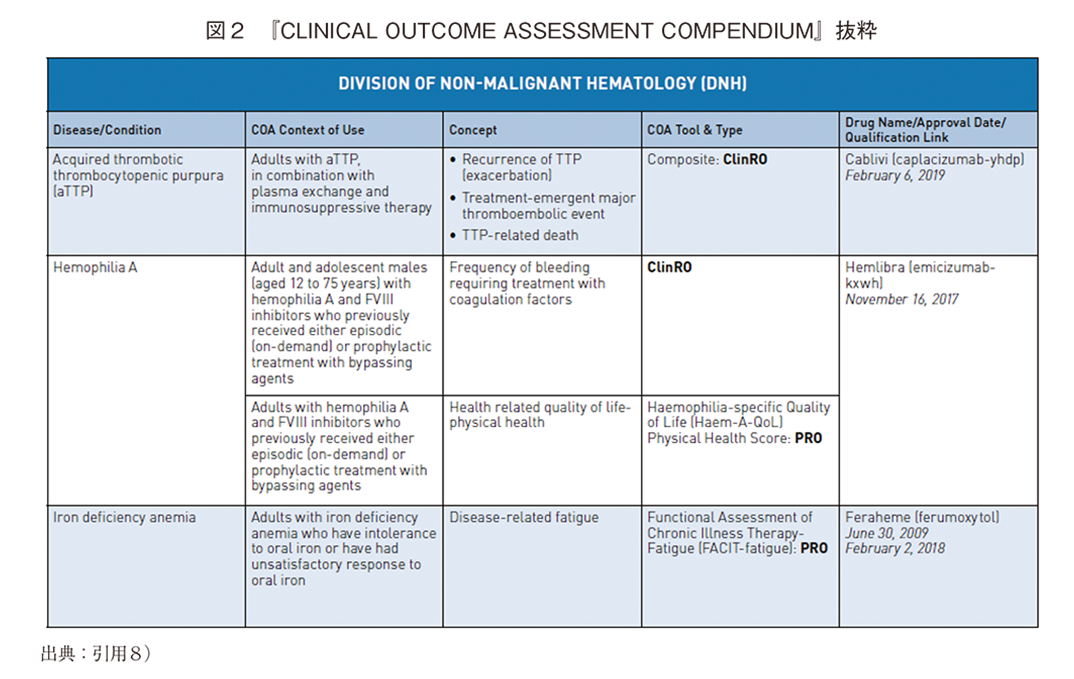
このように国内においては、医薬品開発への積極的な患者参画とPROの活用について産官学が推進している背景から、近年の医薬品開発におけるPROの使用実態を理解するために、米国FDAが2021年に公表した『CLINICAL OUTCOME ASSESSMENT COMPENDIUM』8)(以下、COA COMPENDIUM、図2)に記載された疾患領域毎のCOAの使用実態を把握し、その中でのPROの位置づけや意義を分析する。それに先立ち、当資料の公表背景の概要を述べる。
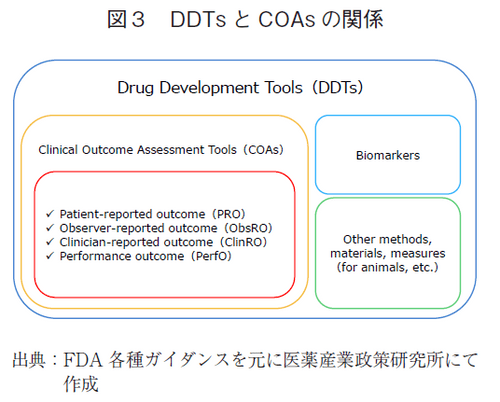
FDAは2009年に『Guidance for Industry, Patient-Reported Outcome Measures:Use in Medical Product Development to Support Labeling Claim』として、製薬企業等の医薬品開発者向けに、承認申請を前提とした臨床試験におけるPRO使用に対する指針を公表した2)。その後米国では2016年に、医薬品や医療機器の開発・承認プロセスの迅速化、研究資金の増額、精神保健サービスの改善等、医療分野の革新を促進することを目的とした『the 21st Century Cures Act』(Cures Act、21世紀治療法)が法制化された9)。これは基本法である「Federal Food, Drug, and CosmeticAct」(FD & C Act、連邦食品・医薬品・化粧品法)に加えて革新的な技術開発の実現のために補完する拡張法として位置づけられる。その第3011条は「医薬品開発ツール(Drug Development Tool,以下、DDT)」の開発を推進する条項であり、DDTすなわち、医薬品開発において有効性・安全性をより効果的に評価するためのPROを含むアセスメントツールの開発・改良を審査するプロセスを記した条項である。またFD & C Actの追加第507条では、FDAが医薬品評価研究センター(以下、CDER)および生物学的製剤評価研究センター(以下、CBER)の見解をもとに、DDTを「バイオマーカー、COA、その他の測定手段や材料」と定義し、DDTを新医薬品、新生物製剤、治験薬の承認申請といった新たな医薬品開発と審査プロセスに使用することを法的に示している10)。
更に同条では、医薬品開発者等が開発・改良しFDAに申請したDDTの科学的妥当性をFDAが確認しその適格性を認定するプロセスも示しており、申請を予定している企業に対するガイダンスとして『Qualification Process for Drug Development Tools』がFDAより2020年に公表されている10)。この中では、疾患や病態解明に向けた研究が進歩するに従い、適格なDDTの開発は革新的な医療技術や医薬品の開発において新たな分野にアプローチし統合することを可能とすると述べられ、例えば新たに開発した適格性のあるDDTを用いて特定の性質を持つ患者を研究対象集団に豊富に含むようにすることで、研究対象集団の規模を縮小し研究期間を短縮できる可能性がある、としている。
同時に2020年には『Patient-Focused Drug Development:Collecting Comprehensive and Representative Input』(最終版)がFDAより公表された11)。これは製薬企業、FDA職員、その他のステークホルダーに向けた、患者中心の医薬品開発を推進する4部シリーズのガイダンスの第1部であり、まず2018年のドラフト公表を経て策定された。患者の経験や視点を医薬品開発および規制判断に組み込むためのガイダンスであり、患者や介護者からの包括的かつ代表的な意見を収集する方法に焦点が当てられている。その後同シリーズとして、『Patient-Focused Drug Development:Methods to Identify What Is Important to Patients』(患者や介護者が重要と考える症状、疾患の影響、治療の負荷、リスクとベネフィット等の情報を収集するためのガイダンス、2022年、最終版)12)、『Patient-Focused Drug Development:Selecting, Developing, or Modifying Fit-for-Purpose Clinical Outcome Assessments』(患者の経験や視点を臨床試験に適切に反映させるためのCOAの選定、開発、修正に関するガイダンス、2022年、ドラフト)13)、『Patient-Focused Drug Development:Incorporating Clinical Outcome Assessments Into Endpoints for Regulatory Decision-Making』(COAを規制上の意思決定に使用するエンドポイントとして組み込むための方法、基準、技術に関するガイダンス、2023年、ドラフト)14)が公表されている。
今回分析対象とした『COA COMPENDIUM』はこれらガイダンスの理解をサポートするために、種々の疾患や症状に対して使用されたPRO等のCOAの情報を一元化、要約したものである。医薬品開発者等にCOA情報を明確にして提供することで、当局と医薬品開発者、研究者間のコミュニケーションを促進することを目的としている。医薬品開発者や研究者が臨床試験にCOAの組み込みを検討する場合は、当資料を出発点とすることをFDAは推奨している。ただし、『COA COMPENDIUM』は包括的なリストではなく、記載されたCOAがすべてFDAによる認定を意味するものではないとされ、ガイダンスを示すものではないとする免責事項が示されており、あくまで検討資料の範囲としていることに注意が必要である。医薬品開発者は臨床試験にCOAを実装する際には、疾患固有の最新版ガイドラインを確認し、疾患や適応を問わず関連する承認審査部門とCOAの選択について実際に話し合うことを強く推奨している。
『COA COMPENDIUM』に記載されている情報は、2016年1月公表のパイロット版では、①2003~2014年の間に新薬申請(New Drug Application,以下、NDA)または生物学的製剤承認申請(Biologics License Application,以下、BLA)において審査承認された新規分子化合物医薬品(New Molecular Entity、以下NME)の添付文書等の情報文書、②CDERのCOA適格性評価プログラム15)によって適格性認定を受けたCOA、③CDERのCOA適格性評価プログラムで審査中だったCOA、から収集された情報であり、2019年の第1回改訂では、④2003~2017年6月までにNDAまたはBLAで審査承認されたNMEの情報文書、⑤2017年1~6月までに承認された新しい適応症または新しい適応患者に関連する効能の補足、⑥CDERのCOA適格性評価プログラムによって新たに適格性認定を受けたCOAの情報、が追加された。更に2021年の第2回改訂版には、⑦2017年7月~2019年6月にNDAまたはBLAで審査承認されたNMEの情報文書、⑧2017年7月~2018年6月までに承認された新適応に関連する効能補足情報、⑨新たに適格性認定を受けたCOAの情報、が追加された。
NMEの承認と有効性の補足について、FDAは添付文書内の臨床研究に関連するCOAの医学的見解をレビューしており、結果評価が複雑すぎて表形式で説明できないケース、追加情報に対応するガイダンスの参照がないケース、現在利用可能なFDA発行のガイダンスでより新しい、もしくはより適切なCOAの使用が推奨されているケースについては、『COA COMPENDIUM』には除かれるルールとしているが、結果的にはほぼ例外なく記載されたとしている。図3にDDT(s)とCOA(s)の関係を簡潔に示す。『COA COMPENDIUM』が対象としたCOAタイプはPRO、ObsRO、Clin-RO、PerfOの4つであり、詳細は後に記す。
2.資料解説と集計方法
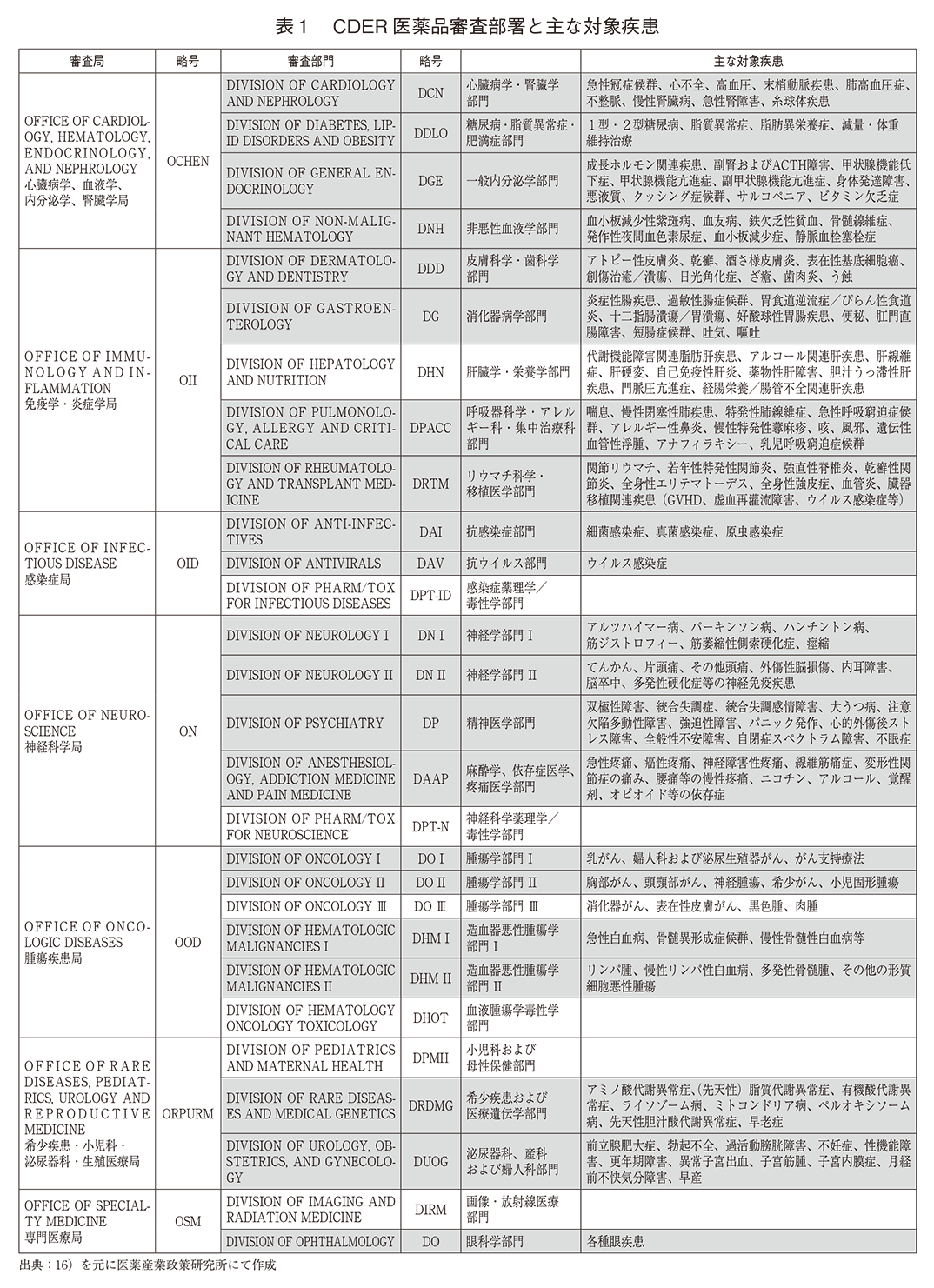
『COA COMPENDIUM』は、CDERに設置されている医薬品審査部署が管轄する疾患群毎に整理されている。医薬品審査部署は「Office」(局)とその傘下部署である「Division」(部門)に分類されており、表116)はCDER内にある審査部署と管轄とする疾患例を示したものである。『COA COMPENDIUM』に掲載されたCOA情報は、グレーで示した部署で審査された医薬品の臨床試験情報から取得したものである。
次に『COA COMPENDIUM』の構成要素を表2に示す。表内に示した説明通りだが、特に「COA Context of Use」と「Concept」の用語の理解が必要となる。「COA Context of Use」は、臨床試験でCOA尺度が使用される試験薬剤の当該疾患に対する使用目的と、試験に組み入れる患者カテゴリーである。例えば、ざ瘡を対象としたある薬剤の臨床試験の対象患者は「Patients 9 years of age and older with inflammatory lesions of non-nodular moderate-to-severe acne vulgaris(中等度から重度の非結節性尋常性ざ瘡の炎症性病変を有する9歳以上の患者」8)、多発性骨髄腫の臨床試験では「Prevention of skeletal related events in patients with multiple myeloma and in patients with bone metastases from solid tumors(多発性骨髄腫患者と固形腫瘍の骨転移患者における骨関連イベントの予防)」というものである8)。「Context of Use」はしばしば「COU」と略される。
「Concept」は簡潔に言えば、治療評価のエンドポイントとして、COAを用いて患者の何を測定するのかを示したものである。具体的には表2にあるように、個人の臨床的、生物学的、身体的、機能的状態、経験等が測定対象となる10)。例えば特定の多発性硬化症に対する臨床試験でのConceptを「Fatigue-related symptoms and associated impacts on daily activities(疲労関連症状と日常生活への影響)」としてPROで評価している8)。発作性夜間ヘモグロビン尿症に対する臨床試験では、PROで「Disease-related fatigue(疾患関連疲労)」の度合いを測定し、ClinROとして医療者が「Transfusion avoidance(輸血回避)」の程度を評価する8)、というものもある。
また複数の「Concept」を評価し、それらを複合(Composite)評価するものも多くある。複合評価には、異なるCOAを組み合わせることもあり(ClinROとPRO等)、BiomarkerとCOAを複合して評価するケースもある。なお『COA COMPENDIUM』には、Biomarkerは複合評価された場合のみ記載されている。

「COA Type」として、PROは先述の通りであり、ObsRO(Observer-reported outcome:観察者報告アウトカム)は、患者または医療専門家以外の者、主に患者家族や介護者による患者の健康状態に関連する測定である。ClinRO(Clinician-reported outcome:臨床医報告アウトカム)は、患者の健康状態を観察した訓練を受けた医療専門家からの報告に基づく測定である。PerfO(Performance outcome:パフォーマンスアウトカム)は患者が一連の指示に従って能動的に行う標準化されたタスクに基づく測定である。そして「COA Tool」は、これらCOAの測定のために用いられる尺度、アセスメントツールである8)、10)。
本稿の『COA COMPENDIUM』情報の定量分析の集計項目(①)と集計ルール(②~⑤)を以下に示す。
①集計項目は、ⅰ)CDERのCOA適格性評価プログラムによって認定されたCOA、ⅱ)疾患/症状数、ⅲ)試験薬剤数、ⅳ)Context of Useの対象年齢(成人、青年期、小児、幼児)毎の数、ⅴ)試験薬剤毎に測定されたConcept数、ⅵ)複合(Composite)評価数、ⅶ)疾患/症状毎のCOA数、ⅷ)Diary(日誌)を用いたPRO数とした。②「ⅲ)試験薬剤数」は、疾患/症状別にContext of Use毎にカウントした。③「ⅳ)Context of Useの対象年齢」が表中から読み取れない場合は疾患の特徴から判断し、すべて成人として集計した。④「ⅴ)試験薬剤毎に測定されたConcept数」は、箇条書きで記載されているConceptは個別に集計し、複数のConceptを「e.g.」として羅列記載している場合は1とカウントした。⑤「ⅶ)疾患/症状毎のCOA数」は、複数のConceptの複合(Composite)評価で、単一のCOAを用いている場合(例;ClinROのみ)は1とカウントした。複合評価で複数のCOAを用いている場合はそれぞれを1としてカウントした(例;PROとPerfOの複合は各1とカウント)。
3.結果
第一に、CDERのCOA適格性評価プログラムで適格性が認定されたCOAを記載する。第二に、『COA COMPENDIUM』には掲載されているが適格性は認定されていないCOAに関連する各種集計結果を記載する。
(1)適格性認定COA
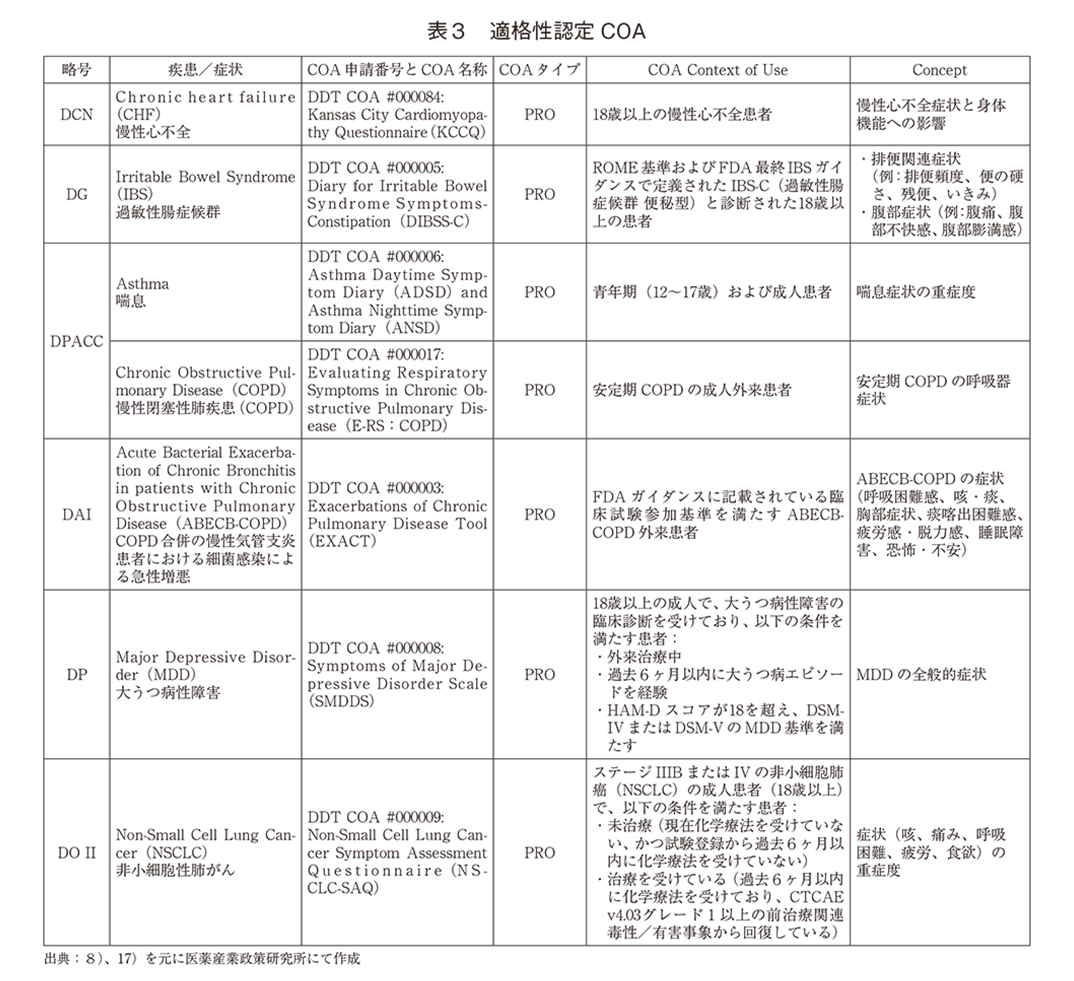
「ⅰ)CDERのCOA適格性評価プログラムによって認定されたCOA」を表3に示す8)、17)。7の適格性認定COAが記載されており、すべてPROであった。慢性心不全、過敏性腸症候群(便秘型)、喘息、COPD、COPD患者の細菌感染時の急性増悪、大うつ病性障害、非小細胞肺がんの自覚症状を評価するPRO尺度であり、喘息に対するPRO(ANSD)のみ青年期患者での使用が可能、残りは成人を対象としたPRO尺度であった。これら尺度の詳細は引用17を確認いただきたい。
(2)適格性未認定COAに関する定量分析
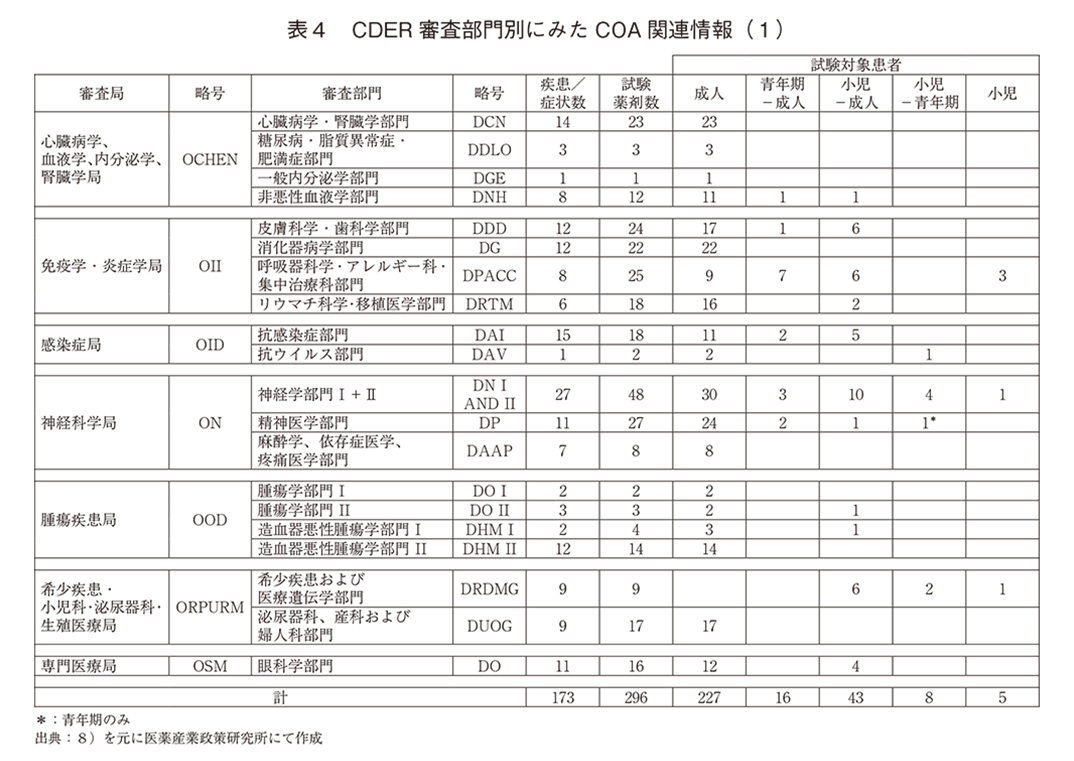
適格性の認定はされていないが申請者への参考として『COA COMPENDIUM』に掲載されているCOA情報について定量的に分析した。「ⅱ)疾患/症状数」は173、「ⅲ)試験薬剤数」は296、「ⅳ)Context of Useの対象年齢」は、成人のみ227、青年期~成人16、小児~成人43、小児~青年期8、小児のみ5であった。なお青年期は12~18歳未満と定義、小児は11歳未満と定義し新生児、乳児を含むケースもある。
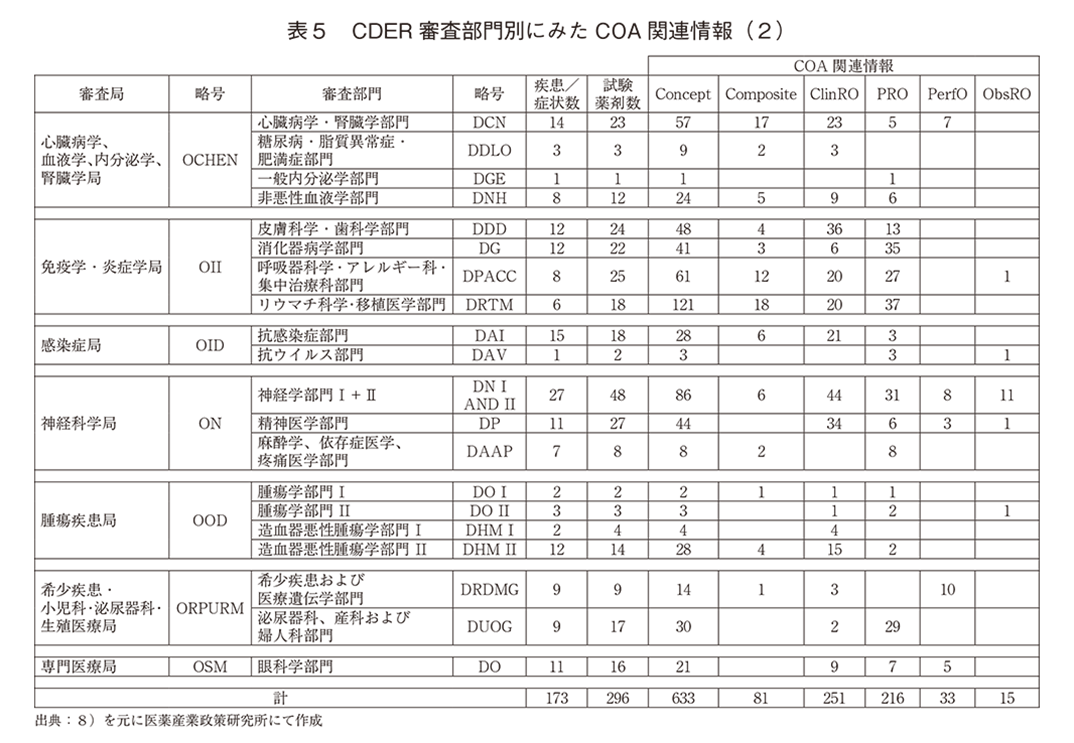
「ⅴ)試験薬剤毎に測定されたConcept数」は延べ633であった。複数のConceptを複合で評価する「ⅵ)Composite評価数」は81、「ⅶ)疾患/症状毎のCOA数」は、ClinRO 251、PRO 216、PerfO 33、ObsRO 15であった。「ⅷ)Diaryを用いたPROの数」は74であった。
次に審査局(Office)、審査部門(Division)別の詳細を表4、5に示す。試験薬剤数が5以上で薬剤数に対するPROアセスメント数の割合が50%以上の疾患領域は、「皮膚科学・歯科学部門」、「消化器病学部門」、「呼吸器科学・アレルギー科・集中治療科部門」、「リウマチ科学・移植医学部門」、「神経学部門Ⅰ・Ⅱ」、「麻酔学、依存症医学、疼痛医学部門」、「泌尿器科、産科および婦人科部門」であった。PerfOは「心臓病学・腎臓学部門」7、「神経学部門Ⅰ・Ⅱ」8、「精神医学部門」3、「希少疾患および医療遺伝学部門」10、「眼科学部門」4であった。ObsROは「神経学部門Ⅰ・Ⅱ」で11、「呼吸器科学・アレルギー科・集中治療科部門」、「抗ウイルス部門」、「精神医学部門」、「抗腫瘍部門Ⅱ」がそれぞれ1であった。
(3)疾患別にみたPROの使用状況
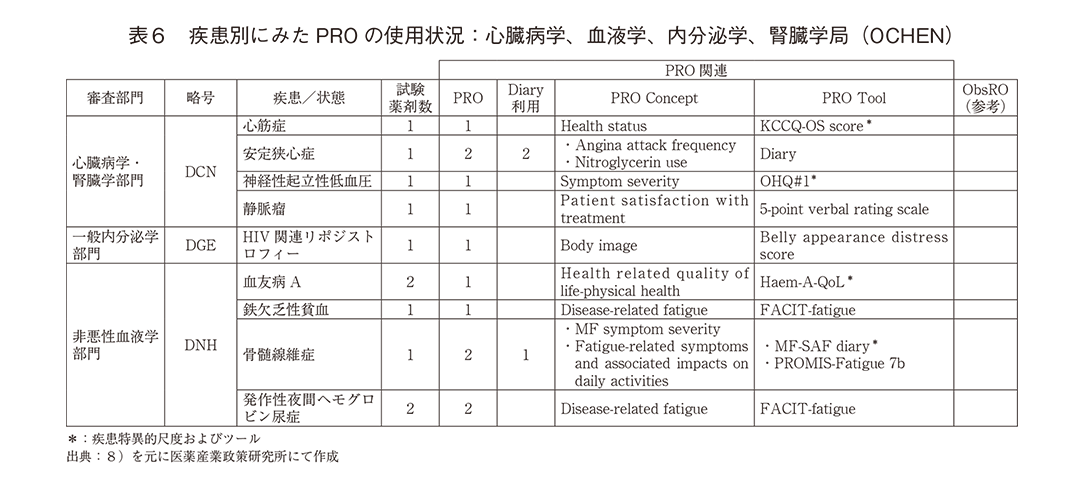
CDERの審査部署に応じて疾患別のPROの使用数を集計し、『COA COMPENDIUM』に記載されたPROのConcept(測定対象)と測定に用いられたTool(尺度)を整理した。「心臓病学、血液学、内分泌学、腎臓学局(OCHEN)」の報告(表6)ではPROが使用された臨床試験の記載は限られており、PRO Conceptは「安定狭心症」、「骨髄線維症」、「発作性夜間ヘモグロビン尿症」が各2、他は1であった。Diary(日誌)によるPROは「安定狭心症」、「骨髄線維症」のみであり、疾患特異的尺度、ツールの利用は「心筋症」、「神経性起立性低血圧」、「血友病A」、「骨髄線維症」の4疾患であった。
「免疫学・炎症学局(OII)」(表7)ではPRO使用の臨床試験、試験薬剤が多く記載されていた。皮膚疾患(皮膚美容、尋常性乾癬)、慢性呼吸器疾患(気管支喘息、COPD、嚢胞性線維症)、リウマチ性疾患および類縁疾患(リウマチ性関節炎、乾癬性関節炎、強直性脊椎炎)において疾患特異的尺度が多く用いられていた。対して、特発性、薬剤性問わず各種の排便機能障害と化学療法誘発性嘔気・嘔吐の臨床試験においては主にDiaryとNumerical Rating Scale(以下、NRS)といった汎用的なPRO尺度が用いられていた。
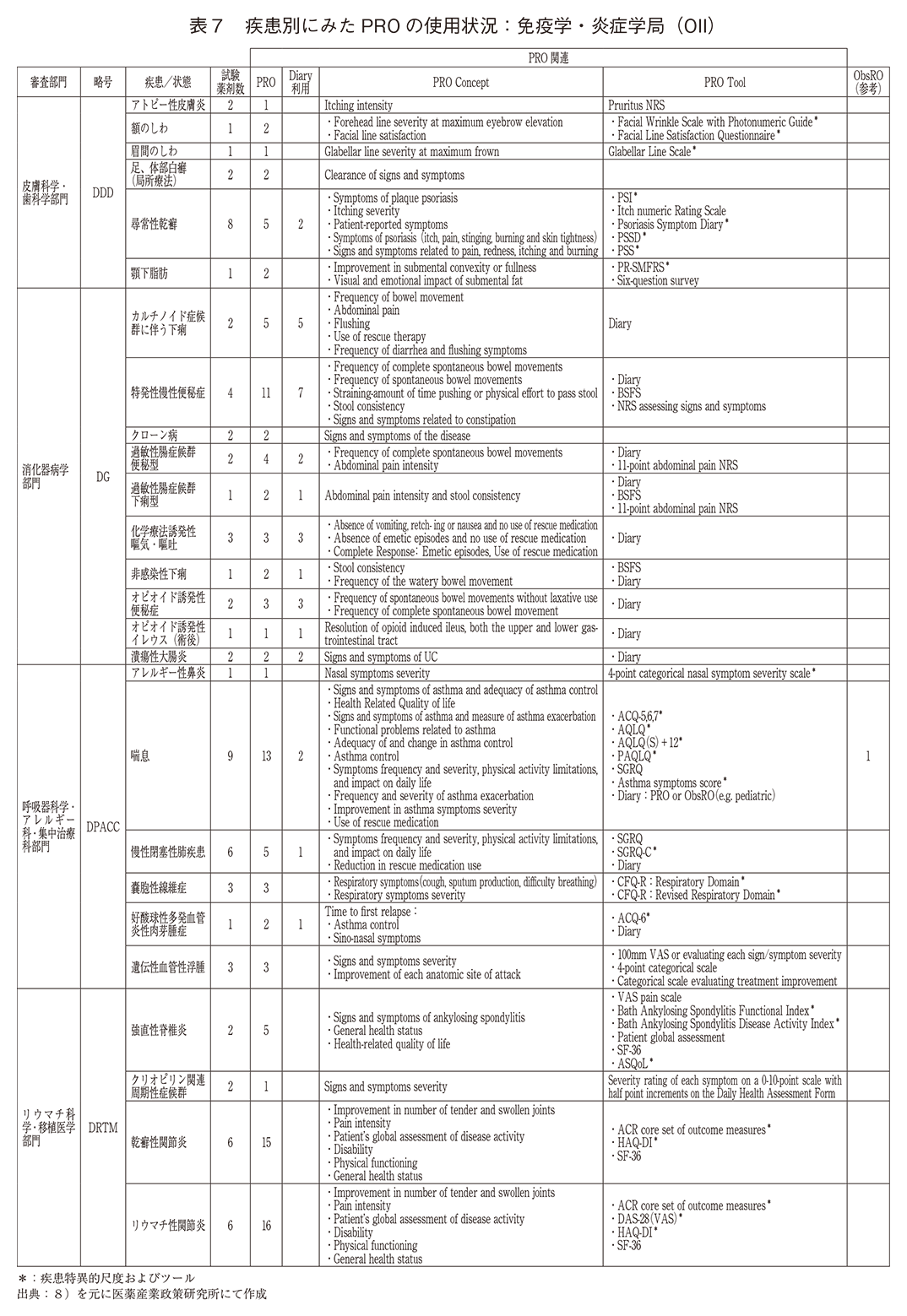
「感染症局(OID)」(表8)のPRO使用の疾患/症状は3あり、嚢胞性線維症、旅行者下痢、インフルエンザであった。インフルエンザに対する小児臨床試験では観察者評価(ObsRO)を可能としていた。
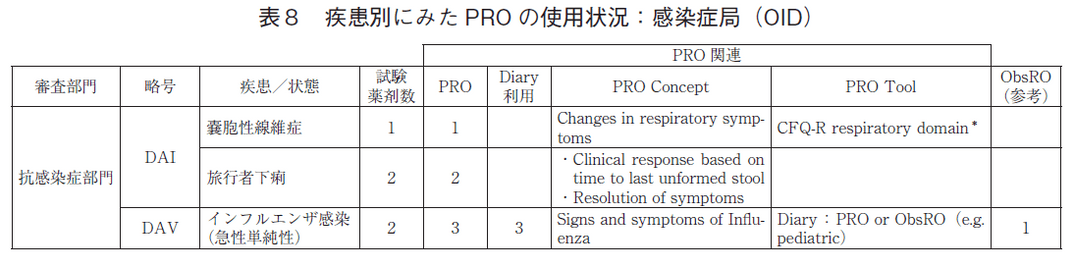
「神経科学局(ON)」(表9)では、「神経学部門」の疾患/症状でPRO尺度の使用記載が多かった。9の疾患特異的尺度が用いられていた反面、舞踏病(Huntington’s chorea)、ランバート・イートン筋無力症候群といった希少疾病のPROは全般的印象(Global impression)といった汎用的尺度であった。また、遺伝子疾患を含めた各種「てんかん」症状に対するPROはすべてDiaryであり、小児患者等ではObsROによるDiaryも可能としていた。「精神医学部門」でのPRO使用の臨床試験はすべて睡眠障害関連であり、Diaryと全般的印象が用いられていた。「麻酔学、依存症医学、疼痛医学部門」では、鎮痛薬の臨床試験のPROはNumerical Pain Rating Scale(以下、NPRS)もしくはVisual Analogue Scale(以下、VAS)による汎用的な疼痛評価のみであった。
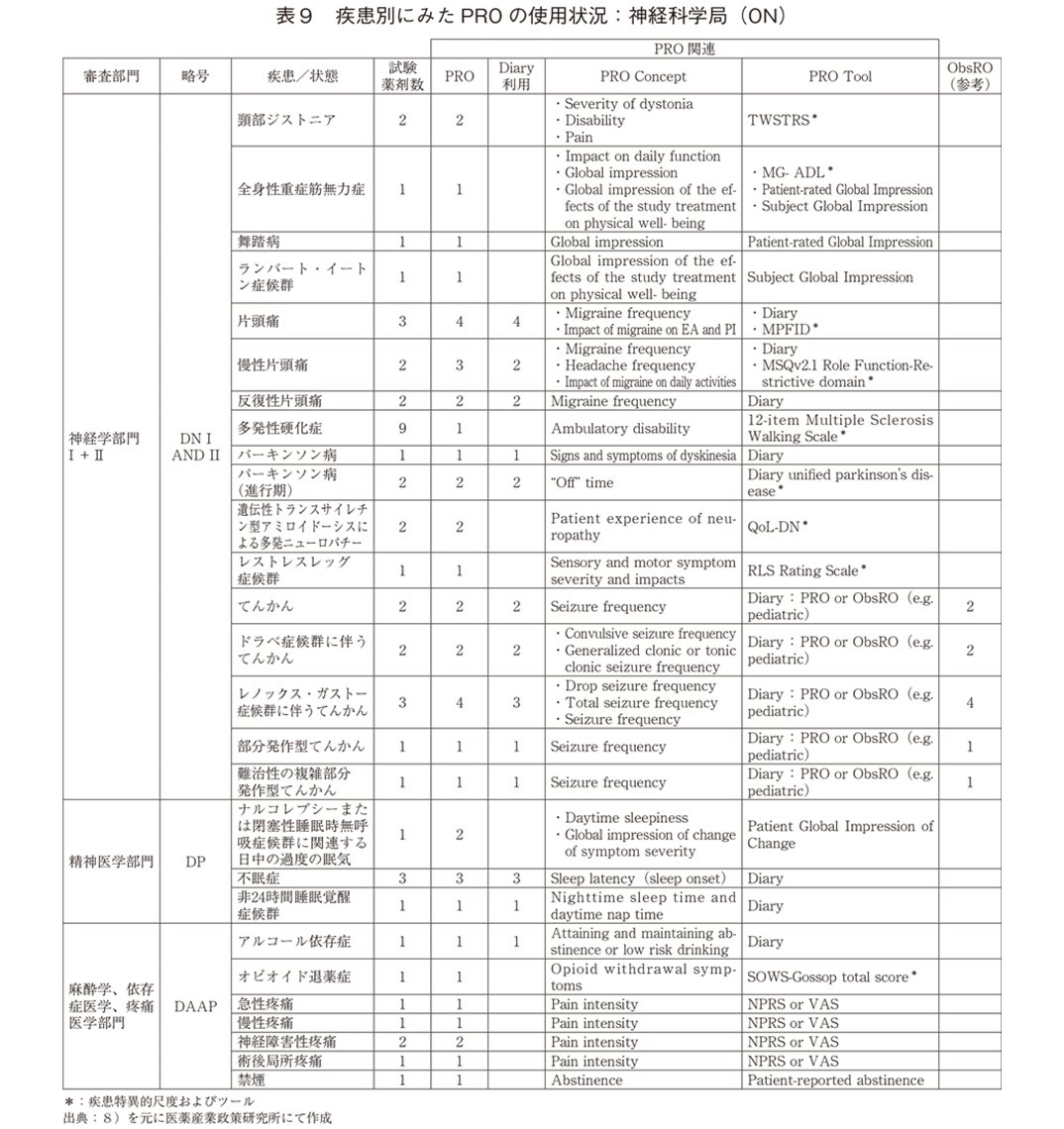
「腫瘍疾患局(OOD)」(表10)のPRO使用の臨床試験は4であり、「転移性去勢抵抗性前立腺がん」の疼痛症状、「転移性非小細胞肺がん」の呼吸器症状、「結節性硬化症」に伴うてんかん部分発作、「慢性GVHD」による不快症状であった。
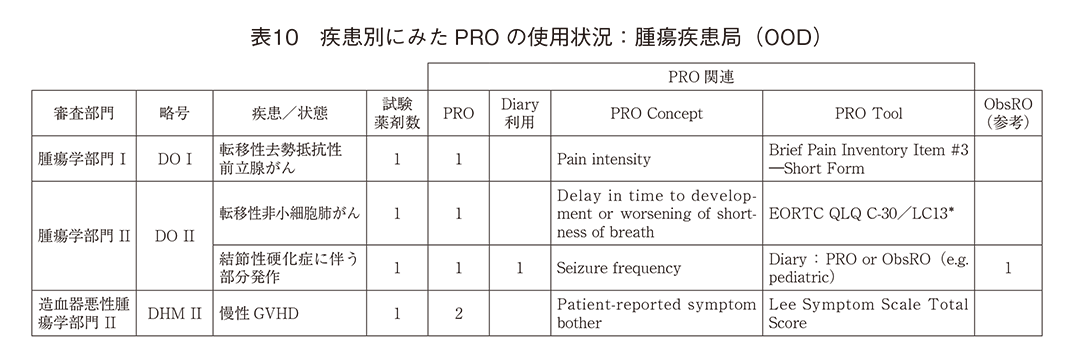
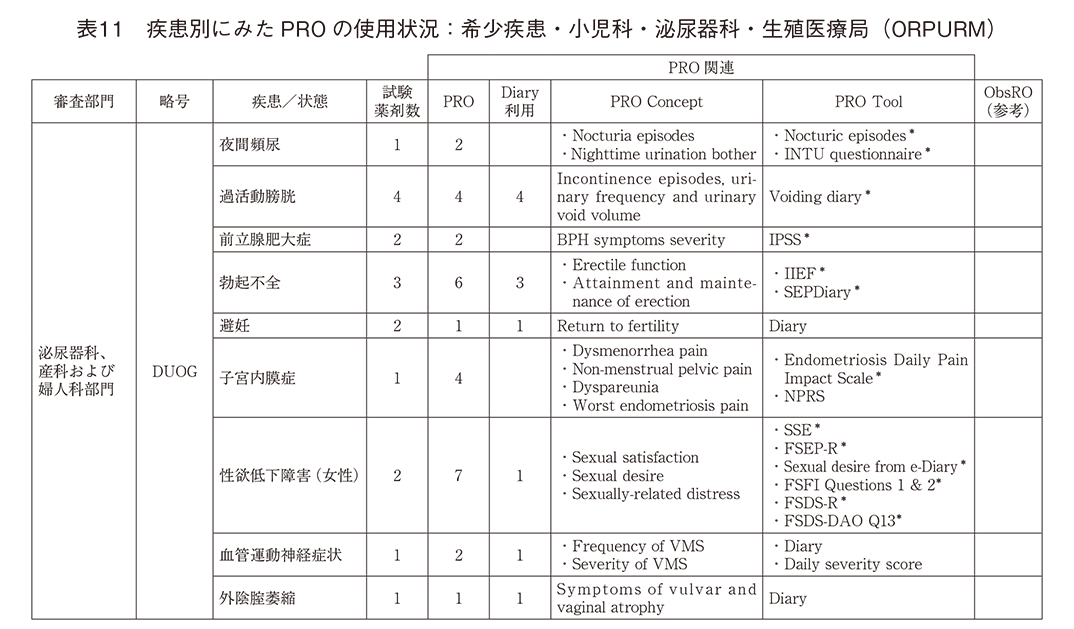
「希少疾患・小児科・泌尿器科・生殖医療局(ORPURM)」(表11)では、「泌尿器科、産科および婦人科部門」のみでPRO使用が記載されていた。排尿障害、性機能障害では疾患特異的尺度の使用が認められていたが、避妊効果、加齢に伴う血管運動神経症状や性器萎縮といった女性特異的な疾患/症状ではDiaryが主であった。
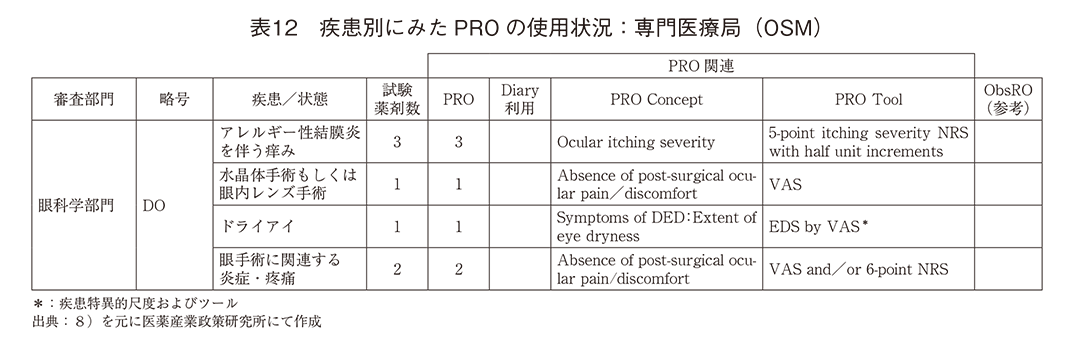
「専門医療局(OSM)」(表12)のPROは「眼科学部門」のみ記載があり、ドライアイが疾患特異的尺度、他は掻痒感、術後の疼痛・不快症状などをNRSもしくはVASで評価するものであった。
4.まとめと考察
本稿では、米国FDAが2021年に公表した『COACOMPENDIUM』に記載された、疾患領域毎の各COA、特にPROの使用実態を調査した。更に臨床試験、試験薬剤および使用されたCOA、PROの各種データ間の関係等を分析しいくつか課題を考察した。
(1)記載データの更新状況
『COA COMPENDIUM』は先述通り、パイロット版が2016年に公表され、その後2019年に第1版、2021年に第2版が公表されたがそれ以降の更新がないため、直近の疾患/症状毎、試験薬剤毎の臨床試験におけるCOAの使用状況、使用トレンドの分析ができない。そのため現状では参考資料の分析としての域は出ないが、最大の医薬品開発国である米国の審査当局が公表している資料であり、臨床試験に使用されたCOAを疾患毎、薬剤毎に一元に整理した資料は他にないため、具体的に臨床試験にPROを実装するための参考資料として価値の高い資料だと考える。『COA COMPENDIUM』には継続的な更新が望まれるとともに、これからPPI/Eを推進しようとする本邦においても臨床試験でのPROの使用状況を一元化する資料の作成が望まれる。
(2)記載データの網羅性
『COA COMPENDIUM』は、パイロット版では2003~2014年、第1版では2003~2017年、第2版では2017~2019年までのNDAまたはBLAで審査承認されたNMEの添付文書等の情報と適応拡大に伴う新たな情報、適格性認定COAの情報で構成されているが、長期に渡って収集された各種の臨床試験情報にしては、先述の定義に示されたNME等のCOA情報は少なく網羅記載されているか明らかではない。あらかじめ包括的リストではないとしているが、そのために情報に偏りがあることも考えられ、更なる調査と研究が期待される。
(3)適格性認定COAの数
2016年に『the 21st Century Cures Act』が制定され、以降米国ではDDT開発が推進されると考えられたが、『COA COMPENDIUM』に記載されたCDERのCOA適格性評価プログラムによって科学的に認定されたCOAは限られた7疾患/症状に対するPROであり、2021年以降を調べたところ、アルコール依存症患者のアルコール摂取量を評価する特殊なPROが新たに適格性認定18)された程度である。これまでのCOAの適格性認定申請をFDAサイトで検索19)したところ、その数は現時点で88であった。その多くは申請の入り口であるLetter of Intent(開発意向書)のレベルで留まっており、科学的妥当性のあるCOAの開発の難しさが伺える。同時に、意向書受理後のステップであるQualification Plan submission(認定計画申請)提出に対してもFDAの受理で留まっているものが多く、適格性認定にも困難のあることが推察される。今後の期待としては、現在適格性認定されたCOAはすべてPROであり、COA開発とCDER適格性認定の志向には「Patient-Focused Drug Development」が基本にあると考えられる。今後アンメットメディカルニーズに対する新規作用機序、新規分子標的、新規モダリティ等の医薬開発が更に進むと考えられるが、Co-creationの観点で考えると、それら新薬によって患者が経験する新たな価値、多様な価値が科学的妥当性をもって深耕されるPROの開発が同時に望まれるであろう。
(4)各COAの使用状況
『COA COMPENDIUM』には、173の疾患/症状に対する臨床試験で298の試験薬剤のCOA使用状況が記載されている。年齢別の延べ数は成人のみが226、青年期から成人が16、小児から成人が45、小児から青年期が6、幼児~小児が5であった。この結果から、記載されたCOAのほとんどが成人対象で使用もしくは開発されたものであり、小児をはじめとした若年層に特異的なCOAは未だ希少であることがわかる。COA別の延べ数はClinRO 251、PRO 216、PerfO 32、ObsRO 15であり、薬剤効果の評価機会を量的にみるとPROはClinROと同程度に導入されていた。対してPerfO、ObsROは少なく、特にObsROはてんかん(の頻度)、喘息症状、インフルエンザ症状(表7、8、9)といった小児-成人共通の疾患で、小児患者等自己評価を的確に表現することが困難な場合にPROとObsROの選択を可能としたものであった。また13~17歳の青年期ADHDを対象とした臨床試験ではPROは記載されておらず、ClinROとObsRO(Connor’s Parent Rating Scale)が使用されていた。
これらの分析から、現在のCOA開発において以下の問題が考えられた。①若年層にフォーカスしたPROをはじめとしたCOA開発は十分とはいえない、②ObsROは小児-成人共通の疾患に限られておりその数も僅少である、③認知症等の器質性精神障害、パーキンソン病等の神経変性疾患に対してObsROの記載がない、④器質性精神障害、神経変性疾患に対するPerfOの記載が僅少である、⑤ムコ多糖症やポンペ病等の先天性希少疾患に対してObsROの記載がない。
上記のような疾患に対する科学的妥当性のあるCOA開発は非常に難易度が高いと推察される。しかし、急速な高齢化の進展によって増加が危惧される器質性精神障害、神経変性疾患に対峙するために、また少子化進展の中、一人でも多くの難治性疾患の小児患者を救う画期的医薬品を開発しこれからの社会的負荷の増大を抑制するためにも、患者自身の評価に加えて、患者の日々の「生活」と「人生」に関わる介護者の視点は非常に重要になると考える。特に医薬品による介護負荷の軽減等の「社会的価値」評価の必要性に関する議論においては、「なぜ、どのように負荷が軽減したのか」について妥当性のある説明ができるようにするためにも、PROに加えObsROとPerfOの開発の高度化は本質的であり必要条件と考える。
(5)疾患領域毎のPRO使用状況
173の疾患/症状のうち82は臨床試験に何らかのPROが記載されていた。つまり残りの91の疾患/症状にはPROは使用されていなかった。確かに急性冠症候群や脳梗塞急性期のような重篤イベントに直結する急性期疾患ではPRO評価は不適と考えるが、『COA COMPENDIUM』内の急性期疾患試験は少数であった。医薬品開発においてPPI/Eの機会拡大を実現するためには、多くの疾患領域でPRO開発の余地が残っているのではないかと考えられた。
PROが使用された疾患/症状には偏りがあり、尋常性乾癬、リウマチ性疾患および類縁疾患といった自己免疫疾患と、喘息、COPD、嚢胞性線維症といった慢性呼吸器疾患、美容皮膚、排尿障害、性機能障害において疾患特異的PRO尺度の使用が充実していた。特にリウマチ性疾患や喘息は、近年になって生物学的製剤等の革新的治療薬が開発されてきたものの、古代より多くの人間を苦しめてきたmajor diseaseであり、疾患特異的なClinRoやPROの豊富な開発は長い臨床研究の歴史で培われた成果と言えよう。
疼痛症状の臨床試験はPROによる評価が主体であったが、先とは異なり、疼痛疾患に対する臨床試験のほとんどはNPRSやVASといった基礎的PRO尺度が用いられていた。国際疼痛学会による疼痛の定義は「実際の組織損傷もしくは組織損傷が起こりうる状態に付随する、あるいはそれに似た、感覚かつ情動の不快な体験」20)とされており、「疼痛は常に個人的な経験」として、周知の通り疼痛評価の本質は主観でありPROによる評価が最重要である。その点を踏まえ、他の疼痛尺度の存在を確認するためにCOA専門サイト21)で簡易検索したところ、当サイトに登録された“Pain”のワードを含むCOAは712あり、疼痛の原因別(神経障害性等)、状態別(慢性等)、基礎疾患別(認知症、鎌状赤血球症等)、臓器、部位(背部、皮膚等)、年齢別(小児等)といった多様な疼痛評価COAが開発されていた。大多数がPROであったが少数ながらClinROやObsROも存在した。患者が体験する疼痛表現は様々である。数値による疼痛レベルの変化だけではなく、患者の特性毎にきめ細やかに患者の不快な表現を拾い上げるPROの開発は、医薬品開発におけるPPI/EとCo-Creationの推進において重要な要素と考える。
排便機能障害、性関連疾患、てんかんの臨床試験では、PROとして「Diary」の使用頻度が高かった。Diaryは患者が日々経験する症状の変化を示す貴重な一次情報であり、患者状態の評価として最適なツールと思われる。しかし定量スケールとは異なり、特に紙媒体の自記式Diaryは患者の個性、気分、状態等によって情報の精度に変動があることが懸念されるとされる。紙媒体Diaryは報告時間の正確性低下、報告ルールの遵守率低下、報告文字の判読性低下といったデータの信頼性確保のための重要な要素であるALCOA(Attributable;帰属可能、Legible;判読可能、Contemporaneous;同時性、Original;原本性、Accurate;正確性)に問題点があると指摘されている7)。その改善として近年Diary情報等を電子的に報告・収集する「ePRO」の導入が推奨されている22)。ePROは記入時間の自動記録、入力リマインダー機能、agileなデータ転送とフィードバック等の報告サポート機能が実装され、文字の判読性も担保されることによりデータ品質と信頼性の向上が期待されるとしている。しかしたとえePROを導入したとしても、医薬品開発におけるCo-Creationが成立するためには、患者もしくは介護者の臨床試験への積極的な協力と、ヘルスリテラシー、データリテラシーが不可欠である。加えて、ePROのDiaryで得られた定性的な一次情報から最大限に価値を引き出すためにも、個々の患者が多様な文脈で表現する非構造の健康情報を、測定可能かつ科学的妥当性の高い構造化データに変換し集約するAI技術の開発はPPI/E、Co-Creationの意義を高める点で重要な課題だと考える。
最後に、引用21のCOA専門サイトに登録されているCOAは8,130あり、“PRO”のワードを含むCOAを検索すると1,580であった。PROは疾患特異的を問わず数多く開発されており、引用7においても「疾患/症状特異的HRQL(健康関連QOL)尺度も枚挙に暇がないほど数多く開発されている」としている。このように数多く開発されてきたPROの中から、医薬品開発のCo-Creationに最適なPROを選択する、もしくは更に科学的妥当性の高いPROを開発するためにも、政府、アカデミアと協力しながら患者と直接コミュニケーションを取り患者の声に耳を傾ける機会を設けることは、今後の製薬産業の重要な取り組みになるものと考える。
5.おわりに
『COA COMPENDIUM』では腫瘍疾患に対するPRO使用例の記載は少なかったが、Patient-Focused Drug Developmentの推進はがん領域でも注目されている。米国国立がん研究所(以下、NCI)は、がん臨床試験の有害事象情報をより正確に把握するために、参画患者自らに治験薬や治験医療技術による有害事象の重症度、頻度、日常生活への影響等を報告してもらうPRO尺度「PRO-CTCAE(Patient-Reported Outcomes version of the Common Terminology Criteria for Adverse Events)」を開発した23)。その日本語版は日本臨床腫瘍研究グループ(JCOG)の承認をうけ、NCIホームページで2017年公開された24)。
2023年にはNCIより、1985~2020年の間に実施された臨床試験をがん領域と非がん領域に分けて、臨床試験に使用されたCOAを定量分析した論文が報告された25)。分析対象の臨床試験のうち、がん領域の18%、非がん領域の26%で何らかのCOAが使用されており、そのうちPROの使用はそれぞれ84%、78%とCOA類型の中でPROの使用頻度が格段に高い点を指摘していた。課題として、early phase trialのCOA使用試験が少なかった点、がん臨床試験においてtreatment-focused trialのCOA使用が17%に対して、supportive care trialは49%だったが、それでも半数に満たなかった点等が指摘されていた。今後これらの課題を含めたCOA、PROに関する研究機会を設けたいと考える。
-
1)
-
2)
-
3)
-
4)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)
-
13)
-
14)
-
15)
-
16)
-
17)
-
18)
-
19)
-
20)
-
21)
-
22)
-
23)
-
24)
-
25)

