Points of View
製造販売後調査等に関する最近の動向と製造販売後データベース調査の
経済性評価
医薬産業政策研究所 主任研究員 富樫満里子
医薬産業政策研究所 主任研究員 渡邉奈都子
医薬産業政策研究所 主任研究員 枝廣 誠
要約
- 製造販売後調査における使用成績調査等の最新動向を整理し、さらに製造販売後データベース調査(以下、DB調査)活用による経済性評価を行うことを目的として、2020~2024年度の新医薬品承認品目の医薬品リスク管理計画(以下、RMP)を対象に調査を行った。
- 新医薬品承認において策定される初回RMPは37.0%で新有効成分含有医薬品が多くを占めた。その数には大きな変化は無いが、承認により新たに計画された調査総数は2024年度に減少傾向が認められた。
- DB調査については、製造販売後調査総数が減少する中で件数は横ばいで割合が増加していた。また、DB調査では大規模かつ対照群を設定した調査が可能であり、対照群を設定しない小規模な旧来の使用成績調査との違いが鮮明となった。一方で、使用されるデータベースは限定的であり、利活用可能なデータベースやレジストリに限界があるといえる。DB調査の活用は特に外資系企業で多く、また、1企業が複数計画している割合が大きい。
- 従来の使用成績調査からDB調査への選択の移行がもたらす業務プロセスの変化と各プロセスで発生するコストを整理し、DB調査への移行可能率から調査期間5年のコスト削減効果は約92億円となると試算した。
- 製造販売後調査におけるDB調査の活用実態を検討した結果、全例調査や対応可能なデータベースの不足、企業の利活用経験の偏りなどが活用の障壁となっていることが示唆された。一方で、DB調査の適切な活用により、調査負担の軽減と経済的効果が確認され、今後の選択肢としての意義が示された。
1.はじめに
近年、わが国では医療の質の向上や効率化、さらには新たな医療技術の創出を目的として、保健・医療・介護に関わる情報の利活用に向けた制度整備が急速に進められている。
2022年6月に「経済財政運営と改革の基本方針2022」(令和4年6月7日閣議決定)1)において医療デジタルトランスフォーメーション(以下、医療DX)の推進が提示され、さらに、2024年6月の「経済財政運営と改革の基本方針2024」(令和6年6月21日閣議決定)2)では、全国医療情報プラットフォームで共有される情報を新しい医療技術の開発や創薬等のために二次利用する環境整備、医療介護の公的データベースのデータ利活用促進が明記された。
医療DXを促進するためには、その経済的利益を定量的に評価し、経済的合理性を明確にする必要がある。European Health Data Space(EHDS)の立法法案に付随して公表された影響評価報告書3)では、EHDSを導入することによる経済的利益が試算されており、この結果は、健康医療情報の情報連携基盤による経済的利益を評価するための重要な事例となっている。
わが国の製薬企業において医療情報の二次利用が進んでいる一事例としては、製造販売後調査におけるDB調査が、平成30年4月1日付のGPSP省令の改正4)によって製造販売後調査の一形態として認められ、製造販売後調査の新たな選択肢となっていることが挙げられる。
本稿ではこのDB調査に着目し、最近の医薬品製造販売後調査におけるDB調査の実施状況や課題、さらに従来の使用成績調査からDB調査への移行がもたらす経済性(コスト削減や業務効率化等)について定性的、定量的な評価を行い、医療情報利活用推進におけるDB調査の意義と将来的な活用可能性を展望する。
2.調査方法
2-1 製造販売後調査等の現状調査
公開情報から製造販売後調査における使用成績調査及びDB調査の現状を調査するため、医薬品医療機器総合機構(以下、PMDA)ホームページで公開されている2020~2024年度(5年度分)の新医薬品承認品目一覧5)掲載品目におけるRMP(2025年4月時点)から、追加の医薬品安全性監視活動の有無とその内容を調査し、承認および一部変更承認(以下、一変)により計画された調査を特定、抽出した。なお、調査項目は新医薬品承認品目数、承認により新規に設定された初回RMP数及び調査数とし、以下に示す条件で情報を整理した。
- ①追加の安全性監視活動の計画、実施の時期に関わらず、承認年度でカウントした。
- ②一般使用成績調査、特定使用成績調査、DB調査のみを抽出してカウントした(市販直後調査、製造販売後臨床試験、使用成績比較調査等はカウントから除外)。
- ③使用成績調査の記載のうち、一般使用成績調査か特定使用成績調査か判断できない場合には、一般使用成績調査としてカウントした。
- ④同一製品内の同一事項(効能効果等)の承認において、既承認規格に対する一変と新規格品に対する承認が存在する場合は、承認と一変にそれぞれカウントした。
- ⑤同一製品に対する複数事項(複数の効能効果等)が同日に承認されている場合は、製品数を別々にカウントした。
2-2 DB調査利用時の経済性評価
従来の使用成績調査と、DB調査の流れを整理し、プロセスごとに発生する作業についてコスト試算を行った。使用成績調査のDB調査への移行可能率から調査期間5年のコスト削減効果を試算した。
3.結果
3-1 製造販売後調査等の調査結果
3-1-1 2020~2024年度新医薬品承認品目背景情報
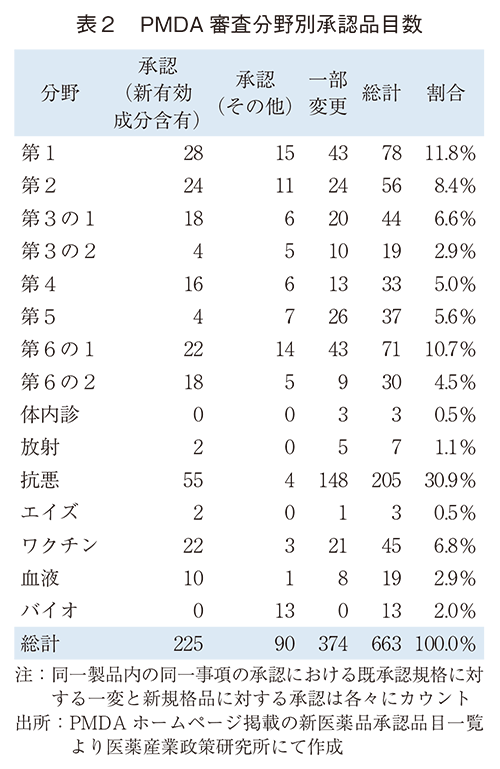
はじめに背景情報として、年度ごとに5年間の新医薬品承認数と初回RMPが設定された品目数を表1に、PMDA審査分野別の品目数を表2に示した。
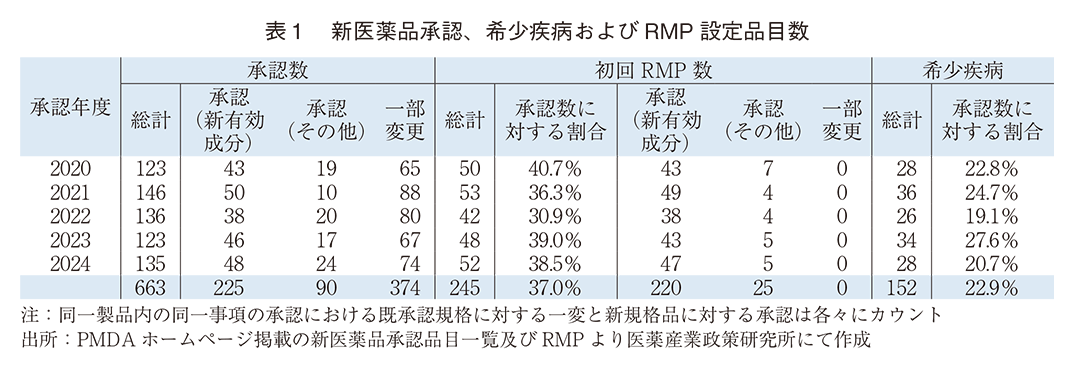
新医薬品の年度ごとの承認品目数は2020年度から多少の増減はあるが123~146品目の間でほぼ横ばいであった。希少疾病用医薬品は年度による偏りはあるが、26~36品目で対象期間全体では全承認数の22.9%の割合を占めていた。初回のRMP設定数は対象期間全体の承認数に対して37.0%であり、承認数と同様に5年間の推移はほぼ横ばいであった。新有効成分含有医薬品ではほとんどの製品(220/225承認)で、その他の医薬品では年度に因り異なるが対象期間全体で27.8%(25/90承認)で初回RMPが設定されていた。
PMDA審査分野別の新医薬品承認品目数を調査した結果、抗悪分野が30.9%、第1分野が11.8%、第6分野の1が10.7%の順に多かった。なお、PMDA新薬審査部担当審査分野を表3に示す。

3-1-2 製造販売後調査の内訳
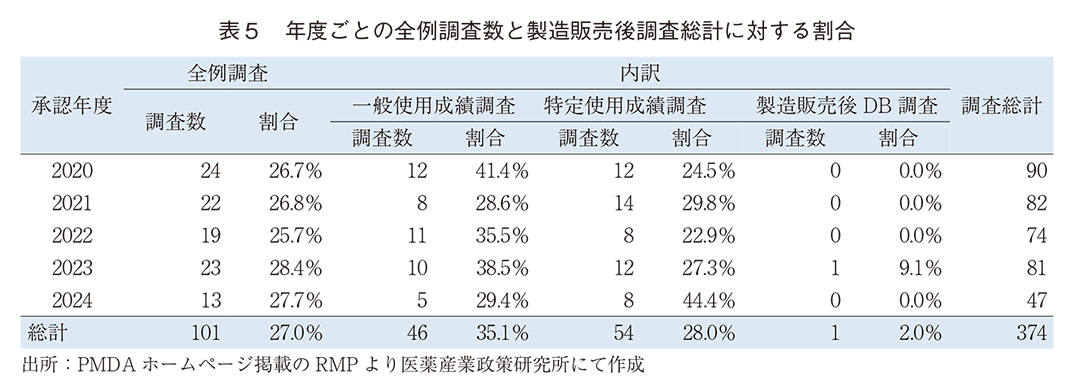
各年度の承認、一変によって計画された製造販売後調査の調査数を表4に、各調査数の割合の推移を図1に示した。調査数総計では2023年度まで80調査前後であった数値が2024年度に47調査に減少している。
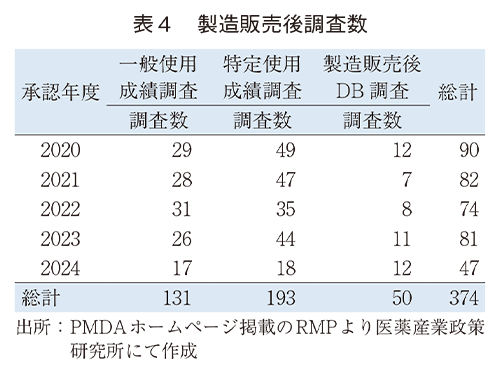
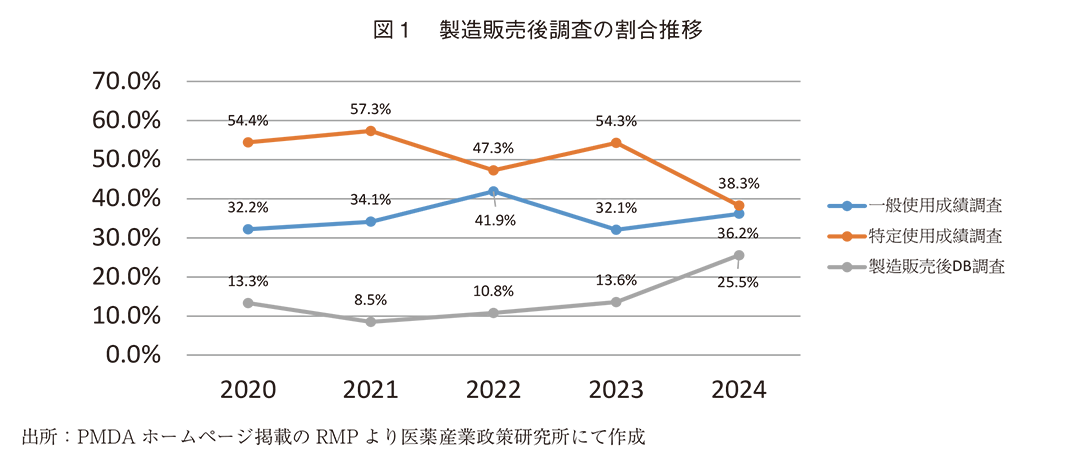
詳細をみると調査数は特定使用成績調査が最も多く、一般使用成績調査、DB調査の順であった。また、一般使用成績調査及び特定使用成績調査の調査数は2024年度に減少、DB調査では横ばいの傾向であった。これを各調査数の割合でみると同年度において特定使用成績調査は減少の傾向に変わりはないが、一般使用成績調査は横ばい、DB調査は2020~2023年度では10%前後と横ばいの傾向であるが、2024年度には25.5%と増加の傾向であった。
さらに製造販売後調査の現状を多角的に調査するため、①全例調査の調査数、②希少疾病用医薬品に対する調査種別、③PMDA審査分野別の各調査数、④各調査の症例規模ならびに⑤対照群の有無についてカウントした。
全例調査は全製造販売後調査の27.0%を占めた。全例調査の調査数は、2023年度までは横ばいだが、2024年度では減少(13調査)傾向がみられる。一方で、割合で各調査の動きをみると特に特定使用成績調査で顕著な増加(44.4%)が認められた。全例調査は従来の一般および特定使用成績調査で計画されているが、DB調査でも全例を補足するものがあった(1調査)。具体的にはレズロックの造血幹細胞移植後の慢性移植片対宿主病に対するもので、TRUMP-GVHDレジストリが利用されていた。(表5)
希少疾病用医薬品の製造販売後調査は調査総計374調査中120調査で約32.1%の割合であった。希少疾病用医薬品に対する調査種別は一般および特定使用成績調査の割合が高いが、DB調査も7調査(5.8%)で選択されている。具体的には以下の製品に対する調査であり、一変で4調査、新有効成分の承認で3調査であった。また、効能効果として造血幹細胞移植後の移植片対宿主病を対象とするものが3調査含まれていた。(表6)
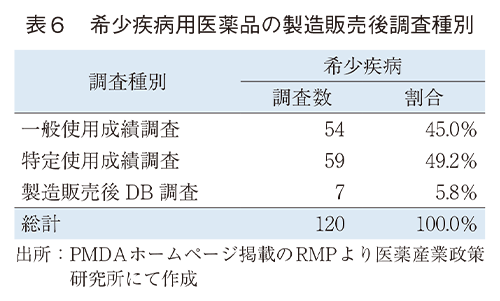
- レンビマ:胸腺癌(一変)
- イムブルビカ:造血幹細胞移植後の慢性移植片対宿主病(一変)
- ジャカビ:造血幹細胞移植後の移植片対宿主病(一変)
- レズロック:造血幹細胞移植後の慢性移植片対宿主病(承認:新有効成分)
- レブロジル:骨髄異形成症候群に伴う貧血(承認:新有効成分)
- トレプロスト:間質性肺疾患に伴う肺高血圧症(一変)
- リブマーリ:アラジール症候群及び進行性家族性肝内胆汁うっ滞症における胆汁うっ滞に伴うそう痒(承認:新有効成分)
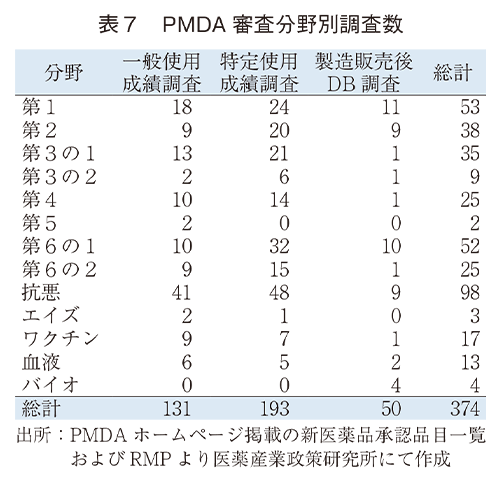
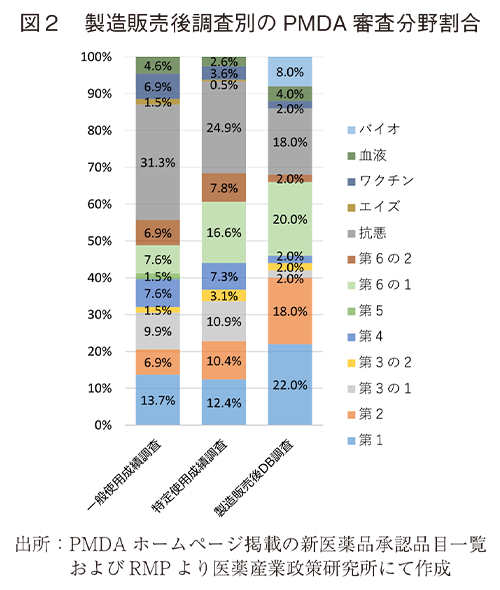
審査分野別の調査数を見ると、調査数の総計は抗悪(98調査)、第1(53調査)、第6の1(52調査)の順で多い。一方で、DB調査数は第1(11調査)、第6の1(10調査)、第2と抗悪(各9調査)の順となっていた。また、バイオはDB調査のみとなっており、エイズ、第5は5年間を通してDB調査は0件であった。第3の1、第4、第6の2は相当数の調査数があるが、DB調査は1調査に留まり、DB調査の割合は低い。(表7、図2)
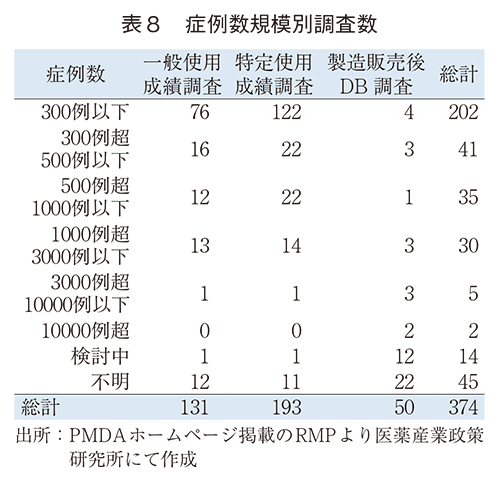
製造販売後調査における症例数規模を見ると、一般および特定使用成績調査では300例以下の調査がそれぞれ58.0%、63.2%を占めており、500例以下でほぼ70%以上を占めていた。一方で、DB調査では300例以下から10,000例を超える調査まで幅広い規模の調査に利用されていることが分かる。DB調査では症例数検討中または不明の調査が多く認められており、この理由としては、DB調査実施の方針は決定しているが、詳細計画検討中の状況であるものが多数であった。また、従来調査における症例数不明の計画は、全例調査の計画が主なものとなっている。(表8、図3)
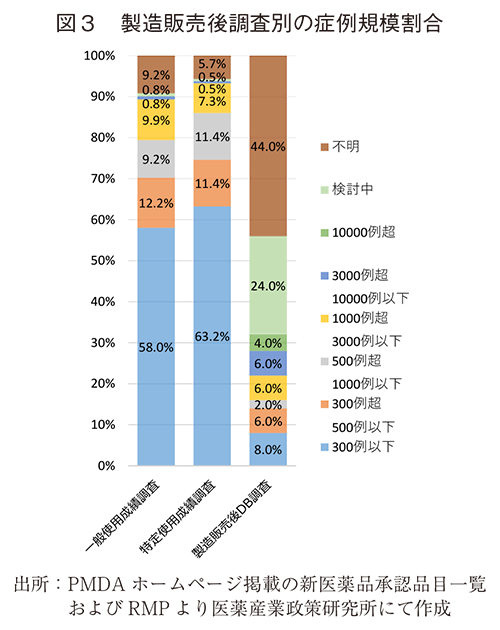
製造販売後調査における対照群設定の有無について、一般および特定使用成績調査では対照群を設定することは想定されないが、一方で、DB調査では全50調査中36調査(72.0%)で対照群が設定されていた。(図4)
3-1-3 DB調査の内訳
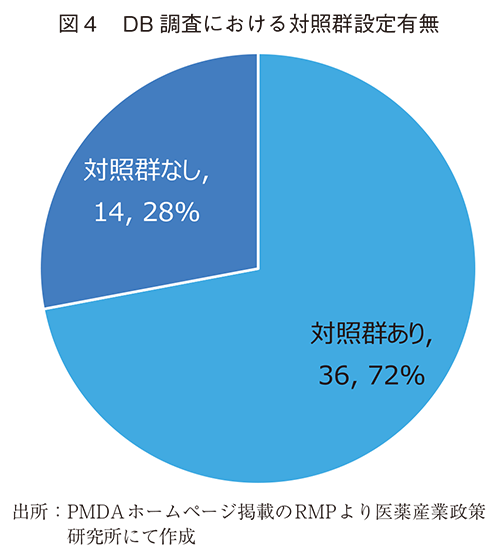
DB調査について、さらに状況を深堀すべく実際に利用しているデータベースの種類を調査し、図5にその割合を示した。
利用されているデータベースはメディカル・データ・ヴィジョン(以下、MDV)が最も多く、Medical Information Database Network(以下、MID-NET)、JMDCが続き、この3種で約50%を占めていた。検討中、不明の調査も複数認められた。複数のレジストリも活用されており、合算するとMID-NETと同じ割合を占める。活用されているレジストリは具体的にTRUMP-GVHD、PIDJ2、CIRCLeであった。それぞれのレジストリ内容を以下に示す。
〈TRUMP-GVHD〉同種造血細胞移植後合併症である移植片対宿主病(graft-versus-host disease, GVHD)に関する詳細な臨床経過情報を収集するために設計されたelectric data capture system(以下、EDCシステム)6)。
〈PIDJ2〉原発性免疫不全症・自己炎症性疾患・早期発症型炎症性腸疾患の遺伝子解析と患者レジストリ7)。
〈CIRCLe〉小児期発症の肝疾患を対象とした多施設前向きレジストリ研究8)。
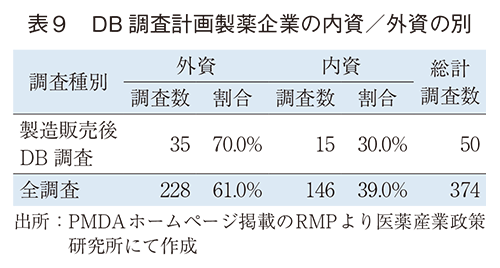
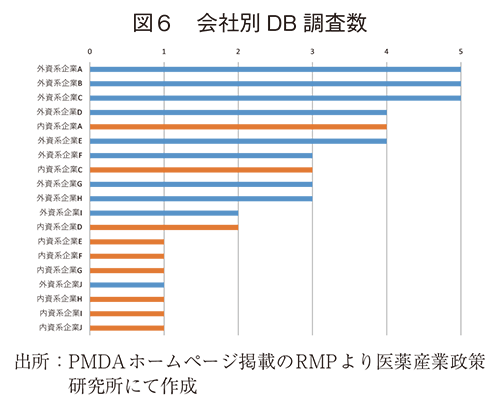
また、DB調査を計画している製薬企業の内資/外資の割合および各企業の実施数を外資系企業・内資系企業の区分でそれぞれ表9および図6に示した。内資/外資の内訳としては、全調査374調査のうち外資228調査(61.0%)に対して内資146調査(39.0%)であったが、DB調査(全50調査)の実施割合は外資35調査(70.0%)、内資15調査(30.0%)と、内資に比べて外資で計画している数が多いといえる。各企業別のDB調査実施数をみると、1社で複数を計画している企業が多く認められ、3調査以上を計画している企業は10社であった。
3-2 DB調査利活用による経済性評価
3-2-1 製造販売後調査の流れと経済性評価関連項目
従来の使用成績調査の流れを図7に示した。従来の使用成績調査は調査計画作成から始まり、主に施設選定、依頼契約、症例登録、調査票回収、データマネジメント、統計解析およびメディカルライティングといったプロセスで進められる。一方でDB調査は従来の使用成績調査の施設選定からデータマネジメントまでのプロセスがデータベースからのデータ抽出に置き換えられる。
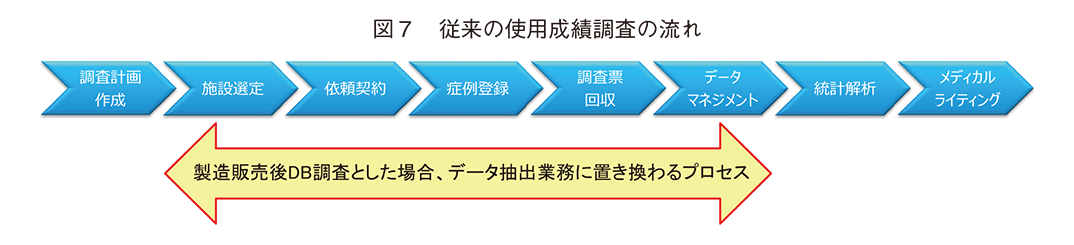
従来の使用成績調査での調査計画作成プロセスは、これまでの使用成績調査の経験等を参考にして計画立案できるため、作業負荷は軽度で短期間での対応が可能といえる。これに対してこれまでの経験の蓄積が少なく、製品単位でデザインやアウトカム設定の確からしさ、データが存在し得るかなどを検討することが必要となるDB調査は作業の難易度が高い。また、データベース選定やデータベース事業者との契約、計画立案打合せに加え、適切な計画策定においてPMDAとの相談を行うことが主流となっているため、相応の準備期間が必要となる。一方で、従来の使用成績調査での調査計画作成プロセスは基本的に承認後速やかに完了させる必要があるが、DB調査では統計解析に用いるデータ抽出までに完了していればよく、調査計画作成に充てる時間は従来の使用成績調査よりも長く確保できる。
従来の使用成績調査では、調査を依頼する医療機関に対する契約やモニタリング業務など施設単位での対応が必要となり、全調査期間を通して継続的に作業負荷、人員、工数がかかる。この業務は内製化される場合には製薬企業における各施設担当MRの工数を利用することとなる。近年ではこの業務を開発業務受託機関(以下、CRO)に外部委託する企業もあり、その場合には委託料が発生するため、外部コストを要する。近年の調査ではEDCシステムを利用した調査が主流となっており、この場合、システム初期設定並びに運用コストが発生する。また、医療機関に対しては調査実施のための報酬、経費等コストの支払いが必要になる。
医療機関においても、調査業務の受託に伴う人員確保や、工数の負担がかかる。特に担当医師においては、調査票作成業務に対する負荷が発生する。
対するDB調査に関するコストは、主にデータ抽出にかかるデータベース利用料であり、医療機関での作業負荷、EDCシステムや医療機関に対する報酬等のコストは発生しない。データベース事業者は統計解析、メディカルライティングを受託業務範囲としていない場合が多いことから、これら業務を外部委託する場合には、別途委託先の選定、契約等の対応を行う必要があるが、このプロセスについての委託は従来の使用成績調査でも実施されている範囲と大きな違いはないと考えられる。
3-2-2 コストメリット試算
本項では、製造販売後調査における従来の使用成績調査とDB調査の経済性を比較する。評価にあたっては製造販売後調査のプロセスのうち、統計解析ならびにメディカルライティングに関わる工数、社内人件費および業務委託コストなどに大きな変動がないことを前提とし、これら以外のプロセスにおいて必要となるコストの差額をコストメリットと考えた。従来の使用成績調査をDB調査に置き換えることが可能な試験割合を掛け合わせることで、複数年におけるDB調査利活用の経済性評価として試算した。なお、本章では実際に金銭の授受が発生する費用項目に加え、医療機関における作業負担など、金銭支出を伴わないリソース消費として無視できない要素についても、可能な範囲で金銭換算による試算を行っている。
従来の使用成績調査にかかる費用
①医療機関へ支払う調査費用、②医療機関スタッフ工数、③医療機関へのモニタリング費用および④EDCシステムセットアップ費用の試算を行った。ただし、これらの項目は調査・試算可能な特定の業務に限定していることに加え、用いた原単位は調査可能な範囲での平均値や代表的な指標等を援用した試算であることに留意が必要である。
① 医療機関へ支払う調査費用
国立病院機構「受託研究費算定要領」9)を参考として、1調査票作成当たりの医療機関への報酬額(事務費、管理費を含む)を一般使用成績調査2.86万円、特定使用成績調査4.29万円と想定する。日本製薬工業協会 ファーマコビジランス部会(以下、PV 部会)によると、分冊ありの調査割合は約55%を占めると報告されており10)、55%の症例では2調査票の作成がなされると仮定し、300例、1,000例又は3,000例それぞれの規模に対する1試験の調査費用を以下のように試算した。
一般使用成績調査
2.86万円×(300例+300例×0.55)
=1,329.9万円
2.86万円×(1,000例+1,000例×0.55)
=4,433万円
2.86万円×(3,000例+3,000例×0.55)
=1億3,299万円
特定使用成績調査
4.29万円×(300例+300例×0.55)
=1,994.85万円
4.29万円×(1,000例+1,000例×0.55)
=6,649.5万円
4.29万円×(3,000例+3,000例×0.55)
=1億9,948.5万円
なお、複雑な作業が伴う調査では、さらに報酬額が高額となる。また、3報告目以降の追加調査票作成が必要な場合には、さらに上記単価分の追加コストが発生する。
② 医療機関スタッフ工数
医療機関スタッフの代表的な業務として、担当医師が調査票を作成するコストを試算した。PV部会によると、1調査票の記載事項は平均76項目と報告11)されており、1項目1分弱として約1時間で作成されると仮定した。医師の給与額は労働時間当たりの給与額が示されている令和6年賃金構造基本統計調査12)から平均時給(病院規模計100~999人、所定内給与額121万4,600円/所定内実労働時間数157時間)約7,700円を算出した。ただし、本給与額は手当や賞与に関する支給額は考慮しておらず、また、時間外勤務を想定していない。
7,700円×1時間×(300例+300例×0.55)
=358.05万円
7,700円×1時間×(1,000例+1,000例×0.55)
=1,193.5万円
7,700円×1時間×(3,000例+3,000例×0.55)
=3,580.5万円
③ 医療機関へのモニタリング費用
従来の使用成績調査では、医療機関に対する契約やモニタリング業務を内製で対応する場合、各施設担当MRの工数を充てて実施することが一般的であるが、内製業務の人件費に係る定量的な試算は困難であったことから、本試算ではこれら業務をCROに委託する場合を想定し、情報収集を行った。CRO業務委託費用は調査計画の複雑さ、調査規模、医療機関数、期間、委託業務内容等さまざまな要因によって見積もられるため、コスト幅が広く公開されている具体的な情報を得ることが難しかったため、専門家へのインタビューにより得た情報より、主にモニタリング費用並びにプロジェクトマネジメント費用として1億円程度(300例規模を想定)のコストがかかっているものと結論付けた。本コストは、施設訪問に際しての交通費は考慮しておらず、また、症例数規模等の増加によってさらに高額となる。
④ EDCシステムセットアップ費用
製造販売後調査データ収集システムとして国内PMS/EDCシステムトップシェアを標榜している富士通エフ・アイ・ピー「PostMaNet」の価格情報13)を参考に以下のように試算した。ただし、2014年の同社プレスリリース上の参考価格であり症例数は499症例以下の月額料金50万円を使用し、通常製品の再審査期間8年の利用を前提とした。なお、同社初期費用は個別見積りであったことより、臨床開発用EDCシステムの価格が公開されている他の3社費用を比較し、最も低価格であった120万円を採用した。
初期費用 120万円+運用費用 50万円×12ヵ月×8年
=4,920万円
DB調査にかかる費用
PMDAとの相談費用(医薬品データベース/レジストリ信頼性調査相談および疫学調査計画相談)14)とデータベース利用料を調査した。
① PMDAとの相談費用

② データベース利用料
DB調査に利用実績のあるデータベースのうち、利用料が公表されているMID-NET利用料15)を参照した。

過去5年間の製造販売後調査に基づくコストメリット試算
症例規模300例、調査期間は通常の再審査期間の8年間、PMDA相談2種各1回実施を前提として従来の使用成績調査費用、DB調査費用およびコストメリットを以下のように試算した。
- 従来の使用成績調査費用:計約1億7,000万円
(医療機関へ支払う調査費用 1,728.87万円*
+医療機関スタッフ工数 358.05万円
+医療機関へのモニタリング費用 1億円
+EDCシステムセットアップ費用 4,920万円)
*:本稿の調査期間における一般使用成績調査と特定使用成績調査の割合(131:193≒2:3)で以下のように試算
1,329.9万×2/5+1,994.85万×3/5=1,728.87万円 - DB調査費用:計約4,700万円
(PMDA相談費用 211.21万+300.79万
+DB利用料 4,212.3万円) - コストメリット:総計約1億2,300万円
2020~2024年度に計画立案が指示された調査数は374調査であった。2017年に厚生労働省のワーキンググループが製造販売後調査で想定されるMID-NETの利活用数の試算を行っており、2015年度に承認された新医薬品の40.0%にDB調査実施の可能性があると試算16)されている。この数値を参考に、すべての調査のDB調査への置き換えは難しいことを踏まえ、約半数(約20%)のDB調査への置き換えが実現すると仮定すると、過去5年間の使用成績調査をDB調査に移行することによる経済性効果は以下のように試算できる。
374調査×DB調査移行率20%×1試験コストメリット1億2,300万円
≒92億円
4.まとめと考察
4-1 製造販売後調査の最近の動向
本稿で調査を実施した2020から2024年度の新医薬品承認品目数に対する初回RMP数の割合は37.0%であった。内訳は新有効成分含有医薬品が多くを占め、その他の製品で各年度数件認められた。
承認により新たに計画された調査の推移をみると、調査総計は2024年度に急な減少がみられた。全体の承認品目数、特に新有効成分においても、また、初回RMP策定の数字においても大きな変化は見られないことから、これらの各調査数の減少は、製造販売後調査の在り方の見直しにより「医薬品の製造販売後調査等の実施計画の策定に関する検討の進め方について」(以下、ディシジョンツリー通知)の一部改正通知17)が発出された影響によるものと推察できる。このような中で数値としては横ばいに見えるDB調査は割合としては増加傾向であり、各調査の選択の在り方も変化している可能性がある。
一方で、全例調査の数においては総調査数の減少によって調査数の低下は認められたものの、割合としては横ばいの状況であった。しかしながら、この内訳をみると、一般使用成績調査における全例調査割合は減少し、特定使用成績調査における全例調査割合が上昇しているともいえる。ディシジョンツリー通知の改正により、全例調査の在り方が大きく見直されており、全例調査は減少ないしは特定の範囲での実施に絞られていく可能性があり、今後の推移に注目したい。なお、DB調査においても全例調査を計画した調査があり、選択するデータベースや疾患(現時点では希少疾病での実施の可能性が高い)によってはDB調査における全例調査実施の可能性があるといえる。今後、各種公的データベースやレジストリ等の整備、連携が進むことにより、このような対応の可能性が拡大することが期待される。
新医薬品承認品目中で希少疾病用医薬品における製造販売後調査のうち7調査5.8%がDB調査であった。希少疾病を対象とする治験では小規模に留まりがちな部分を、データベースを活用し補完する可能性もあると考えられる。また、同種同効品での計画履歴があることで次のDB調査の計画を促進する可能性が高まるといえる。
PMDA審査分野ごとにみると、主に承認品目数の多い審査部門における調査数が多いことが言えるが、一方で調査の指示割合が比較的少ない分野も存在する。特に第5分野は37品目の承認があるにもかかわらず一般使用成績調査が2調査のみとなっている。第5分野は泌尿生殖器官・肛門用薬ならびに医療用配合剤の担当となっており、医療用配合剤の有効成分は一定の安全性が評価された既承認成分であることが多いことが背景にあると考えられる。DB調査数をみると、実施割合の高低に分野ごとの違いが認められた。要因としてはPMDA担当分野ごとの受容度の違い、積極的なデータベース利活用を進める製薬企業の開発分野の傾向あるいは疾患ごとのDB調査の適用の向き不向きなどが考えられるが、その特定は難しく今後の動向を注視したい。
症例規模別の集計からは、一般および特定使用成績調査では300例以下の調査が最も多く60%程度であり、10,000例を超える調査は認められなかった。一方で、DB調査では幅広い症例数が設定されており、症例数に対する許容幅の広さが目立った。症例数規模と作業負荷やコスト増加が比例する傾向にある従来の使用成績調査に対して、DB調査は症例規模による作業、コストへの大きな影響がない点は、DB調査を選択する場合の理由のひとつとなる。しかしながら、症例数検討中や不明とされている調査が多く認められ、実際の割合を反映しているかどうかは不明である。DB調査では、承認審査時点ではDB調査実施について合意し、承認を得た後、具体的な調査内容についてはPMDA相談等を経て計画を最終化するため、評価時期に合わせたデータ抽出を行う時点までに症例数等を含めた計画の最終化が行われている状況が伺われる。
また、従来の使用成績調査では対照群の設定は想定されないが、一方でDB調査では対照群が設定された調査は72.0%と高い割合を示した。大規模で対照群を設定した調査を実現しやすい点はDB調査ならではのメリットであるといえる。
利用されているデータベースの種類はMDVやJMDCといった商用データベース、MID-NET、疾患別レジストリ3種などで非常に限定されていた。これらのデータベースは、データベース事業者が個々に診療情報を収集するものであり、それぞれに対象集団や格納情報、構造等に特徴や限界がある。当局が推進している各種公的データベース構築、医療情報の連結などの整備により、DB調査でも選択できるデータベースが増加し、利活用が進んでいくことを期待したい。
DB調査を計画している製薬企業は内資に比較して外資で多く、日本国内での従来の製造販売後調査のノウハウを持つ内資と、外国の医療データ利活用のノウハウを持つ外資との選択の違いが表れているとも解釈することができる。また、DB調査を計画している企業は1社で複数の計画をしている実態から、はじめてDB調査を選択するところに高い壁があると推察された。
4-2 DB調査の経済的評価
本稿では医療情報利活用における経済的メリットを評価する一事例として、DB調査の活用による経済的評価(コストメリット)を試算した結果、300例規模の調査における従来の使用成績調査とDB調査の試算可能な項目による比較において、1試験1億2,300万円のコストメリットがあると試算された。この数値から、従来の使用成績調査をDB調査に移行することによる経済的効果を5年間で約92億円と算出した。
ただし、これらの試算には多くの制約があることに留意が必要である。ひとつには本稿で示すことができた試算項目は限定的であり、実際のコストは調査の種類・規模、内容の複雑性、期間、モニタリング方法、相談回数、使用するデータベースなど、さまざまな条件によって大きく変動する。また、特に多数の安全性検討事項(以下、SS)が設定されている製品においては、従来の1使用成績調査で確認できるSSを、必ずしも1DB調査で捉えられるとは限らない。
一方、厚生労働省のワーキンググループやPV部会は従来の使用成績調査の中にDB調査で代替可能な事例があることを報告しており、DB調査が適用可能であるにも関わらず、十分にこのメリットを利用できていない製品が存在する可能性が示唆されている。なお、本稿では、厚生労働省ワーキンググループの報告を基に試算を行ったが、PV部会の2024年度活動において、従来の使用成績調査のうちDB調査の実施が可能であったと考えられる割合は23.3%(全てのSSをDB調査でカバー可能な調査4.9%、一部のSSのみDB調査で実施可能な調査18.4%)であることが報告18)されており、DB調査への移行可能率については今後の検討課題である。しかしながら、これらの試算割合には全例調査や希少疾病用医薬品の調査は含んでいない。本稿での調査結果では、特に希少疾病用医薬品でのDB調査の実績があることや、昨年度実施された製造販売後調査の在り方の見直しによるディシジョンツリー通知改正により、全例調査の対象が絞られていく可能性、各種データベースの整備やバリデーションの促進により、利活用可能なデータベースやレジストリの数が増加し、評価可能となるSSの幅が広がると考えられることなどから、今後DB調査の利活用可能率は上がっていくものと推測される。
従来の使用成績調査は通常症例数300例規模の調査が主流であったが、DB調査では対照群を設定できることや、数千例規模での実施も可能であるため、選択するべき状況がそもそも異なる可能性もある。
これらを踏まえ、また、ディシジョンツリー通知に基づく追加の安全性監視活動の要否および製造販売後調査の選択は、それぞれの製品の特性、目的等に合わせ、最適なものを設定する必要があり、従来の使用成績調査のすべてをDB調査に置き換えることができるものではないと考えられる。これらの特徴や利点を理解したうえで、DB調査のコストメリットを最大限に生かす選択をしていくことが重要と考えられた。
5.おわりに
わが国では、医療DXが進行する中、その効果や試算手順については、これまで十分な調査研究が行われておらず、個々の実例などを示すに留まっている。本稿では、近年日本において推進されている医療DX促進の要となる医療情報基盤構築による製薬企業の医療情報利活用における経済的メリットに注目し、代表的な事例となる製造販売後調査におけるDB調査の活用状況について検討を行った。
医薬品のDB調査は2018年以降、当局が認める製造販売後調査の一形態となったが、現時点においてもその活用が十分に進んでいるとは言い難い状況であった。背景には、全例調査が依然として一定の割合を占めており、現在利用可能なデータベースで対応できるものが非常に限られていること、規制対応で求められるレベルの信頼性確保や継続的、長期的なフォローが可能で利活用の同意取得などの整備がなされたデータベースが不十分であること、利活用に必要なバリデートされたデータベースの充足性に課題があること、そして製薬企業における利活用が一定の企業の範囲に留まり、利活用能力やノウハウに偏りがあることなど、複数の課題が存在している。
一方で、DB調査の利活用によって、一定の条件下ではあるが、製造販売後調査に対する負担軽減が図られる、つまり経済的メリットが認められる試算結果を得ることができた。このことは、今後適切な状況を捉え、DB調査を選択していくことの意味付けを与えるものである。
本報告は製造販売後調査に焦点を当てた報告としたが、医療DX推進による種々の活動における経済的影響を整理し、経済性評価を行うことは、医療情報利活用の意義を考え、理解、把握し、各種ステークホルダーの意識を高め、共通認識を持つこと、ひいてはわが国の医療DXを促進することに貢献する。そして、推進に際しての課題等への積極的な取組みを促進するひとつのきっかけを作るものと考えられる。今後の医療情報の活用が実効性のあるものとなるよう、製薬企業における医療情報の積極的な活用と、規制当局、あるいは関係する研究機関等による継続的な経済性評価、効果検証がなされていくことを期待したい。
-
1)
-
2)
-
3)
-
4)平成29年10月26日付け厚生労働省令第116号「医薬品の製造販売後の調査および試験の実施の基準に関する省令の一部を改正する省令」
-
5)
-
6)
-
7)
-
8)
-
9)国立病院機構、「受託研究費算定要領」2020年3月30日改訂版
-
10)日本製薬工業協会 医薬品評価委員会 ファーマコビジランス部会、内部資料
-
11)日本製薬工業協会 医薬品評価委員会 ファーマコビジランス部会、内部資料
-
12)厚生労働省、令和6年「賃金構造基本統計調査」
-
13)富士通エフ・アイ・ピー株式会社、プレスリリース「製造販売後調査データ収集システム「PostMaNet」の新バージョ ンを販売開始」(2014年6月30日)
-
14)
-
15)
-
16)平成29年6月28日付け厚生労働省「医療情報データベースの運営の経費等に関するワーキンググループ報告書」
-
17)令和6年7月18日付け医薬薬審発0718第1号、医薬安発0718第1号「「医薬品の製造販売後調査等の実施計画の策定に関する検討の進め方について」の一部改正について」
-
18)日本製薬工業協会 医薬品評価委員会 ファーマコビジランス部会 継続課題対応チーム6、令和5年度成果報告会「薬剤疫学に基づくDB調査・比較調査に関する課題対応」(2024年3月)

