目で見る製薬産業 小児用医薬品の国内承認及び収載に関する最新動向
医薬産業政策研究所 主任研究員 吉浦知絵
医薬産業政策研究所 主任研究員 吉野九美
医薬産業政策研究所 主任研究員 白石隆啓
要約
- 小児用医薬品に対するニーズは高いものの、開発難易度や採算性などの観点で課題が残っている。
- 2018年1月から2024年12月に日本で承認された新医薬品のうち、小児適応に関連する承認は237件あり、うち72件が新有効成分医薬品であった。小児適応に関連する承認件数は最大でも各年の全承認件数の3割程度であったが、小児適応に関する承認件数及び全承認件数に対する割合は調査期間中で増加傾向を示した。
- 分析対象とした小児適応関連の承認のうち、40%が希少疾病用医薬品であった。申請データの動向として、公知申請によるものが10%、海外臨床試験成績のみでの承認は4%であった。その他は日本国内のデータを取得しており、日本を含む国際共同治験を実施したものが41%、その他は45%であった。
- 同一の疾患において成人での承認取得から小児の承認取得までのラグ期間について調査したところ、小児適応の承認のうち77%が成人からの遅れなく承認されていた。
- 薬価上の評価に関しては、収載時の加算では2024年度では突出して規格間調整のみの算定における特例(小児加算)への該当件数が多かった。薬価改定時の小児加算は件数も増加傾向だが、2024年度以降で高い加算率に該当したものが顕著に増加した。
1.はじめに
小児用医薬品は医療ニーズが高いものの、一般に成人と比べて開発が進みにくいことが問題視されている1、2)。また、医薬産業政策研究所でも小児用医薬品の欧米に対するドラッグ・ラグの懸念を指摘している3、4)。これに対して近年では薬事制度、薬価制度の両面から小児用医薬品の開発促進につながる制度変更が発出されている。例えば薬事制度においては、小児用医薬品の開発計画の策定に関する考え方の整理5、6、7)や、独立行政法人医薬品医療機器総合機構(以下、PMDA)における開発計画の相談受付8)が開始され、また薬価制度としては、小児加算の加算率の柔軟な判断や新薬創出等加算の品目要件への小児用医薬品の追加、成人開発と同時に小児開発計画を策定し承認を得た場合の加算率引き上げ、市場拡大再算定における補正加算への小児用の開発計画に基づき開発が進められている既収載品の追加などの変更があり9)、一層の開発促進へ向けて環境の整備が進められている。
本稿では、小児用医薬品の新薬開発の最新動向を可視化することを目的として、PMDAがホームページ等で公表する審査報告書、添付文書、インタビューフォーム等の情報から小児適応に関する情報を抽出し、その経時変化などを分析した。また、中央社会保険医療協議会などの資料をもとに小児用医薬品を開発した企業に対する評価の動向についても分析したため、これらについて報告する。
2.調査方法
本稿における小児用医薬品の承認件数に関する調査対象は、PMDAホームページの「新医薬品の承認品目一覧」10)に掲載されている医薬品とし、2018年1月から2024年12月の承認を対象として承認件数は審査報告書1報につき1カウントとした。小児適応に関する承認の抽出は、審査報告書、添付文書、インタビューフォームにおける「効能又は効果」または「用法及び用量」に小児への使用が明記されているものに加え、「用法及び用量」で成人の使用に制限されていない品目でかつ小児への使用が制限されていない品目11)を解析対象とした。
新有効成分の承認については、「新医薬品の承認品目一覧」10)にて新有効成分含有医薬品の記載があるものとした。小児適応を持つ新効能の承認について、「小児に関する新効能」として分類した。なお本稿では、成人の既承認効能に、小児に対する用量の追加をはじめて行った場合(新用量医薬品としての一変承認)も「小児に関する新効能」として分類した。また、小児同一効能における対象年齢の拡大、用法及び用量の追加などの承認は「その他」として分類した。ワクチン類については別にカウントした。「新医薬品の承認品目一覧」10)に希少疾病用医薬品と明記されているものを希少疾病用医薬品として集計した。
申請データの動向は、審査報告書にて評価資料として提出された試験の分類をもとに集計した。なお、「新医薬品の承認品目一覧」10)における特記事項の内容が「適応外使用通知に基づく申請」、「事前評価通知に基づく申請・事前評価品目の審査通知に基づく迅速審査」、もしくはそれに準ずるものを「公知申請」と分類した。成人と小児のラグに関しては、審査報告書、添付文書、インタビューフォーム中の「効能又は効果」の記載をもとに同一効能と判断したものについて調査した。承認日は「新医薬品の承認品目一覧」10)に記載された承認日とした。なお、小児の適応のみ、もしくは小児の適応が成人に先行して承認されたものについては、小児が成人から遅れたわけではないとして今回の調査では「ラグなし」に含めた。
本稿で調査対象とした小児用医薬品に関する新薬収載時の加算などの情報は、中央社会保険医療協議会12)の資料である「新医薬品一覧表」から集計した。薬価改定時の加算(以下、改定時加算)に関する情報は診療報酬関連情報13)に関する資料から集計した。同一成分、同一投与形態、同一効能効果は1カウントとし、改定時加算の加算率が銘柄で異なる場合は高い方で集計した。なお、2018年1月から2024年12月に承認された医薬品が原則収載もしくは改定時の評価をされる時期として、収載状況は2018年度から2024年度を、改定状況は2020、2022、2024、2025年度14、15、16)を調査対象期間とした。これは、多くの場合は承認から原則60日以内、遅くとも90日以内に収載される17)こと、そして、改定時加算は2年または1年分の承認をまとめて薬価改定時に評価されることを踏まえて判断した。ただし、承認状況の調査とは情報源が異なるため対象範囲は完全には一致しない場合もある。
3.結果
(1)小児適応を持つ新医薬品の国内承認件数
2018年から2024年の間に日本で承認された新医薬品のうち、小児適応に関連する承認件数の年次推移を図1に、承認件数の内訳を図2に示した。小児適応に関する承認は7年間で237件あり、ワクチン類を除くと210件であった。図1で示したとおり、2018年から2024年までの小児適応に関する承認件数は増加傾向を示した。全承認件数に対する小児適応に関する承認件数の割合(ワクチン類除く)を算出したところ、調査期間において2024年が最も高く(35.2%)、過去の調査18)で報告したように、不妊治療薬の効能追加が突出して多かったため新医薬品全体の承認件数が多く小児適応の件数が相対的に低くなった2022年を除き、おおむね増加傾向を示した(図1)。
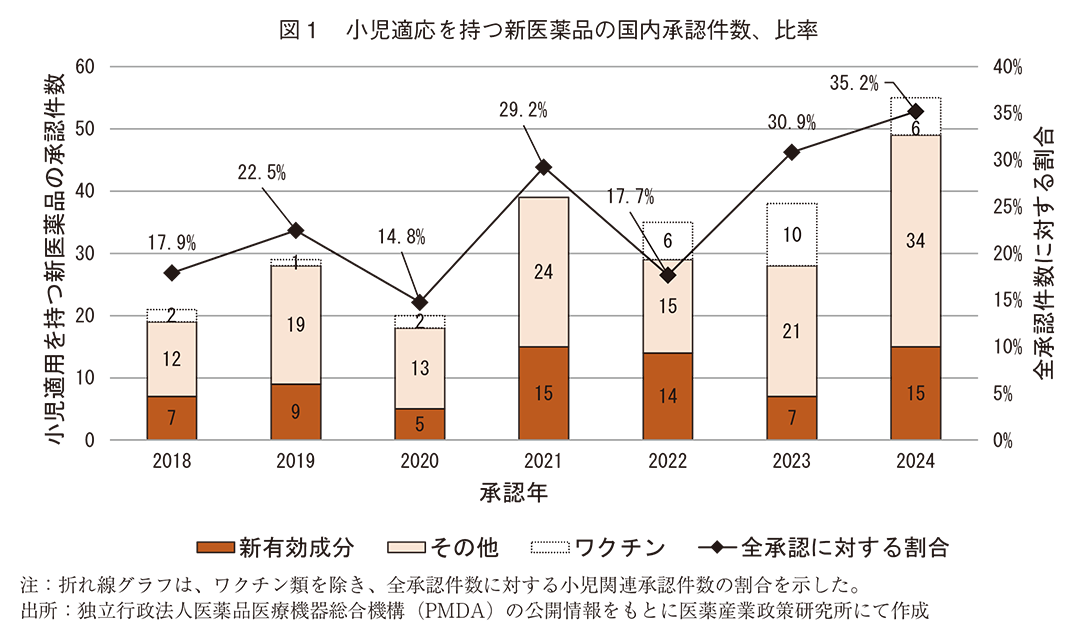
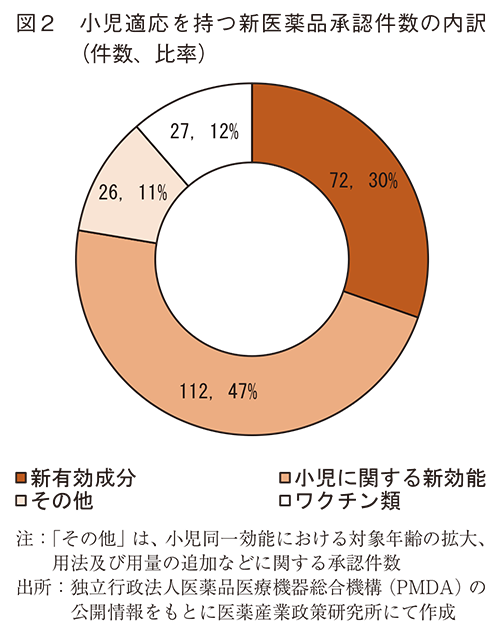
承認件数の内訳は、新有効成分含有医薬品が72件(30%)、小児適応を持つ新効能の承認が112件(47%)、その他(小児同一効能における対象年齢の拡大、用法及び用量の追加など)が26件(11%)あった(図2)。
本稿における3.結果(2)~(4)では図2で示した新有効成分及び小児適応を持つ新効能に関する承認184件について分析した。
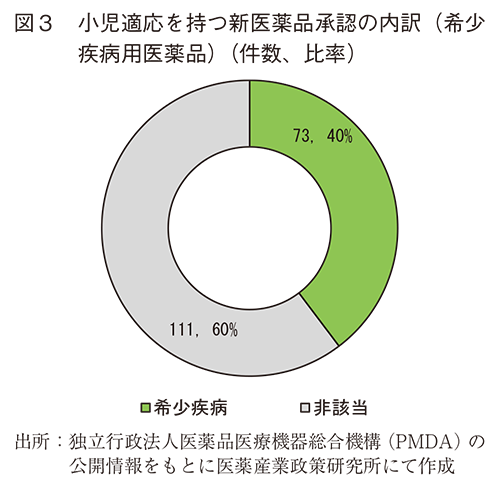
(2)小児適応を持つ新医薬品の国内承認件数の内訳(希少疾病用医薬品)
2018年から2024年の間に日本で承認された小児適応を持つ新有効成分含有医薬品(72件)及び小児適応を持つ新効能の承認(112件)について、希少疾病用医薬品の指定の有無について調査した。その結果、図3のとおり小児適応に関連する承認件数のうち希少疾病用医薬品に該当するものは73件(40%)であった。
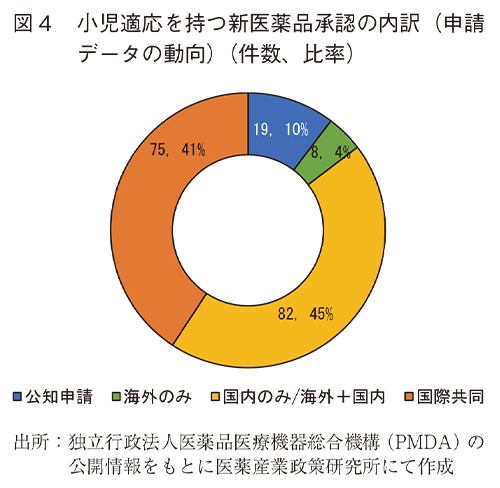
(3)小児適応を持つ新医薬品の国内承認件数の内訳(申請データの動向)
2018年から2024年の間に日本で承認された小児適応を持つ新有効成分含有医薬品(72件)及び小児適応を持つ新効能の承認(112件)について、申請データの動向を調査した。その結果、図4のとおり公知申請によるものが19件(10%)であった。評価資料として臨床試験成績が提出されたもののうち、海外臨床試験成績のみでの承認は8件(4%)であった。国内での臨床試験が提出されたものが82件(45%)、日本を含む国際共同治験(以下、国際共同治験)が評価資料に含まれるものが75件(41%)であった。
(4)成人から小児までのラグ
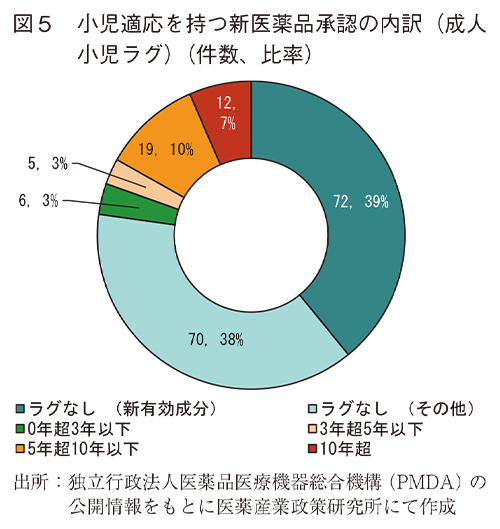
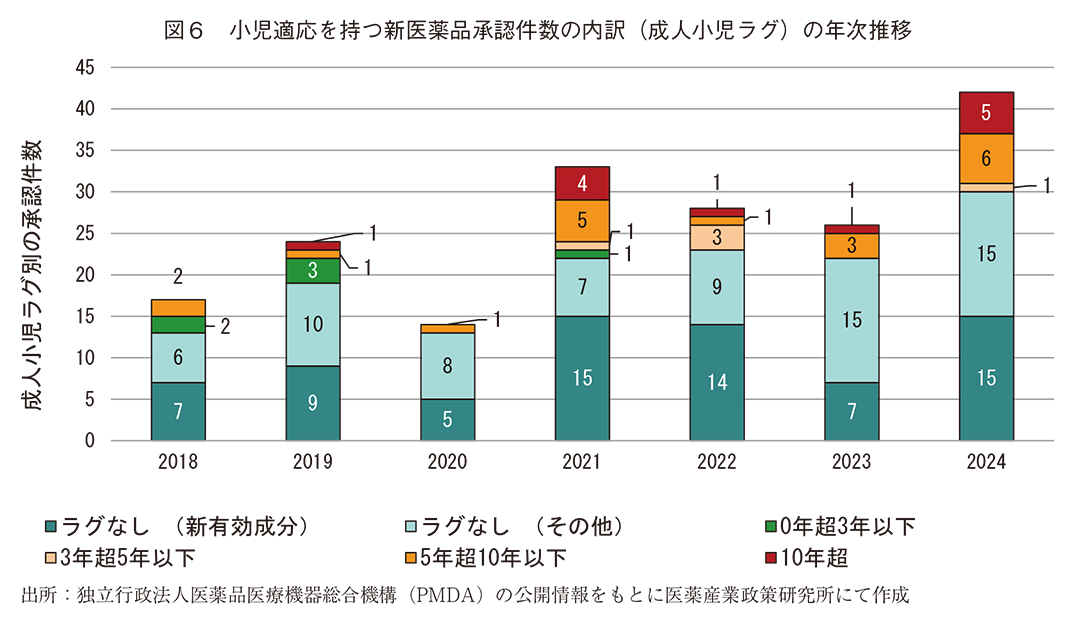
2018年から2024年の間に日本で承認された小児適応を持つ新有効成分含有医薬品(72件)及び小児適応を持つ新効能の承認(112件)について、同一効能の成人の用法及び用量が初めて承認された時点からのラグ(経過期間)とその年次推移について調査した。その結果、図5のとおり、分析対象とした184件のうち成人小児ラグなしが142件(77%)であった。そのうち新有効成分含有医薬品は72件(39%)であった。ラグが3年以下のものは6件(3%)であり、これらを合わせると80%が成人での承認後3年以内に小児に関する適応も承認されていた。また、これらの内訳の年次推移を図6に示した。
(5)薬価上の評価(加算の動向)
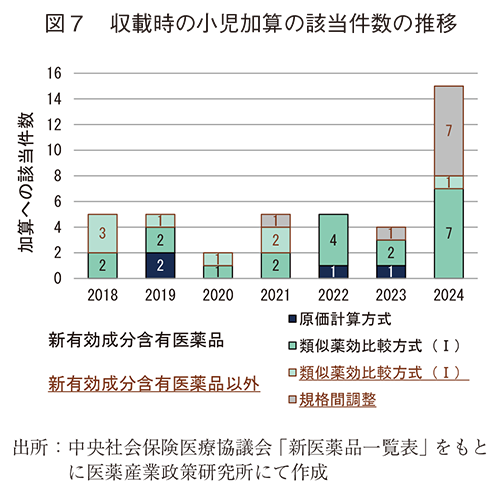
2018年から2024年の間に日本で承認された小児適応に関連する新医薬品の薬価上の評価を確認する目的で、収載時と改定時の加算の状況を調査した。収載状況に関しては、図7に小児加算の該当件数の推移を示した。小児加算は市場性加算Ⅰと併算定不可のため、小児加算の件数のみを考察することは一概には困難であるものの、市場性加算Ⅰの件数は減少していない状況(2022年度:13件、2023年度:9件、2024年度17件)において、2024年度は小児加算の合計件数が増加していた。また、小児加算の中でも「規格間調整のみの算定における特例(小児加算)」の件数が突出して多かった(2018-2023年度:0~1件/年度、2024年度:7件/年度)。小児加算は併算定不可のルールに加えて比較薬が小児加算に該当していた場合にも加算対象外となるため、類似薬効比較方式Ⅰで算定された品目についても件数の考察が困難な一面があるが、規格間調整のみの算定における特例(小児加算)については、先行して成人適応を有する医薬品への小児適応の追加への評価と考えられる。
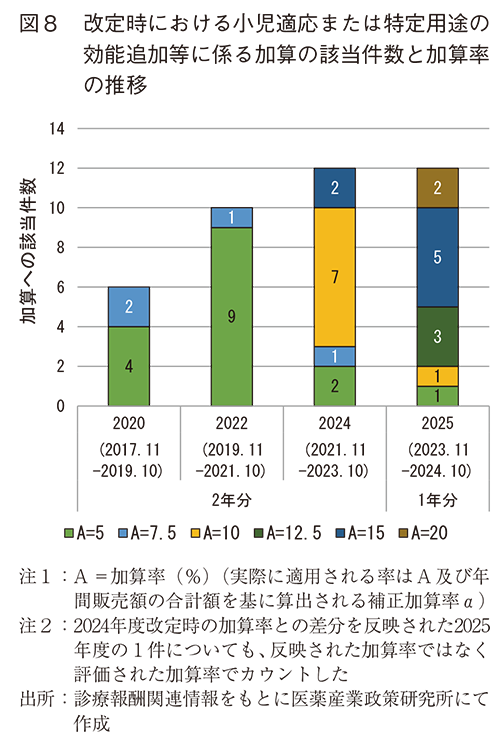
改定状況に関しては、図8に小児適応の効能追加等に係る加算と特定用途の効能追加等に係る加算(小児関連)19)の該当件数の推移を示した。図8のとおり件数としては増加傾向を示していた。2025年度は2024年度と同じ件数となっているが、2024年度までは過去2年分の承認が改定時にまとめて評価されたのに対し、2025年度は過去1年分の承認が評価されたことをふまえると2025年度も含めて該当件数の増加傾向が続いていると言える。一方で、加算率については、2024年度を境に加算率10%以上(A=10以上20))が顕著に増加していた。
4.まとめ・考察
小児用医薬品は医療ニーズが高い一方で新薬開発のハードルの高さがあり、その開発促進に向けては各種議論がなされているところである。本稿では、小児用医薬品開発の最新動向を可視化することを目的として、PMDAの公開データから小児適応に関する情報を抽出しその経時変化などを分析した。また、新薬の薬価収載時、改定時加算の動向についても厚生労働省の公開データから分析した。結果について以下で考察する。
図1で示したとおり、小児適応に関連する承認は最大でも全体の3割程度ではあるものの、2018年から2024年までの小児適応に関する承認件数及び全承認件数に対する割合は増加傾向を示した。小児用医薬品については、冒頭で触れた直近の施策の以前から開発促進に向けた整備は行われており21)、再審査期間の延長22)や特定用途医薬品指定制度の創設23)など小児用医薬品等の研究開発を促す通知が2020年にも出されている。医薬品の開発着手から承認取得までに要する期間を考えると、最近の増加傾向はこれら数年前の施策の効果が反映された可能性もある。今後は、直近の施策の効果も加わり承認件数の増加として見られる可能性が期待される。
図3で示したとおり、小児適応を持つ新有効成分及び新効能の承認件数のうち、40%が希少疾病用医薬品であった。小児用医薬品と希少疾病用医薬品はともに患者数が少ないため、それらが重複した場合には開発がより難しく承認件数は少ないと考えたが、全承認件数における希少疾病用医薬品の割合は2018年から2023年の期間で25%程度であったことと比較すると(医薬産業政策研究所での調査結果)、小児適応に関する医薬品の承認では希少疾病用医薬品の割合は高かった。本稿で調査した小児かつ希少疾病用医薬品の承認では、公知申請が0件、海外臨床試験成績のみでの承認は6件であり、その他の67件では国際共同治験または国内での臨床試験結果により承認を取得していた。小児用医薬品及び希少疾病用医薬品開発についてはその難易度や課題対応など議論されているが、難しい課題であるにも関わらず企業として着実に小児用医薬品の開発を進めている状況であると考えられる。
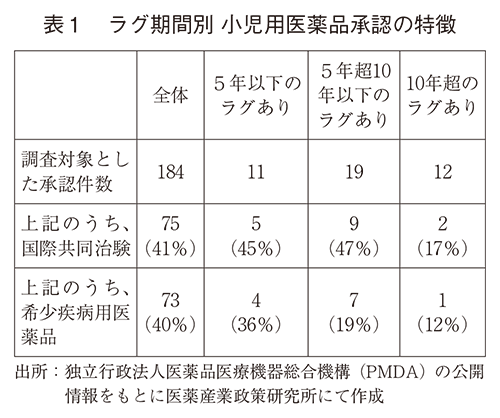
図5及び図6では、本稿で調査した小児適応に関連する新医薬品の承認について、同一効能の成人の用法及び用量が初めて承認された時点からのラグ(経過期間)を分析した。このうち新有効成分含有医薬品が39%、新効能が38%と、77%がラグなし、つまり、成人から遅れることなく小児で承認を取得していた。また、新有効成分含有医薬品全体において小児適応を持つ品目の割合も増加傾向にあり2021年以降は25%以上の水準であった(医薬産業政策研究所での調査結果)。このことから、当該品目の成人での開発段階から小児適応も視野に入れて開発を進めていたものと考えられる。また本稿で調査した小児適応に関連する医薬品の多くが海外での承認実績を持つものであった。欧米では新薬開発時の小児開発計画検討が義務化されていること24、25)や、米国では小児の希少疾病に関連した優先審査のバウチャー・プログラムが導入されていること26)など、海外でも小児用医薬品の開発促進のための施策がある。グローバル製品の割合が多いことによりこれらの海外状況が日本にも影響し、成人小児ラグなしが多いという結果になった可能性が考えられる。実際に、成人効能での承認から10年経過後に小児適応が追加されたラグの長い12件については、ラグが10年以下のものに比べて国際共同治験の割合が顕著に少なかった(表1、ラグ10年超:17%)。一方で、ラグが10年超では国内での臨床試験結果により承認を取得していたものが12件中8件(国際共同治験2件含む)あり、公知申請4件より多かった。これは、既存の医薬品に対する小児への適応拡大が企業主体で積極的に取り組まれた結果と考えらえた。また、希少疾病用医薬品該否別でラグ期間の割合を見ると、ラグの長い承認件数では希少疾病用医薬品の割合が小さかった(表1、ラグ10年超:12%)。すなわち、希少疾病用医薬品に比べて希少疾病用医薬品以外の方が小児適応の開発に時間がかかる場合が多い傾向が見られた。要因については調査できていないが、同種同効薬がある領域では小児を対象とした被験者募集の難易度が希少疾病の場合より高い可能性が考えられる。
ここまでは小児適応に関連する新医薬品の承認に関する動向について考察したが、薬価上の評価についても考察したい。図7に示したとおり、2024年度は規格間調整のみの算定における特例(小児加算)については件数が増加した。また、図8に示したとおり薬価改定時に小児加算を得た件数の加算率の分布が2024年度の前後では異なっていた。加算率という観点では、小児加算は5~20%の範囲で規定されているが、2023年度までは大半の品目で5%が適用され、それを超える加算率が適用されることは稀であった9)。しかし、2024年度の薬価制度改革により柔軟な判断がなされることとなり、より高い加算率で評価されることが増えた。すなわち小児用医薬品開発に対するインセンティブが向上したと考えられ、小児用医薬品開発の課題の一つである採算性に対しての後押しとなり小児開発が漸進することも期待される。今後もその効果の検証と合わせて、小児医薬品に関する開発環境の整備は継続して行われるべきものと考える。
5.おわりに
本稿の調査では、最新年で全体の3割程度であるが小児用医薬品の承認件数の占める割合は増加傾向であることを示した。近年の小児用医薬品の承認において、国際共同治験への参画や成人小児同時の効能追加の占める割合から示されるように、小児用医薬品開発に対する企業の前向きな取り組みの結果であると考えられる。2024年度は小児用医薬品の開発促進に向けた新たな枠組みや薬価制度改革があった。これらの効果による承認数の増加が期待されるとともに、効果の検証に基づいた継続的な環境整備が望まれる。
-
1)日本製薬工業協会 医薬品評価委員会 臨床評価部会、「日本の小児用医薬品承認品目における開発および承認内容の現状と今後に向けた検討」、レギュラトリーサイエンス学会誌、vol. 15、no.1、7-27、2025
-
2)拝郷久満ら、「小児用医薬品の国内開発における課題と今後の展開-小児用の医薬品開発に関する企業へのアンケート調査より-」、レギュラトリーサイエンス学会誌、vol. 14、no.1、5-24、2024
-
3)医薬産業政策研究所、「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その1-希少疾患-」、政策研ニュース、No.69(2023年7月)
-
4)医薬産業政策研究所、「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その2-抗がん剤-」、政策研ニュース、No.69(2023年7月)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)「用法及び用量」で成人の使用に制限されていない品目で、かつ小児への使用が制限されていない品目”については、下記の点を確認し該当する承認件数のみ分析対象とした。・小児を対象とした臨床試験が実施されたもの・審査報告書中で機構の見解として小児への使用が可能と記載されたものなお本稿では、年齢のみの指定の場合は15歳未満のものを小児として取り扱った。
-
12)
-
13)
-
14)2020年度薬価改定では2017年11月~2019年10月、2022年度薬価改定では2019年11月~2021年10月、2024年薬価改定では2021年11月~2023年10月、2025年薬価改定では2023年11月~2024年10月の承認状況が評価された。
-
15)
-
16)
-
17)医薬産業政策研究所、「新薬の薬価収載状況 -2018年度薬価制度抜本改革の収載時薬価への影響-」、政策研ニュース、No.64(2021年11月)
-
18)医薬産業政策研究所、「日本で承認された新医薬品とその審査期間 -2022年承認実績と経年動向調査-」、政策研ニュース、No.68(2023年3月)
-
19)特定用途の効能追加等に係る加算は2024年度の1件のみ。
-
20)A:加算率(%)(実際に適用される率はA 及び年間販売額の合計額を基に算出される補正加算率α)
-
21)
-
22)
-
23)
-
24)
-
25)
-
26)

