Points of View 補正加算を中心とした新医薬品の算定状況の推移 -2024年度薬価制度改革後の収載3回分を含めた調査-
医薬産業政策研究所 主任研究員 吉野 九美
要約
- 本稿では、補正加算を中心とした新医薬品の算定状況を公開情報である中医協資料をもとに調査し、2024年度薬価制度改革前後を中心に動向を分析した。2024年度は収載実績がまだ3回分であり十分なデータが揃っていないものの、新有効成分含有医薬品30品目の収載があったことから、現時点での暫定的な分析は可能と判断し実施した。
- 2024年度薬価制度改革で充実が図られた各種加算制度の影響を暫定的に調査した結果、有用性系加算、市場性加算/小児加算、新薬創出・適応外薬解消等促進加算(新薬創出等加算)に該当した割合は、いずれも増加傾向が認められた。一方、2024年度薬価制度改革では継続審議となった原価計算方式の開示度、加算係数の制度は、依然、課題として残っている様子が伺われた。
- 原価計算方式の一部に課題を残しつつも、医薬品の価値がより評価され始めてきている、もしくは評価され得る価値を有する医薬品の上市が増えていることが示唆され、医薬品のイノベーションの適切な評価と革新的新薬の持続的な創出の好循環の実現に向けて、今後の動向に期待がもたれる。
1. はじめに
日本における新医薬品の薬価は、「薬価算定の基準について」で規定されたルールに基づき決定される1)。この新医薬品の薬価算定に関する制度は、昭和57年に厚生省医政局長の私的諮問機関である「新医薬品の薬価算定に関する懇談会」で検討され、「新医薬品の薬価算定に関する懇談会報告」によってルール化2)されて以降、様々な変遷をたどってきた。創薬環境等の変化に伴い、医薬品の価値を評価する変更と共に、国民皆保険の維持に向け薬剤費抑制の方向に働く変更もなされてきたが、中でも「補正加算」の制度は、医薬品の価値やイノベーション等を評価する制度として時代と共に変遷してきており、2024年度薬価制度改革においても、様々な拡充があった3)。
本稿では、主に補正加算に着目し、新医薬品の薬価算定について2024年度薬価制度改革前後の状況を公開情報に基づいて調査、考察することにした。
2. 調査方法
2018年4月から2024年8月までに新医薬品として収載された新有効成分含有医薬品について、収載時薬価に関する情報(薬価算定方式、補正加算、新薬創出・適応外薬解消等促進加算(以下、新薬創出等加算))を、中央社会保険医療協議会(以下、中医協)「新医薬品一覧表」4)などから取得した。同一成分かつ同一投与形態は1としてカウントした。
薬価制度改革は2年に1度行われ、その都度種々の変更があるが、2018年度は抜本改革として特に大きな見直しがあり、中でも、補正加算と新薬創出等加算で大幅な制度変更があった。2018年度の制度改革以前の補正加算は類似薬効比較方式(Ⅰ)での算定品目のみを対象とした制度であり、原価計算方式では営業利益率の増減によって追加的な評価がされてきたが、2018年度より原価計算方式でも類似薬効比較方式と同様の補正加算の制度が導入され、薬価全体に加算がなされるようになった。また、新薬創出等加算は「乖離率(市場実勢価格と薬価の差)が平均以下」という従来の品目要件を撤廃し、対象品目が希少疾病用医薬品、収載時に有用性加算などを取得した医薬品、新規作用機序の医薬品などに限定された5)。こうした2018年度抜本改革の影響については過去の政策研ニュースで調査、分析済みである5)こと、また、補正加算等の各種加算制度の調査を2024年度の薬価制度改革に着目して行うには2018年度以降に収載された医薬品に限定し2018年度抜本改革による変動を除外する必要があると判断したことから、本稿の調査対象期間は2018年4月から2024年8月までとした。
なお、薬価制度は2018年度以降も2年に1度の制度改革で種々の変更があるため厳密には複数年度にわたって一概に比較できない点も多い。実際に、新薬創出等加算は制度改革のたびに対象品目の要件が追加となっていることから、本稿では制度改革ごと(2年ごと)の比較を行った。一方、補正加算については2020、2022年度の変更は限定的6、7、8)なものであり、特に有用性系加算、市場性加算、小児加算への変更はなかったことから、2024年度薬価制度改革の前後で比較可能と判断した。ただし、2024年度の収載はまだ3回分(新有効成分含有医薬品30品目)であり、制度改革前のデータ(2018~2023年度に収載された新有効成分含有医薬品243品目)と比べて数が少ない。したがって、本稿は2024年度薬価制度改革が補正加算を中心とした算定状況に及ぼした影響を現時点のデータをもとに暫定的に調査・分析するものであることを事前に提示しておく。
次に、分析の切り口を2-1から2-3で示す。
2-1. 算定方式
新有効成分含有医薬品が該当する算定方式は、主に類似薬効比較方式と原価計算方式である(図1)。類似薬効比較方式に(Ⅰ)と(Ⅱ)があるが、類似薬効比較方式(Ⅱ)は補正加算の対象外となる。そこで、新医薬品として収載された新有効成分含有医薬品について、類似薬効比較方式(Ⅰ)と原価計算方式に該当した割合の全体的な傾向と投与形態別の傾向を調査した。
2-2. 補正加算
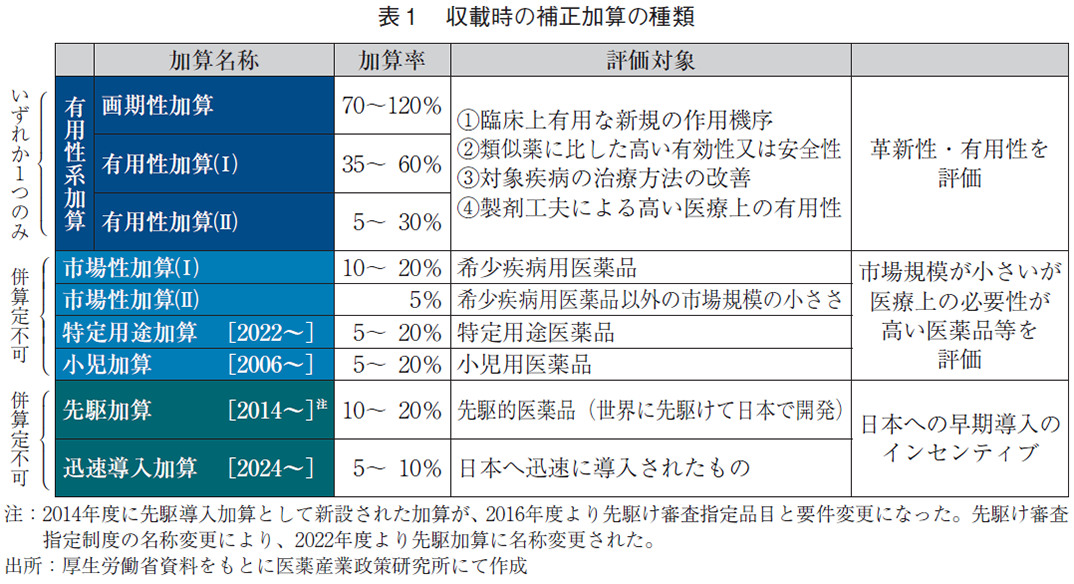
新有効成分含有医薬品が収載時に該当する可能性がある補正加算は、有効性や安全性等の観点で革新性・有用性を評価する加算である有用性系加算(画期性加算、有用性加算(Ⅰ)、有用性加算(Ⅱ))、市場規模が小さいが医療上の必要性が高い医薬品等を評価する加算(市場性加算(Ⅰ)、市場性加算(Ⅱ)、特定用途加算、小児加算)、日本への早期上市のインセンティブとして設けられた加算(先駆加算、迅速導入加算)である(表1)。
こうした加算はこれまでの薬価制度改革で状況の変化に応じた見直しが行われてきたが、2024年度薬価制度改革においても、顕在化したドラッグ・ラグ/ドラッグ・ロスへの対応としてイノベーションの評価の拡充が図られ、各種加算の制度に多くの変更があった(表2)。具体的には、補正加算のうち有用性を評価する加算である有用性系加算への要件追加(表3)、市場性加算や小児加算での加算率の柔軟な運用、日本への早期導入に関するインセンティブとしての加算の新設、さらには収載後の薬価の維持に関する制度である新薬創出等加算の対象品目の追加がなされた。2024年度薬価制度改革後の収載は3回分(4月収載、5月収載、8月収載)のみであり、正確な分析にはデータが不足している可能性は否めないが、現時点でのこうした制度変更の影響の程度を調査した。



2-3. 原価計算方式における加算係数について
前述のとおり、2018年度より原価計算方式にも類似薬効比較方式と同様の補正加算の制度が導入されたが、同時に加算係数の制度も導入された。加算係数とは、医薬品の製品総原価のうち薬価算定組織9、10)に開示できる額の割合(開示度)に応じて0~1の範囲で設定される係数である。原価計算方式で算定された品目が補正加算に該当した場合、評価された補正加算の率にこの加算係数を乗じて計算された値が、実際の薬価に反映される補正加算率となる。つまり、加算係数が0の場合は、補正加算が評価されても薬価には反映されない。こうした加算係数の状況がどのようになっているかを調査した。なお、加算係数の制度は2024年度薬価制度改革においては変更がなかったため、本項目に関しては2024年度前後の比較は行わなかった。
3. 結果
3-1. 算定方式の現状
① 算定方式の割合(年次推移)
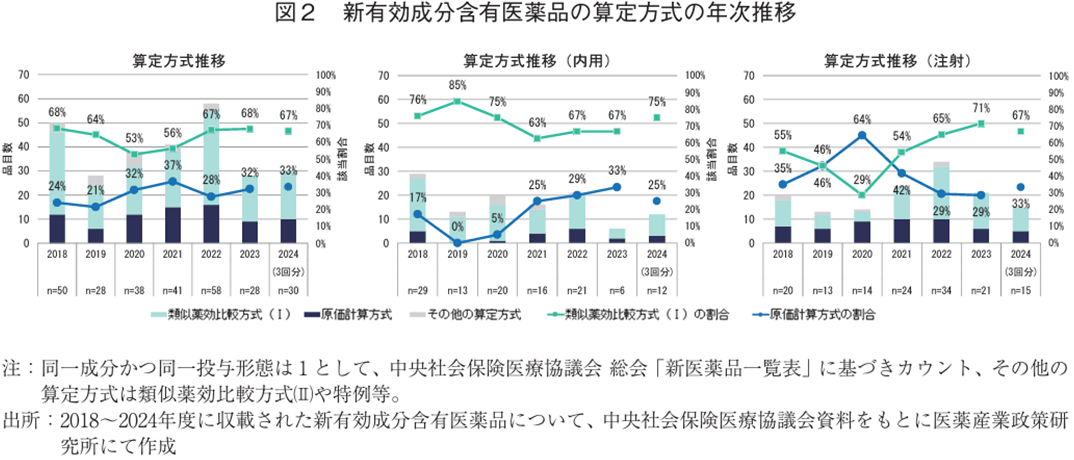
2018~2024年度(2024年度は4月、5月、8月の3回分)に収載された新有効成分含有医薬品に用いられた算定方式について、類似薬効比較方式(Ⅰ)と原価計算方式の医薬品数とその割合を調査した。その結果、年度によって多少の変動はあるものの、類似薬効比較方式(Ⅰ)の方が多く、近年は概ね類似薬効比較方式(Ⅰ)が7割程度、原価計算方式が3割程度となっていた。2024年度の3回分の収載でも類似薬効比較方式(Ⅰ)が67%(20/30)、原価計算方式が33%(10/30)と昨年度までと同様の割合を示していた(図2)。
② 算定方式の割合(投与形態別の年次推移)
投与形態別に見ると、内用薬では全体と同様に原価計算方式が少ない傾向が継続して認められた一方で、注射薬は原価計算方式が多くなっている時期もある等、投与形態によって異なることが示唆された(図2)。2022年度以降では内用薬・注射薬に関わらず、6~7割が類似薬効比較方式(Ⅰ)、2~3割が原価計算方式での算定となっており、2024年度薬価制度改革後も同様の水準であった。
3-2. 補正加算等の現状
① 補正加算等の種類と2024年度薬価制度改革での変更点
補正加算の制度は創薬環境の変化や医薬品の価値の広がり、また薬事制度の変遷等に合わせて、医薬品の価値を評価する制度として年々拡充されており、2006年に小児加算、2014年に先駆加算、2022年に特定用途加算が導入された(表1)。さらに2024年度薬価制度改革においては、迅速導入加算の新設、有用性系加算の要件の追加(異なる創薬及び製造プロセス、作用機序に基づく限定した患者集団、QOL等の副次評価項目での改善など)、市場性加算や小児加算の加算率の柔軟な運用、特許期間中の薬価に関する加算制度である新薬創出等加算の対象品目の追加など、イノベーションの評価につながる複数の変更があった(表2)。2024年度薬価制度改革以降の収載は4月、5月、8月のまだ3回分ではあるが、現在までに30品目の新有効成分含有医薬品の収載があったことから、以下に補正加算の状況を見る目的で有用性系加算、市場性/小児加算、新薬創出等加算について、動向を暫定的に調査した。
② 有用性系加算の現状
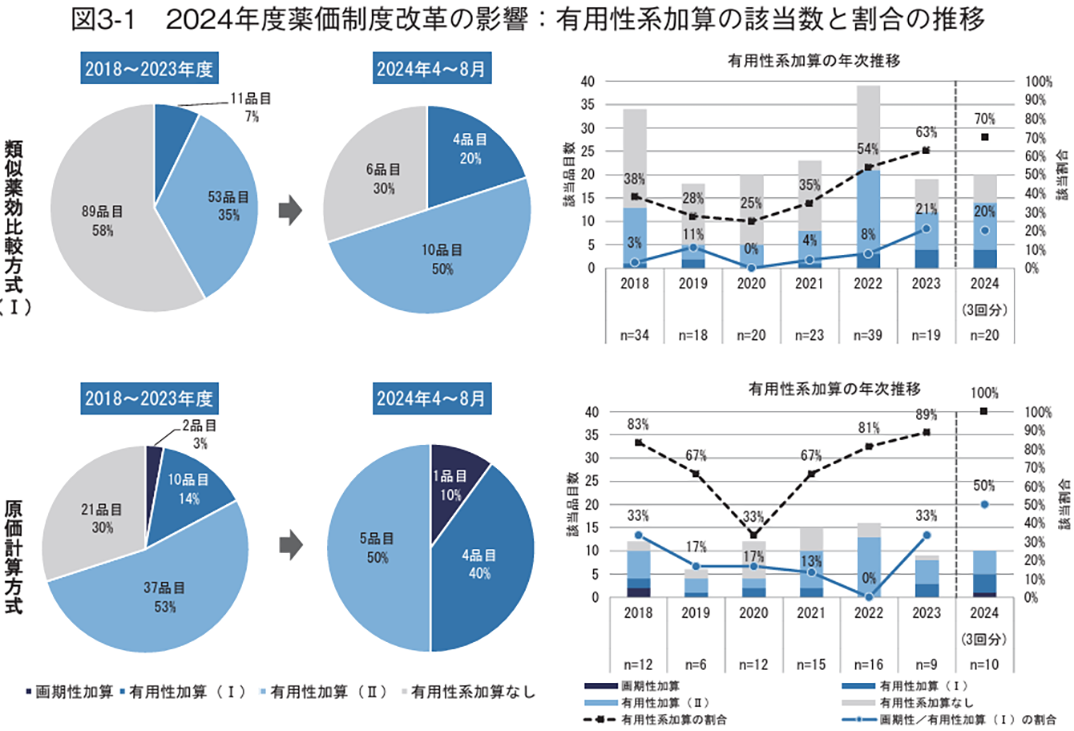
まず、有用性系加算への該当状況を検討した。2018年度以降に収載された新有効成分含有医薬品について、画期性加算、有用性加算(Ⅰ)、有用性加算(Ⅱ)に該当した医薬品の割合を類似薬効比較方式(Ⅰ)と原価計算方式の算定方式別に調査したところ、すべての有用性系加算の割合は類似薬効比較方式(Ⅰ)では2018~2023年度は42%(64/153)のところ、2024年4~8月は70%(14/20)、原価計算方式では2018~2023年度は70%(49/70)のところ、2024年4~8月は100%(10/10)となり、2024年度薬価制度改革後に大きく増加した(図3-1左)。特に、有用性加算(Ⅰ)への該当割合の変化がいずれの算定方式でも顕著であり、類似薬効比較方式(Ⅰ)では7%(11/153)から20%(4/20)、原価計算方式では14%(10/70)から40%(4/10)に増加した。算定方式別に年次推移を確認すると、有用性系加算全体としては、いずれの算定方式においても2021年度以降に該当品目の割合が増加する傾向がみられ、有用性系加算に該当した品目の割合は2024年4~8月に調査期間中で最も高い値となった(図3-1右、類似薬効比較方式(Ⅰ):70%、原価計算方式:100%)。有用性系加算の中でも加算率が高い画期性加算と有用性加算(Ⅰ)に該当した品目の割合は、いずれの算定方式でも2023年度から増加傾向が見られ、原価計算方式では2024年4~8月に調査期間中で最も高い該当率となった(図3-1右、類似薬効比較方式(Ⅰ):20%、原価計算方式:50%)。
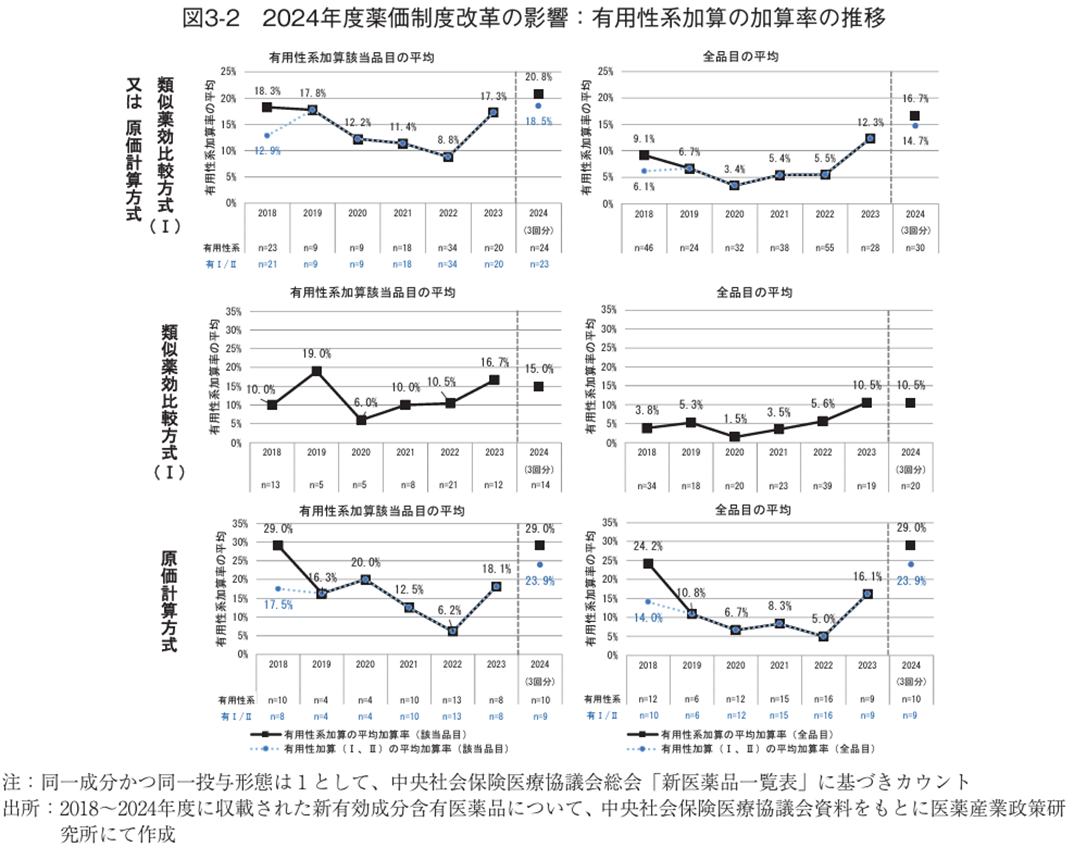
次に、有用性系加算の加算率を検討した。2018年度以降に類似薬効比較方式(Ⅰ)又は原価計算方式で算定された新有効成分含有医薬品について、有用性系加算の加算率の平均を調査した。有用性系加算該当品目の平均加算率は、画期性加算の該当品目があった2018年度(18.3%)と2024年度(20.8%)では、その他の時期に比べて高めの値を示した。全品目の平均(有用性系加算非該当の品目は加算率0%として計算)で比較すると、2022年度までは10%未満だったが、2023年度に12.3%と初めて10%を超え、2024年4~8月では16.7%と初めて15%超となった(図3-2上)。画期性加算は加算率が特に大きく、該当品目の有無が平均値に与える影響が大きいため、有用性加算(Ⅰ)(Ⅱ)の動向を確認する目的で画期性加算を除外した平均値も調査した。その結果、除外後の平均においても2024年度に調査期間中で最も高い値を示した(図3-2上、破線)。算定方式別に見ると、類似薬効比較方式(Ⅰ)では2023年度と2024年度は概ね同等の水準である一方、原価計算方式では2023年度より2024年度で高い値を示していた(図3-2中下)。
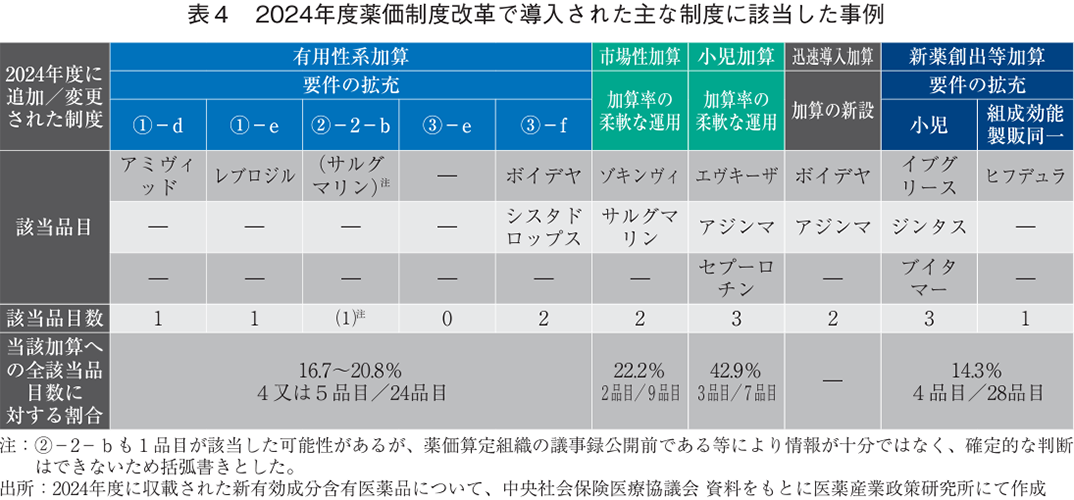
2024年度薬価制度改革で拡充された有用性系加算の要件については、これまでに①-d(異なる創薬及び製造プロセス)1品目、①-e(対象疾患領域で長期間の新規作用機序の新薬収載がない)1品目、③-f(重要な副次評価項目での改善)2品目の該当事例があった11)(表4)。
③ 市場性加算、小児加算の現状
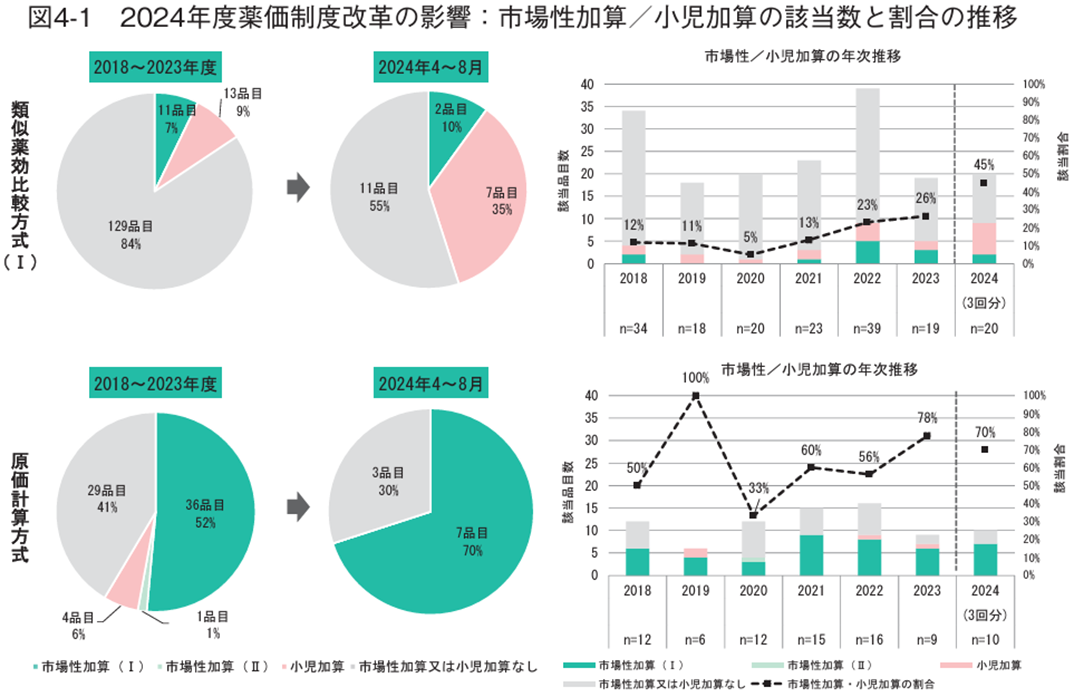
まず、市場性加算、小児加算への該当状況を検討した。2018年度以降に収載された新有効成分含有医薬品について、市場性加算((Ⅰ)又は(Ⅱ))、小児加算に該当した医薬品の割合を類似薬効比較方式(Ⅰ)と原価計算方式の算定方式別に調査したところ、上記いずれかの加算に該当した割合は類似薬効比較方式(Ⅰ)では2018~2023年度に16%(24/153)だったものが2024年4~8月は45%(9/20)、原価計算方式では2018~2023年度に59%(41/70)だったものが2024年4~8月は70%(7/10)となり、2024年度薬価制度改革前後で大きく増加する傾向が見られた(図4-1左)。市場性加算、小児加算は算定方式によって制約となり得る要件が一部異なることや、市場性加算と小児加算は併算定不可であることから、個々の加算の分析を算定方式ごとに行う際は注意が必要ではある1、12)が、各加算を見ると類似薬効比較方式(Ⅰ)では市場性加算(Ⅰ)は7%(11/153)から10%(2/20)と微増もしくはほぼ同等の水準であった一方で、小児加算は9%(13/153)から35%(7/20)と増加傾向が見られた。原価計算方式では市場性加算(Ⅰ)が52%(36/70)から70%(7/10)と増加傾向がみられた一方で、小児加算は6%(4/70)から0%(0/10)と減少していた(図4-1)。
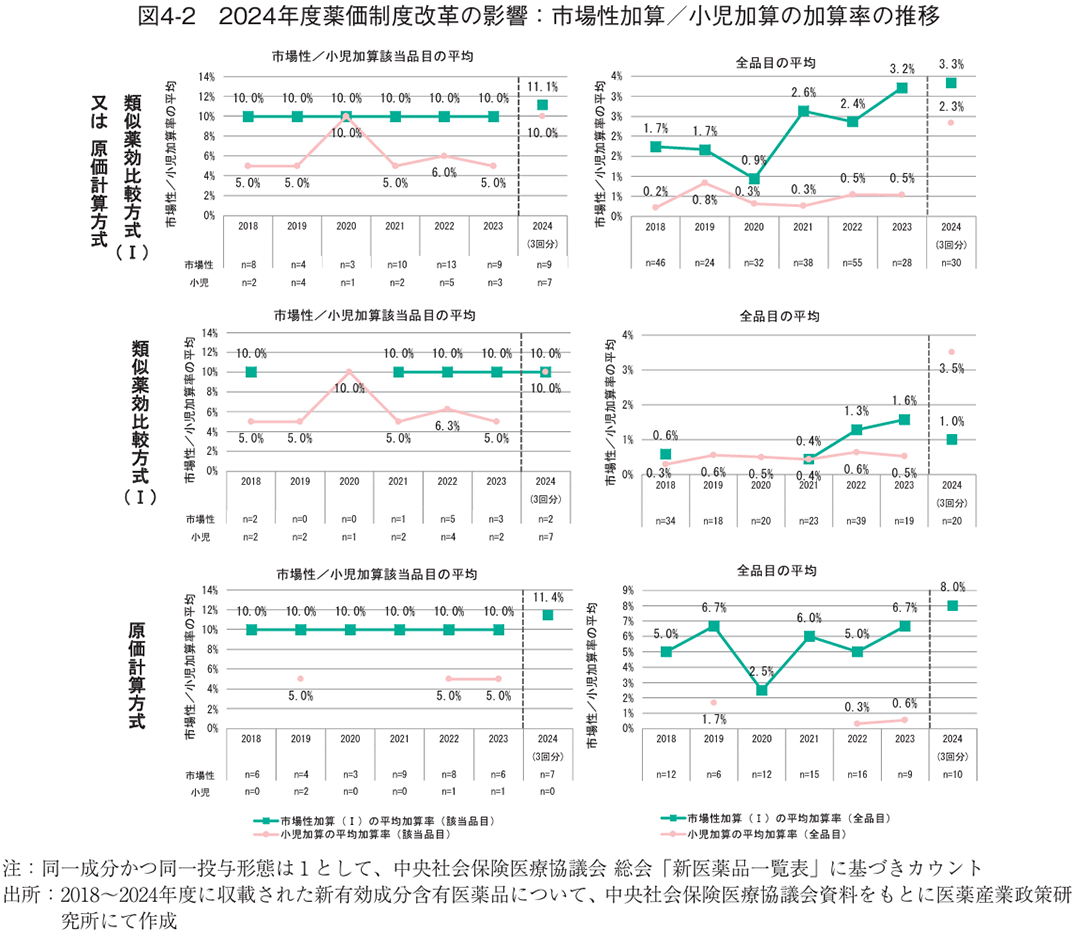
次に、市場性加算、小児加算の加算率を検討した。2018年度以降に類似薬効比較方式(Ⅰ)又は原価計算方式で算定された新有効成分含有医薬品について、市場性加算(Ⅰ)と小児加算の加算率の平均値を調査した。各加算への該当品目の平均値は、市場性加算(Ⅰ)は2024年度制度改革前まで一貫して10.0%だったところ、2024年度は11.1%と初めて10%超の値を示した(図4-2上左)。また、小児加算については、該当品目が1品目のみだった2020年度を除くと概ね5~6%だった平均値が2024年度では10%となった(図4-2上左)。全品目の平均(市場性加算(Ⅰ)もしくは小児加算非該当の品目は加算率0%として計算)で比較すると、小児加算が2024年度で増加傾向を示し、2024年度薬価制度改革前はいずれの時期も1%未満だった平均値が、2024年度は2.3%と増加した(図4-2上右)。
2024年度薬価制度改革で導入された「加算率の柔軟な運用」に該当した事例は市場性加算(Ⅰ)9品目中2品目(22.2%)、小児加算7品目中3品目(42.9%)であった(表4)。またその他の加算として、日本への早期導入のインセンティブとしての加算(先駆加算、迅速導入加算)については品目数が少なく今回は推移の分析までは行わなかったが、2024年度薬価制度改革で新設された迅速導入加算に該当した品目は8月までに2品目あった(表4)。
④ 新薬創出等加算の現状
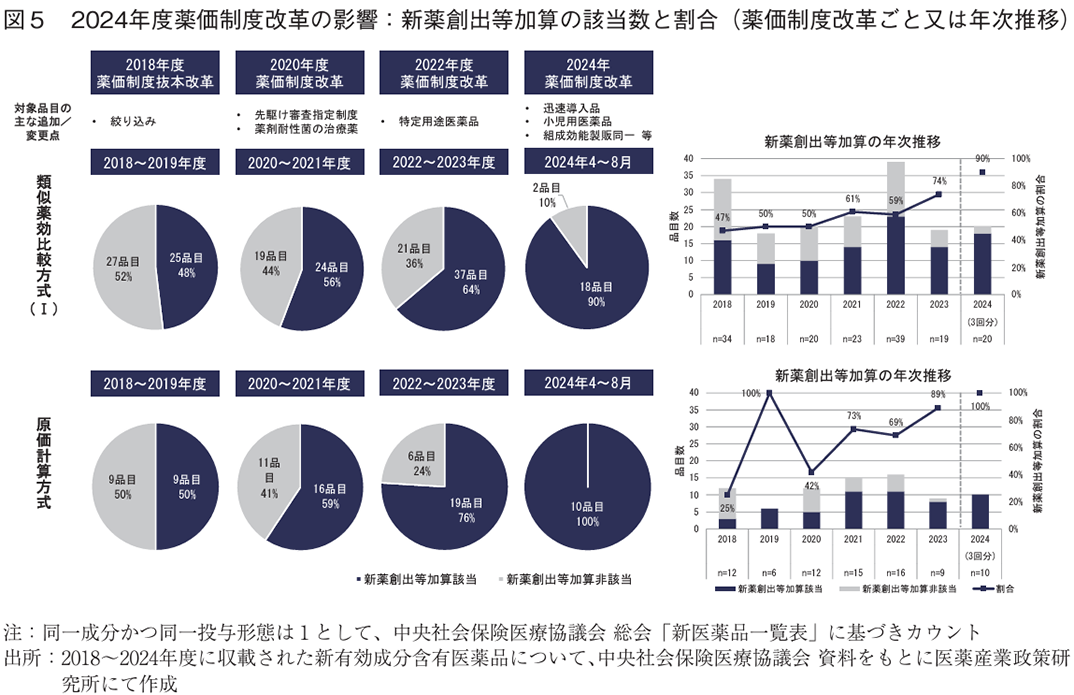
2018年度以降に類似薬効比較方式(Ⅰ)又は原価計算方式で算定された新有効成分含有医薬品について、新薬創出等加算に該当した医薬品の割合を調査した。新薬創出等加算は制度改革のたびに対象品目の要件が追加となっていることから、制度改革ごと(2年ごと)の比較を行った。その結果、類似薬効比較方式(Ⅰ)では48%(25/52)、56%(24/43)、64%(37/21)、原価計算方式では50%(9/18)、59%(16/27)、76%(19/25)といずれの算定方式でも2024年度薬価制度改革前まで10~15%程度の増加傾向にあったが、2024年度はさらに25%程度増加し、それぞれ90%(18/20)、100%(10/10)であった(図5左)。年次推移でみても、例数の少ない原価計算方式で年度ごとのばらつきが大きいものの、いずれの算定方式でも概ね増加傾向にあり、2024年度に調査期間中で最大の値となった(図5右)。
2024年度薬価制度改革で導入された要件が該当した事例は、新薬創出等加算28品目中4品目(14.3%、小児加算:3品目、組成効能製販同一:1品目)であった(表4)。
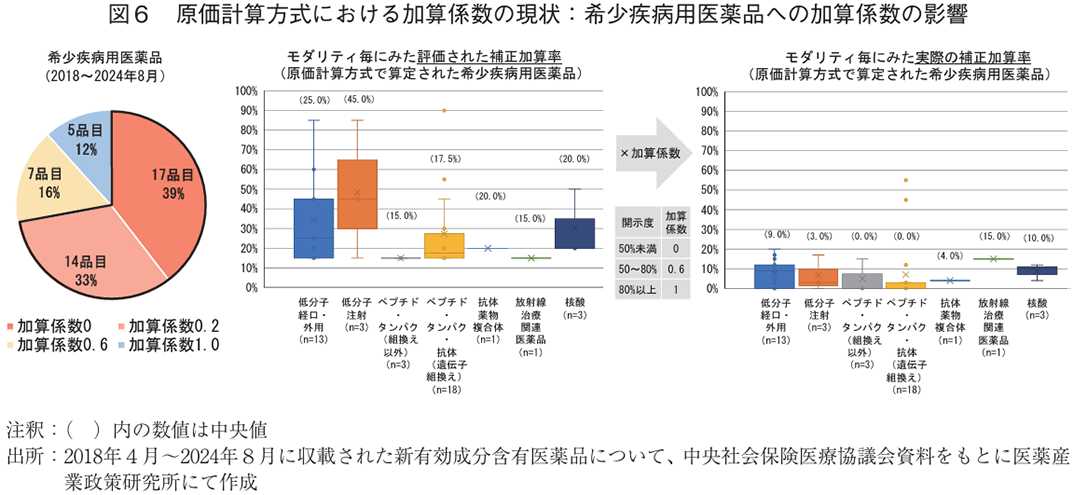
3-3. 原価計算方式における加算係数の現状
原価計算方式での算定品目において、2018年度より補正加算の制度と同時に導入された加算係数の現状を、医薬品の中でも特にアンメット・メディカル・ニーズの高いものの一つとされる希少疾病用医薬品に着目して調査した。2018年4月から2024年8月までの希少疾病用医薬品の加算係数を調査した結果、約7割が最小の加算係数(2022年4月1日収載までは0.2、それ以降は0)となった(図6左)。次に、希少疾病用医薬品で評価された加算率と実際の薬価に反映された加算率をモダリティ別に調査した結果、モダリティに関わらず、15~20%以上の補正加算に該当した品目が多い中、実際に薬価に反映された補正加算率はモダリティに関わらず20%以下の品目が多かった(図6中右)。
4. まとめ・考察
本稿では2018年4月から2024年8月までに収載された新有効成分含有医薬品について、補正加算を中心とした算定状況を調査した。算定方式については、年度によって多少の変動はあるものの一貫して類似薬効比較方式(Ⅰ)の方が多く、近年は類似薬効比較方式(Ⅰ)が6~7割、原価計算方式が2~3割程度となっていた(図2)。一方で、注射薬では内用薬に比べて原価計算方式の割合が高い傾向があるが、2022~2023年は類似薬効比較方式(Ⅰ)が6~7割、原価計算方式が2~3割となっており、2024年度も水準に大きな違いは見られなかった。この点は、2024年度薬価制度改革で算定方式の変更はなかった点と矛盾しないと考えられる。
補正加算については、医薬品の価値を評価する制度として創薬環境や薬事制度の変遷等の状況の変化に応じた見直しが行われており、2006年度に小児加算、2014年度に先駆加算(先駆け審査指定制度加算)、2022年度に特定用途加算が導入された。さらに2024年度薬価制度改革においては、顕在化したドラッグ・ラグ/ドラッグ・ロスへの対応として、有用性系加算の要件追加や迅速導入加算の新設など、イノベーションの評価につながる複数の変更がなされた(表2)。
まだ3回の収載のみではあるが、制度の充実が図られた有用性系加算、市場性加算、小児加算、新薬創出等加算いずれについても、2024年度が調査期間中で最も高い該当率であった(図3-1、4-1、5)。加算率についても、2024年度は高い水準であることがわかった(図3-2、図4-2)。
また、新設された有用性系加算や新薬創出等加算の要件、そして「加算率の柔軟な運用」等の2024年度薬価制度改革の変更点への該当品目がすでにあり(表4)、改革された制度が実際に適用され始めている様子が伺えた。これまでに有用性系加算の新規要件に該当した4品目(有用性加算(Ⅰ):2品目、有用性加算(Ⅱ):2品目)は、新規要件が制度化されていなかったと仮定した場合も今回該当した有用性加算(Ⅰ)又は(Ⅱ)の要件を満たしていた。したがって、2024年度薬価制度改革の有用性系加算への影響は、現時点(2024年8月)では、加算率への寄与が主であり各加算(画期性、有用性((Ⅰ)、(Ⅱ))への該当率への影響は少ない状況が伺える。
一方、年次推移を見ると、補正加算に関する大きな制度変更がなかった昨年度までも各種補正加算が増加傾向を示していたことを踏まえると、評価されるべき価値を有する医薬品が増えてきている可能性が伺える。新薬創出等加算についても、制度改革毎に該当率が増加している様子が見られたが、例えば、2022年度に対象に追加された「特定用途医薬品」は2024年8月現在までに新薬収載時に該当した品目はないことなどから、2022年度薬価制度改革による該当品目数への影響はないと考えらえる。また、2020年度に追加された要件である「先駆的医薬品」「薬剤耐性菌の治療薬」についても、この要件のみで新薬創出等加算に該当した事例がないことが厚労省の資料にも記載されている13)ことから、昨年度までの制度変更による該当品目数への影響は非常に限定的であると考えられる。以上より、2023年度までに有用性系加算と新薬創出等加算のいずれにおいても該当品目の割合が増加傾向を示していたことは、評価されるべき価値を有する医薬品が増えてきたためである可能性が考えられる。こうした状況の中で、2024年度でも補正加算・新薬創出等加算への該当割合が増加したことから、評価されるべき医薬品の増加に加えて、2024年度薬価制度改革の影響として医薬品のイノベーションがより高く評価されつつある可能性も考えられた。なお、2024年9月25日の中医協薬価専門部会においても、新医薬品として収載された成分に関して、有用性加算の適用状況や、市場性加算/小児加算の実績等の図表を用い、主に前年の2023年度と比べて2024年度で該当数や加算率が増加傾向である旨が事務局より説明された13)。新有効成分含有医薬品に着目した本稿の調査結果も概ね同様の傾向が見て取れ、矛盾しない結果となった。2024年度はまだ3回分の収載であることから、今後もこうしたトレンドが継続するかどうか、動向を注視したい。
また、今年度新設された迅速導入加算については、近年新設された先駆加算や特定用途加算のような「新たな薬事上の指定制度と一対一で紐づく加算」に比べ、関連する薬事制度が既存の制度、かつ、薬事上の特別措置の中で比較的該当数が多い優先審査14)のみであることから、加算に該当する事例が早期に生じやすい可能性があり、薬価上のインセンティブとして早期に効果が表れやすい特徴があると考える。薬事制度に紐づく加算は、その性質上、加算の該当状況が薬事制度の指定状況に依存する。新たな薬事上の指定制度を対象とした加算は、制度導入後に当該指定品目が承認・収載されるまで、つまり新設された加算への該当事例が出てくるまでには一定の期間を要する場合が多く、加算の該当数も当該薬事制度の指定数に依存する。実際に、2015年度から薬事制度が開始した先駆け審査指定制度(現・先駆的医薬品指定制度)を対象とした加算は「先駆け審査指定制度加算(現・先駆加算)」として2016年度に運用が開始15、16)されたが、初めて適用されたのは2018年3月17)である。また加算該当数も、希少疾病用医薬品18)(毎年、10~30成分程度の指定あり)に紐づく市場性加算(Ⅰ)が毎年10例前後の該当事例があるのに対し、先駆的医薬品(2020年度以降は毎年5成分以下の指定のみ19))に紐づく先駆加算は、2022年度までは年数品目あったものの2022年5月収載を最後に1年以上事例がない状況となっている。2020年度に薬事制度が開始した特定用途医薬品指定制度(2024年8月までに公表されている指定は1品目のみ20))を対象とした加算は特定用途加算として2022年度に導入されたが、2024年8月までに新薬収載時での該当事例はなく、改定時の該当事例が1品目という状況である。一方、2024年度に新設された迅速導入加算は、関連する薬事制度は以前から存在する優先審査21)のみであること等から、該当事例が早期に生じやすい可能性が考えられた。実際に、制度改革後の3回目の収載までにすでに2品目が該当している。今後も、薬価上のインセンティブとして導入早期から効果が得られることが期待される。
補正加算の今後の課題の一つとしては、原価計算方式の加算係数が挙げられる。2018年度に原価計算方式で導入された加算係数の制度は、その設定根拠となる開示度とともに妥当性について様々な議論がなされてきた。原価計算方式で算定された品目は、補正加算に該当しても加算係数次第では薬価に反映されないが、今回希少疾病用医薬品に着目して調査した結果、その約7割が最小の加算係数(2022年4月1日収載までは0.2、それ以降は0)であること、さらに補正加算による実際の薬価への影響は限定的であることが示唆された(図6)。また、有用性系加算についても、直近の事例として有用性系加算の中で最も加算率の高い画期性加算への該当品目が2024年5月に6年ぶりにあったが、加算係数が0だったことから合計90%の評価された加算が薬価に反映されなかった22)。これについては、中医協の診療側委員23)から加算係数の制度の在り方に課題感を示す発言もあった。加算係数の設定根拠となる製品総原価の開示度については以前からその妥当性や向上に向けた施策等が中医協等で議論されてきたが、近年の製薬産業のグローバル化やモダリティの高度化に伴うサプライチェーンの複雑化等により、企業努力に限界が来ている可能性が考えられる24)。実際に、開示度向上を目的とした加算係数の制度変更8)後に開示度が改善されていない状況25)を考えると、何らかの別の対策が必要と考えられる。
以上より、補正加算は、医薬品のイノベーションを評価する制度として拡充されてきた中で、加算係数の制度が残る課題となっている様子が伺える。開示度については、2024年度薬価制度改革での変更はなく継続審議となっている(表2)ことから、今後の議論が期待される。
5. おわりに
本稿では、2024年度の3回分の収載情報も含めた最新の新有効成分含有医薬品の薬価算定状況について補正加算を中心に報告した。補正加算は加算係数の課題が残るものの、制度として拡充されてきており、2024年度薬価制度改革においてもイノベーションが評価される方向での変更がなされたこと、そしてその変更が3回分の収載ですでに複数適用され、影響が出始めていることがわかった。一方で、制度変更がない年度の結果等から、評価され得る価値を有する医薬品の割合が増加している可能性も伺われた。以上から、医薬品のイノベーションの適切な評価と革新的新薬の持続的な創出の好循環の実現に向けて、今後の動向に期待がもたれる。
-
1)「薬価算定の基準について」(令和6年2月14日付け保発0214第1号厚生労働省保険局長通知)
-
2)
-
3)
-
4)
-
5)医薬産業政策研究所、「新薬の薬価収載状況—2018年度薬価制度抜本改革の収載時薬価への影響—」、政策研ニュースNo.64(2021年11月)
-
6)補正加算の制度に関して2020年度の変更はなかった。2022年度は特定用途加算の追加、先駆加算の名称変更、加算係数の変更(2018年度に原価計算方式に導入された制度。製品総原価のうち、薬価算定組織での開示が可能な部分の割合(開示度)に応じて、加算率に差を設ける。2022年度に、開示度50%未満の品目の加算係数が0.2から0に変更された。)がなされたが、有用性系加算、市場性加算、小児加算等への変更はなかった。
-
7)
-
8)
-
9)薬価算定組織では新薬の薬価算定について、類似薬の有無、類似薬、最類似薬選定の妥当性、補正加算適用(加算要件への適否)、製品製造原価の妥当性(原価計算方式の場合)、薬価算定案に対する企業の不服意見の妥当性などを検討する。
-
10)医薬産業政策研究所、「国民にとって納得性の高い薬価及び薬価制度に向けて」、リサーチペーパー・シリーズNo.83(2024年3月)
-
11)薬価算定組織の議事録公開前(2024年10月1日時点)である等により情報が十分でなく、確定的な判断はできないが、②-2-b(算定組織の判断により、比較試験の実施が困難な難病・希少疾病への考慮が可能となった)も1品目が該当した可能性がある(表3)。
-
12)市場性加算と小児加算は、市場性や小児に関する要件に加え、「比較薬が当該加算又は類似する加算の適用を受けていない」という要件がある。そのため、類似薬効比較方式(Ⅰ)においては市場性や小児に関する要件を満たした医薬品であっても、加算に該当しない場合がある。さらに、小児加算と市場性加算は併算定不可であることから、市場性加算(Ⅰ)と小児加算の個別の割合は算定方式間で一概に比較できるものではなく、考察には注意を要する。なお、比較薬に関する具体的な要件は以下である。
市場性加算(Ⅰ):比較薬が市場性加算(Ⅰ)の適用を受けていない
市場性加算(Ⅱ):比較薬が市場性加算(Ⅰ)又は市場性加算(Ⅱ)の適用を受けていない
特定用途加算:比較薬が特定用途加算の適用を受けていない
小児加算:比較薬が特定用途加算(小児の疾病の治療等に係る指定を受けて加算対象となった場合に限る)又は小児加算の適用を受けていない(例外規定あり) -
13)
-
14)医薬産業政策研究所、「日米欧の新薬承認状況と審査期間の比較」、政策研ニュースNo.70(2023年11月)
-
15)2014年度に新設されていた「先駆導入加算」の要件を変更することで対応された
-
16)
-
17)
-
18)
-
19)
-
20)
-
21)優先審査とは、希少疾病用医薬品のうち優先審査該当とされたもの、先駆的医薬品、特定用途医薬品等の他、適用疾病が重篤である等の要件に該当する医薬品について優先的に審査される制度である。「「優先審査等の取扱いについて」の一部改正について」(2024年(令和6年)1月16日医薬薬審発0116第2号・医薬機審発0116第2号厚生労働省医薬局医薬品審査管理課長・医療機器審査管理課長連名通知)に基づいて厚生労働省が決定する。
-
22)
-
23)
-
24)
-
25)医薬産業政策研究所、「医薬品がもたらす価値の変遷に伴う評価制度の課題」、ポジションペーパー・シリーズNo.3(2024年10月)

