目で見る製薬産業 近年における国際共同治験の動向調査 -2023年までの動向とアジア地域について-
医薬産業政策研究所 主任研究員 東 宏
医薬産業政策研究所 主任研究員 白石隆啓
要約
- 米国臨床試験登録サイトClinicalTrials.govを用い、国際共同治験の動向を調査した。
- 日本の国際共同治験の参加率は登録治験全体に対して堅調に上昇し、2023年は26.9%であった。
- 直近10年間でアジア主要地域が参加する国際共同治験の52.8%に日本は参加していた。
- 一方、主導する企業分類によって参加率は大きく相違し、製薬が主導しアジア主要地域が参加する国際共同治験では日本の参加率は62.2%に対し、EBPが主導した場合は24.6%であった。
- 他のアジア主要地域と比較し、EBP主導の国際共同治験に対する日本の参加率が相対的に低かった。
1.はじめに
近年、医薬品の開発は世界規模で行われることが多くなり、医薬品承認を目指した臨床試験も、単一国内ではなく国家間を跨いだ国際共同治験が台頭している。国際共同治験とは、新規の医薬品の世界的規模での開発及び承認を目指して企画される治験であって、一つの治験に複数の国の医療機関が参加し、共通の治験実施計画書に基づき、同時並行的に進行する治験、とされ1)、新たな治療選択を望む患者さんへ新薬をより早く届ける上で重要な役割を担っている。
これまで政策研ニュースにて米国国立衛生研究所(NIH)等によって運営されている臨床試験登録システム(ClinicalTrials.gov)2)を用い、国際共同治験の状況や参加国の分析を報告している3、4、5、6)。これは世界各国が独自の臨床試験登録サイトを持ち、その登録状況に差がある中で、世界的な医薬品開発状況を総合調査するために着目すべきひとつの代表データベースとしてClinicalTrials.govが妥当と考えたからである。現状米国が世界で最も医薬品開発が活発な場であること、さらにはClinicalTrials.govは米国のサイトでありながら、各社の情報発信目的など企業戦略の観点により米国が参加しない臨床試験情報も含まれていることなどから、世界的な状況の調査に適していると判断した。
他方、政策研ニュースにて、ドラッグ・ラグ/ロスの課題に関連して、国内未承認薬の増加に国際共同治験の参加国組入れの影響度が大きいことも報告している7)(抗悪性腫瘍剤におけるピボタル試験の日本組み入れ状況の分析)。従って、国際共同治験の動向を調査することは、日本における新規医薬品のアクセス向上を考える上で大変重要である。本稿では、前報の政策研ニュースNo.66(2022年7月)6)との比較を中心に試験数や参加率などを多面的に調査し、後半ではアジア地域が参画する国際共同治験の動向と新興バイオ医薬品企業(EBP:Emerging Biopharma)の関わり合いについても分析する。
2.調査方法
調査方法は政策研ニュースNo.66と同様の手法を取った。即ち、米国国立衛生研究所(NIH)等によって運営されている臨床試験登録システム(ClinicalTrials.gov)2)を用い、同システム内で登録されたInterventional Studies(Clinical Trials)のうち、PhaseがPhase2(1/2含む)またはPhase3(2/3含む)で、Funder TypeにIndustryを含む登録がされている試験を対象とし、試験数や参加率などを調査した(2024年7月1日時点)。また、実施国が1ヶ所のみ登録されている試験を単一国治験、2ヶ所以上登録されている試験を国際共同治験と定義した。さらに、本稿ではアジア主要地域として国際共同治験の序列頻出国から、日本、韓国、中国、台湾、シンガポール、タイと定め、地域分類はClinicalTrials.govのLocation項通りとした。
3.ClinicalTrials.gov登録件数の推移
ClinicalTrials.govに登録される臨床試験について、図1は試験開始年ごとの推移を2000年から2023年まで示している。2021年以降に着目すると、国際共同治験は1,239件、総数は3,342件をピークに減少している。ここで、各分類の数値において留意すべき事項があり、各試験において開始段階では単一国試験で進め、経時的に別国への治験登録が拡大するケースが存在する。従って各治験の登録内容が時期によって変化することが、データ取得日に近いほど多くなり、このことは前報で詳細に報告している6)。また総数においても確認時期によって若干の変動を確認している(前回2021年総数は3,364件、データ非開示)。
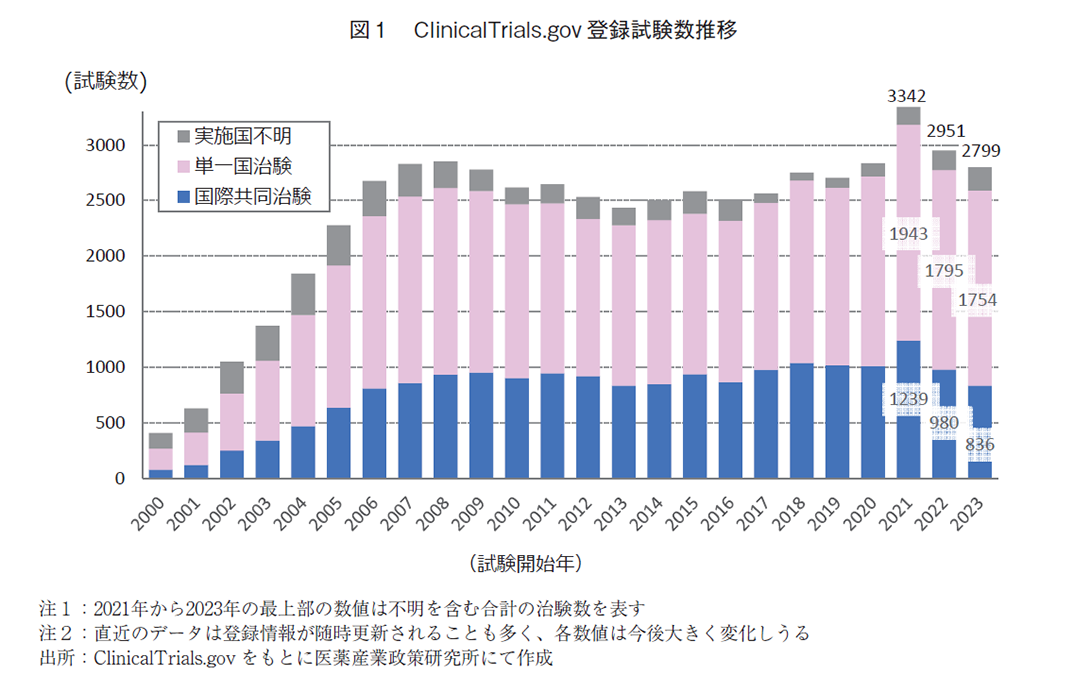
4.国別の国際共同治験/単一国試験の実施数
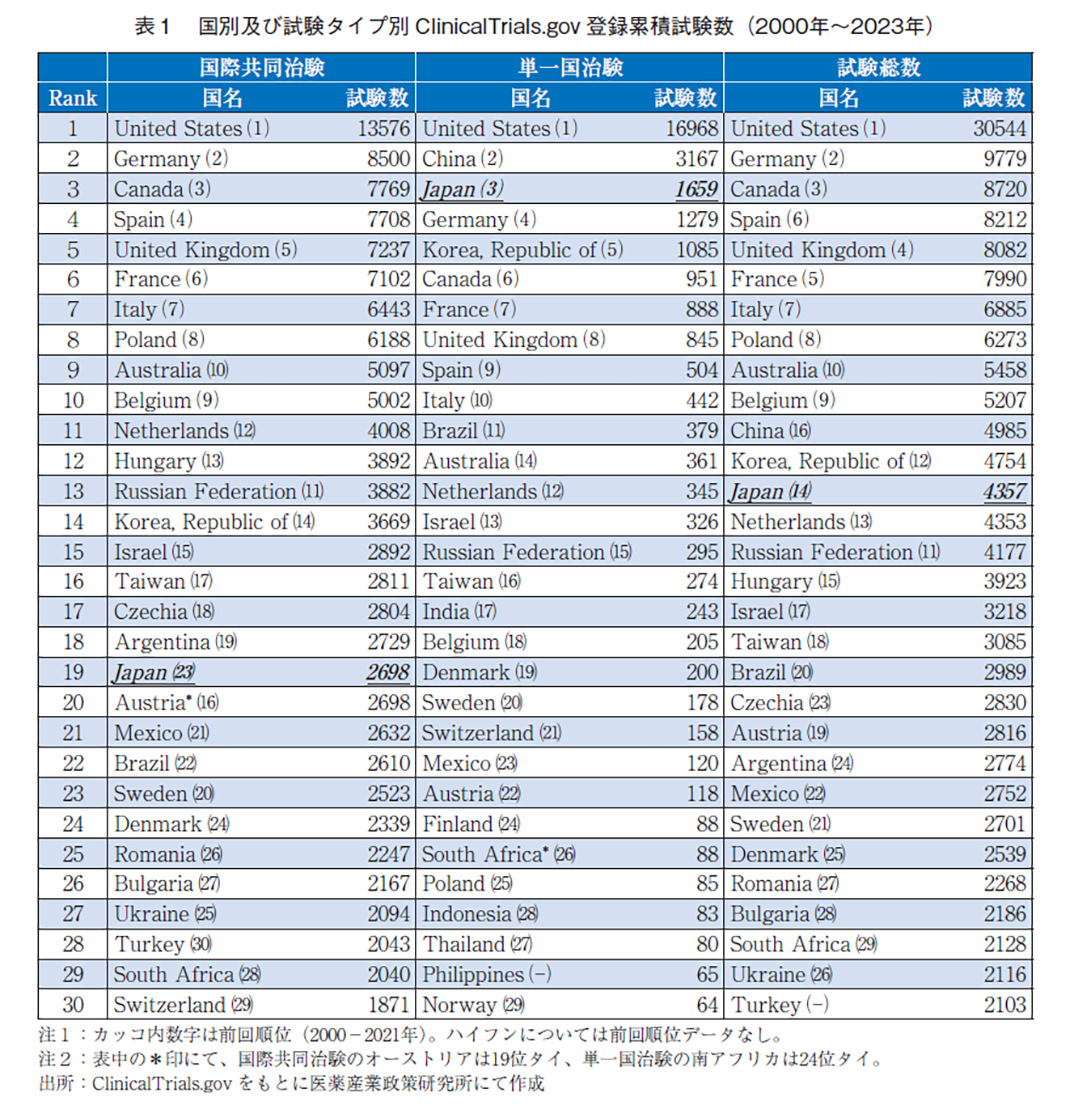
2000年から2023年にわたる累積治験数を国別毎、試験タイプ毎(国際共同治験、単一国治験及び試験総数)に分類し、上位30か国を表1に示す。各国の全体的な傾向は前報と同様であった。
前回順位との比較に注目すると、国際共同治験の上位に変動は少ない一方、日本は23位から19位タイに上昇し、集計国の中で最大のランクアップであった。本指標は20年以上の累積試験数であり、順位変動が起こりにくい点を考慮すると、前回からの2年間で4ランク上昇することは意義深い事象と捉えることが出来る。アジアの他地域に目を配ると、韓国、台湾に次ぐ3番手であり、この点については次節から詳しく分析する。一方で順位が後退した上位国はベルギー、ロシア、オーストリア、スウェーデン、ウクライナ等であった。2022年2月以来のロシア・ウクライナ情勢による影響度は、単純に結び付けられないものの一定の影響はあったものと推察する。試験総数の順位では、日本は一つ順位を上げて13位となった。一番順位の変動があったのは中国(16位から11位)であり、これは単一国治験の大幅な進展があったためと考察する。
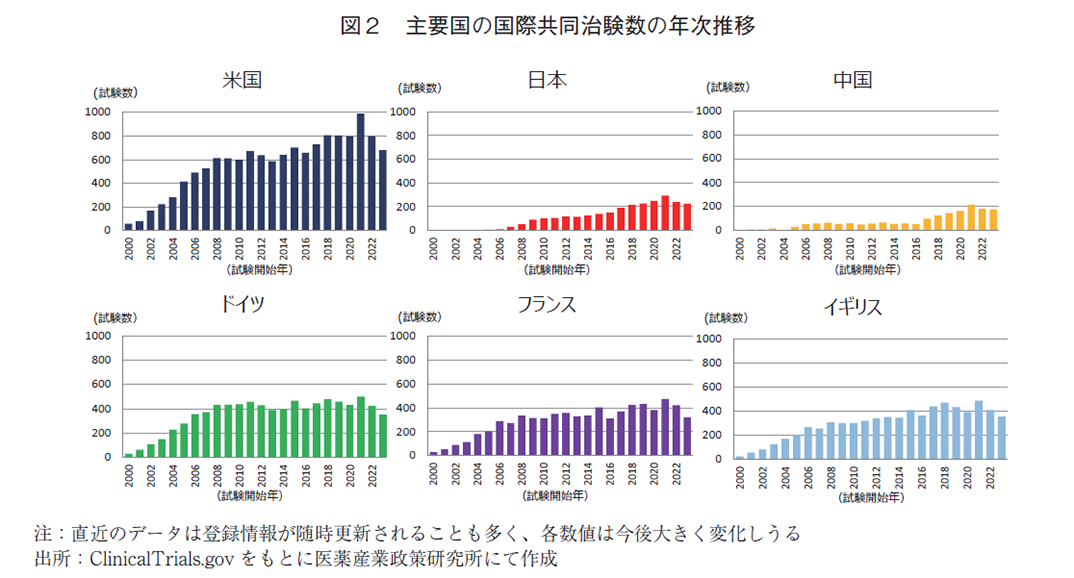
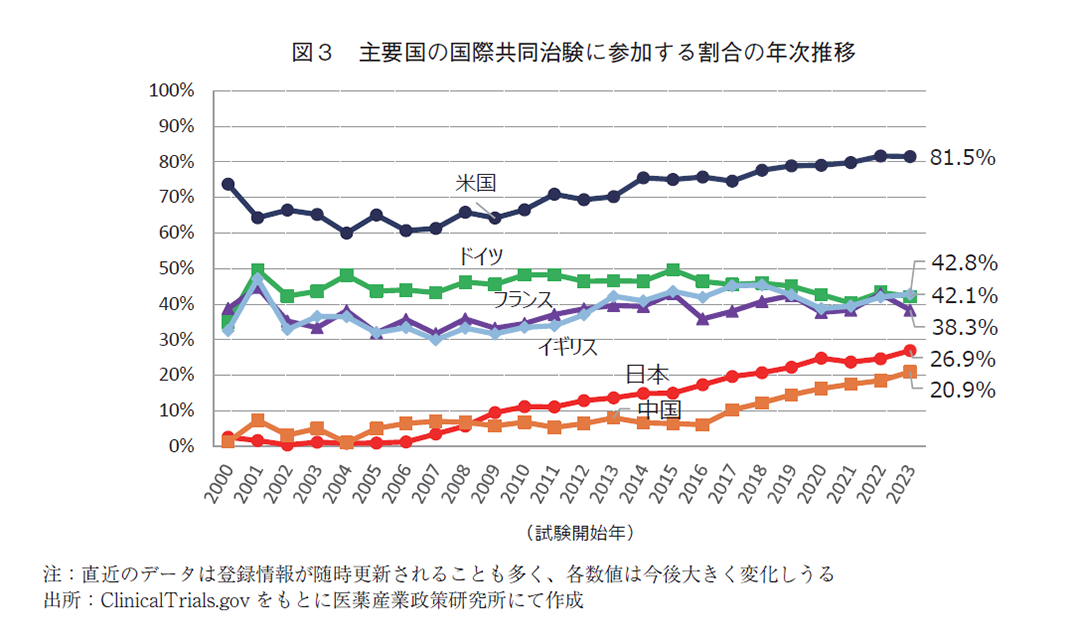
続いて、図2にて主要国(米国・日本・中国・ドイツ・フランス・イギリス)毎の国際共同治験数の年次推移を、また図3にて当該年で実施された全国際共同治験に対する参加割合の年次推移を示す。
主要各国とも国際共同治験数の年次増減傾向は類似しているものの、全国際共同治験に対する参加割合でみると、米国は高い水準を保ち、欧州勢に変動があまり見られない中、アジア勢が堅調に上昇していることが分かる。2023年では日本が26.9%、中国が20.9%とそれぞれ過去最高値であり、欧州勢との差は徐々に縮小している。このことからも国際共同治験に対するアジア地域の存在感が増してきていると考察する。
5.アジア主要地域の国際共同治験数
アジア地域は、一般に欧米から見ると地理的、文化的、言語学的な距離があり、国家内の民族も欧米に比べ多様性が少ないと言われている。また治験環境や承認申請制度の相違も存在し、米国が世界で主な医薬品開発の場となっている現状で、日本がこれらの克服すべき課題を乗り越え、より多くの国際共同治験へ参加することが、新たな医薬品へのアクセスを確保するために必要である。
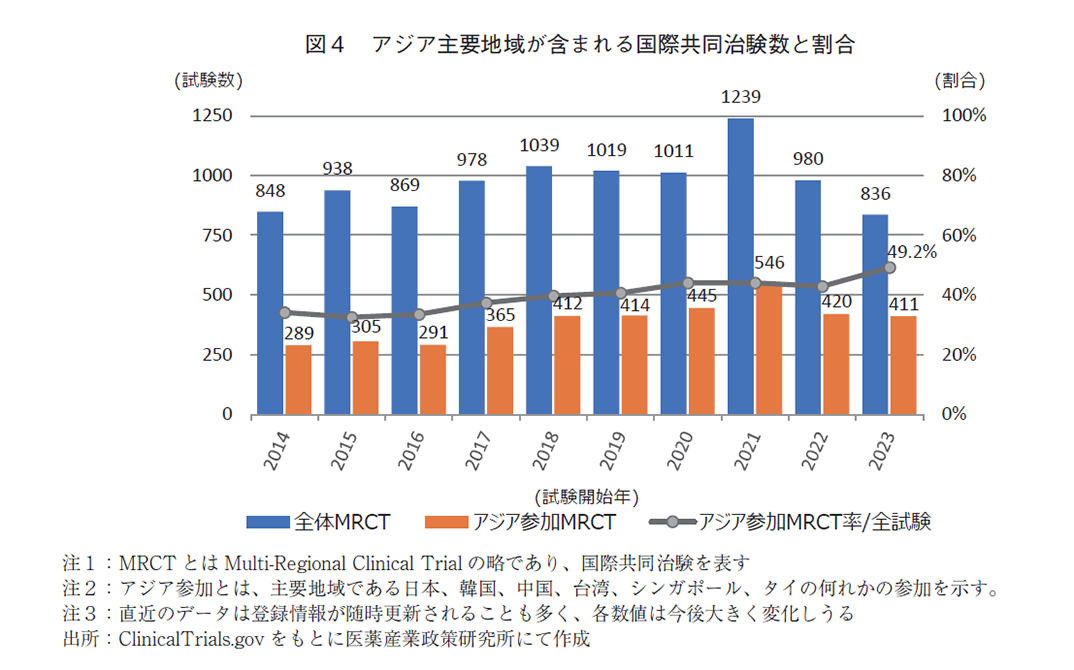
本節では米国臨床試験登録システムにおける国際共同治験の中で日本を含むアジア地域の関わりについて分析した。図4には、国際共同治験全体に対して、アジア主要6地域(日本、韓国、中国、台湾、シンガポール、タイ)が含まれる試験数とその割合を示す。なお、2000年代までは全体の登録試験数も低いこともあり、アジア地域の登録件数、登録率も低いことを確認している。直近の状況と適切に比較解析するにはサンプル数が少ないと判断したため、以降の分析では2014年から2023年の直近10年間のデータを示す。直近10年間では登録全体の国際共同治験に対し、アジア主要地域の何れかが参加する試験割合は緩やかに上昇基調と捉えることが出来る。2014年は289試験、2021年は分析期間で最多の546件であった。2023年は49.2%とほぼ半数の治験に対しアジア主要地域が組み込まれており、前節図3の結果と同様に、アジア地域のプレゼンスが高まっていることが分かった。
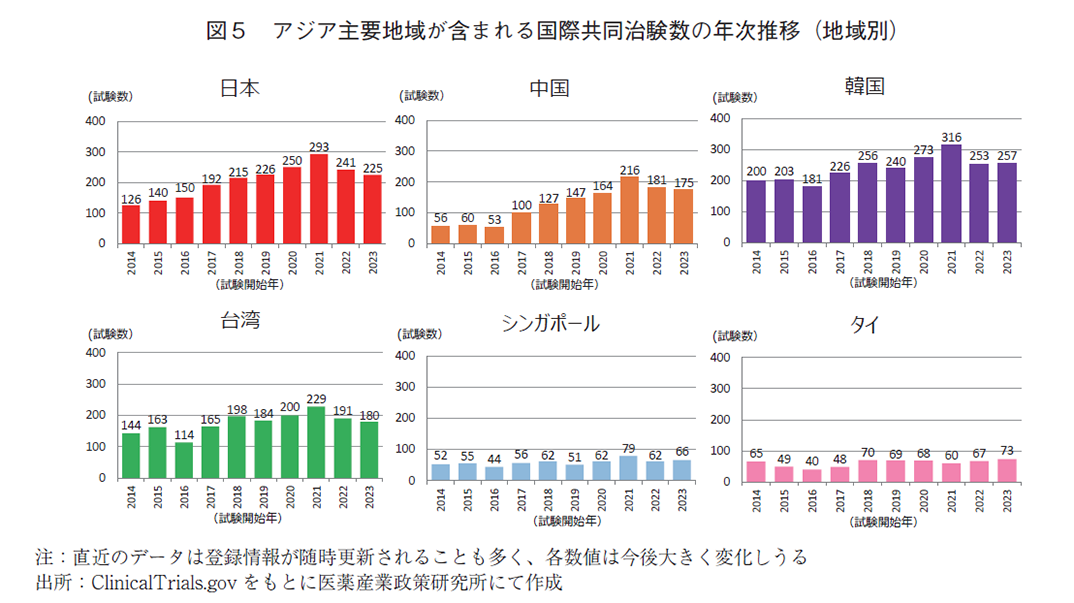
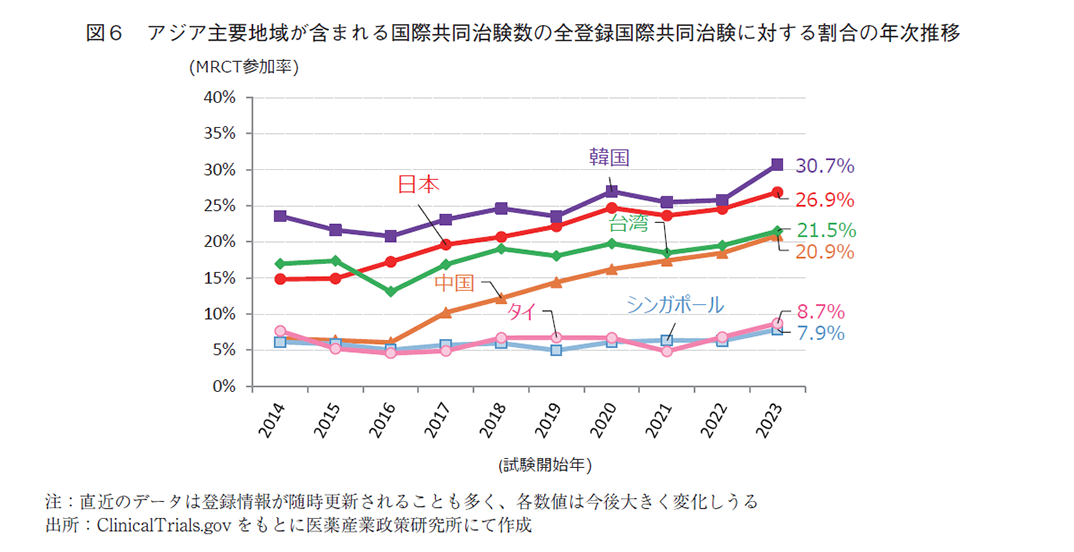
次に地域別で分けた国際共同治験数(図5)と、当該年で実施された全国際共同治験に対する参加割合(図6)の年次推移を示す。第4節の表1にてアジア地域に絞った2000年以降の国際共同治験の参加件数に着目するとトップは韓国の3,669件、次いで台湾の2,811件、日本の2,698件であった。地域別の国際共同治験参加率を経年変化で見てみると、直近10年間で韓国はアジア地域で一番国際共同治験に参加している国であり、2023年では全体の30.7%に参加している。台湾は緩やかに上昇してきており、2023年は全体の21.5%の参加率であった。日本は2016年に台湾と入れ替わりでアジア地域2番手となり、2023年には全体の26.9%であった。さらに近年は、中国も参加率が上昇しており、2023年には全体の20.9%と台湾に迫る勢いを見せている。
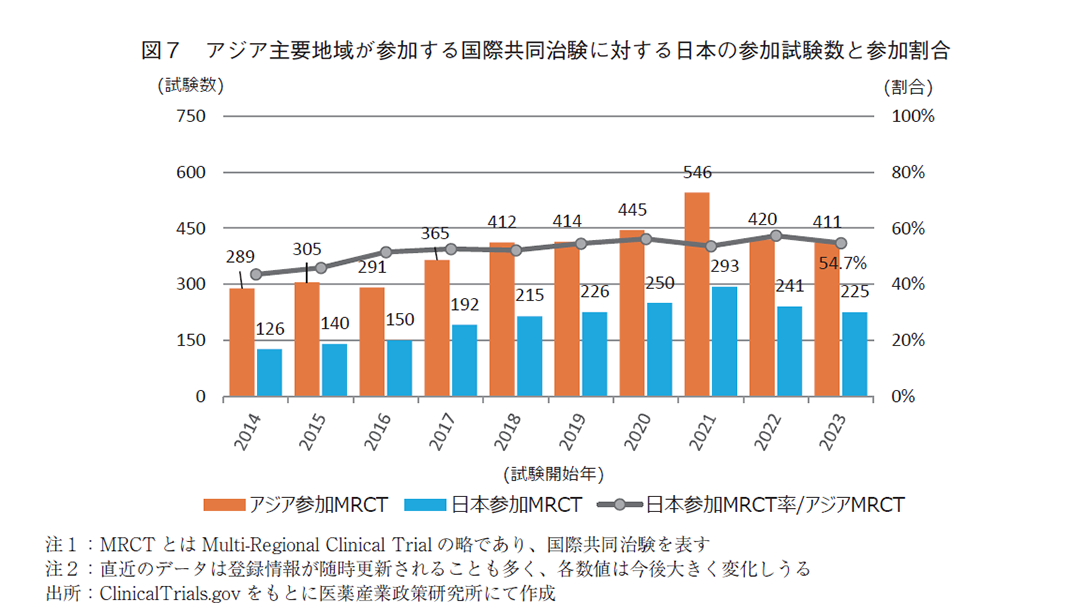
次にアジア主要地域の中で日本の参加状況を調査した。即ち、アジア地域を視野に入れている国際共同治験の中で日本がどの程度の参加率なのか、分析を行った。(図7)結果、直近10年間で緩やかな増加傾向を続けており、2016年に50.5%(291件中150件)と半数を超え、2023年には54.7%(411件中225件)となっている。よって近年では、ClinicalTrials.govに登録される国際共同治験において、アジア主要地域も対象に含まれる試験のうち半数以上には日本が参加していることがわかった。
6.EBPのアジア主要地域の国際共同治験数
近年、世界の医薬品開発において、新興バイオ医薬品企業(Emerging Biopharma:以下、EBP)の台頭が目覚ましいことは各方面で報告されている8、9)。本稿ではEBPを、1990年以降の設立、かつ試験開始年の前年売り上げが5億ドル未満の企業と定義し、大手を含む製薬企業を主な比較対象とすることでEBPが主導する国際共同治験の特徴を調査した。前述の通り、ドラッグ・ラグ/ロスの課題克服において、EBPが日本で医薬品開発する際の開発障壁を小さくすることは重要である。その一例として、日本開発のために追加で試験を実施する状況を避けるべくEBP主導の国際共同治験に先手で日本が参画することは実効性のある方策と考える。なお、本稿の調査におけるEBPは国籍を問わず、米国、欧州、アジア含む全世界の企業である。
表2と図8ではアジア主要6地域が参画する国際共同治験について、ClinicalTrials.govのLead Sponsorに登録されている団体ごとに日本の参加状況を試験数で分類した。結果、直近10年間のアジア主要地域が参加する国際共同治験は、図4及び図7の橙色で示す全3,898試験であり、うち2,058試験(52.8%)に日本は参加していた。また主導企業分類別にみると、製薬企業(171団体)が主導する国際共同治験に、日本は全2,943試験中で1,830試験(62.2%)に参加していた。他方、EBP(445団体)が主導する国際共同治験に、日本は全871試験中で214件(24.6%)に参加しており、双方の間に大きな相違を確認した。
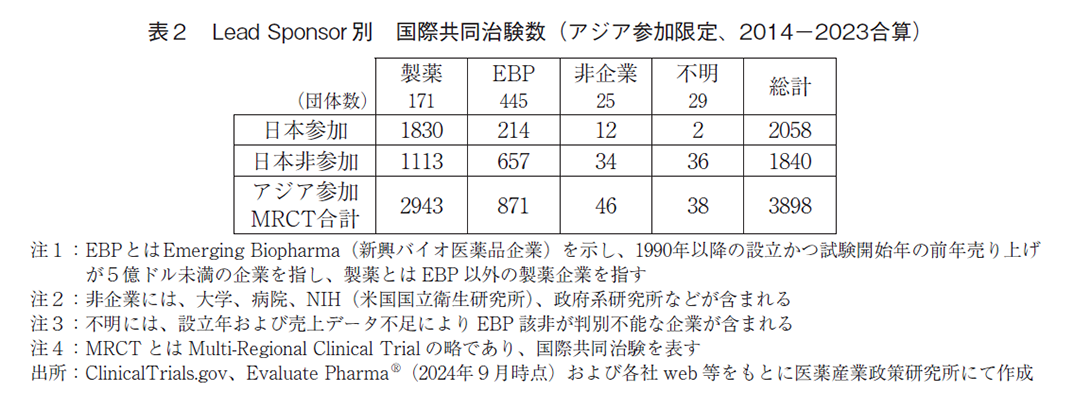
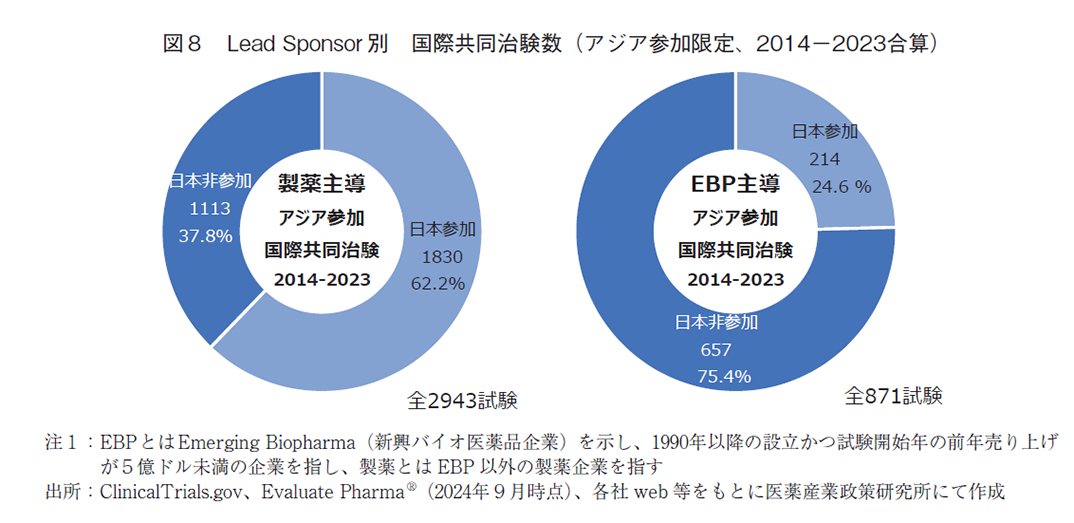
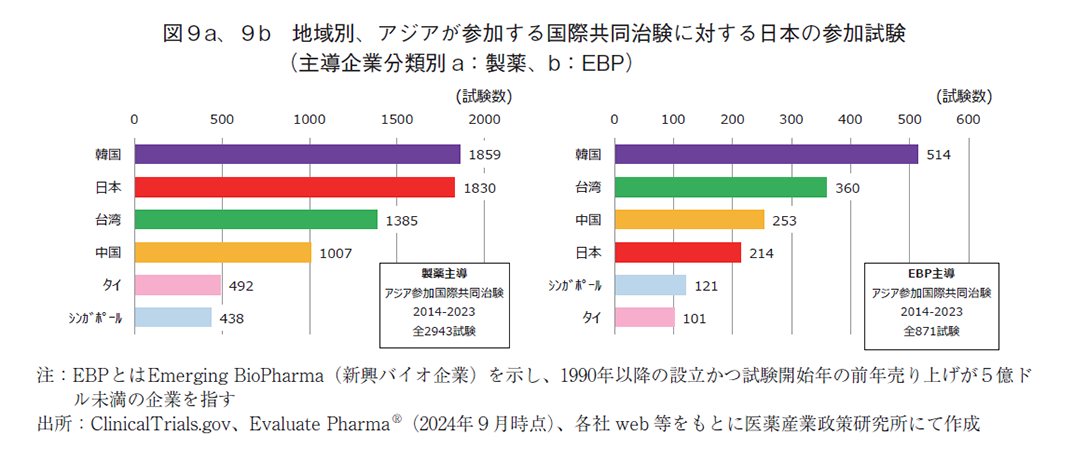
次に、アジア内の他地域参加状況を併せて検討した。図9aおよび図9bではアジア主要6地域別における、アジアが参加する国際共同治験への参加件数を主導企業別に分けて示す。直近10年間で製薬主導のアジア参加国際共同治験では、韓国が最も多く全2,943試験中で1,859試験(63.2%)であり、日本は次点の1,830試験(62.2%)の参加であった。さらには台湾の1,385試験(47.1%)、中国の1,007試験(34.2%)と続いていた。他方、EBP主導のアジア参加国際共同治験では、韓国の最多参加は変わらず全871試験中で514試験(59.0%)であった。続いて台湾の360試験(41.3%)、中国の253試験(29.0%)であり、日本は4番手の214試験(24.6%)であった。これらより、アジアが参加する国際共同治験で最も多くの試験に参加していたのは韓国であった。翻って日本に着目すると、製薬主導の試験では韓国とほぼ同数であったが、EBP主導の試験では数にして2.4倍の相違があり、大きく引き離されていた。
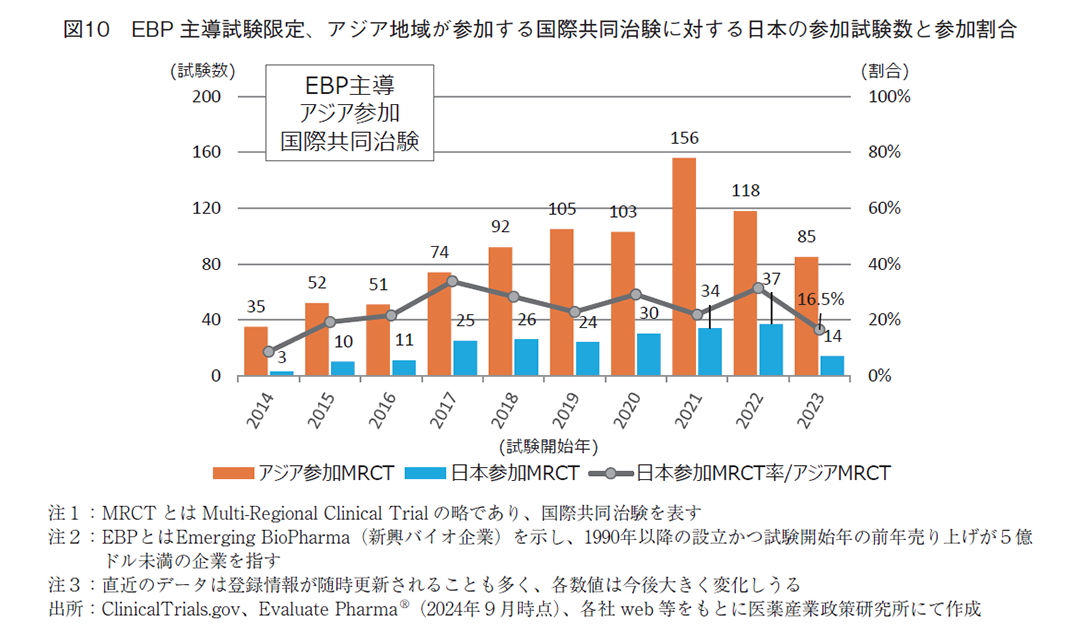
さらに、経年変化を調査すべく、図10では年次推移として参加試験数と参加率を示す。結果、2014年では3試験であったものが、徐々に増加し、2022年に最多37試験となった。ただし、アジア他地域の何れかが参加する全試験との割合でみると、2017年の33.8%(74件中25件)を境に、近年は停滞気味と捉えることができ、20%から30%台に留まっている。
7.考察
本節では第6節で述べたアジア主要地域におけるEBP主導の国際共同治験に対する日本の参加状況について焦点を絞って考察する。得られた結果より、主導する団体の違いによって日本の参加件数と参加率が大きく相違し、EBPが主導するアジア地域を視野に入れた国際共同治験では、残念ながら日本の参加率は他地域に先んじられる状況が明らかとなった。この背景については様々な要因が存在すると考える。例えば韓国では国の政策として治験環境の拠点整備に取り組んできており、2004年から5年間で46億円を投じ、15か所のClinical Trial Centerを設立してきた10)。また、治験届から試験開始までのスピードも各種手続きを同時並行して行い期間短縮につながっていると推察する。日本の参加率が比較的低い事象について、上述する欧米からの地理、文化、言語、民族構成の相違といった事由では単純には説明がつかないものと考察する。EBPはその企業特性上、会社規模が小さく売上げがまだ少額であり、コンパクトな治験で迅速な治験結果を訴求し、治験実施にスピードやコストなどを重視することが想定される。日本における治験環境、臨床開発モニター(CRA)との面談頻度、対象患者の集約度、治験審査委員会の開催頻度や中央化、臨床治験実施医師のマンパワーなど、様々な側面や基準で是々非々の議論が沸き起こっている状況である11、12)。また薬事審査面でも海外先行医薬品の国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について課長通知13)などが発出されており、日本にとって一番良い形を国全体が模索している段階と捉えられる。
8.おわりに
本稿では国際共同治験及び単一国治験の動向をClinicalTrials.govの登録状況を基に報告した。近年における日本の国際共同治験参加状況は、登録治験全体に対して参加率は上昇していた。他方、製薬企業主導の国際共同治験への参加率においてアジア主要地域では日本は最上位国の一つだが、EBP企業主導の国際共同治験への参加率は最上位国の半分未満の水準であり、特にEBP主導の国際共同治験に対しては参加向上の方策が必要と考える。そして今まさに様々な議論が各方面で活性化しており、産官学一体で実効性のある解決策を見出し、新たな医薬品や新たな治療オプションが必要とする患者さんにいち早く届くことを願って止まない。
-
1)「国際共同治験に関する基本的考え方について」(平成19年9月28日付け薬食審査発第0928010号厚生労働省医薬食品局審査管理課長通知)
-
2)
-
3)医薬産業政策研究所、「国際共同治験の実施状況—実施試験数による分析—」政策研ニュースNo.41(2014年3月)
-
4)医薬産業政策研究所、「新薬の国際共同治験実施状況と症例数—新薬の臨床開発と承認審査期間調査より—」政策研ニュースNo.48(2016年7月)
-
5)医薬産業政策研究所、「近年の国際共同治験の参加国の分析—臨床試験登録システムClinicalTrials.govを基に—」政策研ニュースNo.58(2019年11月)
-
6)医薬産業政策研究所、「近年における国際共同治験の動向調査」政策研ニュースNo.66(2022年7月)
-
7)医薬産業政策研究所、「ドラッグ・ラグ:なぜ、未承認薬が増えているか?」政策研ニュースNo.66(2022年7月)
-
8)IQVIA Institute report“Emerging Biopharma’s Contribution to Innovation”
-
9)
-
10)飯島肇、大橋京一「韓国アカデミアにおけるClinical Trial Center について」臨床薬理、2007, 38(2), 73-75
-
11)
-
12)
-
13)「海外で臨床開発が先行した医薬品の国際共同治験開始前の日本人での第Ⅰ相試験の実施に関する基本的考え方について」(令和5年12月25日付け医薬薬審発1225第2号厚生労働省医薬局医薬品審査管理課長通知)

