目で見る製薬産業 日米欧の新薬承認状況の比較(2023年)
医薬産業政策研究所 主任研究員 吉浦 知絵
医薬産業政策研究所 主任研究員 富樫満里子
要約
- 2023年に日米欧で承認された新医薬品の承認品目数、薬事上特別措置件数及び審査期間について調査した。
- 2023年の国内の全承認品目数は106品目、NME数が30品目であった。米国では全承認品目数が128品目、NME数が55品目であった。欧州では全承認品目数が140品目、NME数が36品目であった。
- 日本では薬事上の特別措置をうけたNME数が2022年と比較して減少した。
- 日本の審査期間の中央値は全承認品目で10.3か月、NMEで10.9か月であり例年並みであったが、欧米と比較して最小であった。
- 2023年に新規に承認された再生医療等製品の数は日本3品目、米国6品目、欧州1品目であり米国の承認数が最多であった。
1.はじめに
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)及びEuropean Medicines Agency(EMA)がホームページ等で公表する情報をもとに継続的に収集、分析している1)。政策研ニュース第68号2)では2022年に日本で承認された医薬品情報に関する分析結果を、政策研ニュース第70号3)では2022年の承認実績を中心に日米欧の新薬承認状況と審査期間の比較分析結果を報告した。本稿では、2023年に日本、米国、及び欧州で承認された新薬の承認数、薬事上特別措置件数及び審査期間に関して報告する。
2.調査方法
日本の調査対象はPMDAホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。日本承認品目におけるNewMolecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。各品目の承認情報は、審査報告書、添付文書、「新医薬品の承認品目一覧」及び薬務公報から抽出した。申請日は審査報告書に記載される申請日とし、承認日は「新医薬品の承認品目一覧」に記載された承認日とした。
米国の調査対象は、FDAホームページの「CDER Drug and Biologic Approvals for Calendar Year」5)に掲載されているNewDrugApplication(NDA)及びBiologic License Application(BLA)に該当する医薬品とした。NMEの集計は、「CDER New Molecular Entity(NME)and Original Biologic Approvals Calendar Year」6)に掲載されている医薬品を対象とした。各品目の承認情報は、FDAホームページ内の各品目情報から抽出した。申請日は各品目のApproval Letterに記載された申請書提出の日付とし、承認日は各品目情報に記載されたApproval Dateとした。
欧州の調査対象は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」7)に掲載された医薬品を対象とした。NMEの集計は、「Newactive substance」に分類されている医薬品を対象とした。各品目の承認情報は、EMAホームページ内の各品目情報から抽出した。申請日は各品目のAssessment Reportに記載された申請書提出の日付とし、承認日は各品目情報に記載されたMarketing authorization issued の日付とした。
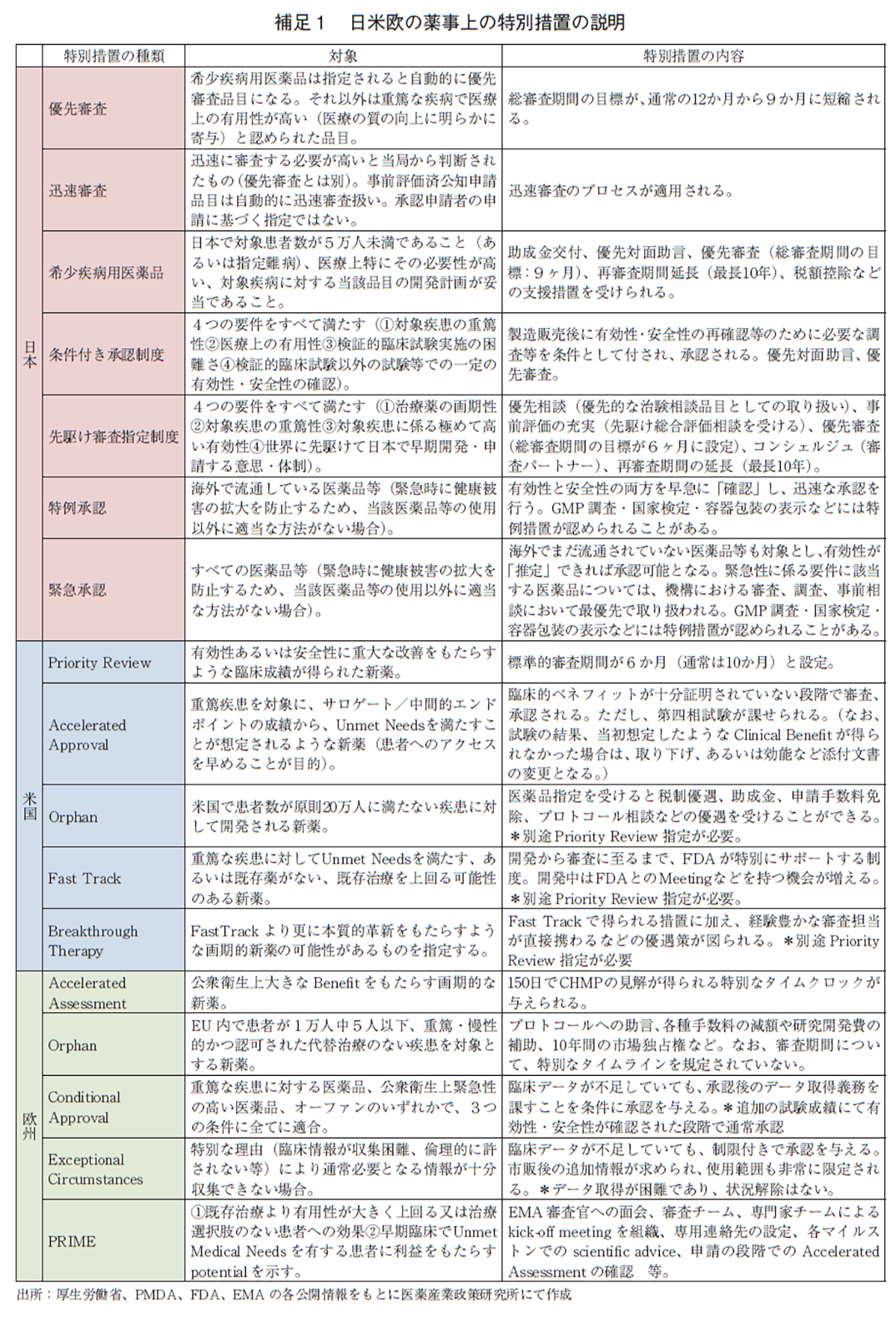
薬事上の特別措置として、日本では優先審査、希少疾病用医薬品、先駆け審査指定制度8)、条件付き承認制度9)、迅速審査を、米国ではPriority Review、Orphan、Fast Track、Breakthrough Therapy、Accelerated Approvalを、欧州ではAccelerated Assessment、Orphan、Priority Medicine(PRIME)、Conditional Approval、Exceptional Circumstancesを対象に集計した。各薬事上の特別措置の内容は補足1にまとめた。
審査期間については、標準的な統計解析ソフトStata/IC 14.2 for Windows(Stata Corp LP、College Station、TX、USA)を使用し、申請日から承認日までの期間を“審査期間”として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した(補足2~4)。
本稿における日本及び米国の承認数の集計対象は上記のとおりであり、再生医療等製品については対象外である。一方で欧州の集計対象には再生医療等製品に相当する品目も含まれる。再生医療等製品の承認数の推移をみるため、新規に承認された再生医療等製品数については以下を対象に別途集計した。日本は、PMDAホームページの「新再生医療等製品の承認品目一覧」10)に掲載されている品目のうち承認・一変別が「承認」または「新規」として記載された品目を対象とした。米国は、FDAホームページの「ApprovedCellular and Gene Therapy Products」11)に掲載されている品目を対象として初回の承認を受けた年を承認年として集計した。欧州は、ATMP(Advanced therapy medicinal products)指定12)を受けて承認された品目に加え、日米の上記集計に該当する品目を対象とした。
3.結果
(1)国内新医薬品の承認品目数とその内訳
2010~2023年の間に日本で承認された新医薬品の承認品目数の年次推移、及び品目の内訳を表1に示した。2023年には106品目が承認され、そのうち新有効成分含有医薬品は30品目であった。
新有効成分含有医薬品以外の申請区分別の内訳では、新効能医薬品が52品目、新用量医薬品が15品目、新投与経路医薬品が5品目、新剤形医薬品が1品目、バイオ後続品が3品目であった。
審査区分別の内訳では、通常審査品目が75品目、優先審査品目は27品目であった。優先審査品目のうち、希少疾病用医薬品は22品目であった。希少疾病用医薬品は集計期間内では2021年に40品目と承認数が最多となったが、2023年はこの半数程度の22品目であり、2022年と比較しても9品目減少した。先駆け審査指定制度対象品目(現在は先駆的医薬品等指定制度)及び条件付き承認制度対象品目の承認数はそれぞれ0品目であった。迅速処理品目の承認数は13品目あり、このうち事前評価済み公知申請品目は7品目であった。2023年の特例承認数はのべ4品目あり、いずれも新型コロナウイルス(SARS-CoV-2)による感染症の予防を効能・効果とする品目についての承認であった。
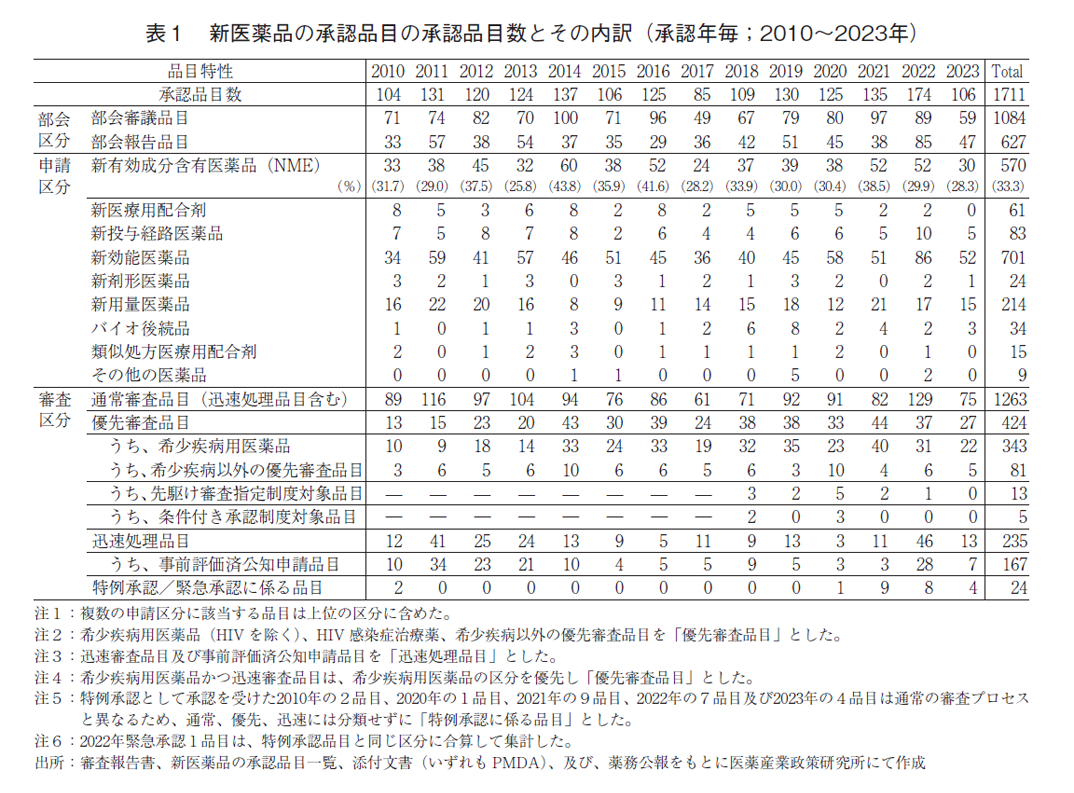
(2)新医薬品の承認品目数の日米欧比較
過去10年間(2014~2023年)の日本、米国、及び欧州で承認された新医薬品の承認品目数を図1に示した。米国では2023年に128品目が承認され、そのうちNMEは55品目であった。欧州では2023年に140品目が承認され、そのうちNMEは36品目であった。米国の2023年のNME数は2022年に比べて18品目増加し、全承認品目数も増加したが、日欧では2022年に比べてNMEがそれぞれ22品目、20品目減少し、全承認品目数も減少した。
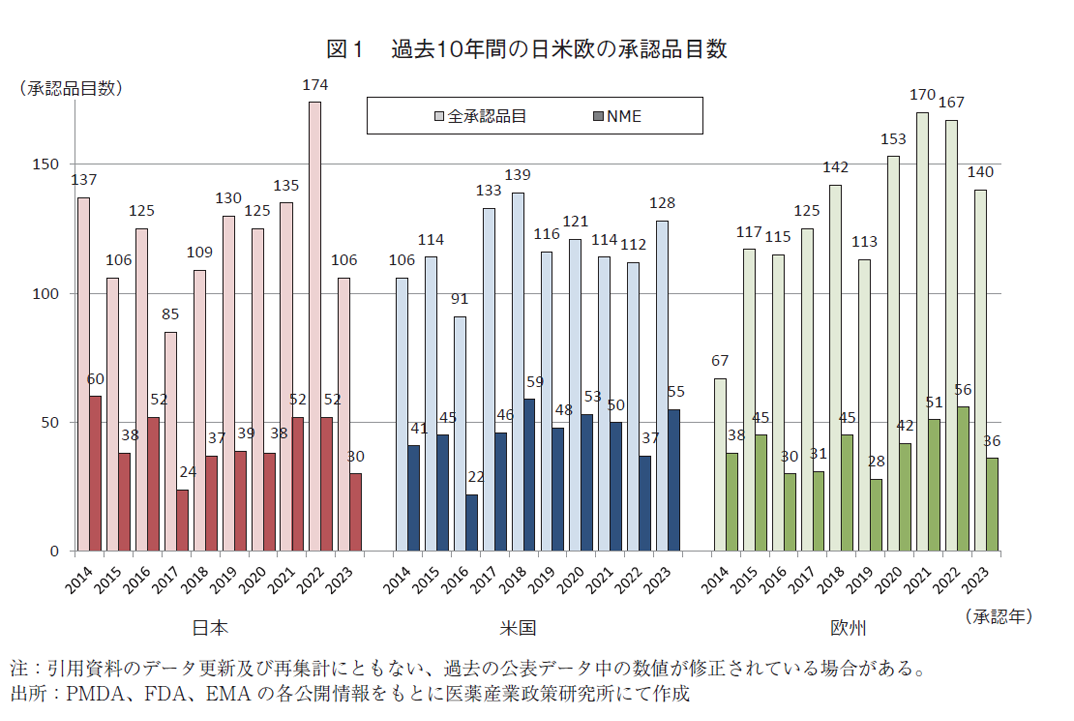
(3)薬事上の特別措置を受けたNME承認品目数
日米欧で過去5年間(2019~2023年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数について図2に示した。
2023年に日本で承認されたNME30品目中、優先審査(希少疾病用医薬品を含む)は10品目(33.3%)、希少疾病用医薬品は7品目(23.3%)、先駆け審査指定制度、条件付き承認制度及び迅速審査の対象はいずれも0品目であった。2023年のNME数は2022年より減少しており、優先審査、希少疾病用医薬品に該当したNME数も2022年と比較して減少した。
米国では、2023年に承認されたNME55品目中、Priority reviewは33品目(60.0%)、Orphan指定品目は28品目(50.9%)、Fast Track指定品目は25品目(45.5%)、Breakthrough Therapy指定品目は9品目(16.4%)、Accelerated approvalは9品目(16.4%)であった。2023年の米国NME数は2022年より増加しており、薬事上特別措置を受けたNME数もBreakthrough Therapy以外では2022年より増加した。
欧州では、2023年に承認されたNME36品目中、Accelerated Assessmentは3品目(8.3%)、Orphan指定品目は10品目(27.8%)、PRIME指定品目は3品目(8.3%)、Conditional Approvalは7品目(19.4%)、Exceptional Circumstancesは1品目(2.8%)であった。欧州は2023年のNME数が2022年より減少しており、薬事上特別措置を受けたNME数についても減少していた。
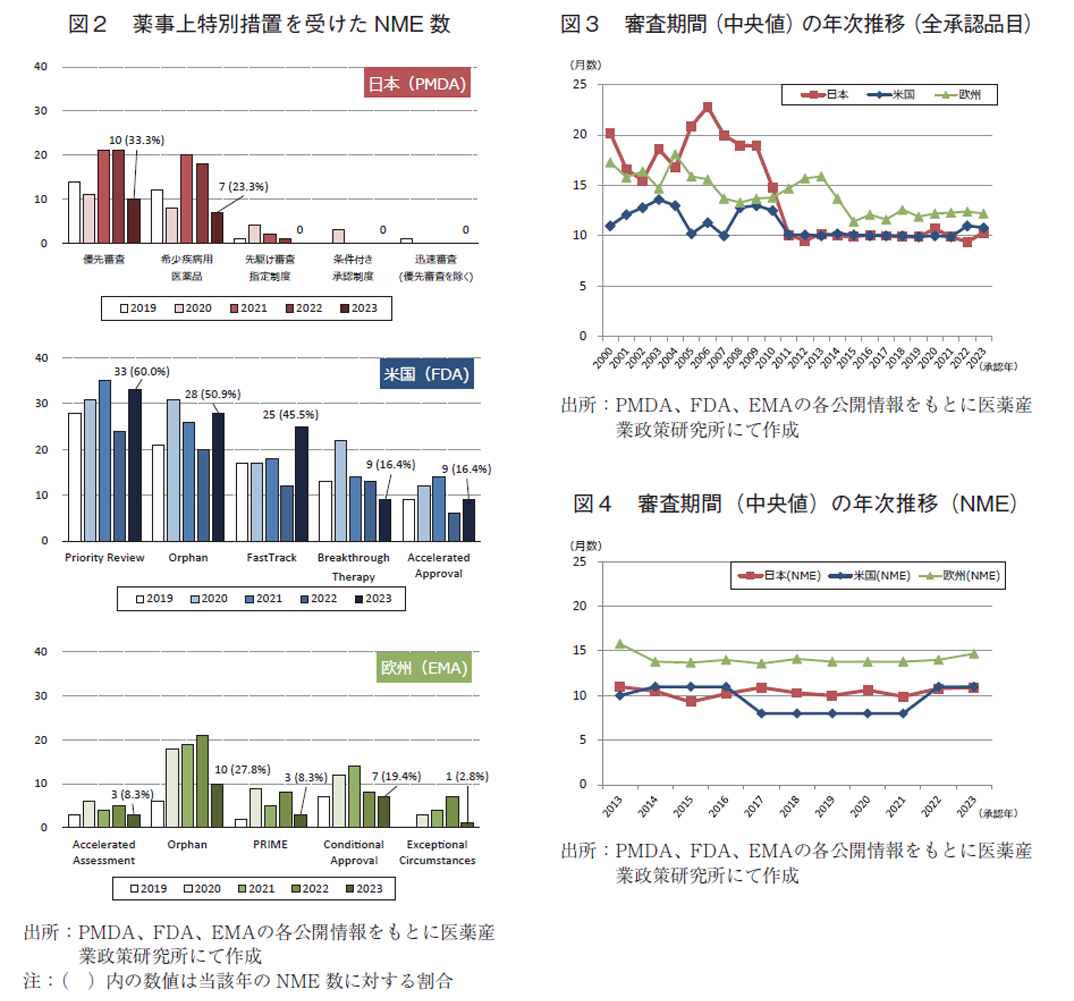
(4)審査期間の中央値の年次推移
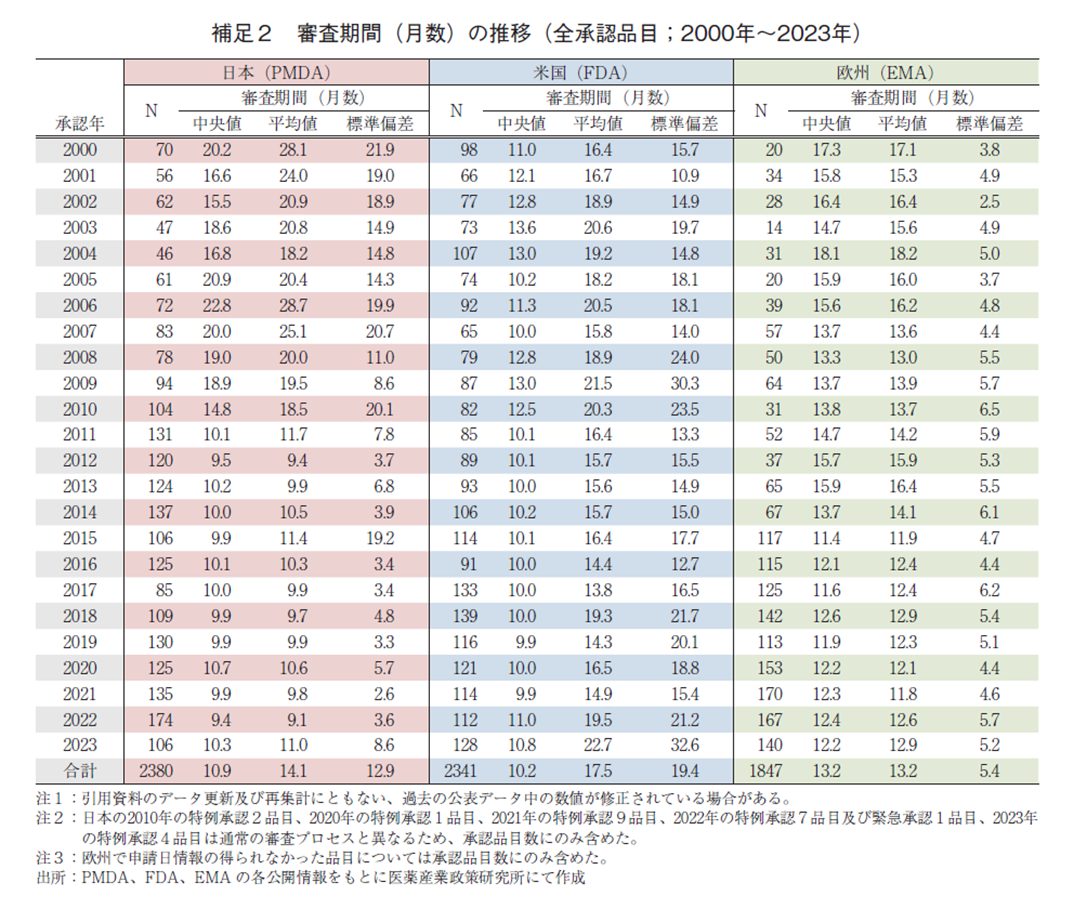
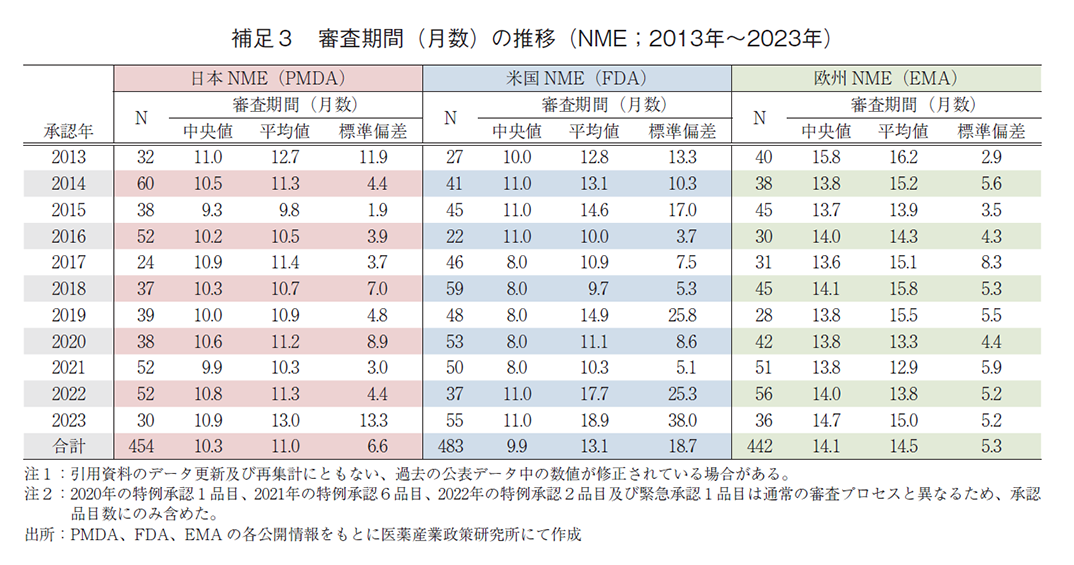
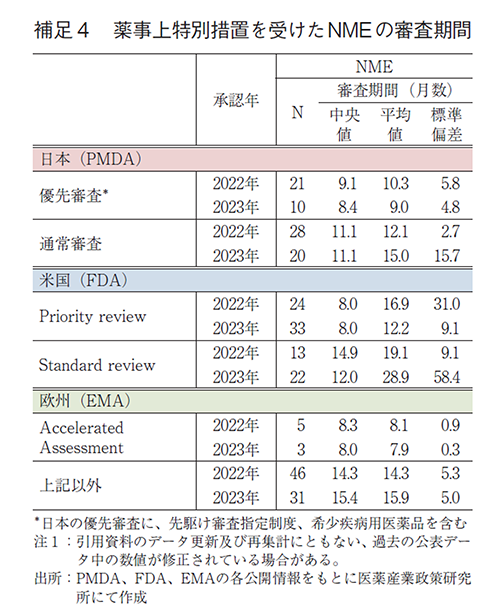
日本、米国、及び欧州で承認された医薬品の承認年毎(2000~2023年)の審査期間の中央値の年次推移を図3に示した。NMEについては日本の審査期間が大幅に短縮した後の2013年から2023年の期間を調査対象とし、審査期間の中央値の年次推移を図4に示した。審査期間、中央値、平均値、標準偏差に関しては補足2及び補足3に示した。NMEのうち審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、米国:Priority review、欧州:Accelerated Assessment)を受けた品目の審査期間については補足4に示した。
調査対象の全期間における審査期間の中央値、日本10.9か月、米国10.2か月、欧州13.2か月であった。2023年は日本10.3か月、米国10.8か月、欧州12.2か月であり、中央値は日本が最小となった(補足2)。年次推移では図3のとおり日本は2011年に大幅な審査期間の短縮が行われて以来、審査期間の中央値は概ね10か月程度で維持されている。
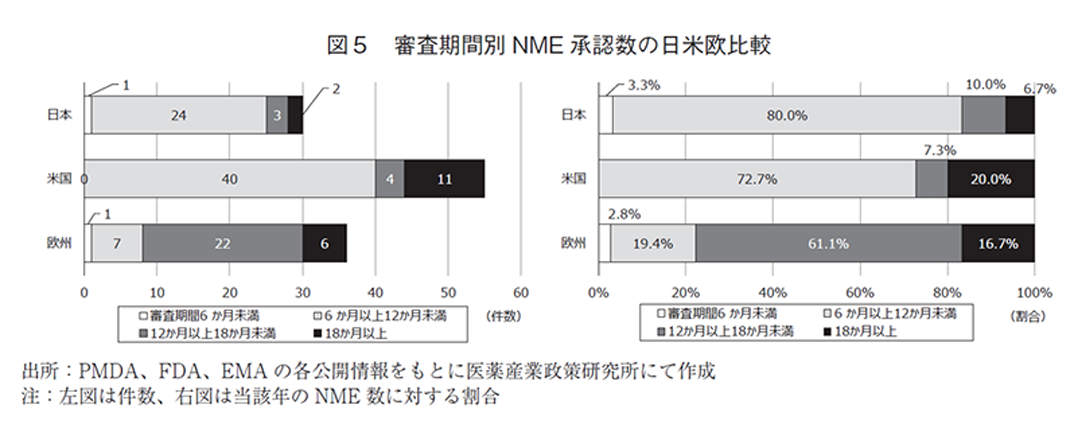
NMEについて調査対象の全期間における審査期間(中央値)は、日本10.3か月、米国9.9か月、欧州14.1か月であった。2023年の審査期間(中央値)は、日本10.9か月、米国11.0か月、欧州14.7か月であり、NMEについても中央値は日本が最小となった(補足3)。年次推移では図4のとおり日米欧ともに集計期間内に大きな変動はなかった。さらに、審査期間別のNME承認数を図5に示した。日米では審査期間が6か月以上12か月未満となるNMEが最も多く、欧州では12か月以上18か月未満が最多となった。
(5)再生医療等製品の承認数の日米欧比較
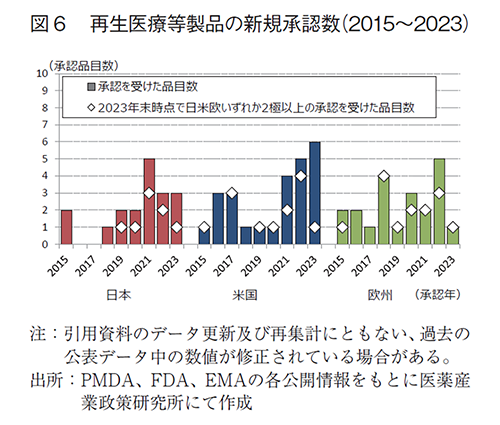
日本、米国、及び欧州で承認された再生医療等製品に相当する品目の新規承認数(2015~2023年)及び2023年末時点で日米欧いずれか2極以上の承認を受けた品目数を図6に示した。日本では2015年から2023年までに18品目が新規に承認を受けており、うち8品目は欧米いずれかまたは両方で承認を受けた品目であった。米国及び欧州では2015年から2023年までにそれぞれ25品目及び21品目が新規に承認を受けており、それぞれ13品目、14品目が2023年末までに日米欧の2極以上で承認を受けていた。
近年は日米欧いずれにおいても新規に承認を受けた品目数が増加しているが、2023年については米国で6品目と過去最多の承認数となり、日本は3品目で2022年と同数、欧州は1品目に減少していた。
4.まとめ・考察
本稿では、日本、米国、及び欧州で2023年に承認された新医薬品の承認品目数、薬事上特別措置件数及び審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。
日本の2023年の承認品目数は、全承認品目数とNME数のいずれも2022年と比べて減少した。欧州も同様の傾向であったが、米国については全承認品目数、NME数のいずれも2022年を上回った。また、直近数年のNME数の推移を見ると、米国は2020年、2021年に53品目、50品目と多く、2022年は37品目と少なかった。日本と欧州では、米国から1年遅れて2021年と2022年のNME数が50品目超となり、2023年は減少した。過去の政策研ニュース第63号13)で報告したとおり、2020年時点で米国では世界初上市品の割合が過半数を占め、日本と欧州では2番手または3番手に上市される品目の割合が高かった。2極以上で承認を得るグローバル製品において米国で最初に承認を得た後に日本または欧州で承認を得るような企業行動がNME数の推移にも影響したと考えられる。
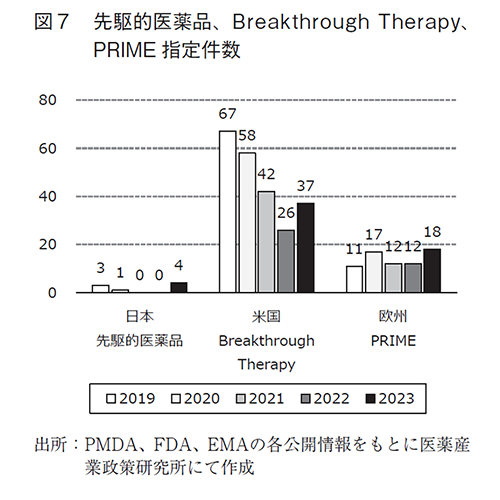
薬事上の特別措置をうけたNME数については、NME数の推移と同様に日本と欧州では2022年より全体的に減少し、米国では増加した。日本においては、先駆け審査指定制度、条件付き承認制度、迅速審査に該当するNME承認数が2023年度はいずれも0件であった。革新的な医薬品を日本国内へ迅速に導入することは重要であるが、図2でNME承認数が比較的多かった先駆け審査指定制度であっても過去5年間で8件、NME数に対して3.8%に留まっていた。開発時点から当局の指導を受けられる点で先駆け審査指定制度と類似する米国のBreakthrough Therapy及び欧州のPRIMEと比べると、同期間でBreakthrough Therapyに該当するNME数は71件(NME数に対して29.2%)、PRIMEに該当するNME数は27件(NME数に対して12.7%)あり、いずれも日本と比較して多かった。図7に過去5年間にこれらの薬事上特別措置の指定を新たに受け、現時点で有効な件数を示した。日本は8件8)、米国は230件14)、欧州70件15)であり、承認数との直接比較はできないものの指定件数そのものが欧米では多かった。
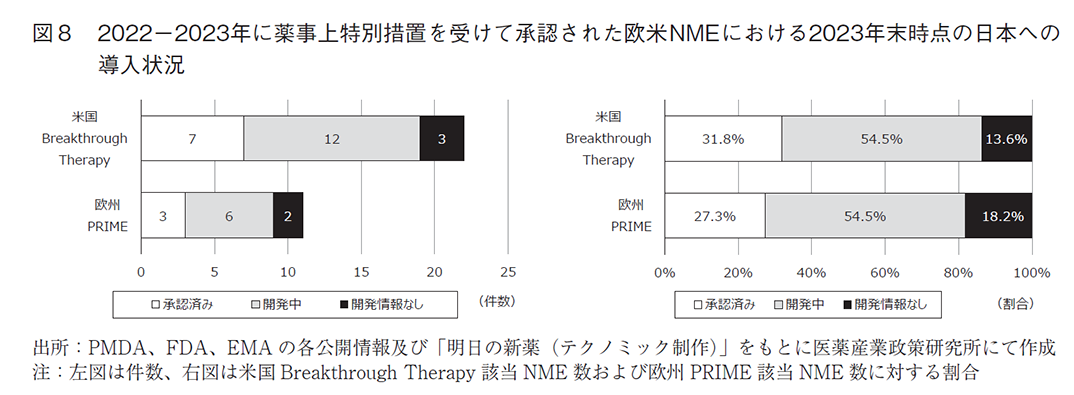
一方で、図8に直近2年間で米国Breakthrough Therapy及び欧州PRIME指定を受けたNME承認品目の日本への導入状況を示したが、8割以上が日本国内で承認済みまたは開発中であった。このことから、欧米で画期的新薬として薬事上特別措置を受けた医薬品の日本への導入が現状著しく遅れているというわけではないが、日本発または日本が一番手となるような新薬を生み出すために先駆的医薬品指定制度などもより一層活用されることが望ましい。欧米と比較して指定件数が少ない現状については、原因の分析や制度面での見直し検討が必要かもしれない。
審査期間については、全承認品目とNMEのいずれも平年並みであり、各極ともに10~15か月であった。本稿で分析した審査期間は申請資料提出日から承認日までとしており、日米欧の各当局から発行される各種レポートにおける審査期間とは一部異なり、当局からの照会事項に対応する時間も含めて審査期間としたものである。例えば2023年の米国の承認品目には、初回の申請日が古く10年を超える審査期間となる品目も含むため、補足2及び補足3で示す審査期間の標準偏差は大きい。本稿の分析において2023年の日本の審査期間の標準偏差は比較的小さく、また2023年の日本の審査期間の中央値は日米欧で最小となった。図5のとおり2023年の日本のNME30品目のうち、審査期間が12か月以上は5品目(16.7%)のみで、6か月以上12か月未満は24品目(80.0%)であり、8割以上が申請日から起算して12か月で承認を得ていた。世界初承認を受ける事例が多い米国では申請から承認までの期間が長くなる可能性があるが、2-3番手に申請する事例が多い欧州と日本の比較でも日本の審査期間の方が短かった。欧米と同等以上に審査期間が短く、当局の設定する目標期間16)内に審査完了が見込めるという点は、新薬上市に向けた開発タイムライン上の予見性も高まることから、日本の審査制度の優れた点であると言える。
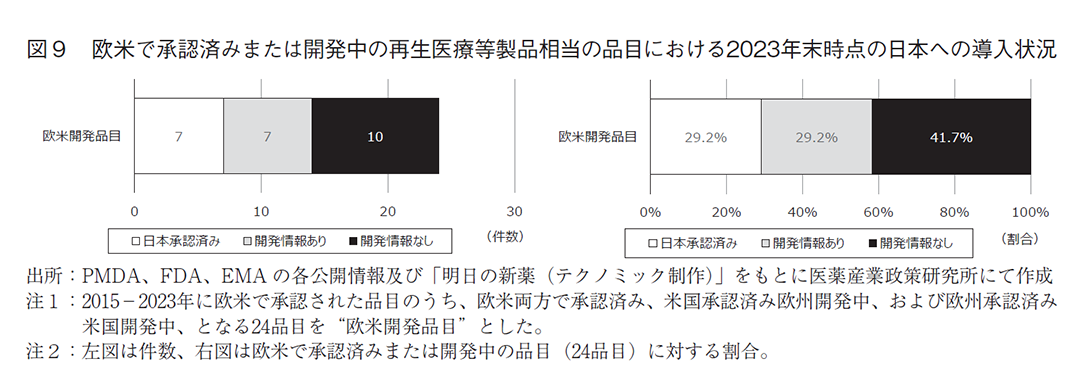
新規に承認された再生医療等製品数は近年増加傾向であるが、2023年は米国の6品目が最多であり、日本は3品目、欧州は1品目と2022年より減少した。また、2023年末時点で2極以上の承認を得たグローバル製品の承認数は日米欧ともに1品目であった。図6で示した欧米の承認品目のうち欧米両方で承認済みまたは欧米開発中となる24品目を抽出し日本での開発情報の有無を調査したところ(図9)、14品目(58.3%)が日本承認済みまたは開発中である一方、10品目(41.7%)は日本での開発情報が得られなかった。医薬品のみならず再生医療等製品においても一部の製品においては日本での開発が遅れるか、日本には導入されない状況が懸念される。治験環境整備など昨今のドラッグラグ・ロス対策の議論に加えて、再生医療等製品特有の各種課題解決に向けた対策が進められることを期待する。
5.おわりに
本稿では、日本、米国、及び欧州で2023年に承認された新医薬品の承認品目数、薬事上特別措置件数及び審査期間について比較調査した。2023年の承認数は米国に及ばないものの欧州と同程度であった。2023年は薬事上特別措置を受けた承認数が他極に比べて日本では少なく、審査期間の中央値は日本が最小となった。欧米と比較した日本のこのような特徴が今後の日本の承認数、特に日本への導入への早さにどのように影響するかは興味深く、今後も継続調査する。
-
1)医薬産業政策研究所、「日本における新薬の臨床開発と承認審査の実績」、リサーチペーパー・シリーズNo.69(2016年11月)
-
2)医薬産業政策研究所、「日本で承認された新医薬品とその審査期間-2022年承認実績と経年動向調査-」、政策研ニュースNo.68(2023年3月)
-
3)医薬産業政策研究所、「日米欧の新薬承認状況と審査期間の比較」、政策研ニュースNo.70(2023年11月)
-
4)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)
-
13)医薬産業政策研究所、「ドラッグ・ラグ:国内NME承認品目の上市状況~米国・欧州との上市時期比較」、政策研ニュースNo.63(2021年7月)
-
14)
-
15)
-
16)

