目で見る製薬産業 国内未承認薬の最新動向 -2023年の日米新薬承認状況をふまえて-
医薬産業政策研究所 主任研究員 吉浦 知絵
医薬産業政策研究所 主任研究員 東 宏
医薬産業政策研究所 主任研究員 森本 潔
要約
- 本稿では、2012年から2023年に米国FDAが承認したNMEを対象とし、日本国内の未承認薬の状況について調査した。
- 米国NMEに対する国内未承認薬の割合は、2016年から2020年末調査時点にかけて毎年増加し、2021年末調査時点以降は64.4%~67.5%の水準で高止まりしていた。
- 2023年末時点の未承認薬の国内開発状況は、“国内開発情報なし”が80品目、“国内開発中”が77品目であった。
- 2018年末時点の未承認薬ではPhase3実施中が26品目であったが、2023年末時点の未承認薬では55品目となり開発後期品目が増加した。
- 2023年末時点の国内未承認薬の米国承認取得企業の分類について、EBP由来品目の割合は約5割であった。“国内開発情報なし”かつEBP由来は2018年末時点の未承認薬では29品目であったが、2023年末時点の未承認薬では45品目に増加した。
- 2023年末時点の国内未承認薬の疾患分類では、品目数の多い順に抗悪性腫瘍剤、神経系用剤、消化管及び代謝用剤、全身性抗感染症薬であった。“国内開発情報なし”品目数の多い順では順序が入れ替わり、神経系用剤、抗悪性腫瘍剤、全身性抗感染症薬、消化管及び代謝用剤となった。
1. はじめに
医薬産業政策研究所では、2021年7月の政策研ニュース第63号1)において他の国では承認されているが日本では承認されていない「国内未承認薬」に拡大の兆候が見られることを報告し、その後も未承認薬の分析を重ね、ドラッグ・ラグ/ロスについて問題提起をしてきた2、3、4、5、6、7、8、9)。この問題に対し、昨今では多方面で論説を目にする機会が増え、昨年度は薬価制度改革10)や薬事政策11)等、具体的な取り組みが進められた。本稿では、これまで報告してきた国内未承認薬について最新動向を把握すべく2023年の新薬承認状況もふまえて再調査し、国内未承認薬数の推移や特徴など報告する。
2. 調査方法
国内未承認薬数の調査対象は2012年から2023年に米国でNMEとして承認された品目とし、日本の承認状況と比較することで国内未承認薬を特定した。具体的には、毎年FDAから発行される報告書「New Drug Therapy Approvals12)」に掲載される各年の新規化合物(NME:New MolecularEntity)を米国NMEとして集計し、国内承認状況については毎年PMDAから発行される新医薬品の承認品目一覧13)を参考に調査した。なお本稿では前述のとおりFDAの報告書「New DrugTherapy Approvals12)」から品目を集計したため、ワクチンと再生医療等製品に区分される品目は調査対象に含まない。
次に、国内未承認薬数の年次推移を確認するため、調査時点毎(各年12月末日)の国内未承認薬数および米国で承認されたNME数に対する日本国内での承認率を集計した(補足1)。各年の集計では年毎の国内未承認薬数の増減があり変化の傾向を解釈することが困難であったため(補足1、2)、本稿でも2021年7月の政策研ニュース第63号1)の解析と同様に本データセットを用いて調査時点毎に国内未承認薬数を集計し、2016年から2023年の期間で5年分の合計値として算出した。比較として、米国で承認されたNME数の5年分の合計値についても同様に算出した。加えて、米国NME数に対する国内未承認薬数の割合を算出した(図1)。
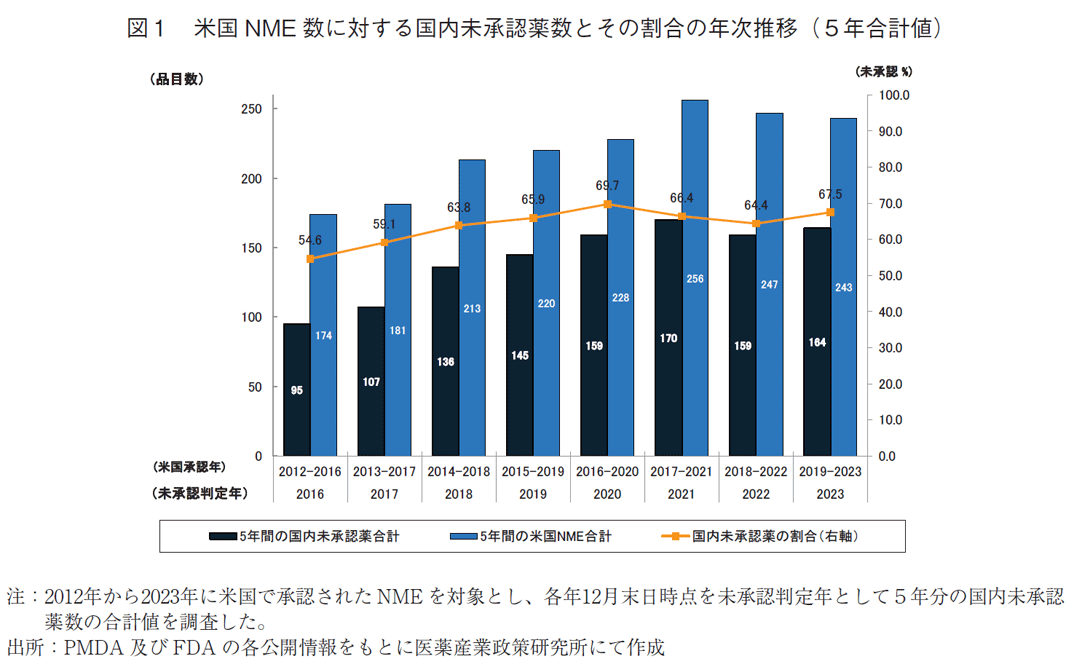
なお、2021年7月の政策研ニュース第63号1)では、日米欧のNMEを調査対象に欧州と米国のいずれかでの承認に対する国内未承認薬数及び割合を算出していたが、本稿では調査対象を米国NMEに限定し、米国でNMEとして承認されていない品目は調査対象外とした。承認時のNME該否は日米欧各極で完全一致しないため、2021年7月の政策研ニュース第63号1)と同じ方法では初回承認時に非NMEであった品目が他の地域で後にNMEとして承認された場合は初回承認年の集計を遡及的に修正する必要があり、過去の集計結果と比べて品目数が変わるケースがあった。これに対して本稿では、今後も本調査を継続的に実施することを念頭におき、平易かつ納得性の高い指標とすべく調査対象を米国NMEに限定して集計し直した。なお、この変更により欧州のみで承認を受けた品目は調査対象外となる。しかし2021年7月の政策研ニュース第63号1)で報告したように、2010年から2020年までに欧米で承認された品目における国内未承認薬のうち欧州のみの承認品目(米国未承認)は8%に留まり、欧州承認品目の多くが米国承認を取得することから、本稿で変更した調査方法でも過去の医薬産業政策研究所の調査と齟齬のない結果になると考えている。
調査対象とした各品目の国内開発状況及び疾患分類については、「明日の新薬(テクノミック制作)」の各品目情報に記載されたATC分類を参照した。また、調査対象とした各品目について米国での承認取得企業が新興企業(以下EBP:EmergingBioPharma)であるかを分類する際には、Evaluate PharmaⓇ(2024年3月時点)の情報をもとに、2018年または2023年末時点で創立30年以内、かつ2018年または2023年の売上げが5億米ドル未満の企業をEBPとして分類した。
なお、本調査は承認数や開発状況の観点からの分析であり、日本国内の医療ニーズを考慮した調査でないことは調査の前提として事前に提示しておく。
3. 結果
3-1. 米国NMEに対する国内未承認薬数の推移
図1に示したとおり年次推移を追った結果、米国NME数の5年合計値は2016年末時点で174品目、2020年末時点では228品目、2023年末時点では243品目と増加していた。これに対し、国内未承認薬数の5年合計値は2016年末時点では95品目、2020年末時点では159品目、2023年末時点では164品目であった。米国NME数に対する国内未承認薬の割合は2016年から2020年末調査時点にかけて毎年増加し(54.6%→69.7%)、約7割が国内未承認という水準に達していたが、その後2021年末調査時点で66.4%となり、以降6割台で推移している(66.4%→64.4%→67.5%)。
本稿では、直近5年分として2023年末時点の国内未承認薬164品目に対してその特徴の分析結果を報告する。また、その前の5年分となる2018年末時点の国内未承認薬136品目の分析結果を比較対象とした。なお、2023年末時点の164品目は2019年から2023年に米国承認を受けたNMEにおける国内未承認薬であるのに対し、2018年末時点の136品目は2014年から2018年に米国承認を受けたNMEにおける国内未承認薬であるため各群の品目の重複はない。
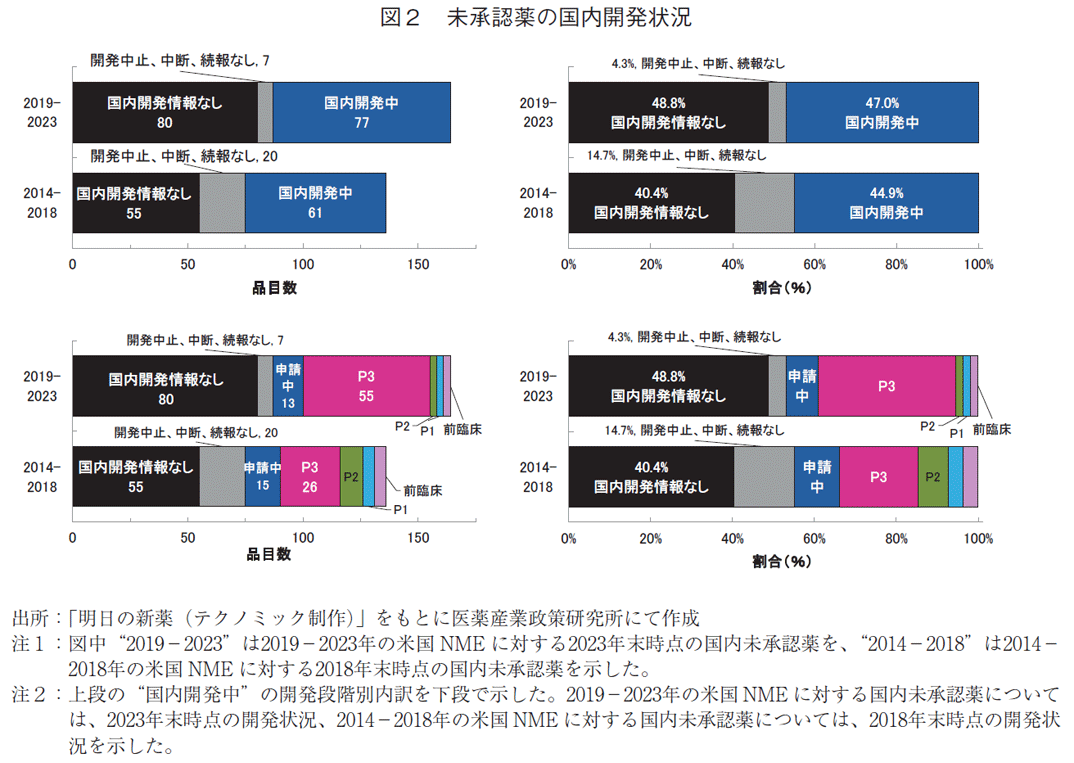
3-2. 未承認薬の国内開発状況
2023年末時点および2018年末時点の国内未承認薬の国内開発状況の内訳を図2に示した。2023年末時点の国内未承認薬のうち国内開発中の品目(申請中を含む)は164品目中77品目(47.0%)であった。2018年末時点の未承認薬では136品目中61品目(44.9%)が国内開発中であったことと比較すると、品目数、未承認薬全体における割合ともに増加した。これらの品目は、承認時期の「ラグ(遅延)」はあるものの国内での臨床開発は進行中であるため、将来的に国内で薬事承認される可能性がある。また、国内開発中の品目をその開発段階別にみると、2023年末時点の未承認薬では2018年末時点の未承認薬と比較して、Phase2以前の初期開発品目の数、割合が減少し、Phase3段階の開発後期品目の数、割合が増加していた。
国内開発情報のない品目は2018年末時点で55品目(40.4%)であったのに対し、2023年末時点では80品目(48.8%)と増加していた。このように国内で開発されていない国内未承認薬について医薬産業政策研究所ではドラッグ・ロス品と定義しており8)、この80品目と“開発中止、中断、続報なし”の7品目は新たに国内開発が開始されない限り今後も「国内未承認薬」として残る。
3-3. 未承認薬の米国承認取得企業の特徴
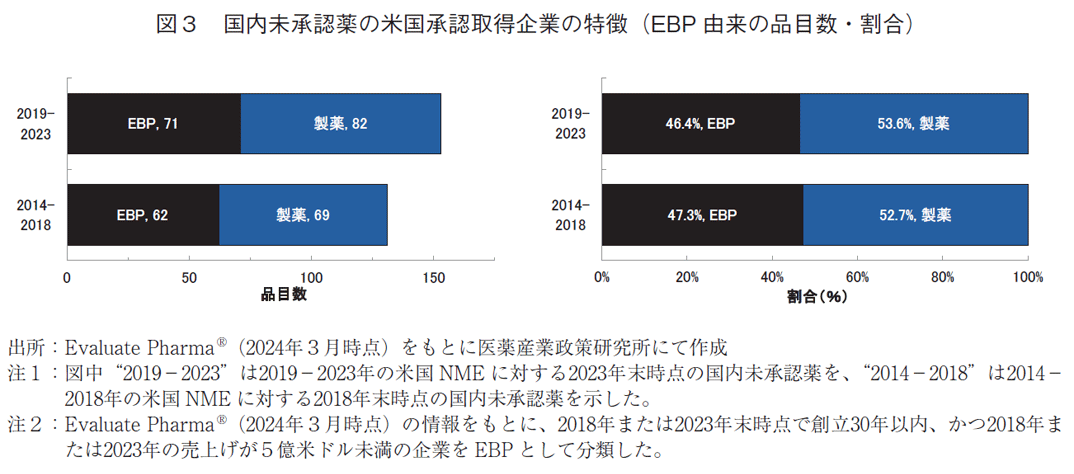
医薬産業政策研究所では過去の調査において日本に足がかりのないEBP由来の品目で国内未承認薬割合が高いことを報告してきた3、4)。昨今の議論においてもEBPによる新薬の増加が国内未承認薬の増加の一因とされており、EBPとの協業を促進するための対策14)が進められている。本稿で分析対象とした2023年末時点の国内未承認薬と、2018年末時点の国内未承認薬のうち企業情報が取得できた品目について、米国承認時の承認取得企業がEBPであった品目数と割合を図3に示した。
EBP由来の品目数は、2023年末時点で71品目であり、2018年末時点の62品目から増加した。EBP由来の割合は、2023年末時点で46.4%であり2018年末時点の47.3%と同水準であった。
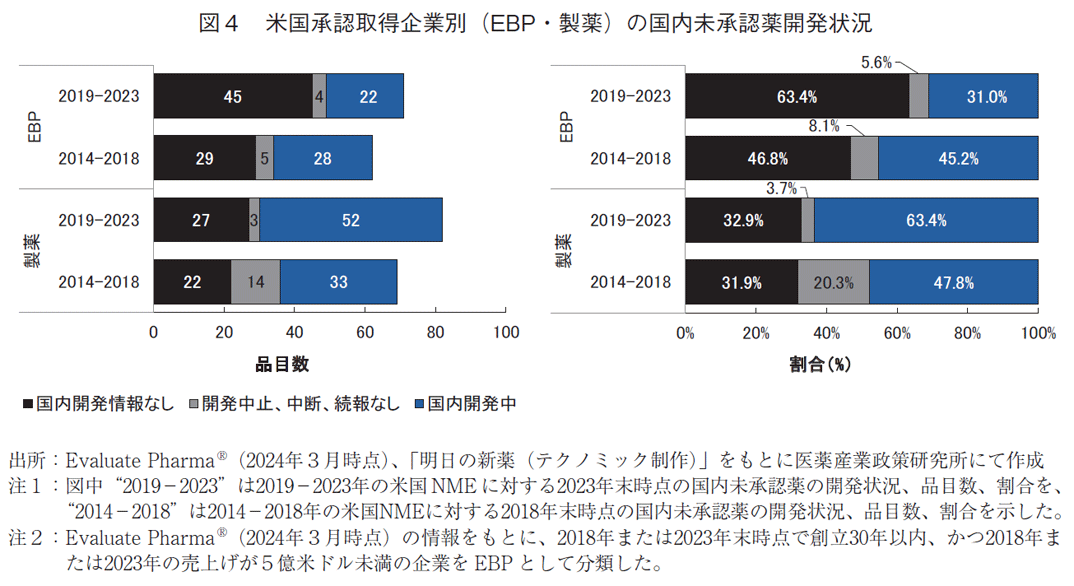
3-4. 米国承認取得企業別(EBP由来・製薬由来)の国内未承認薬開発状況
3-2で示した未承認薬の国内開発状況について、企業情報を取得できた品目で米国承認時の承認取得企業別に図4に示した。
EBP・製薬由来別に未承認薬の国内開発状況を見ると、2023年末時点のEBP由来71品目のうち開発情報がないものは45品目(63.4%)であり、2018年末時点のEBP由来62品目中29品目(46.8%)に比べ品目数、割合ともに増加した。一方、2023年末時点のEBP由来71品目のうち開発中は22品目(31.0%)であり、2018年末時点のEBP由来62品目中28品目(45.2%)に比べ品目数、割合ともに減少した。
3-5. 国内未承認薬の対象疾患分類
図5には、2023年末時点と2018年末時点の国内未承認薬について疾患分類別に品目数を示した。2023年末時点の未承認薬では、抗悪性腫瘍剤が49品目と最多であり、神経系用剤、消化管及び代謝用剤、全身性抗感染症薬と続いた。米国で承認されたNME数に対する国内未承認薬の割合は、抗悪性腫瘍剤(74.2%)、神経系用剤(75.0%)、消化管及び代謝用剤(68.0%)、全身性抗感染症薬(66.7%)であった(掲載図なし)。2018年末時点の未承認薬で多かった全身性抗感染症薬の品目数が2023年末時点では減少した。
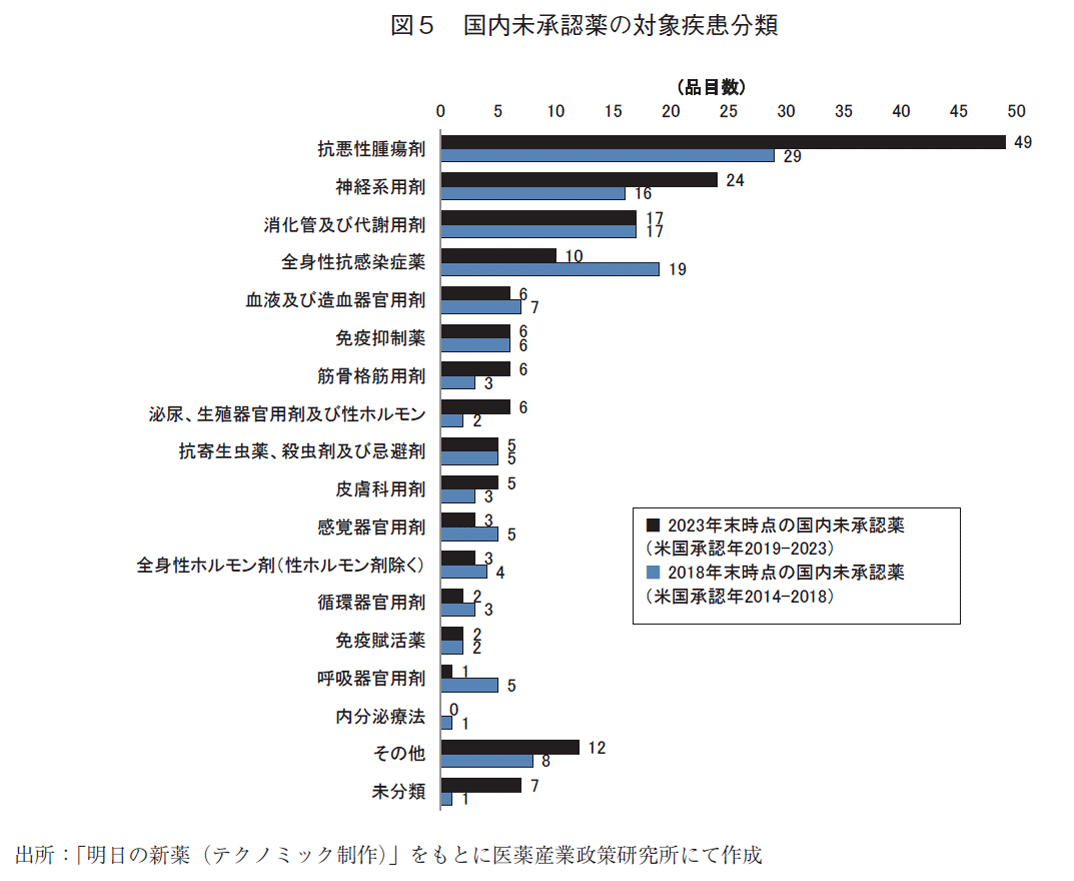
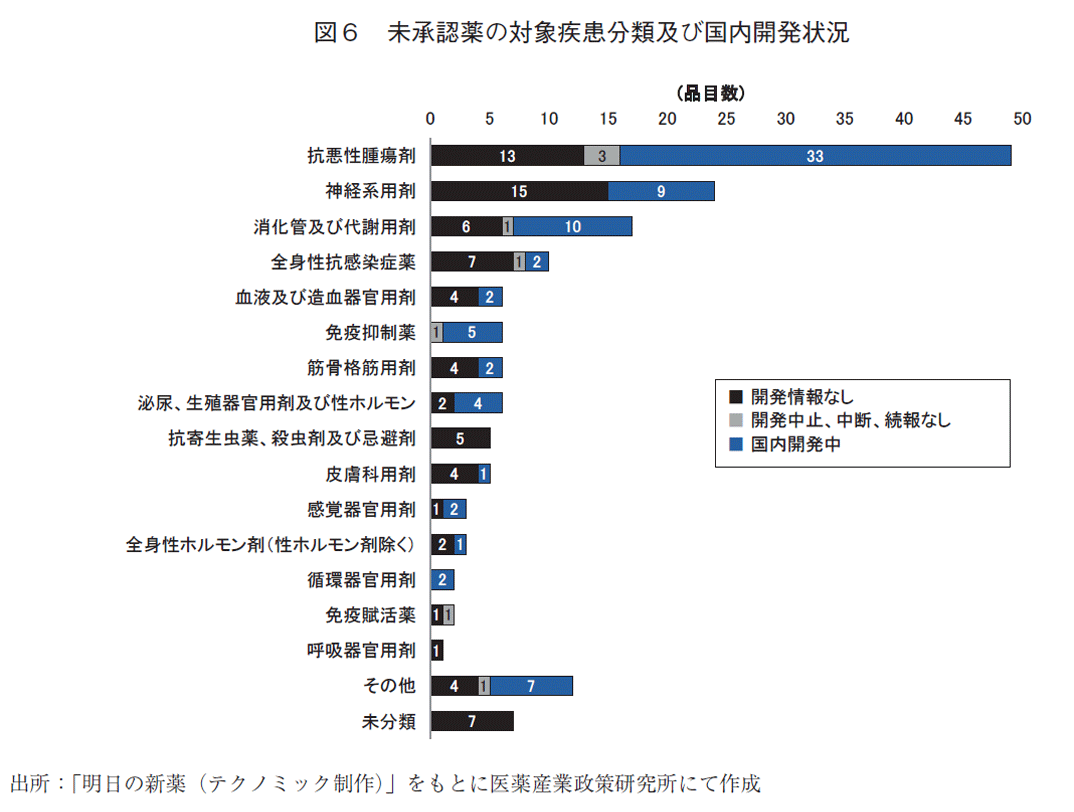
また、図6には、2023年末時点の国内未承認薬について疾患分類と国内開発状況分類別に品目数を示した。2023年末時点の国内未承認薬で品目数が最多であった抗悪性腫瘍剤のうち、国内開発情報がない品目は13品目のみで、残り36品目は国内開発が着手された品目であった。未承認薬のうち国内開発情報がない品目に限ってみると、品目数の多い順に神経系用剤(15品目)、抗悪性腫瘍剤(13品目)、全身性抗感染症薬(7品目)、消化管及び代謝用剤(6品目)となっていた。
4. まとめ・考察
本稿では2012年から2023年に米国FDAが承認したNMEを対象として日本国内の未承認薬の状況を調査した。米国NMEに対する国内未承認薬数の5年合計値は、2016年末時点では95品目、2020年末時点では159品目、2023年末時点では164品目と増加した。国内未承認薬の割合は、2016年から2020年末調査時点にかけて毎年増加し、2021年末調査時点以降は64.4%~67.5%の水準で高止まりしていた(図1)。
次に、2019年から2023年に米国承認され2023年末時点で国内未承認であった164品目、および2014年から2018年に米国承認され2018年末時点で未承認薬であった136品目の合計300品目について開発状況、欧米承認取得企業、疾患分類を調査した。2023年末時点、2018年末時点で未承認であった品目群それぞれの特徴の変化と、冒頭で述べた未承認薬に対する具体的な取り組みに期待される効果について以下考察したい。
2023年末時点の国内未承認薬164品目のうち国内開発中の品目は77品目あり、2018年末時点の未承認薬で国内開発中であった61品目と比較するとPhase2以前の品目数が減少してPhase3段階にある品目数が増加した(図2)。米国で承認されたNME数に対する割合としても、2023年末時点でPhase3実施中は22.6%(243品目中55品目)であり、2018年末時点のPhase3実施中12.2%(213品目中26品目)と比較して増加した。Phase2以前の開発初期品目の減少幅はEBP由来の方が大きく(製薬由来7→4品目、EBP由来13→5品目)、Phase3段階の品目数は製薬由来、EBP由来ともに増加した(製薬由来18→38品目、EBP由来8→14品目)(掲載図なし)。一部のEBP由来品目も含め、米国開発に並行して国内承認に必要なデータを取得するなど日本での開発が早期化している可能性や、国内の追加試験としてPhase1のみで早期に承認に至るケースが増加した可能性などが考えられた。このような変化はドラッグ・ラグの期間短縮という観点で改善傾向ととらえることができるかもしれない。一方で2024年3月の政策研ニュース第71号9)では、長期のドラッグ・ラグ発生に影響する因子として欧米承認後の日本での追加試験について述べた。2023年末時点の未承認薬では、米国承認後に国内開発中の品目が依然として77品目ある状態である(図2)。今後は国際共同治験への日本人参加促進などにより、国内開発中の未承認薬がより早期に進捗し国内承認されることで、未承認薬数としても減少していく状況が望まれる。
国内開発情報のない未承認薬について、2023年末の未承認薬(80品目、48.8%)では2018年末時点の未承認薬(55品目、40.4%)と比較して品目数・割合ともに増加した(図2)。さらに、EBP由来品目に着目した場合も国内開発情報のない未承認薬の品目数、割合は増加した(29品目、46.8%→45品目、63.4%)。逆に、EBP由来品目における国内開発中の未承認薬は品目数、割合ともに減少した(28品目 45.2%→22品目 31.0%、図4)。EBP由来で国内開発情報のない未承認薬は、米国で承認されたNME数に対する割合として見た場合も2023年末時点で18.5%(243品目中45品目)であり、2018年末時点の13.6%(213品目中29品目)に対して増加した。日本に足場のないEBP由来の品目などで国内開発着手には依然としてハードルがあることが考えられる。
2022年7月の政策研ニュース第66号3)では、EBP由来品目のピボタル試験への日本組み入れが少ない要因について治験手続きの煩雑さの課題等を考察し、EBP品目の国際共同治験への日本人参加促進の施策、日本市場展開を意図するEBPとの早期提携を促進する施策などの重要性を述べたが、昨今では薬事制度改革に加えてPMDAの海外拠点設置14)といった米国EBPにアプローチするための取り組みが新設されており、これらの施策が実際に作用してEBP由来品目の早期国内開発着手、ひいては未承認薬の減少につながることを期待したい。
EBP由来のみならず製薬企業由来で国内開発が行われていない未承認薬も存在した(図4)。未承認薬の課題を検討する際に国内市場における経済合理性の観点から議論されることがあるが、医療ニーズがあるにも関わらず経済性の観点で国内開発に至らない品目をなくすことは重要と考える。2022年7月の政策研ニュース第66号3)では薬事・臨床試験環境の課題に加え、日本展開の期待事業価値の課題とEBP品目導入に対するインセンティブや収益を担保するための政策の重要性について述べた。令和6年度薬価制度改革10)では、迅速導入加算の新設など革新的新薬のイノベーションの適切な評価に向けた変更点が盛り込まれ、これらによりEBP由来、製薬由来に限らず現在国内開発のない未承認薬の日本での事業展開促進が期待されるが、経済合理性を担保する施策については継続的な議論が続けられることも合わせて期待したい。
2023年末時点の未承認薬の疾患分類では、新薬全体に占める割合の多い抗悪性腫瘍剤の品目数が最多であり、神経系用剤、消化管及び代謝用剤と続いた。また、“国内開発情報なし”に限った場合には神経系用剤が最多であり、次いで抗悪性腫瘍剤、全身性抗感染症薬と続いた(図6)。全体の割合と“国内開発情報なし”の割合に差が生じた一因として、抗悪性腫瘍剤の病態への理解など研究開発が進歩した良い面が反映されている可能性が考えられる。医薬品の研究開発の実態に関する医薬産業政策研究所の調査15)では、抗悪性腫瘍薬の開発パイプライン数が全体の半数程度を占めるなどこの領域の研究開発が活発であることを報告している。一方で、“国内開発情報なし”の品目が多かった神経系用剤は、グローバル製品を対象に医薬品開発の成功確度について述べた文献16)において最も成功確度の低い分野の一つと報告されている。また、小児用医薬品についても治験の困難さ等の理由によるドラッグ・ロスが課題視されており17)、このように開発難易度の高い疾患領域や国内患者数の少ない小児、希少疾病などに対する医薬品についても遅滞なく国内開発が進められるような施策が重要と考えられる。2024年初に希少疾病用医薬品等の指定に関する変更18)、小児用医薬品の開発計画策定推奨19)といった通知が発出されているが、これらの施策の国内開発促進への効果を期待するとともに、効果検証を含めた継続的な議論が行われることを期待する。
5. おわりに
本稿では、2023年の新薬承認情報もふまえて最新の国内未承認薬の状況を報告した。ここ2~3年の未承認薬数の増加傾向は落ち着いているもののいまだ高水準であり、日本国内で欧米に比肩する高水準の医薬品アクセス環境を維持するという観点では今後も注視していく必要がある。
2023年末時点の未承認薬の分析から、依然としてEBP由来品目で開発未着手の品目数が多い点など、今般のドラッグ・ラグ/ドラッグ・ロス対策の方向性に合致した課題が残存することがわかり、今後これらの対策が実際に作用して未承認薬数の減少として効果が表れることを期待する。
補足1 国内未承認薬数と米国NMEの国内承認率の集計
分析に用いたデータセットは以下の通りである。2012年から2023年の米国および日本のNME承認情報を用い、調査時点毎(各年12月末日)に米国の初承認年ごとの国内未承認薬数および米国で承認されたNMEの日本国内での承認率を集計した。
各年の太線で囲った数値は、その年の米国NME数に対する国内未承認薬数および国内承認率である。各年の米国NME数には増減があり、新規に発生する国内未承認薬数も年によってばらつきが生じる。本稿では、この1年ごとのばらつきによらず年次推移を追うことを目的に、米国NME数および国内未承認薬数については5年分の合計値として算出することとした。

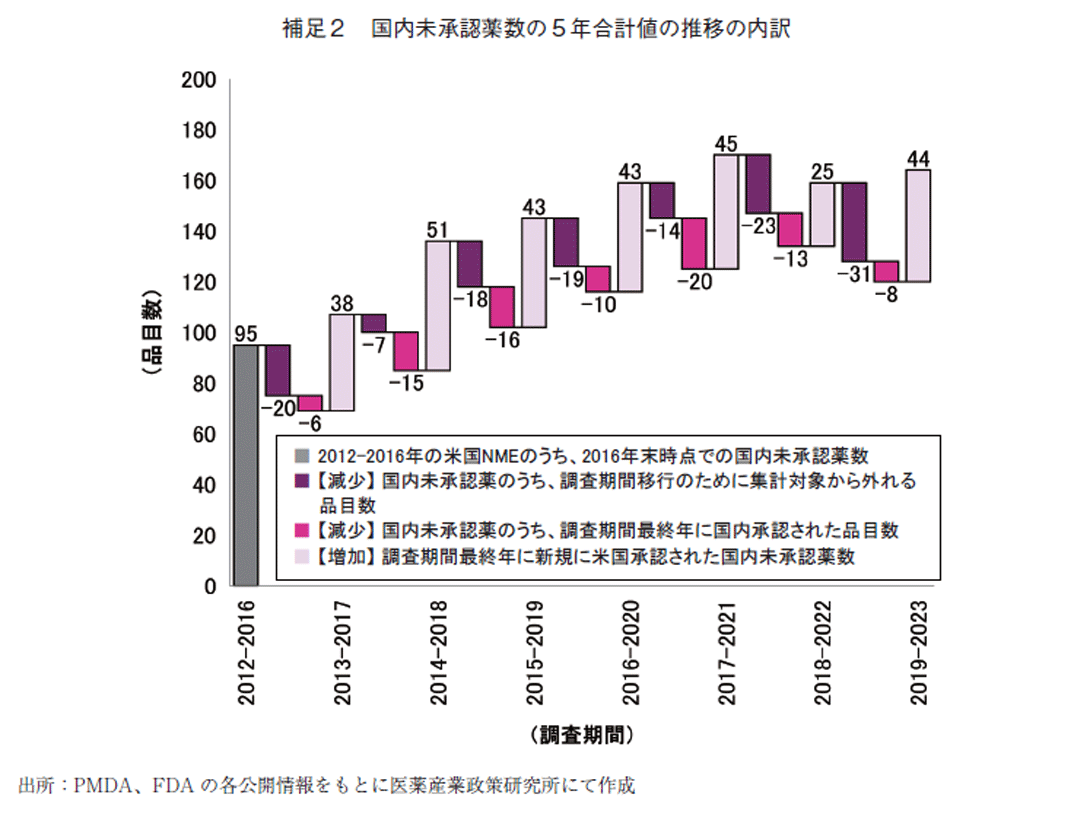
補足2 国内未承認薬数の5年合計値の推移の内訳
前述のとおり本稿では国内未承認薬数を5年合計値として集計している。年次推移として、前年との差異を生じる要因としては、増加分として新規の国内未承認薬があり(補足1の太線内数値に相当)、減少分としては米国承認が5年前であった未承認薬数が国内未承認の状態のまま集計から外れ、また前年に国内で承認を受けた数が集計から外れる。下図では、国内未承認薬数の5年合計値の前年との差異について2016年末時点の未承認薬数を起点として内訳を示した。いずれの要素も1年ごとでは増減があり、1年ごとの増減から年毎の傾向を把握することは困難であった。例えば、図1では2021年末調査時点以降で未承認の割合が高止まりしたことを示したが、2021年末時点は前年度の承認品目が20品目と比較的多く、2022年末調査時点は米国で承認されたNMEにおける国内未承認薬の追加分が少なかった、というように1年ごとの変化に与える影響の大きさは年毎で異なっていた。
-
1)医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュースNo.63(2021年7月)
-
2)医薬産業政策研究所「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」政策研ニュースNo.66(2022年7月)
-
3)医薬産業政策研究所「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」政策研ニュースNo.66(2022年7月)
-
4)医薬産業政策研究所「ドラッグ・ラグ:日本と欧州の未承認薬状況の比較」政策研ニュースNo.67(2022年11月)
-
5)医薬産業政策研究所「新薬の国際普及の計量分析:米国承認新薬の日欧承認に注目して」政策研ニュースNo.67(2022年11月)
-
6)医薬産業政策研究所「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その1 - 希少疾患-」政策研ニュースNo.69(2023年7月)
-
7)医薬産業政策研究所「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その2 - 抗がん剤-」政策研ニュースNo.69(2023年7月)
-
8)医薬産業政策研究所「ドラッグ・ラグ:日本承認品のラグ実態の分析」政策研ニュースNo.70(2023年11月)
-
9)医薬産業政策研究所「ドラッグ・ラグ:日本承認品の長期ラグの要因分析」政策研ニュースNo.71(2024年3月)
-
10)
-
11)
-
12)
-
13)
-
14)
-
15)医薬産業政策研究所「医薬品の研究開発の実態~アンケート調査に基づく研究開発期間、成功確率、研究開発費用~」リサーチペーパーNo.82(2024年3月)
-
16)Helen Dowden and Jamie Munro, Trends in clinical success rates and therapeutic focus, Nature reviews drug discovery, 18(7), 495-496, 2019
-
17)
-
18)
-
19)

