Points of View 臨床試験実施国に関する調査 ~創薬モダリティ間の比較~
医薬産業政策研究所 主任研究員 高橋洋介
要約
- いずれのモダリティでも、米国において最も多くの臨床試験が実施されていた。
- 近年は中国での臨床試験数が大きく増加し、特に中国国籍企業による抗体医薬や遺伝子細胞治療の伸びが顕著であり、それらの多くは抗がん剤として開発されていた。
- 日本地域では、細胞治療、遺伝子治療、遺伝子細胞治療における臨床試験数が、他モダリティに比して相対的に少なかった。これらモダリティの日本での医薬品開発を活性化する施策が期待される。
1. はじめに
政策研ニュースNo.65「実用化の進む遺伝子治療の現状と将来展望」において、遺伝子治療や遺伝子細胞治療の開発動向について俯瞰し、本邦における開発上の課題を整理するとともに、課題解決に向けた取り組みについて紹介した1)。また記事の中では「(課題解決を図らなければ)ドラッグ・ラグよりも深刻なドラッグ・ロスへと繋がりかねない」と言及し、国内で遺伝子治療の研究開発が活性化することへの期待感を示した。時を同じくして、近年日本の医薬品市場における「ドラッグ・ラグ」の再燃を危惧する声が高まっており2)3)、さらには「ドラッグ・ロス」が社会問題として取り上げられるようになり、厚生労働省の開催する「医薬品の迅速・安定供給実現に向けた総合対策に関する有識者検討会」において解決策が議論されたところである4)。本稿においては、国内における遺伝子治療や遺伝子細胞治療に特に着目して、「ドラッグ・ラグ」や「ドラッグ・ロス」の兆候について調査を試みる。将来の新薬を占う一つの先行指標として、臨床試験段階にある医薬品パイプラインが考えられる。政策研ニュースNo.68では、Phase 3段階にある開発品のオリジネーター企業に関して調査を行い、医薬品の研究開発の活発な企業国籍やその経年変化を考察すると同時に、国際的な開発ラグの動向についても分析した5)。ただし、日本市場における新薬動向を分析・考察する上では、開発企業国籍だけでなく臨床試験が実施されている地域も重要な指標となるだろう。そこで本稿では、臨床試験の実施国(臨床試験実施サイトの存在する国籍)について焦点をあて、創薬モダリティ間の差異や経年変化などの切り口から調査を行うこととした。
2. 調査方法
本稿の一連の調査研究においては、医薬品データベースであるEvaluate Pharma(2023年9月時点)に収載されている情報を用いた。Evaluate Pharmaにおける臨床試験情報は、ClinicalTrials.gov6)、EudraCT7)及びjRCT8)(旧JapicCTI)に掲載されている情報に基づいており、ここに収載されている全phaseの臨床試験を対象に分析を行った。医薬品候補となる被験物質のモダリティについては、Evaluate PharmaにおけるTechnologyの項目をもとに分類した。具体的には、低分子医薬:Small molecule chemistry、抗体医薬:Antibody(Monoclonal antibody及びRecombinant antibody)、組換えタンパク: Protein peptide therapeutics、核酸医薬:DNA RNA therapeutics、細胞治療:Cell Therapy、遺伝子治療:Gene Therapy、遺伝子細胞治療:Gene-modified Cell Therapyに分類した。各臨床試験の試験開始日をもとに3年(36か月)刻みで期間を区切った上で、モダリティ毎に臨床試験数(臨床試験開始数)の経年変化を分析した。なお、直近のデータは、試験開始日が2021年1月から2023年8月31日までの29か月間を対象としているため、それ以前の36か月の期間における臨床試験数と直接比較出来ない点に留意する必要がある。
各国における臨床試験数の分析では、一つの臨床試験が複数国にまたがって実施されている場合(国際共同試験など)には、それぞれの国に1試験として集計した。そのため各国の臨床試験数の合算値がグローバル全体での臨床試験数には一致しない点に留意する必要がある。また、臨床試験実施国別のスポンサー国籍の分析においては、1試験に対してスポンサーが複数存在する場合にはスポンサー数で按分して集計9)を行った。臨床試験のPhaseの調査では、多段階の相を一つの試験として実施する場合には、より後期段階の相の臨床試験とみなして集計した(Phase 1/2試験であれば、Phase 2とみなした)。
3. 結果
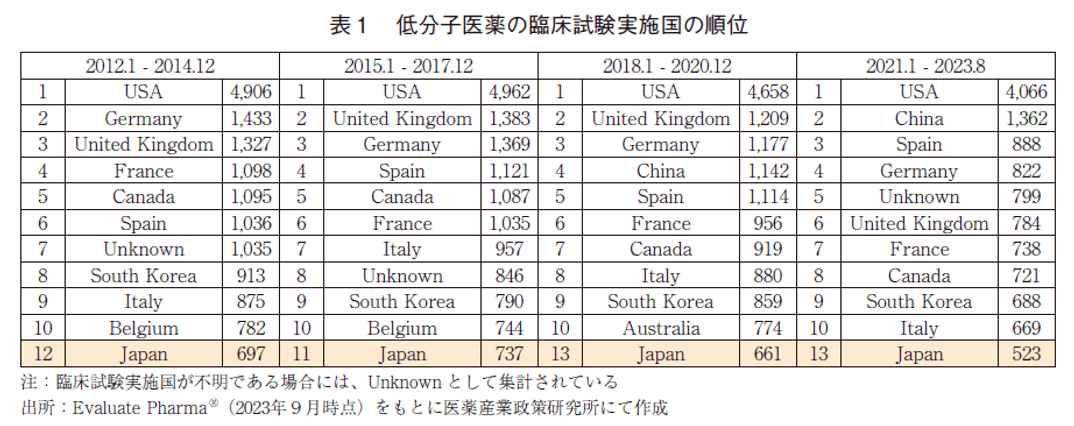
低分子医薬の臨床試験実施国の順位を表1に示した。低分子医薬の臨床試験実施国は、2012年以降常に米国が1位であり、各期間において4,000試験を超える規模が維持されていた。これは以降に示す全モダリティ区分の中で最も多い数値である。米国を除くと上位には欧州の国々が名を連ねており、順位の多少の変動はあるものの概ね同程度の臨床試験数であった。近年著しく順位を向上させているのが中国であり、2012~2014年と2015~2017年ではランク圏外であったが、2018~2020年では4位、2021~2023年では2位まで上昇していた。日本の順位は、各調査期間において12位→11位→13位→13位と推移しており、最も臨床試験数の多い米国と比較すると、調査期間を通して1/7~1/8程度を維持していた。
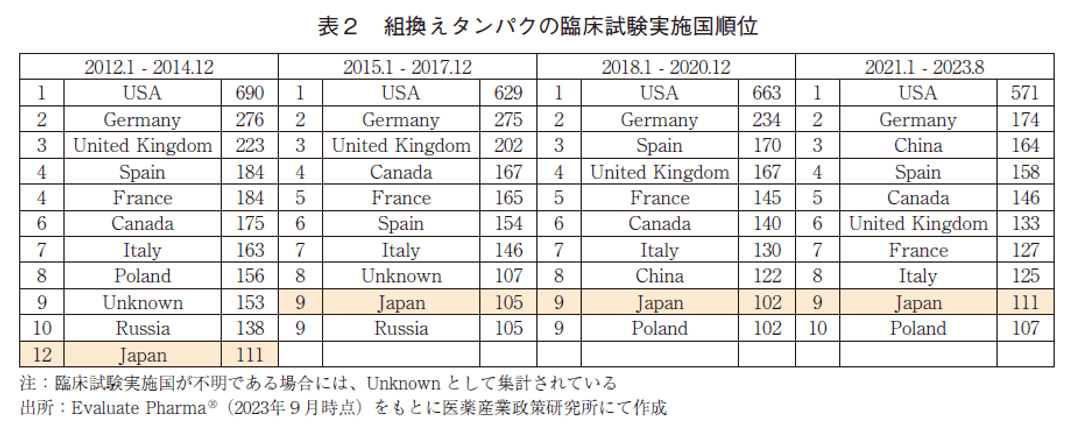
組換えタンパクの臨床試験実施国の順位を表2に示した。組換えタンパクの臨床試験実施国は、他モダリティと同様に2012年以降米国が常に1位であり、各期間において600試験を超える規模が維持されていた。米国を除くと上位には欧州の国々が名を連ね、順位の多少の変動はあるもののドイツが常時2位に位置していた。低分子医薬同様に、近年中国が著しく順位を向上させており、2012~2014年と2015~2017年ではランク圏外であったが、2018~2020年では8位、2021~2023年では3位まで上昇していた。日本の順位は、各調査期間において12位→9位→9位→9位と推移しており、臨床試験数は調査期間を通して米国の1/6程度を維持していた。
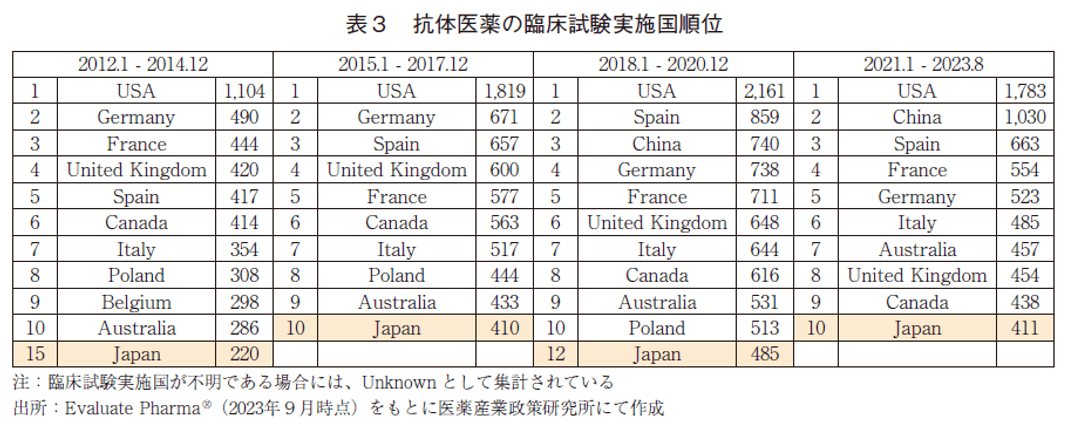
抗体医薬の臨床試験実施国の順位を表3に示した。抗体医薬の臨床試験実施国は、他モダリティと同様に2012年以降常に米国が1位であり、3年毎の各期間における試験数は右肩上がりに増加していた。米国を除くと上位に欧州の国々が名を連ねているのは低分子医薬等と同様の傾向であったが、欧州の中でもスペインが上位に位置していることが特徴的である。また他モダリティと同様に、中国は近年著しく順位を向上させており、2012~2014年と2015~2017年ではランク圏外であったが、2018~2020年では3位、2021~2023年では2位まで上昇していた。さらに、直近では米国の6割程度の規模まで臨床試験数が増加しており、このことは他モダリティと比べても特徴的であった。日本の順位は、各調査期間において15位→10位→12位→10位と推移しており、臨床試験数は調査期間を通して米国の1/4~1/5程度を維持していた。
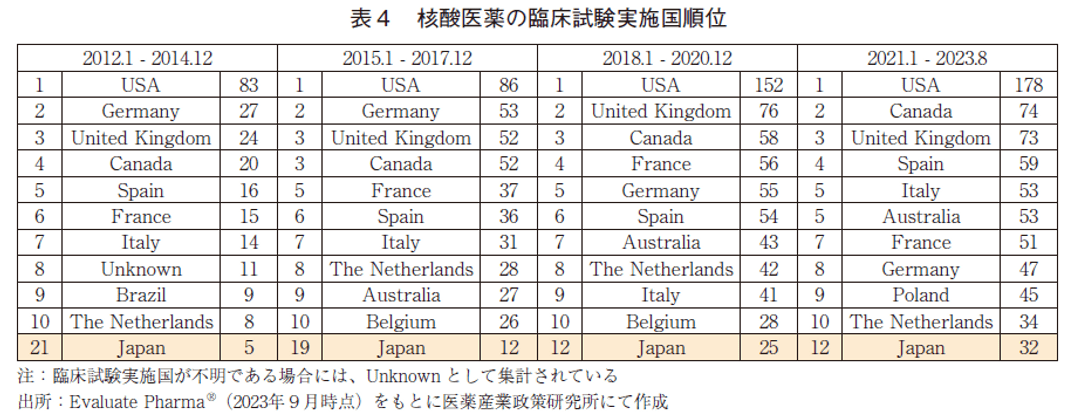
核酸医薬の臨床試験実施国の順位を表4に示した。核酸医薬の臨床試験実施国は、他モダリティと同様に2012年以降米国が常に1位であったが、直近における試験数でも178試験に留まっている。ただし、3年毎の各期間における試験数は右肩上がりに増加しており、注目度が急速に高まっているモダリティであると考えられる。米国を除くと上位には欧州の国々が名を連ねているのは他モダリティと同様の傾向であったが、カナダが上位に位置していることが特徴的である。また他モダリティとは様相が異なり、中国は10位以内にランクインしていなかった。日本の順位は、各調査期間において21位→19位→12位→12位と推移しており、近年の臨床試験数は米国の1/6程度であった。
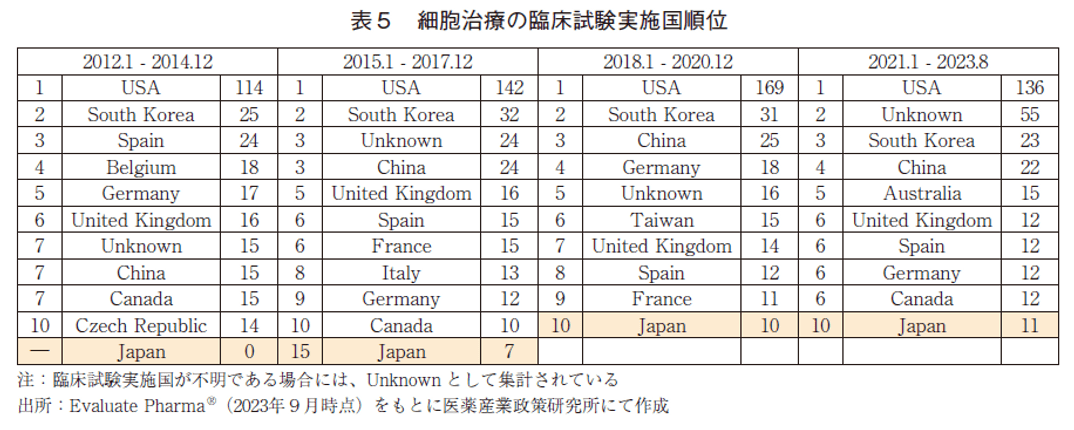
細胞治療の臨床試験実施国の順位を表5に示した。細胞治療の臨床試験実施国は、他モダリティと同様に2012年以降米国が常に1位であり、3年毎の各期間における試験数は右肩上がりに増加しているものの、核酸医薬に比べると伸びは緩やかであった。米国を除いた上位の様相は他モダリティと大きく異なっており、韓国が上位に位置していることが特徴的である。韓国は幹細胞関連技術に関する研究に重点的に取り組み特許出願数を大きく伸ばしているという報告10)とも合致する結果である。また中国は調査期間において7位→3位→3位→4位と推移しており、常に上位に位置していることも特徴的であった。日本の順位は、各調査期間において、実績なし→15位→10位→10位と推移しており、近年の臨床試験数は米国の1/10を下回る水準に留まっていた。
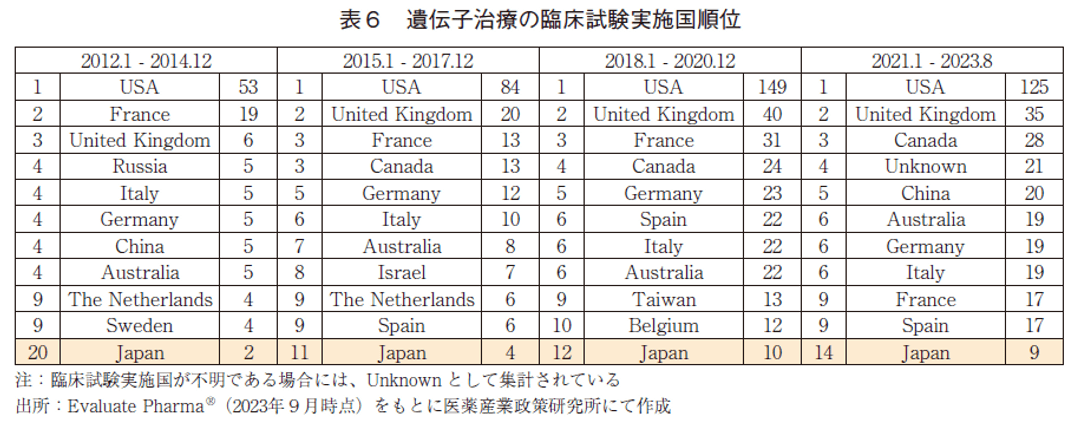
遺伝子治療の臨床試験実施国の順位を表6に示した。遺伝子治療の臨床試験実施国は、他モダリティと同様に2012年以降米国が常に1位であったが、直近における試験数では125試験に留まっていた。ただし、3年毎の各期間における試験数は右肩上がりに増加しており、注目度が急速に高まっているモダリティの一つであると考えられる。米国を除くと上位には欧州の国々が名を連ねており、なかでも英国が近年2位に位置している点が特徴的である。また中国は直近で5位まで順位を上げていた。日本の順位は、各調査期間において20位→11位→12位→14位と推移しており、近年の臨床試験数は9試験に留まり、米国の1/10を下回る水準であった。
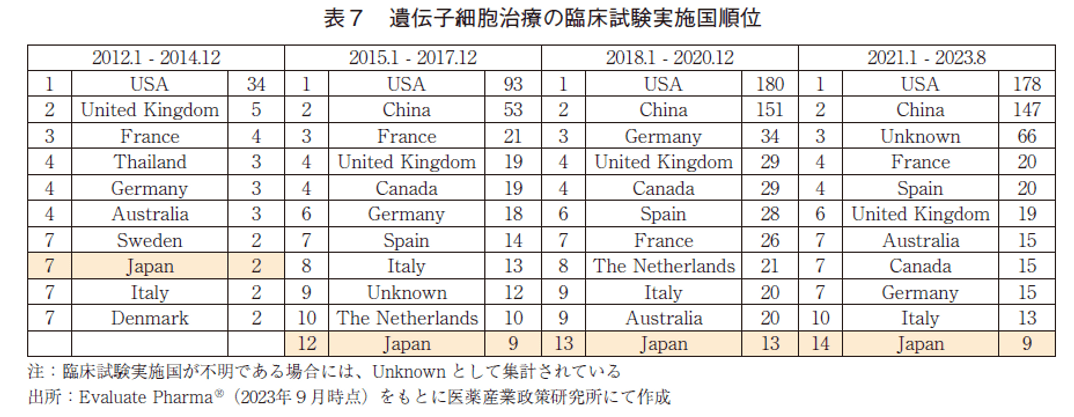
遺伝子細胞治療の臨床試験実施国の順位を表7に示した。遺伝子細胞治療の臨床試験実施国は、他モダリティと同様に2012年以降常に米国が1位であったが、直近における試験数でも178試験に留まっていた。ただし、3年毎の各期間における試験数は右肩上がりに増加しており、注目度が急速に高まっているモダリティの一つであると考えられる。2015年以降、中国は米国に次ぐ2位を維持しており、また試験数としても米国に迫る水準まで増加していた。日本の順位は、各調査期間において、7位→12位→13位→14位と推移しており、近年の臨床試験数は米国だけではなく中国の1/10をも下回る水準に留まっていた。
次に、遺伝子治療と遺伝子細胞治療に関して、直近の2021年以降の状況を詳細に分析した。各国における遺伝子治療の臨床試験数を図1(表6の2021.1-2023.8に対応)に、また各国の臨床試験に対するそのスポンサー国籍の割合を図2に示した。同様に、遺伝子細胞治療の臨床試験数を図3(表7の2021.1-2023.8に対応)に、そのスポンサー国籍の割合を図4に示した。遺伝子治療や遺伝子細胞治療においては、Phase 2試験結果を以って承認申請に進む可能性もありえることから、図1及び図3においては後期臨床試験の指標としてPhase 2とPhase 3試験の合算値も併せて示した。
遺伝子治療
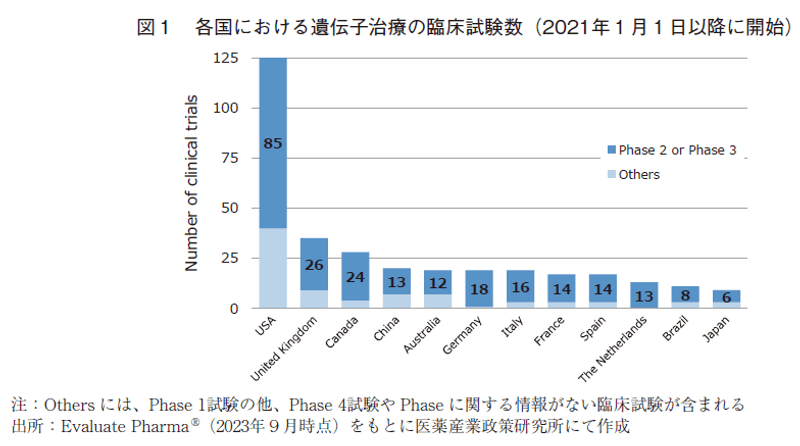
図1の通り、遺伝子治療の臨床試験はいずれの国においても過半数がPhase 2以降の後期臨床試験であった。特にオランダ、ドイツ、カナダ、イタリア、フランス、スペインでは、Phase 2以降の割合が高く8割を超えていた。
最も臨床試験数の多い米国(125試験)においては、そのうち約74%(92.7試験)は米国の企業や研究機関等がスポンサーとなって実施されたものであり、最大の割合を占めていた。次いで多いスポンサー国籍はスイス(約8%、10.5試験)、日本(約4%、4.5試験)と続いていた。
カナダやオーストラリアで実施されている臨床試験では、米国のスポンサーによって実施されている割合が高く、中国、ドイツ、フランスにおいては米国のスポンサーの割合が他国と比して相対的に低かった。米国のスポンサーが実施している臨床試験の実施地域は、米国、カナダ、英国、オーストラリアの順に多く、日本は3.5試験に留まっており、上位12か国の中でもっとも少ないという結果であった。
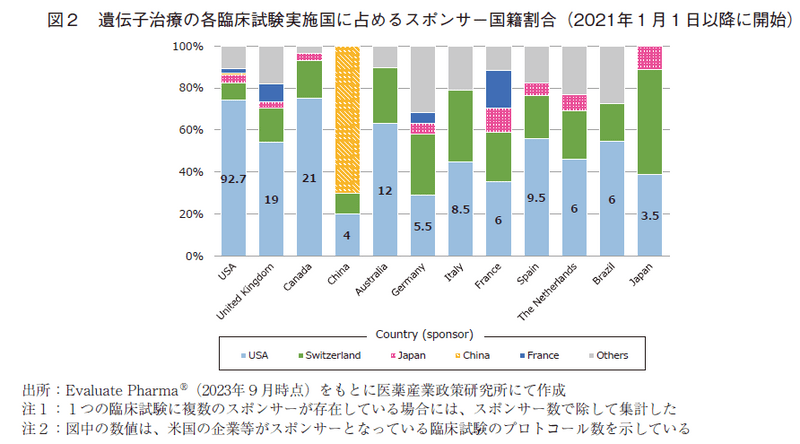
図2に示した通り、臨床試験数が多くかつ米国のスポンサーによる試験数が多い英国に焦点をあて、英国地域で実施している試験数の19を精査すると11)、そのうち17試験が米国のスポンサーによってのみ実施され、4試験は米国と他国のスポンサーの共同試験として実施されており、全21試験が存在していた(表8)。この21試験のうち、英国と米国の2国のみで実施されているものが3試験、米国と英国を含む3か国以上で実施されているが日本地域を含まないものが13試験存在する一方で、日本地域を含む臨床試験は2試験のみに留まっていた。この結果から、遺伝子治療においては、日本地域の組み入れをせずに国際共同治験が実施される傾向にあることが示唆された。
中国で実施されている臨床試験では、その大半が中国国籍のスポンサーによって実施されており(70%、14試験)、中国の企業や研究機関は自国で臨床試験を行うケースが多いと考えられた。
米国に次いで臨床試験数が多いのは、スイスの企業もしくは研究機関等によるものであり、試験数としては米国地域での実施数(10.5試験)が多く、各国地域に占める割合としては日本、ドイツ、イタリアで高いという結果であった。

遺伝子細胞治療
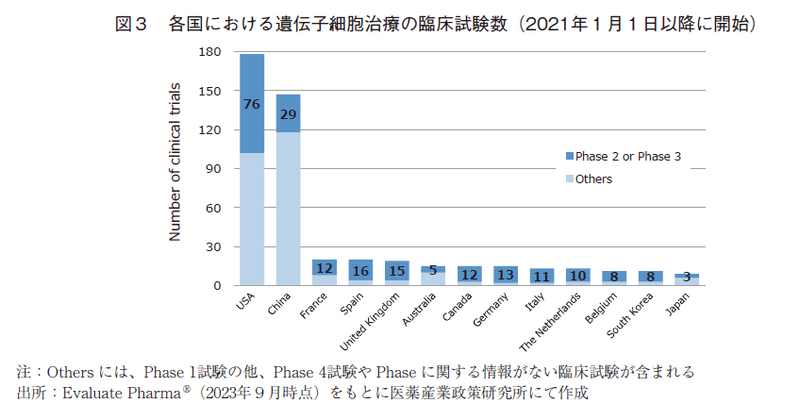
図3に示した通り、遺伝子細胞治療の臨床試験では、Phase 2以降の後期臨床試験の割合が高い国と低い国で2極化していた。中国(19.7%)、日本(33.3%)、オーストラリア(33.3%)、米国(42.7%)でPhase 2以降の割合が低く、半数を下回っていた。
最も臨床試験数の多い米国(178試験)においては、そのうち約82%(146.2試験)は米国の企業や研究機関等がスポンサーとなって実施されたものであり、最大の割合を占めていた。米国国籍以外のスポンサーの関与は限定的であったが、スイス、英国、日本、フランスのスポンサーによって実施されている臨床試験も一定程度存在していた。
中国は米国に迫るほどの数の臨床試験が実施されている地域であったが(図3)、その大半が中国国籍のスポンサーによって実施されており(約88%、129.5試験)、中国の企業や研究機関は自国で臨床試験を行うケースが多いと考えられた。
欧州の各国やカナダ、オーストラリアの地域で実施されている臨床試験では、米国のスポンサーによって実施されている割合が高く(5~7割程度)、次いでスイスや英国のスポンサーの関与が確認できた。日本地域で実施されている臨床試験では、米国のスポンサーによって実施されている割合は約39%に留まり、日本のスポンサーによって実施されている試験は約33%の割合で存在していた。自国のスポンサーの割合が高いという傾向は、韓国でも同様であった。
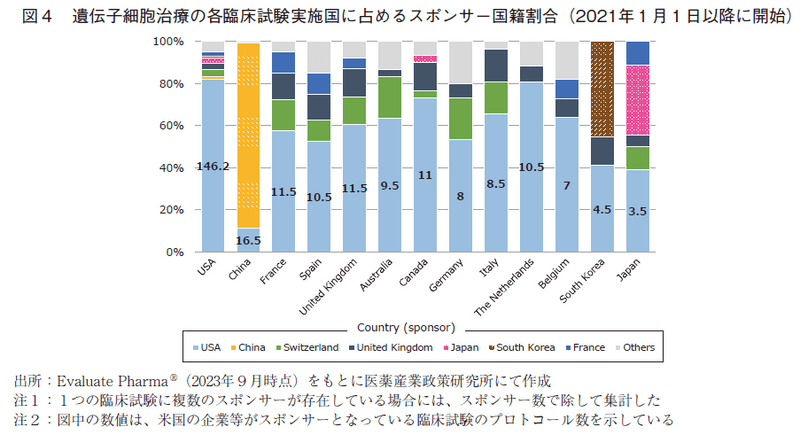
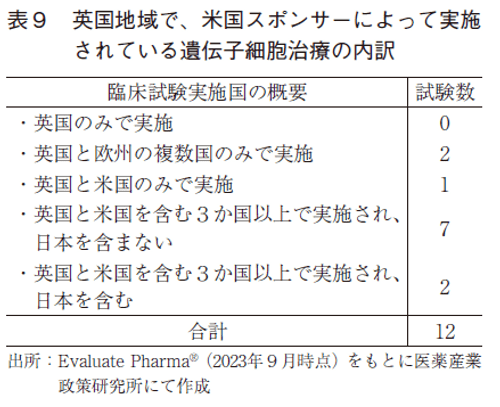
米国のスポンサーが実施している臨床試験の実施地域は、米国、中国、英国、フランスの順に多く、日本は3.5試験に留まっており、13か国の中でもっとも少ないという結果であった(図4)。また、遺伝子治療と同様に英国に焦点をあて、米国のスポンサーが英国地域で実施している試験を精査すると11)、11.5試験のうち11試験が米国のスポンサーのよってのみ実施され、1試験は米国と他国のスポンサーの共同試験として実施されており、全12試験が存在していた(表9)。この12試験のうち、英国地域でのみ実施されているものは存在せず、英国と欧州複数国で実施されており米国を含まないものが2試験、英国と米国の2国のみで実施されているものが1試験、米国と英国を含む3か国以上で実施されており日本地域を含まないものが7試験、米国と英国を含む3か国以上で実施されており日本地域を含むものが2試験という結果であった。この結果から、遺伝子細胞治療においても、日本地域の組み入れをせずに国際共同治験が実施される傾向にあることが示唆された。
4. まとめ・考察
本稿では、医薬品のモダリティ毎に、各国で実施されている臨床試験数をカウントし、国別の試験数の比較や試験数の経年変化などに関して分析を行った。その結果、いずれのモダリティにおいても米国での臨床試験数が常時最大であった。その理由として、米国には多くの製薬企業や研究機関が存在し自国内で研究開発を推進していることも挙げられるが、他国に存在する製薬企業などであっても市場規模が最大である米国市場での上市を目指して米国での臨床試験を行っているということもあるだろう。米国に次ぐ2番手以降の臨床試験実施国に目を向けると、概ね欧州各国やカナダなどが上位に名を連ねているが、多くのモダリティにおいて中国が近年急速に順位を上げていることが特徴的である。特に抗体医薬及び遺伝子細胞治療においては、直近で米国に次ぐ2番手まで順位を上げている。過去の政策研ニュースにおいて報告しているように、近年中国企業による医薬品開発が活発になってきており、特に抗がん剤の開発事例が増加している5)12)。抗体医薬では免疫チェックポイント阻害剤など、遺伝子細胞治療ではCAR-T細胞などが、抗がん剤として応用される事例が多く存在することから、今回の調査結果において中国地域での抗体医薬及び遺伝子細胞治療の臨床試験数が増えているという事実とも整合していると考えられた。Evaluate PharmaのIndicationの分類を参考に調査すると、中国で実施されている臨床試験のうち、抗体医薬では約7割、遺伝子細胞治療は約9割が実際に抗がん剤として開発されているものであった。
次に、日本で実施されている臨床試験の状況に目を向ける。最も実施例の多い低分子医薬では常時10位付近を維持していた。政策研ニュースNo.66の報告では、全医薬品を対象とした臨床試験数で日本は14位に位置しており12)、今回の調査結果である低分子医薬の順位とも概ね近い結果である。この順位の高低やその是非について本稿で深く掘り下げて論じることは控えるが、日本は医薬品マーケットサイズが大きい国である一方で、欧米での承認を目指す場合には日本地域が臨床試験実施国として選択されないことや(一般的には、承認を目指す国と類似の人種構成の国が、臨床試験実施国として選択される)、日本の臨床試験コスト(症例単価)がグローバル平均より高く13)、かつ他国に比べて症例集積スピードが遅い14)という状況など、これら複合的な要因によって臨床試験実施国のランクでは10位前後に落ち着いていると考えられる。しかしながら、低分子医薬での日本で実施された臨床試験数は米国の1/7~1/8程度の規模で常時一貫していることから、これを基準と想定した上で他モダリティの状況を考察することとする。本調査で設定した4つの期間において、組換えタンパクでは米国の1/6程度を維持、抗体医薬では米国の1/4~1/5程度を維持、核酸医薬では当初は米国の1/10にも満たなかったものが近年1/6程度まで上昇という状況にあり、これらモダリティでは低分子医薬と同程度の水準で臨床試験が行われていると考えられた。一方、細胞治療、遺伝子治療、遺伝子細胞治療では、近年臨床試験数が上昇しているものの未だ米国の1/10を下回る水準であり、これら3つのモダリティでは日本における臨床試験の実施例が相対的に少なく、やや低迷していると考えられる。
本稿では遺伝子治療、遺伝子細胞治療に特に着目して、各国で実施されている臨床試験の相やスポンサー国籍について詳細に調査を行った。
遺伝子治療の臨床試験の相を分析した結果、多くの国でPhase 2以降の後期段階の臨床試験の割合が高かった。この全体的な傾向は、鍵井による報告15)とも整合している。その中でも、オランダ、ドイツ、カナダのような後期臨床試験の割合が高い国が存在しており、今回の調査ではその要因まで明らかにすることは出来ていないが、他国で実施されたPhase 1試験結果を受けて次相の臨床試験を実施しやすい状況にあることが推察される。
遺伝子細胞治療の臨床試験の相を分析した結果、各国におけるPhase 2以降の臨床試験の割合は2極化していた。臨床試験数自体の多い米国と中国では、Phase 2以降の臨床試験の割合は相対的に低かった。図4の結果も勘案して考察すると、これらの国で見出されたシーズについて、自国内での早期段階の臨床試験によって評価されている事例が多いのではないかと考えられる。米国や中国と同様に、日本もPhase 2以降の臨床試験の割合が低い国であるが(33.3%)、自国のスポンサーによって実施されている早期段階の試験が3試験存在するなど、日本初のシーズの実用化例が増える未来に期待を抱かせる結果であった。
遺伝子治療による臨床試験数が最も多い米国地域では、そのうち約74%が米国のスポンサーによって実施されており、最大の割合を占めていた。さらに、米国は遺伝子細胞治療による臨床試験も最も多く実施されている地域であり、そのうち約82%は米国のスポンサーによって実施されており、遺伝子治療と同様に最大の割合を占めていた。図2や図4の結果から、遺伝子治療や遺伝子細胞治療に関わる創薬シーズはその多くが米国から生み出され、米国のスポンサーは自国内での開発を最優先していると推察できる。そして自国に次いで臨床試験を実施している地域は欧州各国であり、日本地域での臨床試験の実施は限定的であった。今回の調査結果では、日本地域における米国スポンサーが関与する臨床試験は遺伝子治療と遺伝子細胞治療ともに3.5試験に留まっており、これは調査対象とした国々の中で最小である。米国スポンサーにとっては日本の臨床試験環境にはまだまだ課題があると映っており、日本での臨床試験を敬遠してきた可能性がある。遺伝子治療や遺伝子細胞治療からは、近年画期的な新薬が次々と誕生している16)。日本の患者さんが最新の遺伝子治療や遺伝子細胞治療に遅滞なくアクセス出来る医療環境を整えるためには、本邦における臨床試験の実施を一層活性化させていく必要があるだろう。
5. おわりに
政策研ニュースNo.65では、日本における遺伝子治療(遺伝子細胞治療)の課題として、(1)基礎研究の充実(研究費の支援、研究者の増加、人材育成など)、(2)規制の整備や緩和(レギュラトリーサイエンス研究、カルタヘナ法対応など)、(3)Transrational Researchの理解や、遺伝子治療の研究開発の経験値の向上、(4)製造施設や試験施設の拡充(CMO、CDMO、CROなど)、(5)特許戦略(競争力のある特許の確保)、(6)啓発活動(医療関係者、患者、国民などの理解を高める)の6点をピックアップした1)。これらの課題を一つ一つ解決することは、日本初の医薬品シーズの拡充だけでなく、国内外の医薬品シーズを遅滞なく日本で医療応用することを後押し、近年問題視されているドラッグ・ラグやドラッグ・ロスの解決の一助ともなるだろう。政策研ニュースNo.65ではこれらの課題が着実に解決されつつある近況も紹介しているが1)、今回の調査結果の限りでは課題解決はまだ道半ばと言えるかもしれない。このほど開催された第29回日本遺伝子細胞治療学会学術集会17)においては、規制をテーマとしたシンポジウムが開催され、独立行政法人医薬品医療機器総合機構(PMDA)の方々から、国内での遺伝子治療・遺伝子細胞治療の開発上の課題解決に向けた当局の取り組みが紹介されるとともに、PMDAスタッフによる個別相談会が設けられていた18)。アカデミアやベンチャー企業、製薬企業などの関係者が学会参加するタイミングにあわせて「本邦での再生医療等製品(遺伝子治療用製品を含む)の開発を検討されている方や将来的にPMDAへの相談を検討されている方などを対象として、PMDAが提供している相談事業の内容や手続きのご紹介のほか、開発製品に関する効率的な相談の実施に向けて、相談内容(範囲)や論点の整理について、一般的な範囲で意見交換させていただく」という主旨で開催された個別相談会であった。この個別相談会に代表されるような、国内外のアカデミアやベンチャー企業、製薬企業をターゲットとした諸政策が結実し、将来的に日本での遺伝子治療・遺伝子細胞治療の開発が活性化することを期待したい。
-
1)医薬産業政策研究所、「実用化の進む遺伝子治療の現状と将来展望」、政策研ニュース No.65(2022年3月)
-
2)医薬産業政策研究所、「ドラッグ・ラグ:国内未承認薬の状況とその特徴」、政策研ニュース No.63(2021年7月)
-
3)医薬産業政策研究所、「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」、政策研ニュース No.66(2022年7月)
-
4)
-
5)医薬産業政策研究所、「Phase 3段階にある開発品のグローバル動向と開発ラグの分析」、政策研ニュース No.68(2023年3月)
-
6)
-
7)
-
8)
-
9)例えば、1つの臨床試験が日本企業1社と米国企業1社がスポンサーとなって実施されている場合には、日本と米国をそれぞれ0.5として集計した。日本企業1社と米国企業2社がスポンサーとなって実施されている場合には、日本を0.33、米国を0.67として集計した。
-
10)
-
11)2国のスポンサーによって共同で実施されている場合にはそれぞれを0.5とカウントして集計しているため、この試験数は実際の臨床試験数には一致しない場合がある
-
12)医薬産業政策研究所、「近年における国際共同治験の動向調査」、政策研ニュース No.66(2022年7月)
-
13)
-
14)
-
15)医薬産業政策研究所、「次世代創薬基盤技術の導入と構築に関する研究」、リサーチペーパー・シリーズ No.77(2021年6月)
-
16)医薬産業政策研究所、「日米欧の新薬承認状況と審査期間の比較」、政策研ニュース No.70(2023年11月)
-
17)
-
18)

