目で見る製薬産業 日米欧の新薬承認状況と審査期間の比較
医薬産業政策研究所 主任研究員 吉浦知絵
医薬産業政策研究所 主任研究員 東 宏
要約
2022年に日米欧で承認された新医薬品の承認品目数および審査期間について、各極の薬事上特別措置の影響を踏まえ調査した。2022年の国内の全承認品目数は174品目、NME数が52品目と最多であった。審査期間の中央値は全承認品目で9.4か月、NMEで10.8か月であり例年並みであったが、欧米と比較した審査期間の中央値は日本が最小となった。また、再生医療等製品の承認数は日米欧いずれにおいても近年増加しており、グローバル製品数も増加していた。
1. はじめに
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報及び審査期間に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)及びEuropean Medicines Agency(EMA)がそれぞれホームページ等で公表している情報をもとに継続的に収集、分析している1)。政策研ニュース第67号2)では2021年の承認実績を中心に日米欧の新薬承認状況と審査期間の比較を、政策研ニュース第68号3)では2022年に日本で承認された医薬品情報に関する分析結果を報告した。今回のニュースでは、2022年に日本、米国、および欧州で承認された新薬の承認品目数、審査期間等に関して報告する。
2. 調査方法
PMDA、FDA及びEMAのそれぞれのホームページに公表されている情報をもとに、標準的な統計解析ソフトStata/IC 14.2 for Windows(Stata Corp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
日本は政策研ニュース第68号と同様、対象はPMDAホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。New Molecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。
米国は、FDA Center for Drug Evaluation and Research(CDER)が承認した「CDER Drug and Biologic Approvals for Calendar Year」5)に掲載されているNew Drug Application(NDA)及びBiologic License Application(BLA)に該当する医薬品を対象とした。NMEの集計は、「CDER New Molecular Entity(NME)and Original Biologic Approvals Calendar Year」に掲載されている医薬品を対象とした。
欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」6)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。
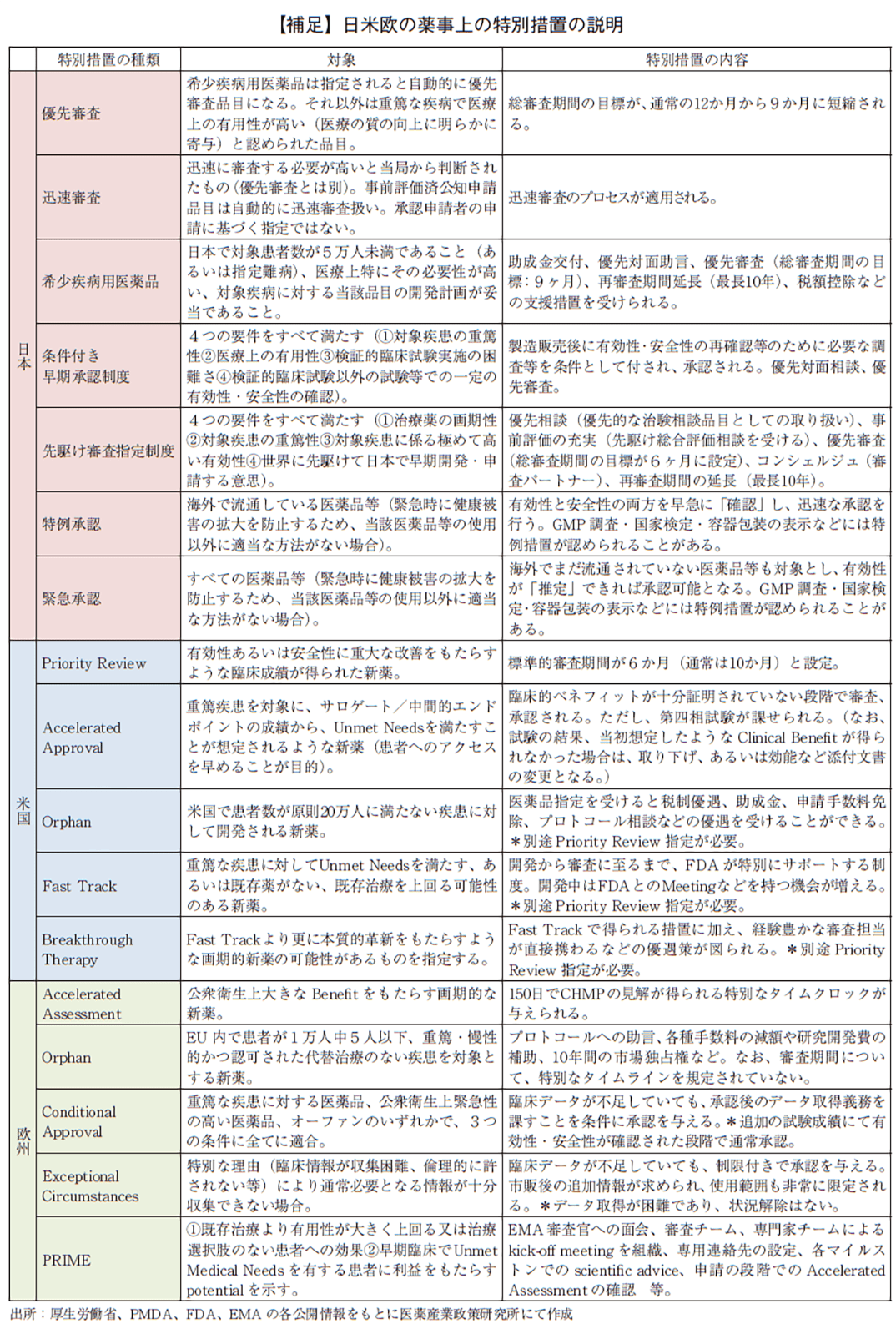
また、薬事上の特別措置として、日本では優先審査、迅速審査、希少疾病用医薬品、先駆け審査指定制度7)、条件付き早期承認制度を、米国ではPriority Review、Accelerated Approval、Orphan、Fast Track、Breakthrough Therapyを、欧州ではAccelerated Assessment、Orphan、Conditional Approval、Exceptional Circumstances、Priority Medicine(PRIME)を対象に集計した。各薬事上の特別措置の内容は補足にまとめた。
3. 結果
(1)新医薬品の承認品目数の日米欧比較
過去8年間(2015~2022年)の日本、米国、及び欧州で承認された新医薬品の承認品目数を図1に示した。日本において2022年に174品目が承認され、そのうちNMEは52品目であった。これは共に過去8年間で最多の承認数であった。米国では2022年に112品目が承認され、そのうちNMEは37品目であった。欧州では2022年に164品目が承認され、そのうちNMEは56品目であった。医薬産業政策研究所での集計開始以来、欧州の承認品目数は2021年に次ぎ2番目に多く、NMEも過去最多であった。
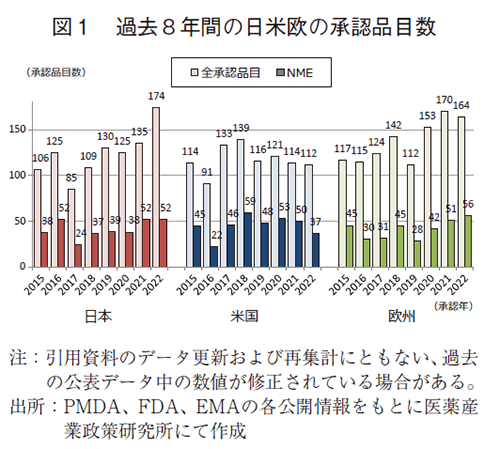
(2)薬事上の特別措置を受けた承認品目数(NME)
日米欧で過去5年間(2018~2022年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数とその割合について調査した(図2)。
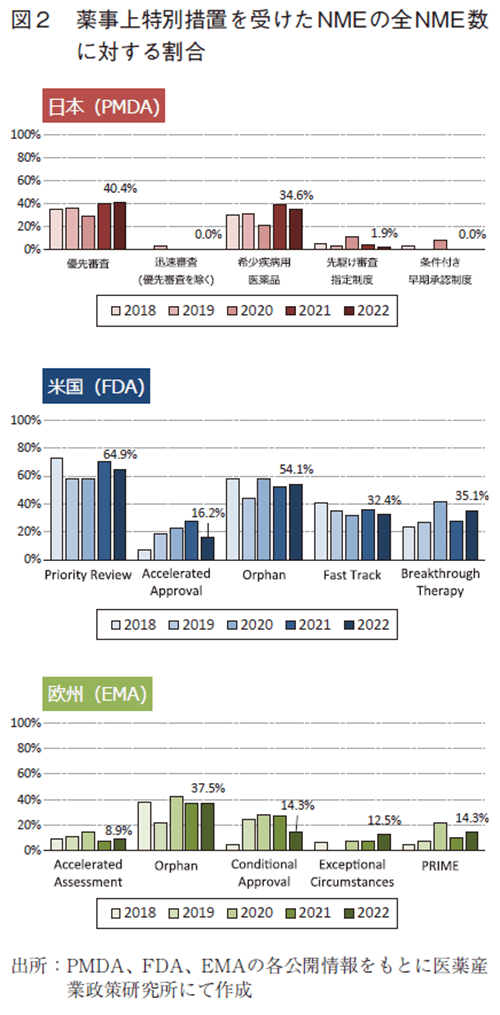
政策研ニュース第68号でも述べたとおり、2022年に日本で承認されたNME52品目中、優先審査(希少疾病用医薬品、先駆け審査指定制度を含む)は21品目(40.4%)、迅速審査(優先審査を除く)は0品目、希少疾病用医薬品(先駆け審査指定制度を含む)は18品目(34.6%)、先駆け審査指定制度の指定品目は1品目(1.9%)、条件付き早期承認制度の適用対象品目は0品目であった。優先審査、希少疾病用医薬品のNME数の割合は昨年同様であり過去最高水準であった。このほか、COVID-19への対応として特例承認に係る品目が7品目(うちNME2品目)、緊急承認に係る品目が1品目であった。
米国では、2022年に承認されたNME37品目中、Accelerated approvalを受けた品目が6品目(16.2%)であり、2011年以降で最多であった昨年14品目と比較して減少した。Priority reviewは24品目(64.9%)、Orphan指定品目は20品目(54.1%)、Fast Track指定品目は12品目(32.4%)、Breakthrough Therapy指定品目は13品目(35.1%)であり、昨年と同水準であった。
欧州については、2022年に承認されたNME56品目中、Accelerated Assessmentは5品目(8.9%)、Orphan指定品目は21品目(37.5%)、Conditional approvalを受けた品目は8品目(14.3%)、Exceptional Circumstancesは7品目(12.5%)、PRIME指定品目は8品目(14.3%)であった。昨年はConditional approvalが2014年以降最多品目数であったが2022年は減少した一方、Exceptional Circumstancesは2014年以降最多であり、PRIME指定品目は2020年の9品目に次いで多い承認数であった。
(3)新医薬品の審査期間の日米欧比較
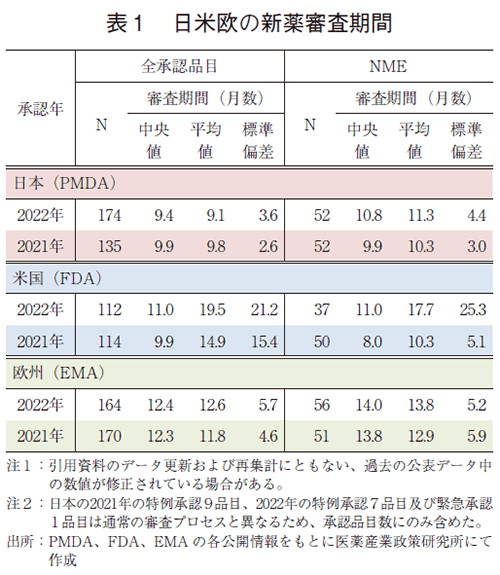
日米欧で2022年に承認された新医薬品の審査期間(月数)を昨年と比較した結果を表1に示した。2022年承認品目のそれぞれの審査期間(中央値)は日本9.4か月、米国11.0か月、欧州12.4か月であり、日本の審査期間(中央値)が最小となった。NMEに関しては、2022年承認品目の各審査期間(中央値)は、日本10.8か月、米国11.0か月、欧州14.0か月であり、日米の審査期間(中央値)は同程度であった。
(4)薬事上の特別措置を受けた品目の審査期間
2022年承認品目のうち、審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆け審査指定制度、米国:Priority review、Breakthrough Therapy、欧州:Accelerated Assessment、PRIME)を受けた品目について表2に示した。特に先駆け審査指定制度、Breakthrough Therapy、PRIMEは画期性の高い新薬を対象とし、審査当局から事前介入を優先的に得られ、さらなる審査期間短縮を目指す制度である。(補足)
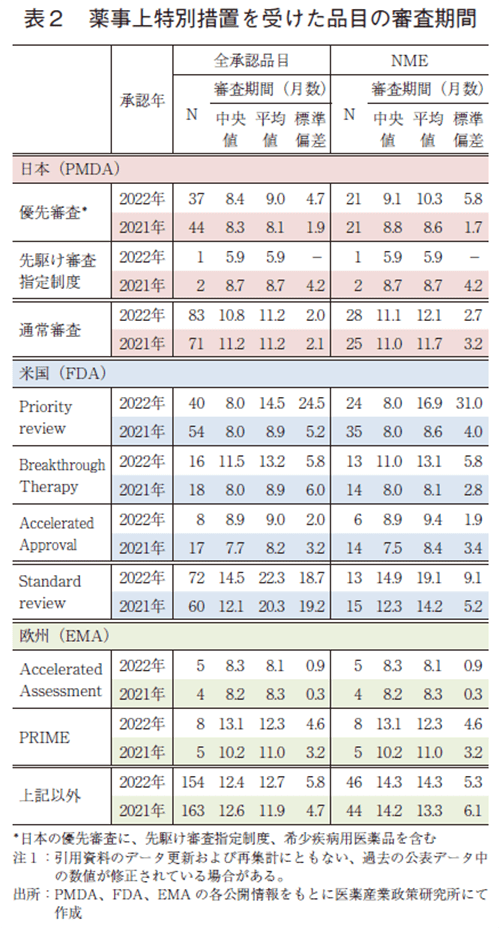
日本での2022年の優先審査品目承認数は、全承認品目(37品目)、NME(21品目)であり、審査期間(中央値)はそれぞれ8.4か月、9.1か月であった。PMDAの設定する目標8)のとおり、37品目中31品目が9か月以内に承認されていた。また、先駆け審査指定制度の指定品目としてNMEの1品目が承認されており、審査期間はPMDAが目標とする6か月を達成した。政策研ニュース第68号で述べたとおり、2022年は公知申請品目の承認が多く通常審査品目承認数は2021年と比べて増加したが、通常審査の審査期間(中央値)は2021年と同程度であった。
米国の2022年のPriority review指定品目の承認数については、全承認品目(40品目)でNME(24品目)とともに2021年より少なかった。審査期間(中央値)はそれぞれ8.0か月、8.0か月と2021年と同じであった。また、審査期間の平均値はそれぞれ14.5か月、16.9か月と2021年と比べて増加し、審査期間のばらつき(標準偏差)も大きかった。FDAは目標値9)としてPriority reviewでは90%の品目でレビュー開始からから6か月以内に完了すべく定めているが、本稿で定義した審査期間は初回の申請日から承認日までとしており、FDAのレビュー期間に加え申請者がデータ再提出等に要した期間も含む総期間を示している。また、審査資料の段階的提出等は考慮していない。Priority review指定品目のうち20品目はレビュー開始以降に申請者がデータ再提出を行っており、本稿で定義した審査期間(申請から承認までに要した期間)としては長くなっていた。Breakthrough Therapy指定品目については、16品目(うちNME13品目)が承認されており、審査期間(中央値)はそれぞれ11.5か月、11.0か月であった。昨年同様に日本の先駆け審査指定品目と比較すると指定品目数が多かった。
欧州では、Accelerated Assessment指定品目が全承認品目で5品目(全てNME)であり、日本や米国と比較して優先的に審査を受けた品目の割合は少ないが、2022年のAccelerated Assessment指定品目の審査期間(中央値)は8.3か月と、指定を受けていない品目と比較して4か月以上短かった。
(5)審査期間の中央値の年次推移(日米欧)
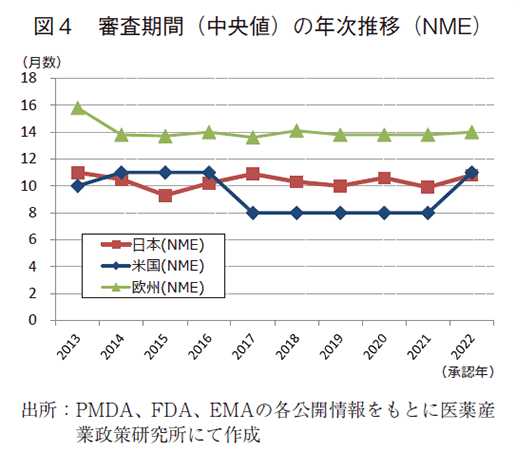
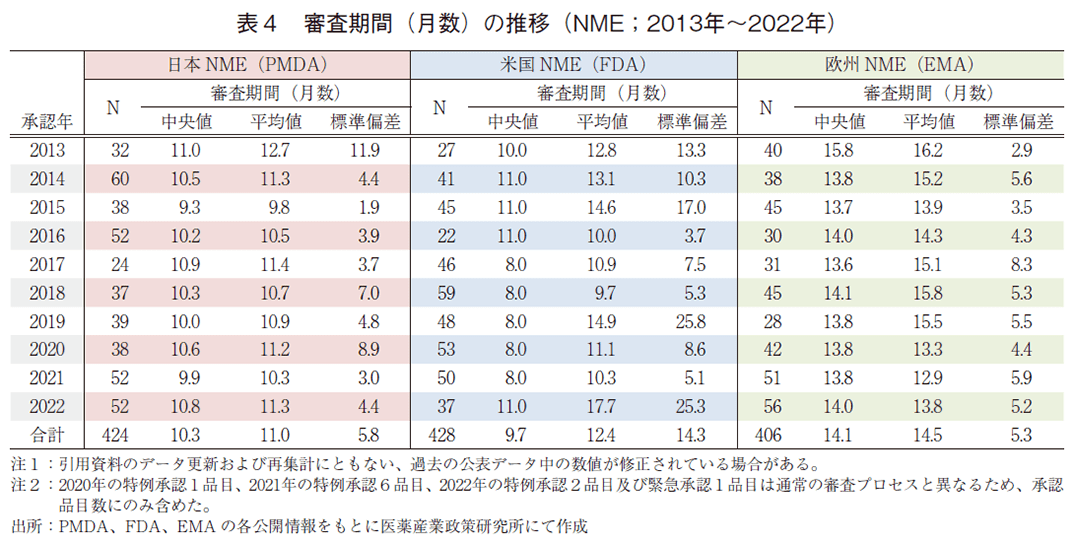
日本、米国、及び欧州で承認された医薬品の承認年毎(2000~2022年)の審査期間(月数)を表3に、審査期間の中央値の年次推移を図3に示した。また、NMEについては日本の審査期間が大幅に短縮した後の2013年から2022年の期間を調査対象とし、承認年毎の審査期間(月数)を表4に、審査期間の中央値の年次推移を図4に示した。
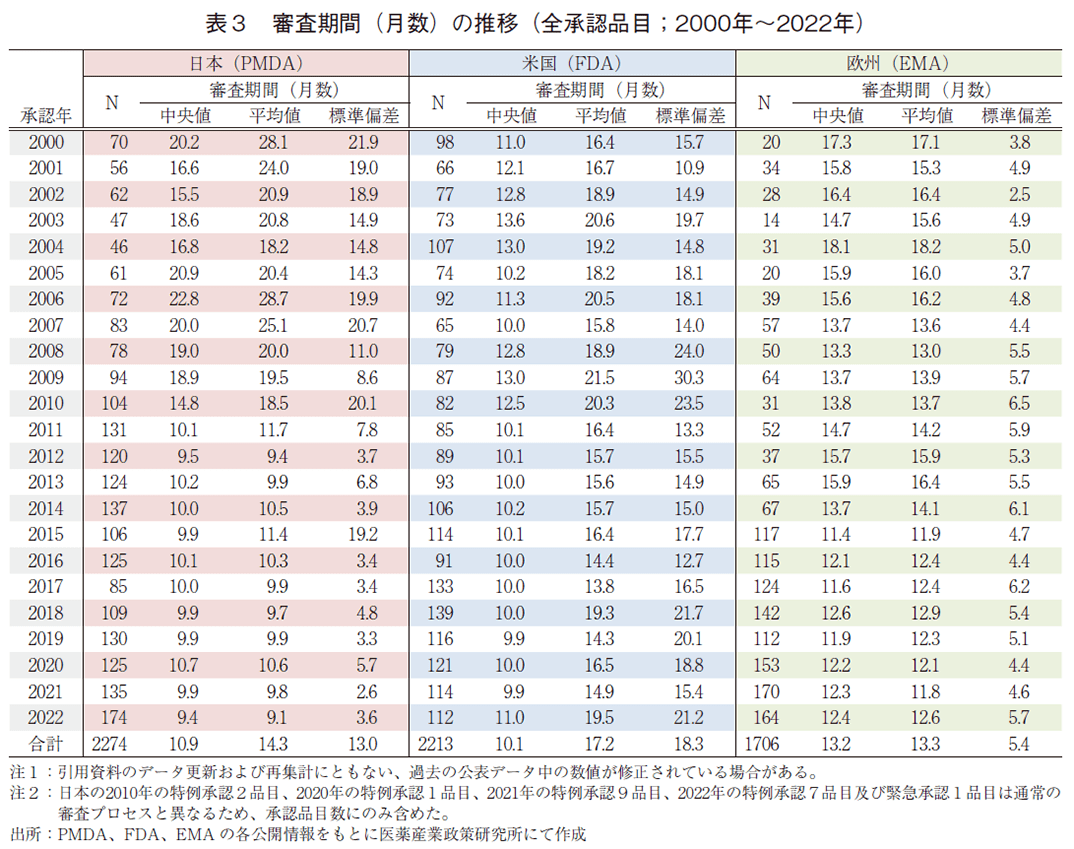
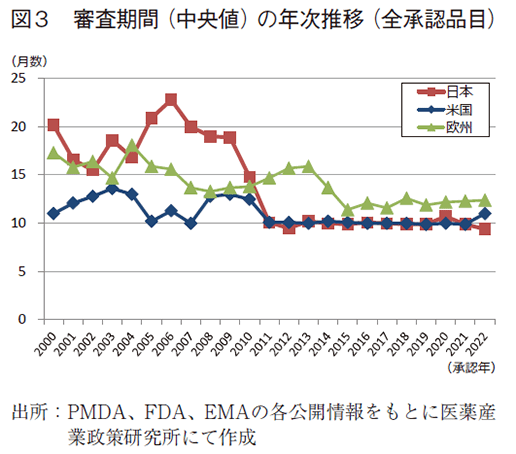
調査対象の全期間における審査期間の中央値は、日本10.9か月、米国10.1か月、欧州13.2か月であった(表3)。2022年は日本9.4か月、米国11.0か月、欧州12.4か月と昨年同様の審査期間を維持しており、中央値としては日本が最小となった。年次推移でみると、2011年に日本で大幅な審査期間の短縮が行われて以来、米国と比肩する審査期間(中央値)で概ね10か月程度、欧州も2015年からは審査期間を短縮(約12か月)している。
一方、NMEについて調査対象の全期間における審査期間(中央値)は、日本10.3か月、米国9.7か月、欧州14.1か月であった(表4)。2022年の審査期間(中央値)は、日本10.8か月、米国11.0か月、欧州14.0か月であり、米国で審査期間(中央値)が2021年と比べ3か月増加したものの、日欧では昨年と同程度の審査期間であった(図4)。
(6)バイオ医薬品の審査期間の日米欧比較
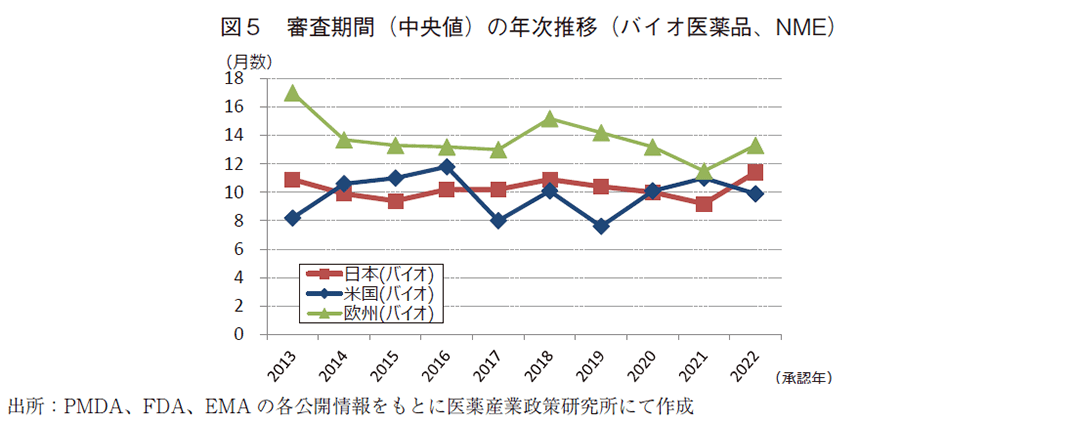
近年、低分子医薬品と比較しバイオ医薬品の存在感が増しており、前報の医薬品市場の上位100品目の世界売上高の割合において半数以上を占めていることが報告されている10)。政策研ニュース第67号では、バイオ医薬品の高い指向能力から高い有効性や画期性が期待され、結果として薬事上特別措置を受けやすく審査期間が短縮する傾向があるのではないかと仮説を立てバイオ医薬品に係る承認期間および特例措置の面から各地域の比較を試みており、今回のニュースにおいても同様に分析を実施した。
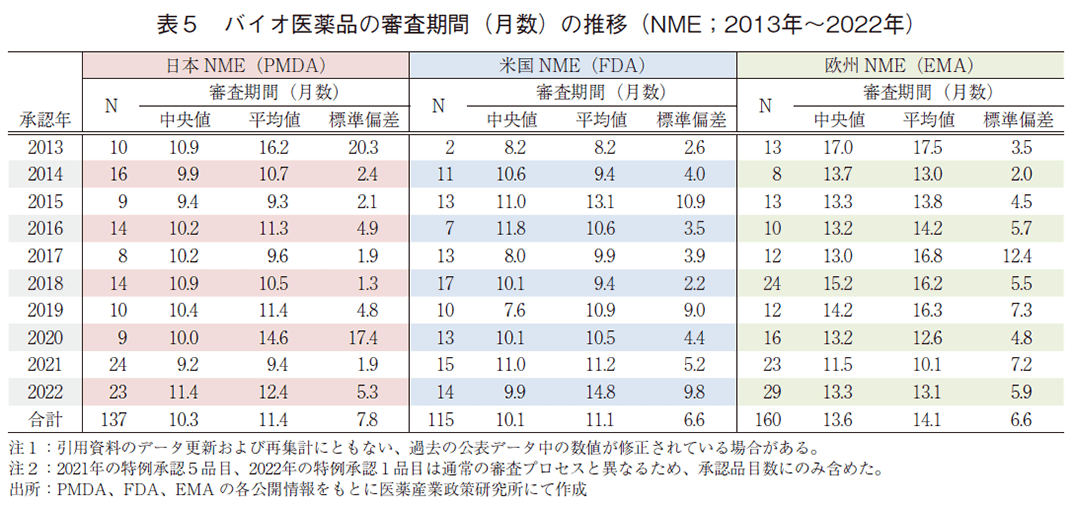
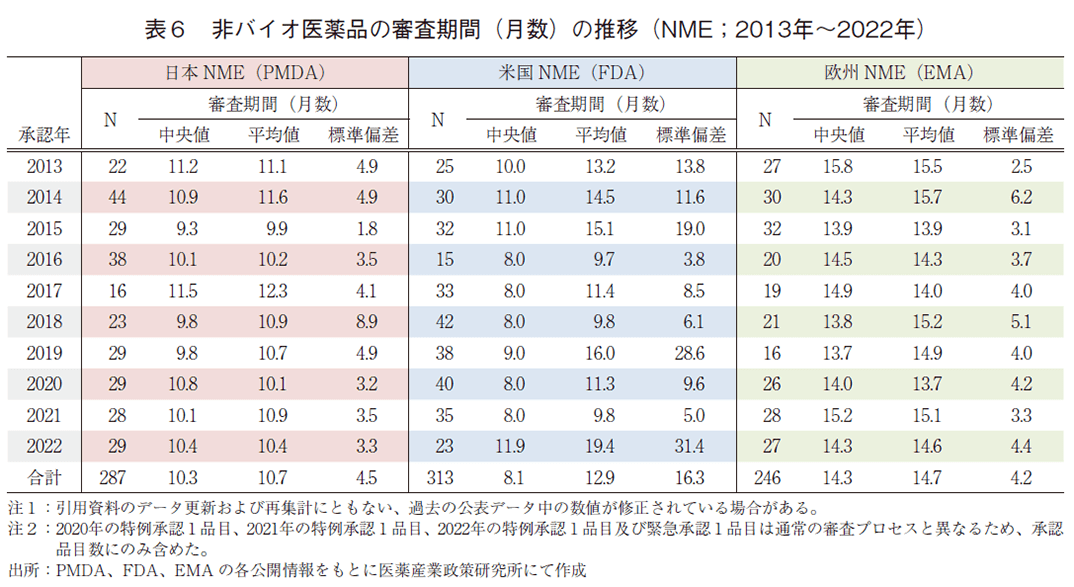
日本、米国、及び欧州で承認されたバイオ医薬品のNMEにおける承認年毎(2013~2022年)の審査期間(月数)を表5に、審査期間の中央値の年次推移を図5に示した。日本では集計年全体では137品目のバイオ医薬品がNMEとして承認されており、全体の審査期間(中央値)は10.3か月であった。特に2022年は過去最多であった2021年の24品目に次ぐ23品目が承認されていた。米国での承認は115品目であり、集計年全体の審査期間(中央値)は10.1か月であった。欧州での承認は160品目であり、集計年全体の審査期間(中央値)は13.6か月であった。比較参考として非バイオ医薬品のNMEにおける承認年毎(2013~2022年)の審査期間(月数)を表6に示す。バイオ医薬品と非バイオ医薬品の審査期間(中央値)を比較すると、2022年は日本でそれぞれ11.4か月、10.4か月と同程度であり、欧米ではバイオ医薬品の審査期間(中央値)の方が短かった。バイオ医薬品の該非が審査期間に与える影響は小さく前回の調査同様の結果となった。少なくとも、日米欧いずれにおいてもバイオ医薬品は非バイオ医薬品と同程度の審査期間が見込めると言える。
(7)再生医療等製品の承認数の日米欧比較
政策研ニュース第68号では2022年に日本で新たに承認を受けた再生医療等製品6品目を報告したが、調査方法にて述べた通り、本稿の承認数の集計対象を日本はPMDAホームページの「新医薬品の承認品目一覧」に掲載されている医薬品としたことから再生医療等製品は対象外である。また、米国についてもFDAの「CDER Drug and Biologic Approvals for Calendar Year」に掲載されている医薬品としたことから、再生医療等製品に相当する製品は対象外である。一方で欧州に関しては、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」に掲載された医薬品を対象に集計したが、再生医療等製品に相当する製品についても対象に含まれる。
ここでは、日本における再生医療等製品に相当する製品の日米欧における近年の承認数について報告する。日本は、PMDAホームページの「新再生医療等製品の承認品目一覧」11)に掲載されている医薬品とし、品目数は承認・一変別が「承認」として記載されたものを対象とし、「一変」は含まない。集計期間は再生医療等製品が新たに定義された現行の薬機法の施行後である2015年以降を対象とした。米国は、FDAホームページの「Approved Cellular and Gene Therapy Products」12)に掲載されている医薬品を対象として初回の承認を受けた年にて集計した。欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」に掲載された医薬品のうち、ATMP(Advanced therapy medicinal products)指定13)を受けて承認された品目を対象とした。
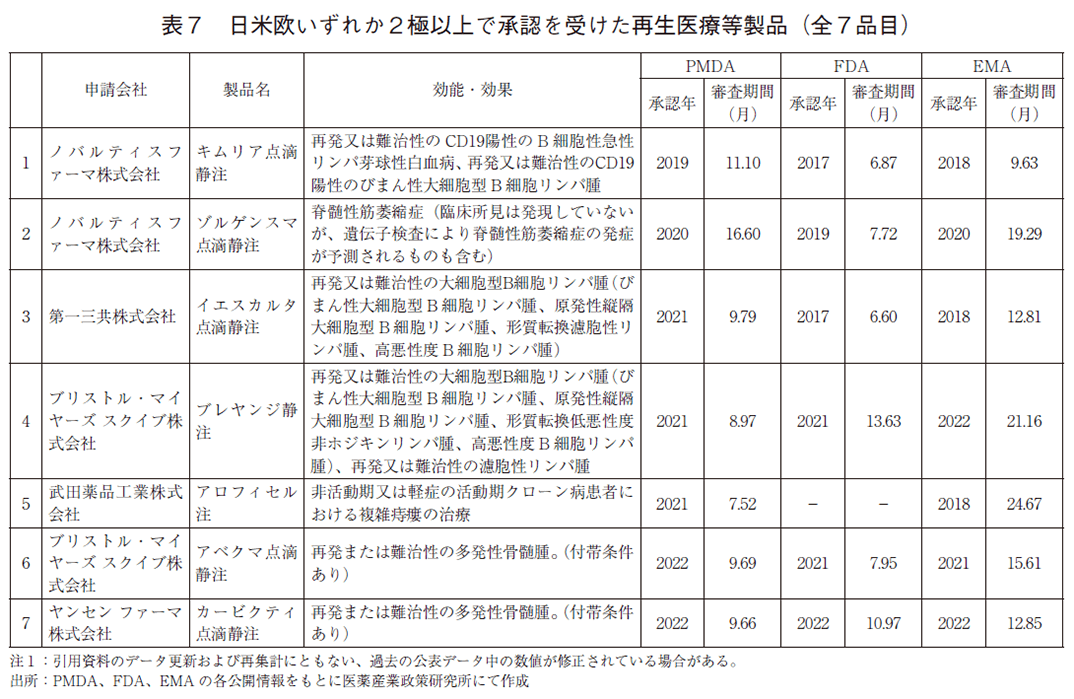
日本、米国、及び欧州で承認された再生医療等製品に相当する製品の新規承認数(2015~2022年)及び2022年末時点で日米欧いずれか2極以上の承認を受けた製品数を図6に示した。日本では2015年から2022年までに15製品が新規に承認を受けており、うち7製品は欧米いずれかまたは両方で承認を受けた品目であった。製品名、各極での承認年および審査期間を表7に示した。
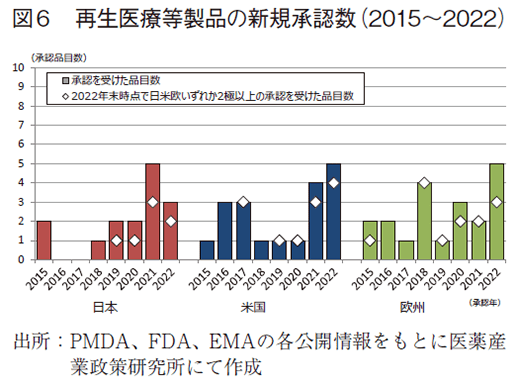
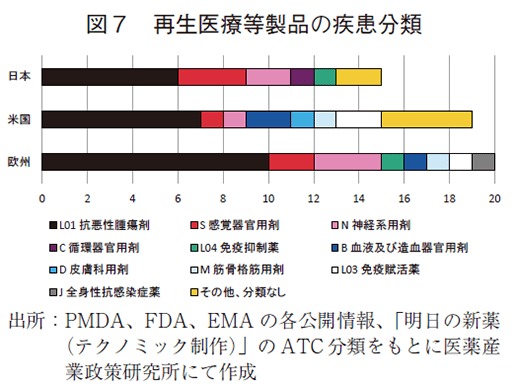
米国および欧州では2015年から2022年までにそれぞれ19製品及び20製品が新規に承認を受けており、それぞれ12製品、13製品が2022年末までに日米欧の2極以上で承認を受けていた。日米欧いずれにおいても新規に承認を受けた品目数が増加しており、また日米欧いずれか2極以上で承認を受けたグローバル製品の承認が増えていることがわかる。また、図7では承認を受けた再生医療等製品の対象疾患分類を示した。抗悪性腫瘍剤が最も多く、日本では感覚器官、神経系を対象とした製品が複数承認を受けている。
表7では日本における再生医療等製品の承認年及び審査期間を同一製品の欧米の審査期間と比較した。
表7で示した7品目のうち4品目は欧米初回承認から1年以内に日本でも承認を受けていた。また、審査期間については7品目のうち5品目が10か月以内に承認を受けており、欧米と同等以上に短期間での審査完了が見込めると言える。
4. まとめ・考察
本稿では、日本、米国、および欧州で2022年に承認された新医薬品の承認品目数および審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。
2022年の承認品目数は過去8年間において、全承認品目数とNME数のいずれにおいても日米欧で高水準の承認状況であった。薬事上の特別措置件数についても昨年同様の水準であった。日米欧いずれにおいても通常審査の審査期間(中央値)と比較して薬事上の特別措置を受けた品目の審査期間(中央値)が短縮しており、措置の効果が得られた結果となっていた。
2022年に日本で承認を受けた全品目を対象とした審査期間の中央値は表3のとおり9.4か月であり欧米と比較して日本が最小であり、標準偏差も3.6か月と小さかった。日本で承認を得るまでの審査期間が欧米と同程度以上であることは、新規医薬品への迅速なアクセスを達成するためには非常に重要な要素であると考えられるため、今後も同水準の維持を期待したい。また、COVID-19への対応として2021年の特例承認9品目があったが、2022年も特例承認7品目及び緊急承認1品目が承認されており、COVID-19流行への対応の活発化、迅速化が進んだと言える。
一方で表1に示したとおり、2022年に米国で承認を受けた品目の審査期間の中央値は全承認品目で11.0か月と平年並みであったものの、平均値は19.5か月となり標準偏差も大きかった。2022年に米国で承認を受けた112品目では、既発売製品が10品目以下の企業14)による製品が63品目(56.3%)であり、2021年の114品目における55品目(48.2%)から増加した。2022年に米国で承認を受けた品目のうち、既発売製品が10品目以下の企業による製品の審査期間の中央値及び平均値は12.0か月及び20.0か月であり、それ以外の企業の審査期間の中央値及び平均値(それぞれ10.0か月及び18.8か月)と比較して長かったことから、既発売品の少ない企業による承認数が多かったことが2022年の審査期間に影響した可能性が考えられる。なお、欧州では小規模の企業に対する薬事サポート制度が存在しており、2016年から2020年の間にこれらの企業による承認申請の成功率が2倍以上に増加したとのことである15)。PMDAにおいても従来の対面助言・事前面談に加えて主に大学、研究機関、ベンチャー企業を対象としたレギュラトリーサイエンス総合相談及びレギュラトリーサイエンス戦略相談の仕組みが提供されている16)。
薬事上の特別措置においては、重篤な疾患に対して高い有効性が期待される医薬品について先駆け審査指定制度、Breakthrough Therapy、PRIMEなどがあるが、欧米のBreakthrough Therapy、PRIME件数と比較すると日本の先駆け審査指定制度による承認件数は少ない。このことが日本における画期性の高い医薬品アクセスへ与える影響については未解析であるが、欧米と同水準の医薬品アクセスを維持向上するためには、現行の薬事上特例措置を最大限有効活用する他さらなる工夫が必要となる可能性がある。
昨年の政策研ニュース第67号に引き続きバイオ医薬品該非別の調査を実施したが、品目数は日米欧ともに昨年同様に過去最高水準であり、審査期間に関してはバイオ医薬品該非別に関わらず同程度であった。また、政策研ニュース第68号でも述べた再生医療等製品の承認状況の日米欧比較を行った。再生医療等製品の承認数は日米欧いずれにおいても近年増加しており、また日米欧いずれか2極以上の承認を受けるグローバル製品数も増加していた。審査期間については表7のとおり製品毎のばらつきがみられるものの日本での審査期間は10か月程度に収束する傾向も認められた。バイオ医薬品、再生医療等製品など、モダリティーにかかわらず一定の審査期間が見込める点は革新的医薬品の早期上市へのハードルを下げる点で重要と考えられる。欧米と同等以上の審査の迅速さの維持に加え、革新的技術やCOVID-19のような不測の事態に対する対応の柔軟性を期待し、今後も本稿の解析を継続したい。
-
1)医薬産業政策研究所、「日本における新薬の臨床開発と承認審査の実績」、リサーチペーパー・シリーズNo.69(2016年11月)
-
2)医薬産業政策研究所、「日米欧の新薬承認状況と審査期間の比較-バイオ医薬品の承認状況も踏まえて-」、政策研ニュースNo.67(2021年11月)
-
3)医薬産業政策研究所、「日本で承認された新医薬品とその審査期間-2022年承認実績と経年動向調査-」、政策研ニュースNo.68(2023年3月)
-
4)
-
5)
-
6)
-
7)
-
8)
-
9)
-
10)医薬産業政策研究所、「世界売上高上位医薬品の創出企業の国籍-2021年の動向-」、政策研ニュースNo.67(2022年11月)
-
11)
-
12)
-
13)
-
14)Evaluate PharmaⓇのパラメーター「Marketed(企業が所有する製品数、全世界対象)」(2023年9月8日時点)にて分類した。
-
15)
-
16)

