目で見る製薬産業 ドラッグ・ラグ:日本承認品のラグ実態の分析
医薬産業政策研究所 主任研究員 東 宏
要約
- ドラッグ・ラグについて、2013年から2022年に日本で承認された新有効成分含有医薬品に焦点を当て解析を行ったところ、ラグ期間(中央値)は概ね短縮傾向にあり、2022年では16.4ヵ月へと縮小した。
- 審査期間の影響を除いた開発ラグがドラッグ・ラグの主要因であることを確認した。
- ラグ期間(中央値)で層別に分析し、ラグ期間が3年以上と長い品目数は減少していた。
- 各極で開発する企業特性別に検討し、欧米と日本で異なる企業が承認取得する医薬品のラグ期間(中央値)は長く、ドラッグ・ラグ全体のラグ期間の短縮へ大きく影響する可能性が示唆された。
- 欧米で新興企業が承認取得した医薬品を日本で担うのは日本製薬企業が主であり、ドラッグ・ラグ期間(中央値)としては経年的な縮小傾向があるものの、依然として長い。
1. はじめに
ドラッグ・ラグとは、海外で使用できる医薬品が、日本で承認され使用できるまでに生じる時間差のことである。ドラッグ・ラグを生じている医薬品の中には日本で承認されているが「遅延」したものと、日本で未だ承認されていない「未承認」のものがある。これまで医薬産業政策研究所では未承認薬の分析を重ね、ドラッグ・ラグ/ロスについて問題提起をしてきた1)2)3)4)5)6)7)。未承認薬の中には国内で開発中のものもあり、海外に遅れて承認される期待があるもの(ドラッグ・ラグ(未承認))と国内開発情報が確認されないもの(ドラッグ・ロス)がある(図1)。また一方、国内承認されていても、海外に遅れて承認されたドラッグ・ラグとなっている品目があり、これらも一刻も早く革新的な新薬を待ち望む患者さんにとっては大きな問題となっている。澁口ら8)は、新有効成分含有医薬品のドラッグ・ラグは、ラグ期間の中央値で改善していることを報告しているが、ラグ期間の長短の違いによる品目の特性などの分析には至っていない。本稿では、ドラッグ・ラグの中央値のみならず、日本承認品目全体におけるドラッグ・ラグの現状を改めて解析し、ラグの完全解消に向けた課題について考察したい。ドラッグ・ラグが生じている医薬品の中で、日本で承認された医薬品の他国先行品に焦点を当てる(図1ハイライト部分)。ドラッグ・ラグ全体の分析、あるいはドラッグ・ロスの分析ではないことを予め明示しておきたい。なお、国内未承認薬の増加には、現時点でドラッグ・ラグ(未承認)の品目動向についても現状把握が必要と考えられるが、開発中のため、ラグ期間の測定は困難であったり、場合によると開発中断されドラッグ・ロスになる可能性もある。これら品目の特性については今後継続検討すべき課題と考えている。

2. 調査方法
本稿での調査は以下の方法にて行った。調査対象は2013年から2022年に日本で新有効成分含有医薬品として承認された品目とし、各国審査当局発表の資料から承認申請日と承認日を特定しラグ期間の確認を行った。具体的には、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)、及びEuropean Medicines Agency(EMA)の各ホームページ等で公表している情報をもとに解析を行っており、欧米のいずれも承認されている場合は、早い期日で承認された地域の情報を採用した9)。対象期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とした。欧州においては中央審査方式での承認情報を採用しているため、各国での承認状況とは異なる場合もある。
なお、日米欧間の品目の紐づけにおいては、日本承認薬に付随するインタビューフォームやClarivate Cortellis Competitive Intelligenceの情報も参考に行ったが、承認日や承認申請日の決定はPMDAの審査報告書並びにFDAにおけるApproval LetterやEMAにおけるEuropean public assessment reports(EPAR)の内容に準拠する。
3. 結果
3-1. ドラッグ・ラグを生じた医薬品の推移
日本で2013年から2022年までに新有効成分含有医薬品として承認された品目は424品目であった。その中で日本が他国に遅れて承認された、即ちドラッグ・ラグが生じた医薬品は301品目(71%)であった。一方、日本が他国に先行した医薬品(欧米未承認品も含む)は114品目(27%)であり、その他として、日米欧間で同一品目の判断が困難である品目、欧米の承認日が確定できずにラグ有無の判断が出来ない品目が9品目(2%)あった。
ドラッグ・ラグを生じた医薬品301品目の年別内訳を2013年から2022年の推移として図2に示す。その結果、品目数では19~46品目の間でドラッグ・ラグを生じていた。直近2年間では再度欧米先行品36品目、当該年承認数の69%であった。
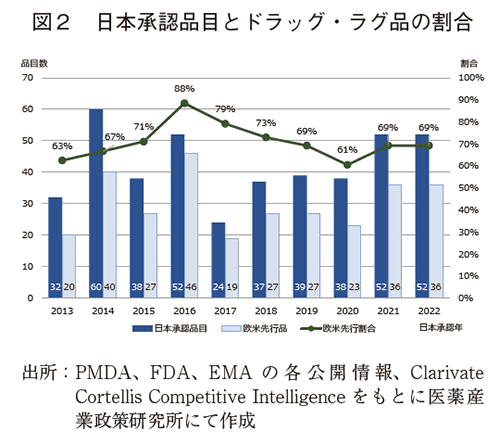
10年間の推移から、調査年ごとの上下はあるものの、日本で承認された医薬品の多くにドラッグ・ラグが依然として存在し、医薬品の開発順位において日本が欧米に比べ先行され続けている実態が確認された。
3-2. ドラッグ・ラグ期間の経時的推移
ドラッグ・ラグのラグ期間の実態を把握すべく、日本と欧米でドラッグ・ラグを生じているラグ期間(中央値)について調査した。図3にドラッグ・ラグ品の品目数、および調査年ごとの承認遅延期間(=ドラッグ・ラグ)と承認申請提出の遅延期間(=開発ラグ)の中央値推移を示した。
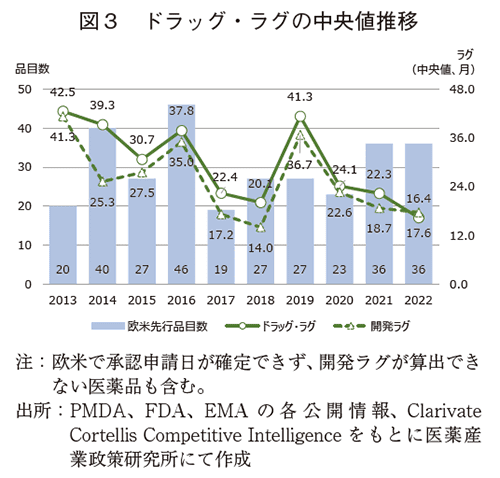
その結果、ドラッグ・ラグの2013年から2016年の中央値は30ヵ月以上であったが、2017年以降は2019年を除き中央値は20ヵ月台となり、最新の2022年では16.4ヵ月であった。このことから、ドラッグ・ラグ期間はここ10年間で概ね減少傾向と捉えることができる。
また、各極の審査期間の影響を除いてラグを分析するため、承認申請日でのラグ(開発ラグ)を比較した。ドラッグ・ラグと類似の傾向がみられ、2013年から2016年は25.3~41.3ヵ月程度であったが、2017年から2022年にラグ期間の短縮傾向がみられ、2019年を除き、14.0~22.6ヵ月の間を推移していた。
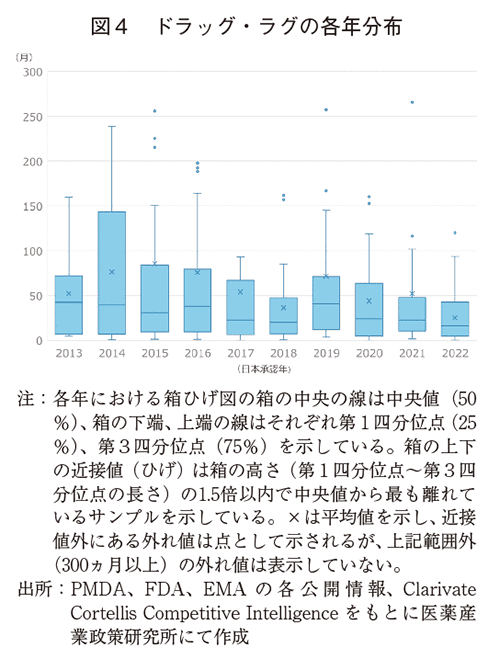
図4に年度毎のドラッグ・ラグ期間の分布を示した。各年度において平均値より中央値が小さく、期間が短い品目が多いことが示唆された。また、第3四分位点が小さくなっておりラグ期間が長い品目は少なくなっていることが示唆された。
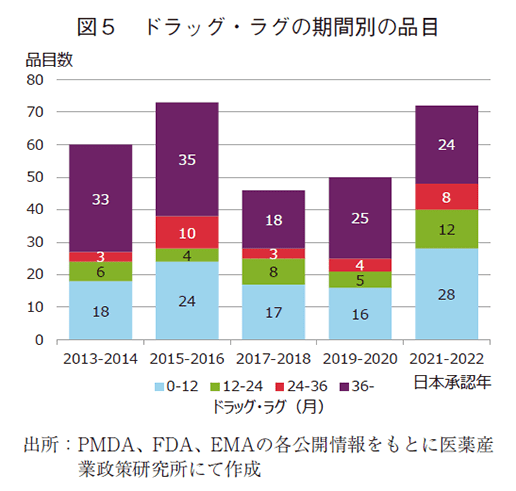
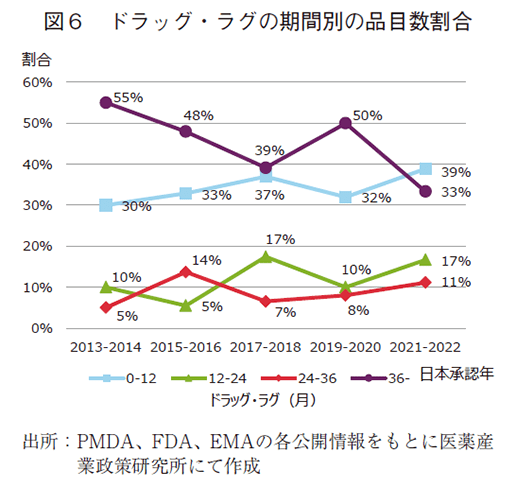
中央値減少推移の内訳を探るため、ドラッグ・ラグ品をラグ期間ごと、即ち、12ヵ月以内、12~24ヵ月、24~36ヵ月、36ヵ月以上において、品目数と全体に占める割合の推移を、2年ずつまとめて集計し調査した(図5、6)。その結果、36ヵ月以上の長期ラグ品目群に着目すると、2013-2014年に33品目あり55%を占めていたが、2021-2022年では24品目、33%とどちらも減少していた。他方、12ヵ月以内の短期ラグ品目では2013-2014年に18品目30%であったが、2021-2022年では28品目39%で増加していた。12~24ヵ月、24~36ヵ月でも2013-2014年と比較し品目数と全体に占める割合は増加し、各々2021-2022年では12品目17%、8品目11%であった。ここ10年では、36ヵ月以上の長期ラグ品目は減少し、36ヵ月未満のラグ品目が増加したことにより、ドラッグ・ラグの中央値(図4実線)が減少したものと考えられた。
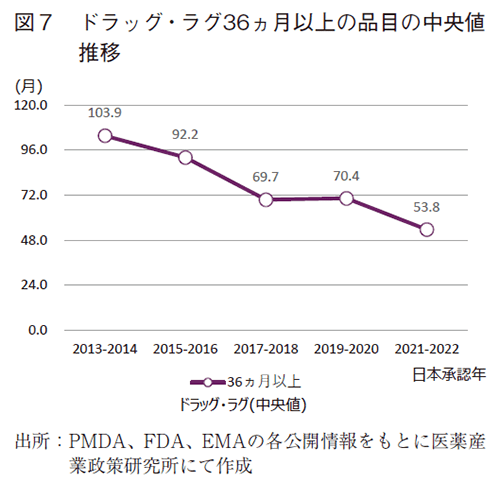
層別でのラグ傾向を把握すべく、36ヵ月以上の長期ラグ品目群の中央値の推移を解析した(図7)。36ヵ月以上の長期ラグ品目群はラグの中央値が縮小傾向にあり、2013-2014年で103.9ヵ月であったものが、2021-2022年ではほぼ半分の53.8ヵ月であった。即ち、ラグ期間中央値の短縮とは別に、長期のラグ品目においても、ラグ期間の短縮が観察され、ドラッグ・ラグの一課題の改善が確認された。
3-3. ドラッグ・ラグを生じた医薬品の企業分類別分析
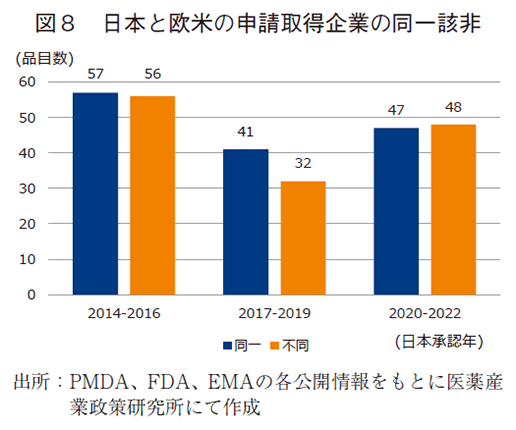
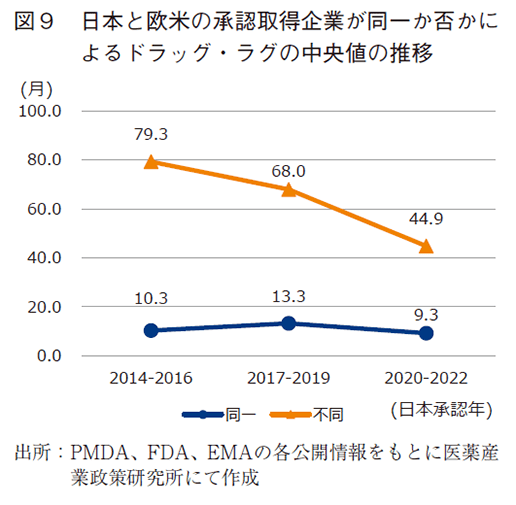
ドラッグ・ラグを生じた品目の特性を把握するため、企業分類ごとに分けて、大枠で推移を捉えるべく3年区分で解析した。まず、欧米において承認を取得した企業と日本において承認を取得した企業が、同一企業か、異なる企業か、調査した。図8に示した通り各々の企業の品目は2014-2016年で57品目と56品目、2017-2019年で41品目と32品目、2020-2022年で47品目と48品目であり、どの年代区分においても約半数の品目で承認取得会社が異なっていた。即ち日本で承認取得される医薬品の約半数は会社間で医薬品開発の主導が移動されている実態を表している。また図9で、同一会社で承認申請するよりも大幅に遅延していることを改めて確認できた。ラグ期間の中央値で、中央値では同一企業の承認取得で9.3~13.3ヵ月であったが、異なる企業の場合は44.9~79.3ヵ月とその差約3~5年の遅延が生じていた。また、推移として承認取得会社が異なる品目のドラッグ・ラグは2014-2016年の79.3ヵ月と比べ、2020-2022年では大幅に短縮し44.9ヵ月となり、経時的な短縮が確認された。勿論、日本と欧米で承認取得企業が異なる場合は、製品移管や買収交渉による手続きの期間を要し、ドラッグ・ラグの発生要因となることは想像に難くないが、異なる企業で開発が主導された医薬品の開発期間が、全体のドラッグ・ラグの短縮に影響度が大きい可能性が示唆された。
日本と欧米で承認取得会社が異なる医薬品の経時的な期間短縮の原因を探るべく、新興企業と製薬企業の企業分類ごとで解析を行った(図10)。本稿では、新興企業とは承認取得時に設立30年以内、かつ承認取得前年の売上げが5億米ドル未満の企業と定義し、製薬企業はそれ以外とした。
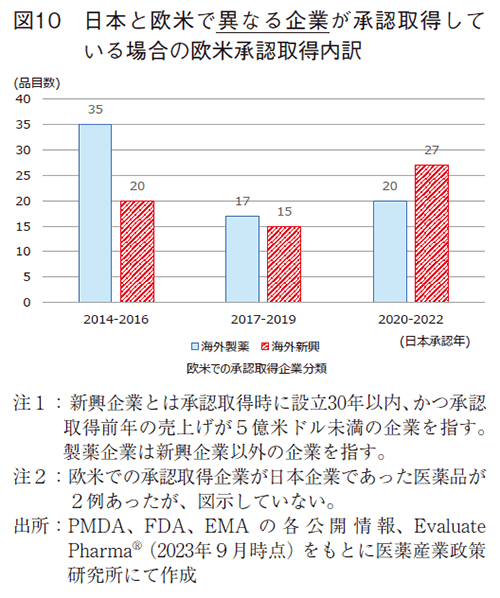
日本と欧米で承認取得会社が異なる医薬品において、まず先行する欧米での承認取得での企業分類に注目した。2014-2016年では海外製薬企業による承認取得が35品目に対し海外新興企業は20品目であった。2020-2022年では海外製薬企業による承認取得が20品目に対し海外新興企業は27品目であった。経時的に海外製薬企業に対し海外新興企業が承認取得する割合が増加していることが分かった。なお、日本製薬企業が欧米で承認取得した品目は2014-2016年に1品目、2020-2022年に1品目あり、日本新興企業が欧米で承認取得した品目はなかった。
次に、承認を取得した企業が異なる品目について、以下4分類(海外製薬企業、海外新興企業、日本製薬企業、日本新興企業)のどの企業が日本で承認を取得していたかを調査した。図11では、欧米での承認取得が海外製薬企業(図a)と海外新興企業(図b)に分け、日本で取得した企業属性を示す。欧米にて海外製薬企業が承認取得した医薬品で、日本にて承認取得した企業属性は、一例として2014-2016年では35品目中、海外製薬企業が16品目46%、日本製薬企業が14品目40%、日本新興企業が5品目14%であった(図11a)。日本では、海外製薬企業と日本製薬企業が同程度、一部日本新興企業が承認取得していた。一方、欧米にて海外新興企業が承認取得した医薬品は、一例として2014-2016年では20品目中、海外製薬企業が4品目20%、日本製薬企業が15品目75%、日本新興企業が1品目5%であった。欧米にて海外新興企業が承認取得した品目は、日本では主に日本製薬企業が開発主導し、次点で海外製薬企業、僅かに日本新興企業が承認取得している(図11b)。この結果から欧米での承認取得企業分類によって日本での承認取得企業の移動先の傾向が異なることと、海外新興企業由来の医薬品において日本での受け手は主に日本製薬企業であることが分かった。なお、日本の承認取得企業が海外新興企業である例は、海外新興企業由来の2020-2022年に1品目のみであった(図11注2参照)。
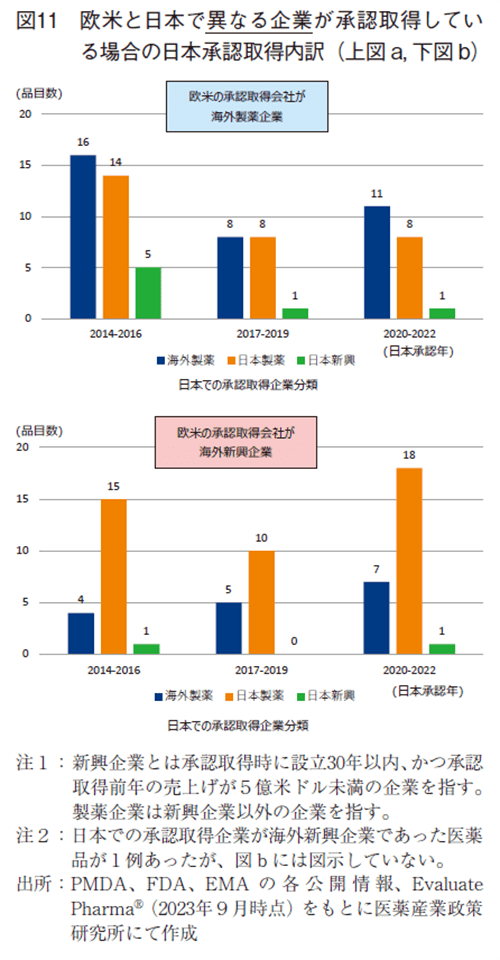
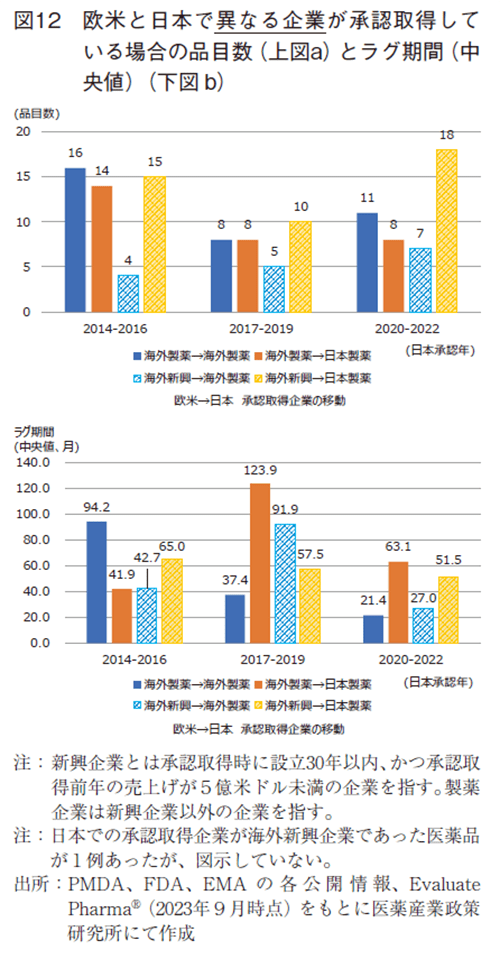
図12では、欧米と日本の承認取得企業が異なっており、品目数が多かった、海外製薬→海外製薬、海外製薬→日本製薬、海外新興→海外製薬、海外新興→日本製薬の4つのパターンについて、その品目数と各分類でのドラッグ・ラグ期間(中央値)を示した。全体の品目のラグ期間(中央値)は図9に示した通り、2014-2016年の79.3ヵ月から、2020-2022年の44.9ヵ月に短縮していた。パターン毎でみると、海外製薬→海外製薬(計35品目)のラグ期間(中央値)は94.2、37.4、21.4ヵ月と推移し、海外製薬→日本製薬(計30品目)のラグ期間(中央値)は41.9、123.9、63.1ヵ月と推移し、海外新興→海外製薬(計16品目)のラグ期間(中央値)は42.7、91.0、27.0ヵ月と推移し、海外新興→日本製薬(計43品目)のラグ期間(中央値)は65.0、57.5、51.5ヵ月と推移した。3つの期間で連続してラグ期間(中間値)が縮小していたのは海外製薬→海外製薬と海外新興→日本製薬であり、2014-2016年と2020-2022年のラグ期間減少率では海外製薬→海外製薬、海外新興→海外製薬、海外新興→日本製薬の順で大きかった。全体のラグ期間(中央値)の減少には数も多く、ラグ期間の短縮が大きい、海外製薬→海外製薬の影響が大きいことが示唆された。
3-4. ドラッグ・ラグを生じた医薬品の薬効分類別分析
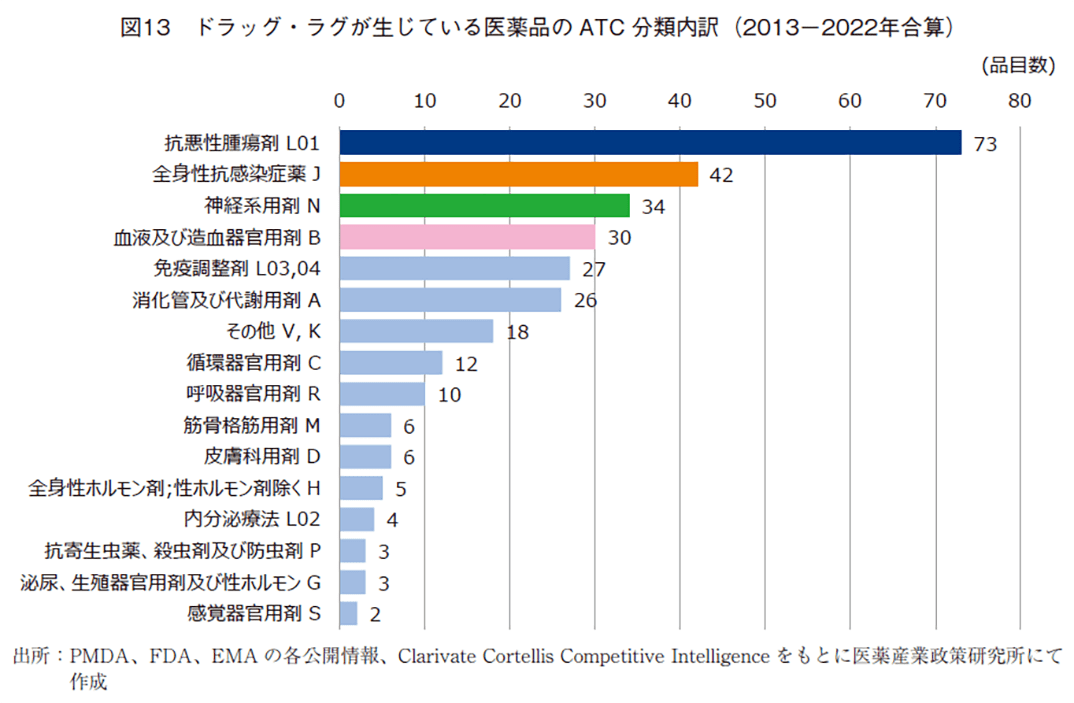
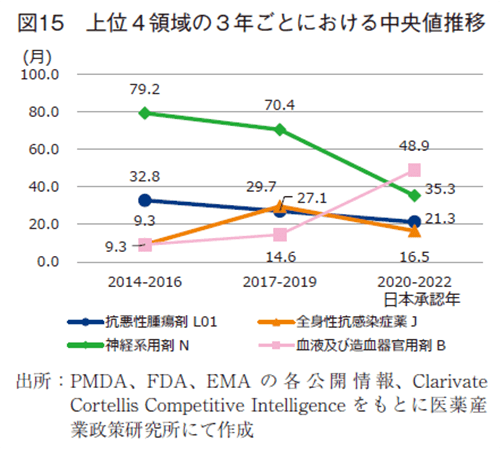
ドラッグ・ラグを生じた医薬品を薬効分類別で分析した(図13)。10年間の合算(301品目)で集計し、品目数が一番多かったのは抗悪性腫瘍薬の73品目であり全体の24%を占めた。次いで全身性抗感染症薬の42品目、神経系用剤34品目、血液および造血器官用剤30品目となった。さらに、領域ごとの経年変化を把握すべく、3年区分ごとの推移を分析した(図14)。上位4薬効分類の品目数を区分年毎でみると、抗悪性腫瘍剤で26、20、21品目、全身性抗感染症薬で11、13、15品目、神経系用剤は9、13、12品目、血液および造血器官用剤で15、10、7品目であった。また、薬効分類別のラグ期間(中央値)をみると、特徴的な例として神経系用剤は35.3~79.2ヵ月と他領域に比べ大きなラグ期間が発生していた。推移としては、経時的に縮小していたことが確認された。他方、2020-2022年で一番大きなドラッグ・ラグは血液および造血器官用剤であり48.9ヵ月、推移として9.3~48.9ヵ月と経時的にラグの拡大が生じていた。品目で占める割合が一番大きな抗悪性腫瘍剤は32.8から21.3ヵ月と経時的にラグの縮小が確認できた。
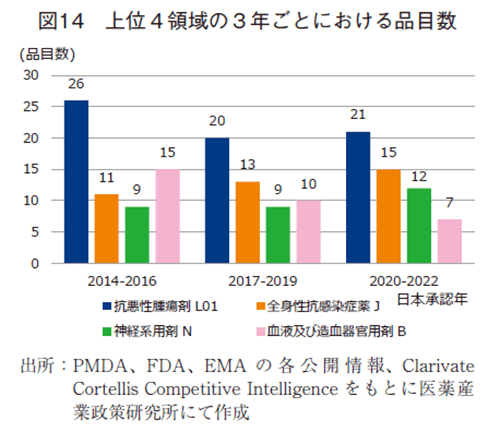
ラグ期間の短縮は見られたものの、図3に示す2020-2022年の全体でのラグ期間が16.4~24.1ヵ月であることから、これら品目数の多い疾患では、ラグが発生しやすい疾患である可能性が示唆された。
4. 考察とまとめ
本稿では、ドラッグ・ラグ/ロスの解消に向け、日本で承認された医薬品の中で生じたドラッグ・ラグの実態を分析してきた。本章では分析内容をもとに、ドラッグ・ラグに係る日本が置かれている現状について考察する。
本稿3-1章にて直近10年間に渡り7割前後の医薬品にドラッグ・ラグが生じていることを示した(図2)。日本で開発、承認された医薬品であることを鑑みると、日本の医療ニーズを満たす医薬品であることは想像に難くない。これらの医薬品の多くが海外に比べて遅れることは回避すべきものと考える。直近2022年のラグ期間の中央値は16.4か月であったことから、半分以上の新有効成分含有医薬品は16.4か月以上のラグがあることがわかる。患者アクセスの観点からラグ期間短縮の必要性は残されているものと考えられる
3-2章にてドラッグ・ラグ期間と開発ラグの承認遅延期間の解析を行い、ドラッグ・ラグのラグ期間の短縮傾向を示した。この事実は医薬品へのアクセス改善を表すため、大変喜ばしいことである。開発ラグとの差はほとんどなく、即ち、審査期間においても近年の日本の状況は大変充実しており、欧米に比してPMDAが迅速に審査を実施している報告が確認できている10)。この背景に、PMDAの承認に係る政策の成果、開発企業のグローバル開発に向けた企業努力があるものと考察する。
また、上述からドラッグ・ラグ期間はほぼ開発ラグ期間で説明でき、ドラッグ・ラグ短縮には即ち開発ラグ短縮が寄与していることが示唆された。企業が日本で承認取得する意義があると判断した医薬品は、過去に比べ速やかに承認に向け開発し承認される傾向にある、ということとなる。なお、図3に示す2019年のドラッグ・ラグ期間(中央値)は41.3%と突出していた。その内訳をみたところ、ドラッグ・ラグが60か月以上の品目が10品目と前年の2倍発生していた。同年でこれらの品目が多かった理由は調査には及んでいない。
3-3章ではドラッグ・ラグを生じた品目の特徴を探るべく、開発企業分類について分析した。欧米と日本で承認取得企業が異なる医薬品の影響が大きいことが示された。内訳をみると欧米で承認取得する海外新興企業の割合の増加があり、これは昨今の潮流である創薬の担い手が新興企業に変遷してきている一端と捉えることが出来る。さらには、欧米で新興企業が承認取得した医薬品を日本で承認取得を担うのは日本製薬企業が主である事を確認した。ドラッグ・ラグ期間(中央値)としては経年的な縮小傾向が観察されたものの、依然2020-2022年で51.5ヵ月と長い。また、欧米で海外製薬企業が承認取得し、異なる海外製薬企業が日本で承認取得した医薬品もドラッグ・ラグ期間が大幅に縮小していたことも確認できた。ドラッグ・ラグの発生要因として、欧米と日本での承認取得企業が異なることは示されたが、その提携や協業などのタイミングや実態の調査には至っていない。しかしながら、この10年間でラグ期間を短縮してきた実態から、さらなるドラッグ・ラグ短縮やドラッグ・ロス解消の糸口が見えている可能性も考える。これらの提携や協業におけるドラッグ・ラグ短縮の実態については、今後の調査分析課題である。医薬品承認取得に向けて医薬品の担い手の移動が行われた時期、臨床ステージと関連付けて詳細に調査するなど、今後の検討課題である。
3-4章では薬効領域別の解析を行った。品目数で上位の疾患領域4群の品目数とラグ期間について推移を調査し、抗悪性腫瘍剤や神経系用剤の領域で過去にはラグ期間が長かったこと、そして経時的にラグ期間が短縮したことが確認された。これらの領域は、国際共同治験への日本組み入れが進んだ領域で、欧米と日本のドラッグ・ラグ解消の一つの現れである可能性が考えられた3)。他方、全体品目の中央値と比較し、まだ多くの品目では改善余地が考えられる。また、直近3年での血液および造血器官用剤のラグ期間延長も確認されたが、要因究明には至っていない。
5. おわりに
今回は様々なドラッグ・ラグのうち、新有効成分含有医薬品であること、2022年までに日本で承認されている品目であることなど、限定した範囲での解析である。これらについてこの10年では改善する様子が示されたが、直近でも半分以上の品目は16か月以上のラグがあり、改善すべき課題と考える。これに加えて、ドラッグ・ラグには、
- 未承認薬の分析では、国内開発中の品目があり、これらはドラッグ・ラグ候補があること
- 新有効成分含有医薬品は日本で承認されていても、適応によっては使えない適応外薬においてもドラッグ・ラグがあること
- ドラッグ・ロスは現時点で開発情報がないが、国内開発がなされ、ドラッグ・ラグに変わり得ること
なども見過ごしてはいけないことを付記したい。
国内未承認薬は2016年以降増加しており、ドラッグ・ラグ/ロス拡大の兆候を報告している1)、2)。国内の患者様が待ち望む医薬品を世界に遅滞なく届けるためにも、ドラッグ・ラグ/ロスを改善する政策の実現に向け、我々製薬企業と規制当局、医療関係者との連携をさらなる強化が求められている。
-
1)医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュースNo.63(2021年7月)
-
2)医薬産業政策研究所「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」政策研ニュースNo.66(2022年7月)
-
3)医薬産業政策研究所「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」政策研ニュースNo.66(2022年7月)
-
4)医薬産業政策研究所「ドラッグ・ラグ:日本と欧州の未承認薬状況の比較」政策研ニュースNo.67(2022年11月)
-
5)医薬産業政策研究所「新薬の国際普及の計量分析:米国承認新薬の日欧承認に注目して」政策研ニュースNo.67(2022年11月)
-
6)医薬産業政策研究所「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その1 -希少疾患-」政策研ニュースNo.69(2023年7月)
-
7)医薬産業政策研究所「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴 その2 -抗がん剤-」政策研ニュースNo.69(2023年7月)
-
8)医薬産業政策研究所「ドラッグ・ラグ:国内NME承認品目の上市状況」政策研ニュースNo.63(2021年7月)
-
9)承認日を基準とし地域を採用しているため、承認申請日が地域間で前後する場合もある。
-
10)医薬産業政策研究所「日米欧の新薬承認状況と審査期間の比較」政策研ニュースNo.70(2023年11月)

