目で見る製薬産業
アンメット・メディカル・ニーズに対する
医薬品の開発状況
医薬産業政策研究所 主任研究員 椿原慎治
要約
公益財団法人ヒューマンサイエンス振興財団による「60疾患に関する医療ニーズ調査」の結果をもとに、アンメット・メディカル・ニーズに対する製薬企業の開発状況を分析した。内外資20社の2023年6月末時点の60疾患に対する開発品目を調査した結果、①医療満足度・薬剤貢献度が共に50%以上の「第1象限」疾患に対する開発品目が前回調査より減少し、医療満足度・薬剤貢献度が共に50%未満の「第3象限」での開発品目が増加していた。②開発品目数、NME成分数が前回調査より増加していた。③「第3象限」疾患に対する開発品目数は疾患間で差が大きく、過去からの調査を含めても開発品目が0の疾患があった。新薬開発の拡大は患者のアンメット・ニーズの解決に大きな寄与となりうるが、疾患間で開発数に大きく偏りがあり、その偏りの解決も今後の新薬開発の課題とすべきであろう。
1. はじめに
医薬産業政策研究所では、公益財団法人ヒューマンサイエンス振興財団(以下、HS財団)による医療ニーズに関する調査結果1)をもとに、新薬の承認および開発パイプラインに関するデータを集計し、アンメット・メディカル・ニーズに対する製薬企業の取組み状況を継続的に分析している2)3)。
前号の政策研ニュース4)では、2019年に報告された第6回HS財団調査をもとに、当調査が対象とした60疾患に対する新医薬品の2022年までの承認状況と、承認数が特に多かった悪性腫瘍治療薬を、カテゴリー別に承認状況の推移を分析した結果を報告したが、本稿では、2023年6月末時点での60疾患に対する開発パイプラインについて調査した結果を報告する。加えて、HS財団調査でアンメット・メディカル・ニーズの充足度が低いとされた疾患に対する医薬品の開発パイプラインの状況を国内外で調査したので報告する。
2. 調査方法
対象は2022年の開発品目調査と同様、内資・外資製薬企業20社の国内開発品目(フェーズⅠ~申請中)を集計対象とした。
主とした情報ソースは、2023年6月末時点の各企業ホームページで開示している国内開発パイプライン情報5)とした。参考情報として、JapanRegistry of Clinical Trials「臨床研究等提出・公開システム」サイト6)、「明日の新薬(テクノミック制作)」サイト7)、独立行政法人医薬品医療機器総合機構ホームページの「治験情報の公開」サイト8)を用いた。また、モダリティ調査と欧米の開発品目調査にはCiteline社「PharmaprojectsⓇ」サイト9)を用いた。当サイトで分子量が不明で「Chemical, synthetic」、「Chemical, synthetic, biologic」の表記の化合物はモダリティを特定しなかった。海外の開発企業の設立年、企業分類調査には「Evaluate PharmaⓇ」10)サイトを用いた。
60疾患の疾患毎の開発品目数は、2019年第6回HS財団調査で得られた医師の治療満足度、薬剤貢献度を軸にプロットしグラフ化した。
3. 結果
(1)60疾患に対する開発品目数と成分数
2023年6月末時点の60疾患に対する開発品は337品目、207成分であった。このうち、新規有効成分(new molecular entitiy、以下NME)は227品目(67.4%)、154成分(74.3%)であり、これら以外は上市済医薬品の効能追加品目であった。また、内資・外資別5)にみると、内資企業で161品目(47.8%)、88成分(42.5%)、外資企業は176品目(52.2%)、119成分(57.5%)であった。
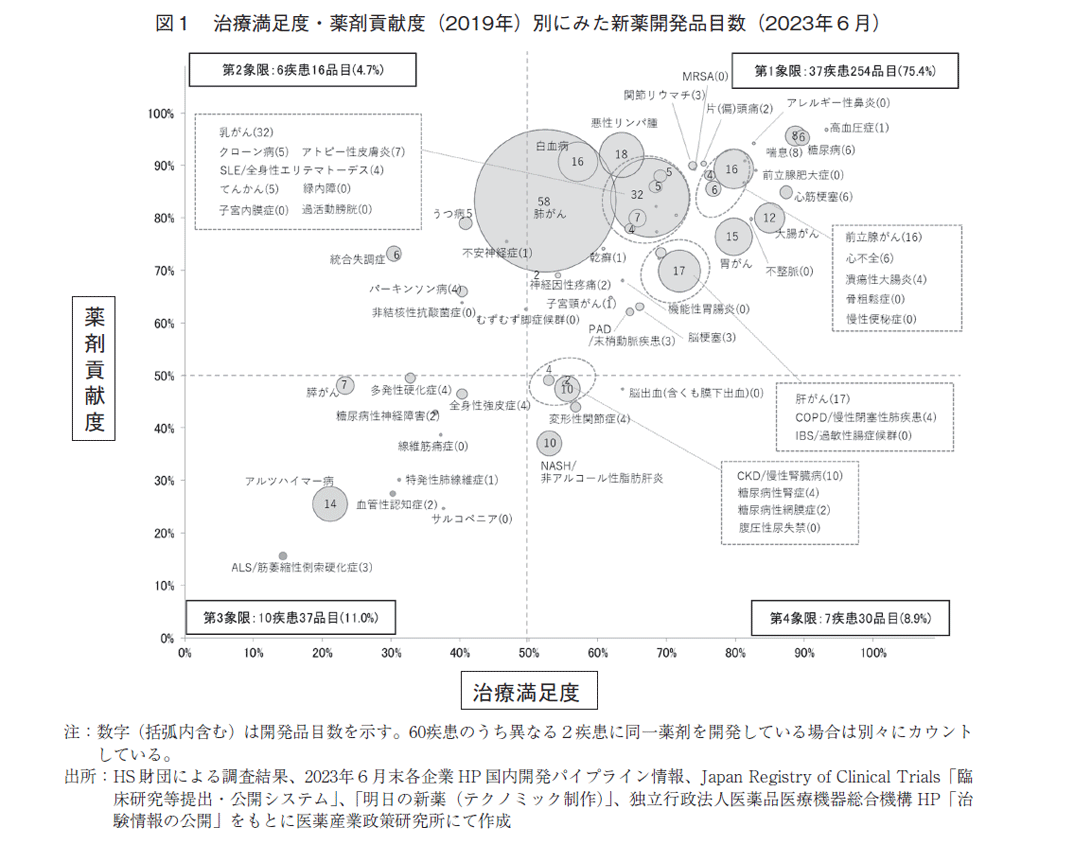
図1は、2019年に報告された第6回HS財団調査で、「重篤な疾患」、「QOLを著しく損なう疾患」、「患者数の多い疾患」、「社会的に影響の多い疾患」等として選択された60疾患に対する治療満足度(横軸)、薬剤貢献度(縦軸)に沿って疾患をプロットし、数値と円の大きさで2023年6月末時点での開発品目数を示している。
60疾患に関連する開発品目数を象限別にみると、治療満足度および薬剤貢献度がともに50%以上である「第1象限」に含まれる疾患に対する開発品目の割合は、37疾患、254品目(75.4%)と最も多かった。医療満足度が50%未満、薬剤貢献度が50%以上の「第2象限」は6疾患16品目(4.7%)、医療満足度が50%以上、薬剤貢献度が50%未満の「第4象限」は7疾患30品目(8.9%)、医療満足度、薬剤貢献度が共に50%未満の「第3象限」では10疾患37品目(11.0%)であった。
(2)各象限の開発品目数と割合の推移
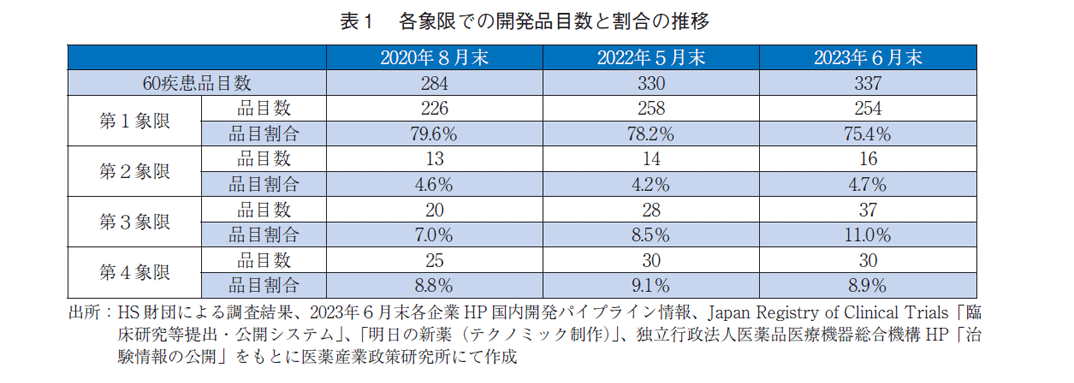
各象限での開発品目数と割合について、2020年、2022年の前2回の調査2)と今回の調査を比較し推移を分析した(表1)。全体の品目数は284→330→337品目と、前回調査から7品目の増加であった。第1象限では、226(79.6%)→258(78.2%)→254(75.4%)と品目数は前回から4品目減少し、割合は約3%低下していた。第2象限は13(4.6%)→14(4.2%)→16(4.7%)、第4象限は25(8.8%)→30(9.1%)→30品目(8.9%)とこれら象限には大きな変動はなかった。対して、治療満足度、薬剤貢献度が共に50%未満の第3象限では、20(7.0%)→28(8.5%)→37(11.0%)と前回調査から9品目増加していた。これらのことより、全体の開発品目数の増加には、主に第3象限の品目数の増加が寄与していることがわかった。
(3)疾患領域別にみた開発品目の推移
60疾患には、10の悪性腫瘍性疾患が含まれており、品目数計は192品目と全体の57.0%を占め、疾患領域として最も多くの品目が開発されていた。品目数の内訳は、第1象限にある「肺がん」58品目、「乳がん」32品目、「悪性リンパ腫」18品目、「肝がん」17品目、「前立腺がん」16品目、「白血病」16品目、「大腸がん」12品目、「胃がん」15品目、「子宮頸がん」1品目であり、第3象限にある「膵がん」は7品目であった。
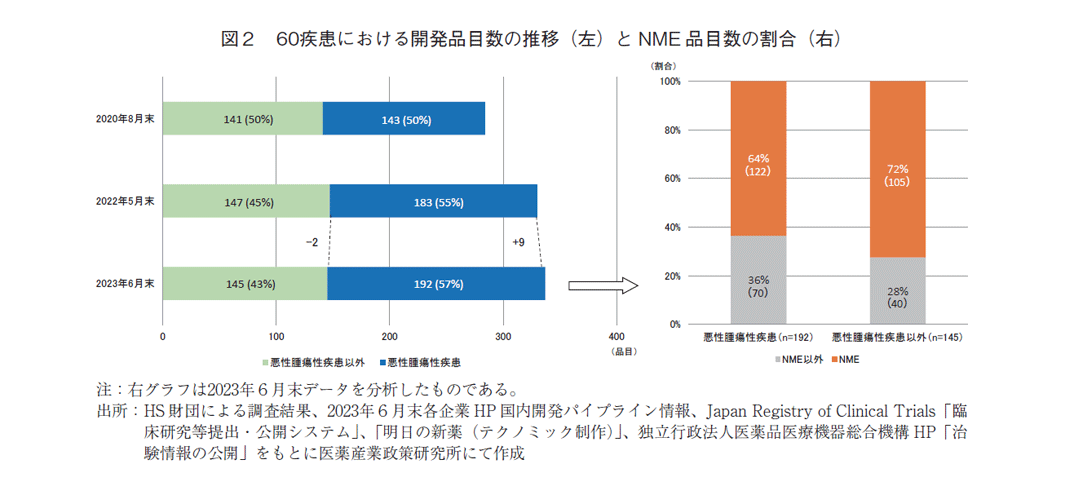
2022年調査と同様に、全体の開発品目に対する悪性腫瘍性疾患の開発品目数とその割合を経時的に評価した。また、本調査における開発品目を悪性腫瘍品目と悪性腫瘍以外の疾患品目に分け、NME品目数と割合を分析した。悪性腫瘍の品目数と割合は、2020年調査では284品目中143品目(50.4%)、2022年調査では330品目中183品目(55.5%)2)、本調査では337品目中192品目(57.0%)と前回より9品目増加していた(図2左)。この192品目におけるNMEは、122品目(63.5%)であった。悪性腫瘍以外の品目は145品目あり、そのうちNMEは105品目(72.4%)であった(図2右)。
(4)NMEのモダリティ分析
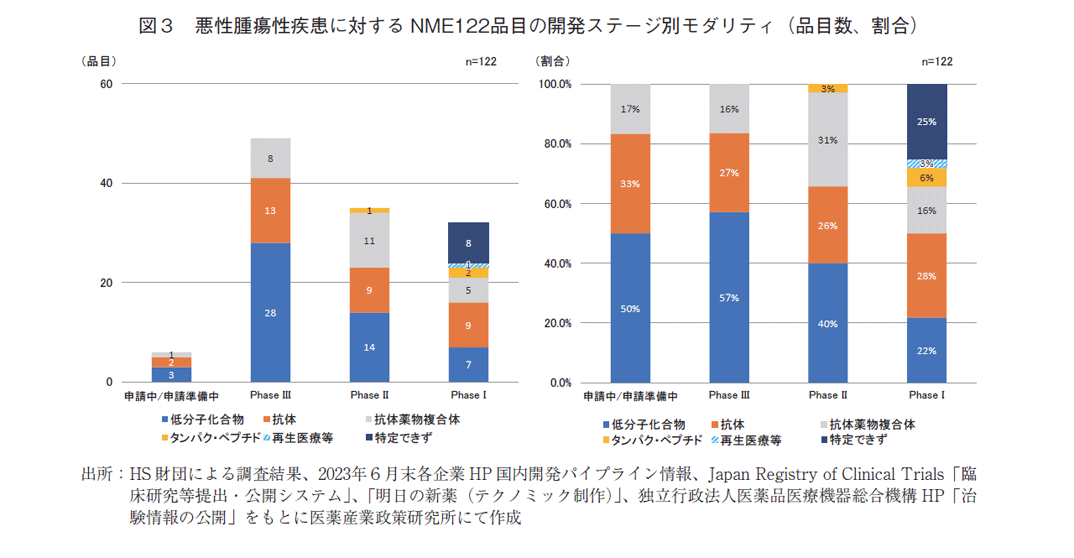
本調査での開発品目を悪性腫瘍性疾患と悪性腫瘍性疾患以外のNMEに分け、開発ステージ毎にモダリティの内訳を分析した。図3の左グラフは悪性腫瘍に対するNME122品目の各ステージでのモダリティ数、右グラフはモダリティの割合を示している。フェーズⅢは低分子化合物が半数以上を占めていたが、ステージ早期では、「抗体医薬」「抗体薬物複合体(Antibody Drug Conjugate、以下ADC)」が増加する傾向が示唆された。しかし、フェーズⅠではモダリティを特定できないケースが多く、また、数社がフェーズⅠを開示していなかったため、傾向の詳細は明らかにできなかった。同様に、悪性腫瘍以外の疾患に対するNMEの105品目を分析すると(図4)、開発早期ではモダリティを特定できない品目も多くあったが、今後、悪性腫瘍以外の領域で、抗体に加え、タンパク・ペプチド医薬、核酸医薬が増加しモダリティの多様化が更に進むことが予想された。
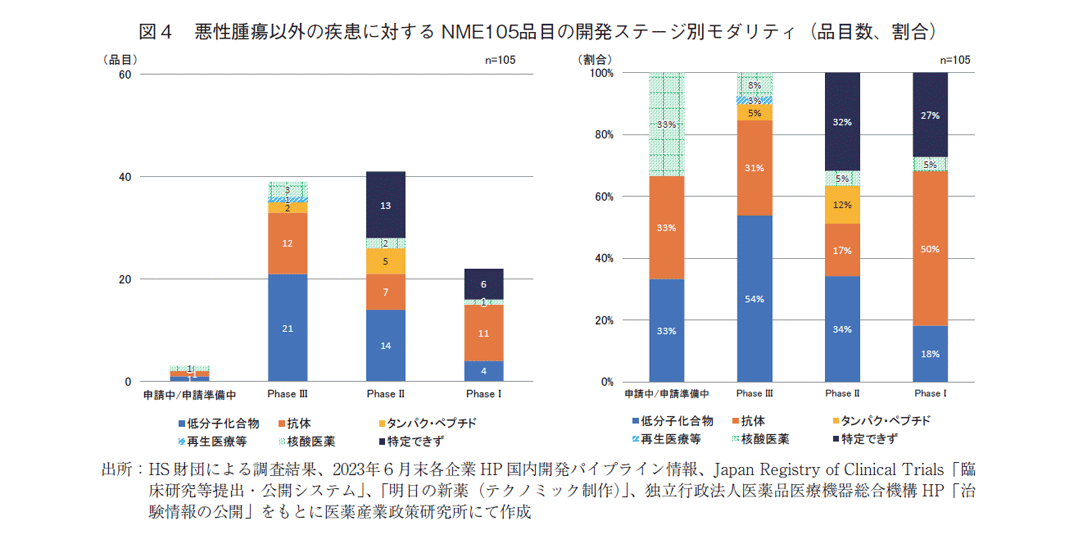
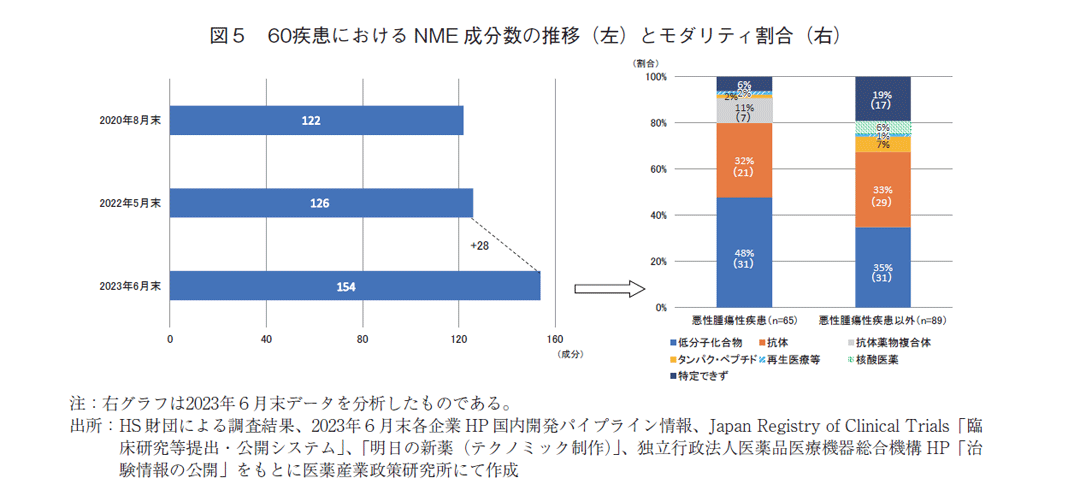
これまで開発状況を品目から分析してきたが、品目は開発効能毎にカウントしているため、1成分を複数の効能で開発している場合、その効能数を品目数として算出している。図5では、NMEを成分単位で分析しているが、経時的に推移をみると(左図)本調査のNMEは前回調査より28成分増え約20%増加していた。また、モダリティ分布をみると(右図)、品目分析との比較からは大きな特徴は認められなかったが、成分あたりの平均予定効能数が低分子化合物1.5(92品目62成分)、抗体医薬1.3(64品目50成分)であったことに対して、ADCは3.6(25品目7成分)であり、他モダリティの2~3倍であった。
(5)第3象限疾患の開発状況
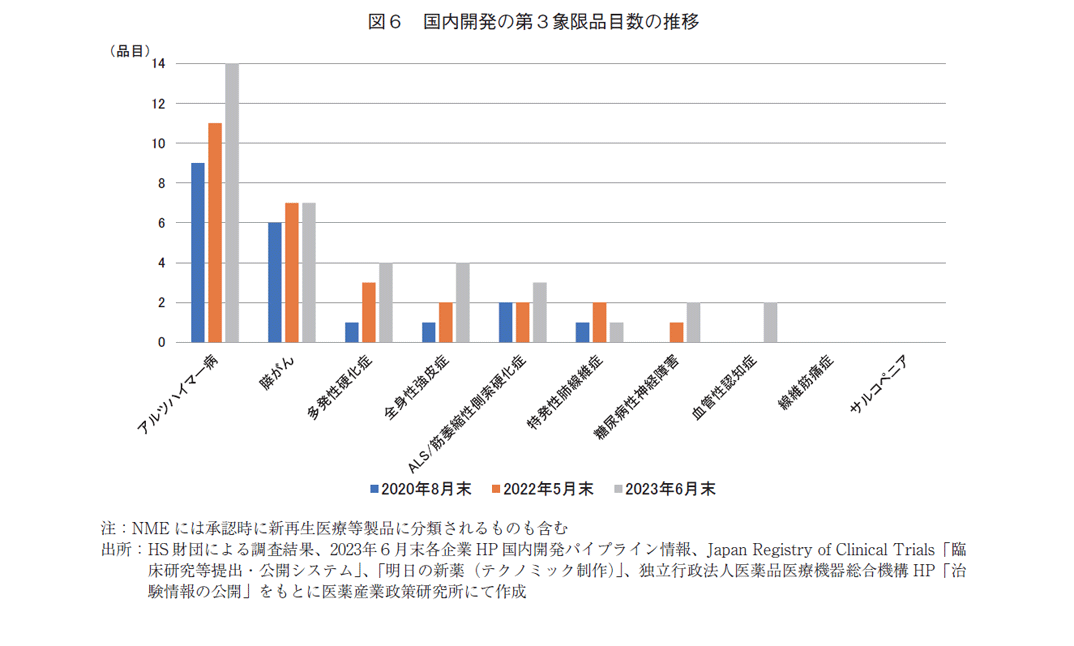
医療満足度、薬剤貢献度が共に50%未満の第3象限での開発品目が増加していたことより、更に深堀して分析した。図6は第3象限に含まれる10疾患に対する開発品目数を2020年調査から経時的に追ったグラフである。元々開発品目が多かった「アルツハイマー病」は9→11→14と増加し、「膵がん」の開発品目は横ばいであった。また、「多発性硬化症」「全身性強皮症」「ALS/筋萎縮性側索硬化症」といった指定難病に対する開発品目も増加傾向にあり、本調査では、10疾患中7疾患で前回調査以上の開発品目数となっていた。しかし、「線維筋痛症」「サルコペニア」に対しては3度の調査においても開発品目はなかった。
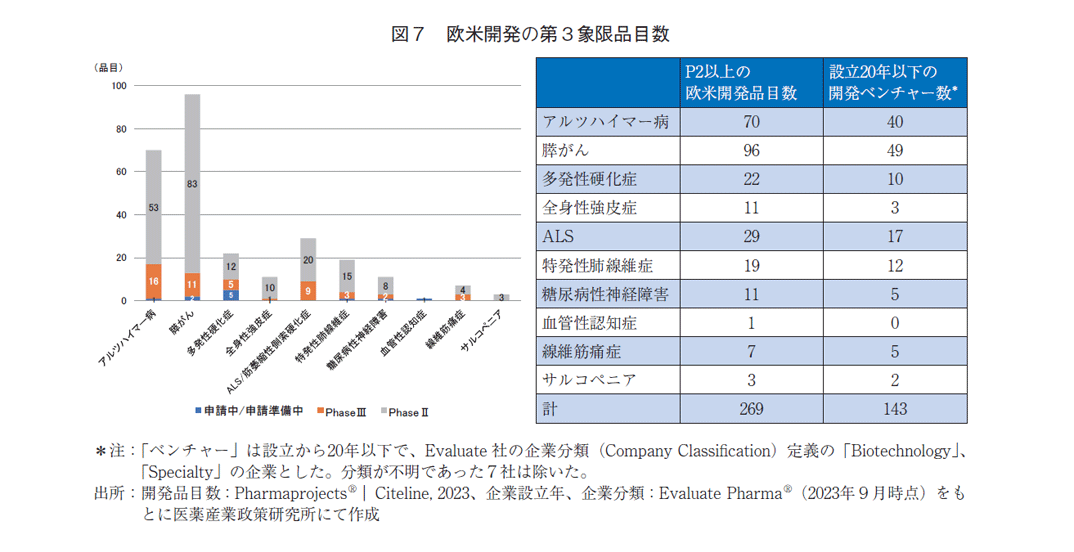
次に、欧米での第3象限疾患に対する開発品目の状況を調査した(図7)。国内未開発で、欧米でフェーズⅡ~申請中にある開発品目を集計対象とした。全体で269品目の開発が欧米で進められており、フェーズⅡ品目が多勢であった。それらの開発企業は設立後20年以下のベンチャー企業が53.2%を占め、単独もしくはパートナー企業と開発を進めていた。アルツハイマー病、膵がんに対する品目が多く、それぞれ70、96と国内の5~10倍以上の品目数であった。繊維筋痛症、サルコペニアに対する品目は少ないながらも、主にベンチャー企業によって開発が進められていた。
4. まとめと考察
HS財団が医療ニーズに関する調査の対象とした60疾患に対する2023年6月末時点の国内における開発品目の状況調査、分析結果を報告した。60疾患に関する開発品は337品目であり、前回調査から7品目増加していた。
60疾患のうち、治療満足度および薬剤貢献度がともに50%以上である第1象限に含まれる疾患に対する開発品目の割合は、37疾患、254品目と全体の75%を占めていた。しかしながら、全体に対する第1象限品目数の割合は、前回調査から低下しており、逆に治療満足度および薬剤貢献度がともに50%未満の第3象限で品目数と割合がともに増加していた。
10の悪性腫瘍性疾患に対する品目数は前回調査より9増加し192であった。開発品目全体の約6割を示し、最も品目数の多い疾患領域であった。192品目のうちNMEは122品目であり、悪性腫瘍品目の約6割がNMEであった。また、悪性腫瘍性疾患に対する品目を開発ステージ別にモダリティを分析したところ、モダリティの今後の変遷を明らかに示すことはできなかったが、ADCがフェーズⅡの段階で抗体医薬、低分子とほぼ同数の開発数となっていたことから、近い将来にADCが悪性腫瘍治療において重要な位置づけになる可能性は高いと考える。
60疾患に対するNME成分が前回調査より約20%増加しており、NMEの国内開発が増加していた。2022年調査時点では、上市済のPD-1抗体、PD-L1抗体、ADC、各種キナーゼ阻害薬、PARP阻害剤等の効能追加試験が多数あり、本調査の時点でこれら臨床試験のうち複数が終了していた。この点はNMEエントリーが拡大された理由の一つであろうと推察された。
今回の調査において、第1、2、4象限の品目数が前回調査とほぼ同数であったことに対して、第3象限の品目数が増加していたことは興味深い結果であった。この結果は、アンメット・メディカル・ニーズの充足度がより低い疾患に対して、各企業がその課題解決に向けて積極的に取り組みを進めている証だと考える。しかしながら、アンメット・ニーズが残存する疾患の中にも一定の期間ではあるが、治療薬が開発されていない線維筋痛症、サルコペニアといった疾患が確認された。また調査の結果から、これら疾患に対して欧米では開発されていながら国内で開発がなされていない品目が多数存在していた。このギャップの要因の一つには、これら欧米品目はベンチャー等の新興企業によって創薬され、臨床試験が実施されているケースが半数以上あり、多くの新興企業で日本での臨床開発は当初より計画外であったからかもしれない。当然、他にも要因はあるであろうが、所謂「ドラッグ・ラグ/ロス」の要因と考えられている事象とかなりの部分が重複するのではないかと想定される。
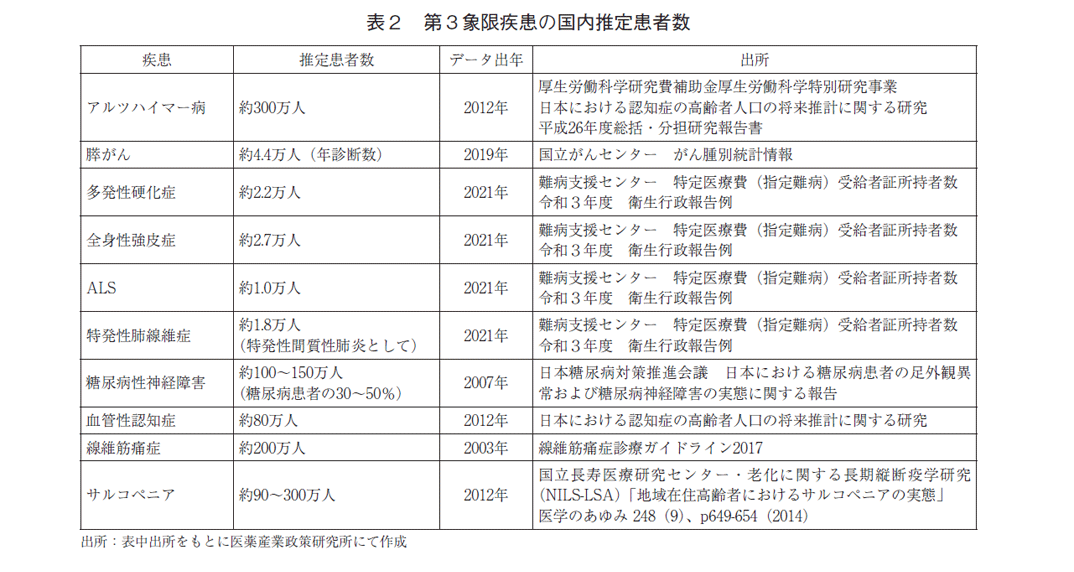
開発がなかった、もしくは僅かであった第3象限疾患の罹患患者は多数いることが報告されており(表2)、多くの患者、患者家族に満たされないアンメット・ニーズが残っているものと推察される。最後に、これら疾患がどのような疾患なのか理解してもらうために、サルコペニア、線維筋痛症、血管性認知症を代表にその特徴と診療の現状を簡潔に記す。
サルコペニア(sarcopenia)は「筋量と筋力の進行性かつ全身性の減少に特徴づけられる症候群で、身体機能障害、QOL低下、死のリスクを伴うもの」と2010年に定義され11)、現在は「骨格筋量の加齢に伴う低下に加えて、筋力および/または身体機能の低下」と定義されている12)。高齢期にみられる骨格筋量の低下と、筋力もしくは身体機能(握力や歩行速度等)の低下が主な病態である。サルコペニアを有する高齢者は筋力低下によって転倒しやすくなるが、転倒による骨折、外傷によってフレイル(虚弱状態)、廃用症候群に陥ることがこの疾患の大きな問題である。骨粗鬆症や慢性腎臓病を併存しやすく、担癌患者や手術患者では死亡リスクが高まるとされている。基本的な治療は運動療法と必須アミノ酸摂取を中心とする栄養療法が中心となる。栄養介入は膝伸展筋力の改善効果が期待できるため推奨されるが、長期的な改善効果は不明とされている13)。これからの超高齢化社会において、高齢者の身体活動が保持され、自立した生活を維持できるようにするために予防法に加え、治療法、治療薬の開発は極めて重要であろう。
線維筋痛症(fibromyalgia:FM)は、3ヶ月以上の長期にわたって全身の筋・骨格系を中心とした結合性組織の激しい疼痛、強いこわばりを主症状とする原因不明の疾患である。激しい疲労感、不眠、頭痛やうつ気分等の多彩な症状を伴う。日本リウマチ財団によると、日本の有病率は約1.7%であり関節リウマチの有病率0.7%よりも高いとされる。発病年齢は40歳後半の年代に多いとされ、日本では男女比が1:4.8と女性の頻度が高いとされている。侵害刺激がなくとも痛みが感じられることから他の慢性疼痛と同様に、下降疼痛抑制系機能の減弱、中枢性感作による痛覚閾値の低下、その原因として脳内ミクログリア活性化による脳内神経炎症の存在12)等が考えられているが、その原因には不明な点が多い。現在使用可能な医薬品としては、電位依存性カルシウムチャネルα2δリガンドのpregabalin、SNRIのduloxetineがあるが、適応はないものの三環系抗うつ薬や抗てんかん剤、ワクシニアウイルス接種家兎炎症皮膚抽出液、弱オピオイド鎮痛剤が使われる場合もある14)。HS財団調査で得られた医師からのFMの治療満足度が低い理由として、「ある程度の効果は得られるが、必ずしも、全員に効くわけではない」、「既存の治療を行っても疼痛が消失する症例が少ない」と、難治性の病態であることが示唆されている1)。2004年の全国疫学調査の結果では、機能予後に何らかの障害を持っているFM患者は約半数にのぼり、FM患者のQOL、日常生活動作(Activitiesof Daily Living:ADL)は健常人に比べて著しく低下していることが明らかになっている15)。そして、FM等の慢性疼痛疾患はプレゼンティーズム、アブセンティーズムを招きやすく、労働生産性の損失が大きいとされる16)。
血管性認知症(vascular dementia:VaD)は、脳梗塞や脳出血等の脳血管疾患の結果、認知症になった状態であり、梗塞した血管の支配領域の脳組織障害、脳出血よる内圧亢進や直接的な脳組織障害が原因と考えられている。また、アルツハイマー型認知症と脳血管障害は共通の危険因子をもつことより合併しやすく、微小梗塞や微小出血を伴うものは脳アミロイドアンギオパチーを随伴していることがあるため、アルツハイマー病との鑑別診断においては注意が必要とされる17)。
治療薬としては、脳梗塞後遺症に伴う意欲改善にnicergoline、amantadineが、攻撃性や興奮にtiaprideが保険適応となっている。HS財団調査での医師の意見では、「治療が行えているとはいえない」が29%、「効く薬がない」が31%の割合で回答され、「発症予防法はあるが、発症時の改善の手段がない」、「治療効果(が低い)」、「根治できない」という意見が挙げられていた1)。梗塞巣、障害組織の機能回復に向けて、現在アカデミアが中心となって自家骨髄間葉系幹細胞投与による臨床試験18)、iPS細胞等の人工多能性幹細胞から樹立した神経幹細胞移植による組織再生の基礎研究が進められている。また、ヒトに対しては、障害を受けたコリン作動性神経の回復およびシナプス再形成を促進する低分子化合物19)や、脳梗塞巣組織の再生に向けての骨髄間葉系幹細胞誘導薬の臨床試験がスタート20)しており、今後の治療法、治療薬開発の動向が注目される。
5. おわりに
治療満足度、薬剤貢献度の低い疾患に対する医薬品開発はもとより非常に困難であることが想定される。製薬企業、ベンチャー、アカデミア、それぞれ単独では治療薬の開発が難しい疾患領域においては、今後、産官学の強力な連携が極めて重要となる。迅速な医薬品開発は、患者、家族、介護者により早期に健康的な日常を取り戻してもらうことはもちろん、社会課題に対するアジャイルな取り組みとしても必要と考える。アンメット・メディカル・ニーズの解決において欧米との差が広がらぬよう、産官学の協力体制によってスピーディな創薬研究と実用化を促進するシステムが、近い将来、国内に構築されることを期待する。
-
1)公益財団法人 ヒューマンサイエンス振興財団「2019年度 国内基盤技術調査報告書-60疾患に関する医療ニーズ調査(第6回)-」等。HS財団は2021年3月末をもって解散した。本医療ニーズ調査等の研究事業は明治薬科大学社会薬学研究室において引き続き実施されることになっている。(参照日:2023年8月1日)
-
2)医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発・承認状況」政策研ニュースNo.31(2010年10月)、No.34(2011年11月)、No.38(2013年3月)、No.52(2017年11月)、No.59(2020年3月)、No.61(2020年11月)、No.66(2022年11月)
-
3)医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発状況」政策研ニュースNo.41(2014年3月)、No.45(2015年7月)
-
4)医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の承認状況」政策研ニュースNo.69(2023年7月)
-
5)対象企業はアステラス製薬、アストラゼネカ、エーザイ、大塚製薬、小野薬品工業、グラクソ・スミスクライン、協和キリン、サノフィ、塩野義製薬、住友ファーマ、第一三共、武田薬品工業、田辺三菱製薬、中外製薬、日本イーライリリー、日本ベーリンガー・インゲルハイム、ノバルティスファーマ、バイエル薬品、ファイザー、MSD。
-
6)
-
7)
-
8)
-
9)
-
10)
-
11)European consensus on definition and diagnosis:Report of theEuropean Working Group on Sarcopenia in Older People. Age Ageing 2010;39:412-423
-
12)サルコペニア診療ガイドライン作成委員会「サルコペニア診療ガイドライン2017年版」
-
13)荒井秀典「サルコペニア診療ガイドライン」日本内科学会雑誌109(10)、p2162-2167(2020)
-
14)一般社団法人日本線維筋痛症学会/国立研究開発法人日本医療研究開発機構線維筋痛症研究班「線維筋痛症診療ガイドライン」(2017)
-
15)松本美富士「本邦線維筋痛症の臨床疫学像(全国疫学調査の結果から)」臨床リウマチ18、p87~92(2006)
-
16)松平浩(研究代表者)「慢性の痛み患者への就労支援/仕事と治療の両立支援および労働生産性の向上に寄与するマニュアルの開発と普及・啓発 令和元年度-3年度 総合研究報告書」(厚生労働科学研究費補助金 慢性の痛み政策研究事業)(2022)
-
17)一般社団法人 日本神経学会「認知症疾患診療ガイドライン2017」(2017)
-
18)
-
19)
-
20)

