目で見る製薬産業 アンメット・メディカル・ニーズに対する医薬品の承認状況
医薬産業政策研究所 主任研究員 椿原慎治
1. はじめに
医薬産業政策研究所では、公益財団法人ヒューマンサイエンス振興財団(以下、HS財団)による医療ニーズに関する調査結果1)をもとに、新薬の承認および開発パイプラインに関するデータを集計し、アンメット・メディカル・ニーズに対する製薬企業の取組み状況を継続的に分析している2)3)。
本稿では、政策研ニュースNo.66(2022年7月)3)の報告で対象とした2019年1月から2021年12月末までに承認された新医薬品に、2022年に新たに承認された新医薬品を加えて分析し、加えて近年、承認品目数が増加している悪性腫瘍性疾患領域に着目し、悪性腫瘍治療薬の承認品目数の推移を2014年1月から2022年12月までの3期に分け、掘り下げて分析したので報告する。
2. 治療満足度・薬剤貢献度別にみた新医薬品の承認品目数

図1は2019年に報告された第6回HS財団調査で、「重篤な疾患」、「QOLを著しく損なう疾患」、「患者数の多い疾患」、「社会的に影響の多い疾患」等として選択された60疾患に対する治療満足度(横軸)、薬剤貢献度(縦軸)に沿って疾患をプロットした2019-2021年の既報3)に2022年分を追加し、2019-2022年の4年間に日本で承認された60疾患に適応を持つ新医薬品の承認件数を、円の大きさおよび数値で示したものである。
新医薬品の定義は「新有効成分含有医薬品」「新効能医薬品」「新再生医療等製品」「再生医療等製品の適用対象の追加」として承認された医薬品とした。
当該期間での総承認件数は431品目であり4)5)、HS財団調査の60疾患に関する承認は181品目(1承認に複数の適応疾患がある品目を含む)、140製品であった。このうちnew molecular entity(NME:新規化合物)は73品目(69製品)であり、その割合は40.3%(73/181)であった。
181品目のうち、内資系企業が承認取得した品目数は74品目(59製品)、外資系企業は107品目(81製品)であった。
60疾患に関する新再生医療等製品は、2022年にCART細胞療法の3製品が悪性リンパ腫を対象に一変承認を受け、1製品は適応疾患の拡大、2製品は既適応患者の要件緩和であり、8品目5製品となった。
60疾患に関連する承認品目数を象限別に見ると、治療満足度および薬剤貢献度がともに50%以上である第1象限に含まれる疾患に対する新医薬品の承認品目の割合は87.8%(159/181)と、前回85.7%を上回り、薬剤満足度、貢献度ともに高い疾患領域に更に新規承認が集中していた。特に悪性腫瘍性疾患の領域で承認された品目が多く、効能別にみると「悪性リンパ腫」25品目、「肺がん」16品目、「白血病」14品目、「乳がん」10品目、「大腸がん」8品目、「肝がん(肝細胞がん)」6品目、「前立腺がん」5品目、「胃がん」3品目、「子宮頸がん」2品目と、第1象限に位置する悪性腫瘍を対象とした薬剤が多くを占め(56.0%、89/159)、2022年は、60疾患内の悪性腫瘍治療薬に新たに29品目が追加された。第2、3、4象限の承認品目数については、それぞれ6品目(3.3%)、7品目(3.9%)、9品目(5.0%)であった。
3. 60疾患における悪性腫瘍治療薬の承認推移
政策研ニュースNo.663)に引き続き、悪性腫瘍治療薬に着目して分析した。
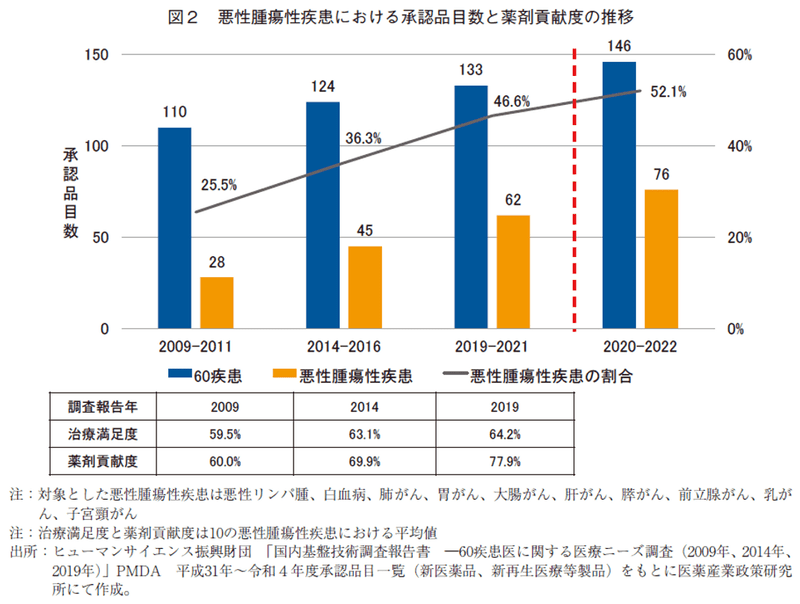
図2は、2009年4月以降に承認された60疾患に関する新医薬品のうち、10の悪性腫瘍性疾患領域(悪性リンパ腫、白血病、肺がん、胃がん、大腸がん、肝がん、膵がん、前立腺がん、乳がん、子宮頸がん)が占める割合を2009-2011年、2014-2016年、2019-2021年の3年間毎の既報データに、2020-2022年の3年間を加えて示したものである。60疾患に関連する承認品目数はそれぞれ110、124、133、146品目と増加し、そのうち10の悪性腫瘍領域の新医薬品数はそれぞれ28、45、62、76品目、割合にすると25.5%、36.3%、46.6%、52.1%と経時的に増加しており、悪性腫瘍治療品目が半数以上を占める結果であった。また、2009年、2014年、2019年のHS財団調査における10の悪性腫瘍性疾患の治療満足度と薬剤貢献度の平均値をみると、両数値とも経時的に増加しており、特に薬剤貢献度の増加量が大きかった。
4. カテゴリー別にみた悪性腫瘍治療薬の承認推移
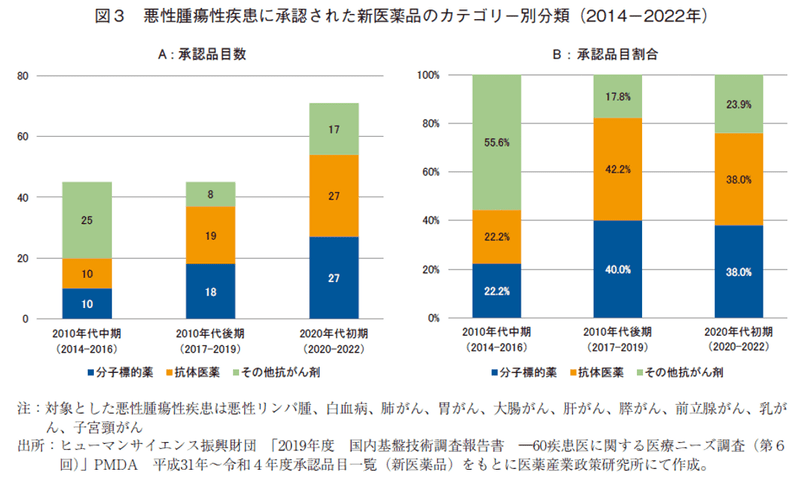
近年の10の悪性腫瘍治療薬の承認品目数の増加要因を調査するために、分子標的薬や抗体医薬に着目し、その増減を探った。第5回HS財団調査結果6)が報告された2014年にさかのぼり、2014-2016年を「2010年代中期」、2017-2019年を「2010年代後期」、2020-2022年を「2020年代初期」として、各3年間に承認された新医薬品を「分子標的薬」、「抗体医薬品」、「その他抗がん剤」、のカテゴリーに分類し、各年次の承認数と承認割合の推移をみた(図3、4)。「再生医療等製品」の5品目は分析から除いた。
「分子標的薬」はこの期間に承認された、分子標的薬として知られるチロシンキナーゼ阻害薬、KRAS阻害薬、BRAF阻害薬、MEK阻害薬、mTOR阻害薬、サイクリン依存性キナーゼ阻害薬、PARP阻害薬、プロテアソーム阻害薬、BCL-2阻害薬を対象とした。「抗体医薬品」は、「遺伝子組換え型抗体医薬品」、「抗体薬物複合体(Antibody Drug Conjugate:ADC)医薬品」を対象とした。「その他抗がん剤」には細胞障害作用、ホルモン阻害作用、代謝阻害作用などの悪性腫瘍治療薬が含まれていた。
3カテゴリーの悪性腫瘍治療薬の品目数は2010年代中期(以下、10年代中期)、2010年代後期(以下、10年代後期)は、ともに45品目と変わらなかったが、2020年代初期(以下、20年代初期)の承認品目数は71品目と、大幅に増加していた(図3-A)。カテゴリー別に推移をみると、「分子標的薬」の品目数は、経時的に10→18→27に増加し、その割合はそれぞれ22.2%、40.0%、38.0%であった。「抗体医薬品」は10→19→27と推移し、割合は22.2%、42.2%、38.0%であった。「その他抗がん剤」は、25→8→17、割合は55.6%、17.8%、23.9%となっていた。
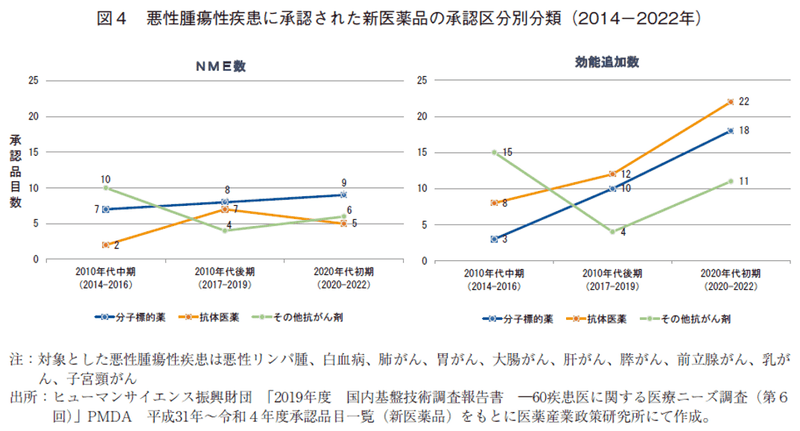
次に、悪性腫瘍治療薬の承認品目数の増加が、NMEの増加によるものか、効能追加によるものかカテゴリー別に推移を分析した。
3カテゴリーのNME数は各期安定した承認数であったのに対し、効能追加数は、「分子標的薬」、「抗体医薬品」が直線的に増加(図4)しており、20年代初期においては、3カテゴリーのNME数は20品目であったが、それに対して適応拡大数は51品目とその差は大きかった。このことから、近年の悪性腫瘍治療薬の承認品目数の増加は、効能追加の影響が大きいことが示唆された。
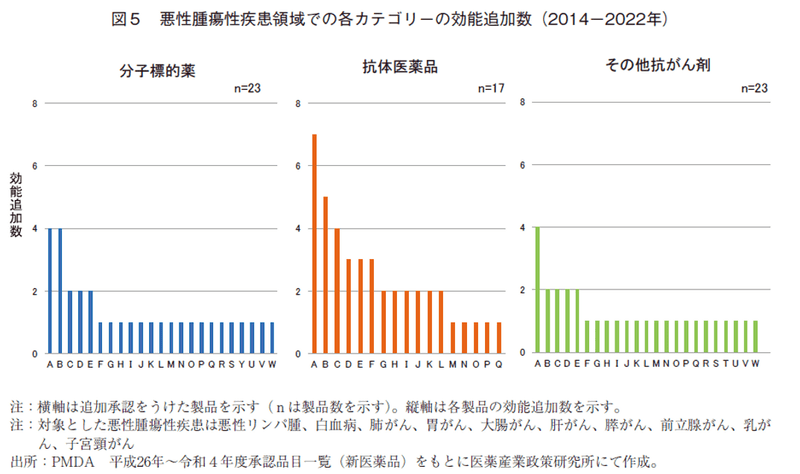
通期で、各カテゴリーにおける効能追加承認の状況を分析すると、2014-2022年の9年間に10の悪性腫瘍領域で新たに効能追加が承認された医薬品は、「分子標的薬」で32品目、23製品、「抗体医薬品」で42品目、17製品、「その他抗がん剤」で30品目、23製品であり、それらをカテゴリー別に追加承認数が多い順に製品を並べた(図5)。抗体医薬品は効能追加承認を複数取得したものが多く、抗体医薬品で効能追加が多い理由として、上位3剤の免疫チェックポイント抗体薬(ニボルマブ、ペムブロリズマブ、アテゾリズマブ)が大きく牽引しており、この3剤で追加承認数全体の約40%を占めることがわかった。これら抗体3製品は優先審査、また、「再発又は難治性の古典的ホジキンリンパ腫」、「進展型小細胞肺癌」に対し希少疾病用医薬品の承認を取得した製品があり、薬事上の優遇措置がなされていた。
5. 内資・外資別にみた悪性腫瘍治療薬の承認数推移
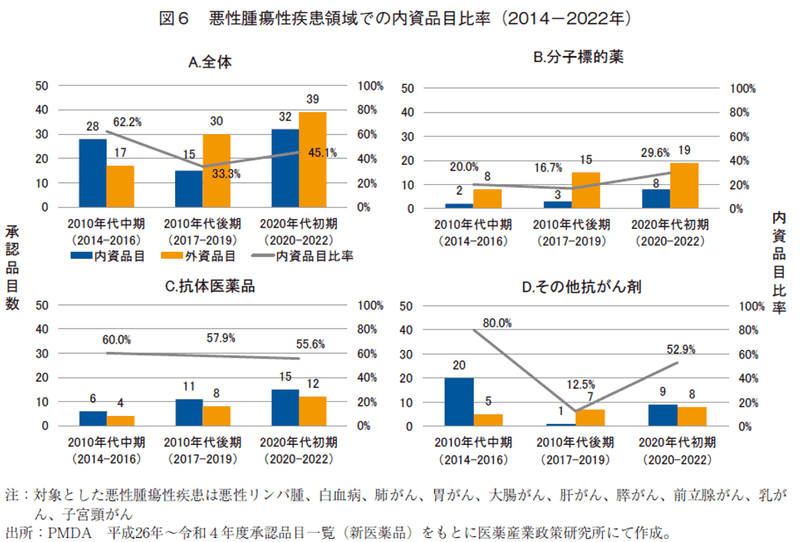
10悪性腫瘍に対する悪性腫瘍治療薬の承認申請企業を内資・外資に分け、10年代中期、後期、20年代初期の承認数の推移を分析した(図6)。悪性腫瘍治療薬全体では、内資企業の承認品目数は20年代初期に増加したが、同期の外資品目は10年代中期に比して約2.5倍増加していた。
カテゴリー別にみると、「分子標的薬」は外資が通期にわたりシェアが高いが、内資品目の承認も経時的に伸長していることが認められた。「抗体医薬品」は、内資、外資ともに伸長しており、内資のシェアは通期にわたり優勢であった。
6. まとめと考察
第6回HS財団調査における60疾患の治療満足度(横軸)、薬剤貢献度(縦軸)に沿って、2019-2022年の4年間に日本で承認された新医薬品を重ねた結果、治療満足度および薬剤貢献度がともに50%以上である第1象限に含まれる承認品目数の割合は87.8%と、2022年の1年間でさらに第1象限に集中していた。特に悪性腫瘍治療薬の品目が第1象限品目の約60%を占めており、直近3年間では60疾患に対する新医薬品の約半数が悪性腫瘍治療薬であった。
近年の悪性腫瘍治療薬の増加の状況を調査するために、第5回HS財団調査が実施された2014年から2022年の9年間を3期に分け、10の悪性腫瘍(悪性リンパ腫、白血病、肺がん、胃がん、大腸がん、肝がん、膵がん、前立腺がん、乳がん、子宮頸がん)に対する治療薬をカテゴリー別に区分し、後方視的に承認品目数の推移を分析したところ、「分子標的薬」と「抗体医薬品」が経時的に大きく増加していることが理由であり、NMEの承認数よりも効能追加の承認数が大きく影響していた。特に免疫チェックポイント抗体薬の承認数が多く、PD-1など、腫瘍細胞が共通して発現する分子を標的として自己免疫の抗腫瘍効果を増強する医薬品は、適応拡大の機会が多いと考えられた。また、細胞内シグナル伝達阻害薬の多くは分子標的薬として知られているが、一部の分子標的薬は、原発臓器が異なってもシグナル伝達分子の遺伝子変異が共通する複数の悪性腫瘍に対して効能追加の承認が得られていた。
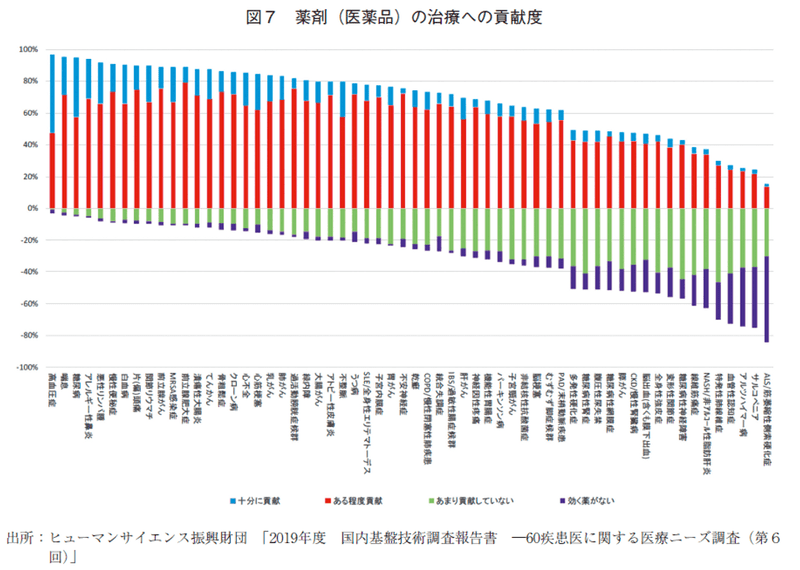
図2に示したように、悪性腫瘍治療薬の経時的な品目数増加にともない、HS財団調査の治療満足度、薬剤貢献度の増加が認められ、治療薬の進歩と治療薬品目数の増加は、悪性腫瘍性疾患の臨床現場に大きく寄与していると考える。しかし、60疾患の治療満足度・薬剤貢献度調査結果1)(図7)を詳細にみると、悪性腫瘍性疾患の領域のように治療満足度、薬剤貢献度が高い象限にある疾患であっても、実際は「医薬品が十分に貢献している」という回答は少ない。どの疾患領域においても依然としてアンメット・ニーズは存在しているといえる。
今回の調査で製薬産業は、治療に対して十分な充足度がなかった薬剤抵抗性の遺伝子変異のある悪性腫瘍や、適応条件になかった患者にも治療機会を持続的に提供していることがわかった。「画期的新薬」の開発はもちろんだが、現在ある医薬品の効能、適応を拡大し、患者のアンメット・メディカル・ニーズに応えていくことは、製薬企業、製薬産業の重要な社会的責務だと考える。
-
1)
公益財団法人 ヒューマンサイエンス振興財団「2019年度 国内基盤技術調査報告書—60疾患に関する医療ニーズ調査(第6回)—」
注)HS財団は2021年3月末をもって解散した。本医療ニーズ調査などの研究事業は明治薬科大学社会薬学研究室において引き続き実施されることになっている。(参照日:2023年5月8日) -
2)
医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発・承認状況」政策研ニュースNo.31(2010年10月)、No.34(2011年11月)、No.38(2013年3月)、No.52(2017年11月)、No.59(2020年3月)
-
3)
医薬産業政策研究所「アンメット・メディカル・ニーズに対する医薬品の開発状況」政策研ニュースNo.41(2014年3月)、No.45(2015年7月)、No.61(2020年11月)、No.66(2022年7月)
-
4)
-
5)
-
6)

