Topics
ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴
その1 -希少疾患-
医薬産業政策研究所 統括研究員 飯田真一郎
医薬産業政策研究所 主任研究員 東宏
医薬産業政策研究所 元主任研究員 吉田昌生
1.はじめに
2010年代後半に日本未承認薬が増加し、新たなドラッグ・ラグが起こりつつある1~5)。その多くの品目は海外の新興バイオ医薬品企業による開発品目であり、希少疾患領域や臨床重要度が高い品目が多いとの特徴があった1~5)。
これら未承認薬においては、がん、中枢神経系用剤、感染症などが多いことが明らかになっていたが1~5)、これらの成人適応に加えて、小児に適応を有する品目も含まれていることが想定され、必要とされる最新医療へのアクセスの課題を的確に把握する必要がある。
ドラッグ・ラグは、いわゆる、海外での既承認薬が日本国内での薬事承認を得るまでに時間を要するラグ(遅延)が問題となっているが、医薬産業政策研究所の調査では、日本未承認薬の増加には、国内開発情報が確認されない品目が多くあることを報告している。この開発情報のない、日本未承認薬は本邦で使用される機会がなくドラッグ・ロスとなる可能性が高く、重大な問題である。
本稿では、日本未承認薬の現状をさらに詳しく把握するため、希少疾患領域の小児適応のある未承認薬に焦点を当て、その実態を調査した。米国オーファンドラッグ指定のある承認品目を調査対象とし、日本未承認薬かつ開発情報のない品目(2022年8月時点)をドラッグ・ロス品目として本稿では定義して、小児適応を有する品目の特徴を分析する。
また次稿6)では、米国での抗がん剤の小児適応を有する品目(2000年から2022年)のうち、日本未承認薬かつ開発情報のない品目(2023年3月時点)をドラッグ・ロス品目としてその特徴を分析するとともに、2020年までに日本で小児適応を取得した品目のドラッグ・ラグを分析し、これらの要因について検討する。
2.調査方法
2010年から2021年に米国食品医薬品局(FDA)の医薬品評価研究センター(Center for DrugEvaluation and Research、CDER)により承認された新規有効成分(New Molecular Entity、NME)のうち、FDAからOrphan Drug指定を受けている品目を調査対象とした。FDA小児適応については、上記NMEのうち、2022年末までに小児適応を取得している品目を集計した。小児適応の有無は、小児適応を網羅的に集計しているデータベースは見当たらないため、米国FDAにて掲載されている、個々製品のPrescribing Information のIndications and UsageおよびPediatric Useの項を確認し、判定した。国内開発状況は2022年8月末調査時点で「明日の新薬」(テクノミック制作)の記載情報に基づき集計した。FDAにて取得していた小児適応疾患については、厚生労働省「指定難病:指定難病病名一覧表(令和3年11月1日版)」、小児慢性特定疾病情報センター「小児慢性特定疾病の対象疾病リスト(令和4年4月1日版)」と照合し、疾患名を同定した。本照合においては、日本製薬工業協会 産業政策委員会 難病・希少疾患タスクフォースのご協力を頂いた。
開発企業の分類は、Evaluate Pharmaから取得した企業設立年、売上高の情報に基づいて行った。FDA承認申請企業を開発担い手とし、FDA承認取得年が設立年から30年以内、且つ、承認取得前年の売上が5億米ドル未満の企業を新興企業とし、それ以外の企業を製薬企業とした。
コラム:日本未承認薬の推移とドラッグ・ラグ、ドラッグ・ロス
医薬産業政策研究所では、欧米で承認されている医薬品について日本での承認有無を確認し、日本未承認薬数の推移を追跡している。この未承認薬数は、ある時点での承認有無を判定したものであり、経時的に変化する数値である。たとえば、2016-2020年に欧米で承認された医薬品のうち、176品目は2020年末時点において日本で未承認である1~5)。2022年末時点での日本承認状況を確認すると143品目に減少しており、2021-2022年に33品目は欧米に遅れて承認されていた。また同176品のうち、2023年3月末時点で86品目の未承認薬は、国内開発情報がない品目であり、これらはドラッグ・ロスとなるリスクが高いものと考えられる。なお、この86品目では、米国にて小児適応があった品目は32品目(37%)であり、うち24品目(28%)はオーファンドラッグ指定を受けていた。小児あるいはオーファン指定のいずれかの品目は計48品目(56%)と半数を超えていた。ある年度時点での日本未承認の品目には、欧米に遅れて承認されるもの(いわゆるドラッグ・ラグ)、長期的に承認されないであろうもの(いわゆるドラッグ・ロス)が含まれる。今後の長期的な承認有無の可能性は推定困難であるため、調査時点において、国内開発情報がない未承認薬を本稿ではドラッグ・ロスと分類している。
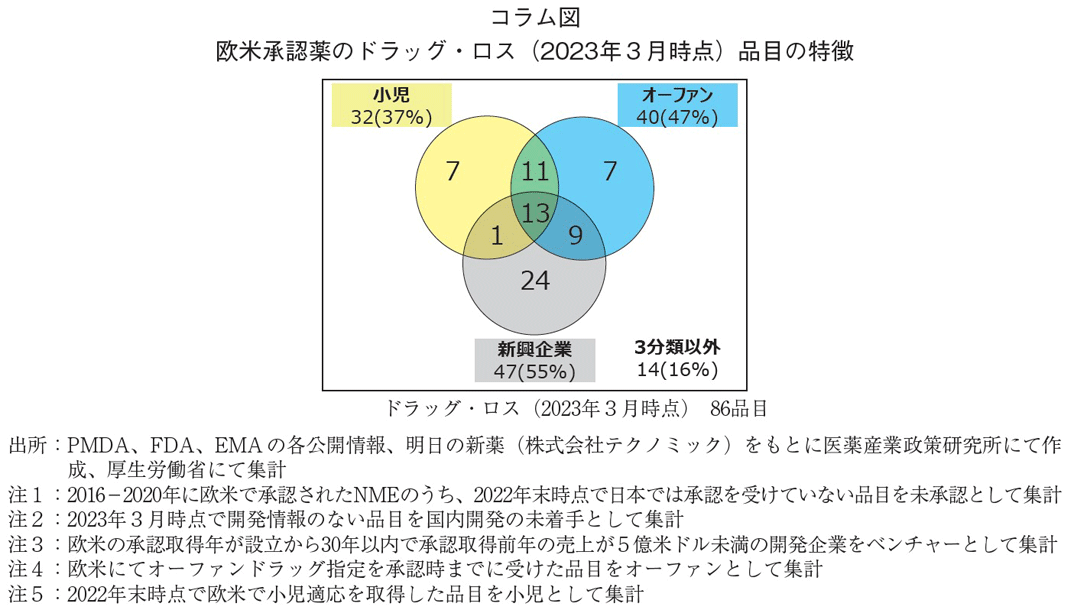
また、2016-2020年に欧米で承認された品目のうち、2020年末時点に日本で承認された品目は、未承認薬としていないが1~5)、この中にはドラッグ・ラグとなる品目も含まれる可能性がある。たとえば、2016年に欧米で承認され、日本は2020年に承認された品目は4年のドラッグ・ラグとなる。医薬産業政策研究所にて調査・分析している日本未承認薬の推移は、主にドラッグ・ロスの課題を可視化するための分析であることから、ドラッグ・ラグ、ドラッグ・ロスの分析には、このデータ特性に留意する必要がある。
3.結果
3-1. 小児適応を持つ米国オーファンドラック品目のドラッグ・ロス
2010年から2021年の間、米国にてオーファンドラッグ指定を受けて承認された新規有効成分は215品目であった。このうち、2022年8月末時点で国内未承認の品目は110品目(51%)に上った(図1)。
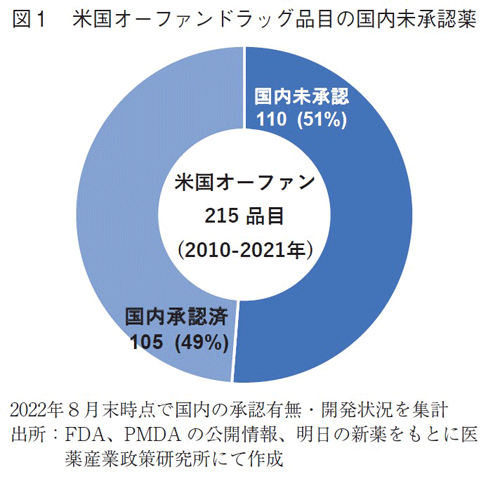
なお、国内承認済の105品目については、米国・日本における小児適応の確認には至っておらず、米国で小児適応があっても日本で小児適応がない品目が含まれている可能性は残っている。そのような品目は日本では適用外薬として小児への使用はできない問題となる。本稿ではこれらの包括的な調査結果に至っていないものの、次稿では小児の抗がん剤にて現状分析しており、併せてご参照頂きたい。
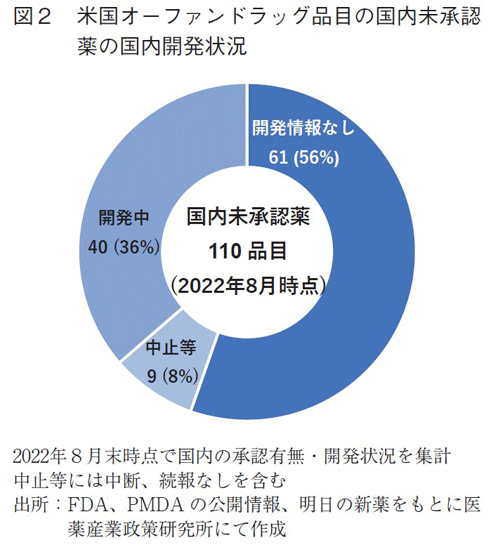
国内未承認の110品目の国内開発状況をみると、開発中は40品目(36%)であったものの、61品目(56%)では国内開発情報は得られなかった(図2)。すなわち、米国にてオーファンドラッグ指定され、承認されたNME215品目のうち、61品目(28%)は、本邦での開発は公開情報によると確認されず、本稿でいうドラッグ・ロス(2022年8月時点)となっていた。
なお、国内開発中に分類された40品目においては、米国にて小児適応を12品目で取得していた(データ省略)。国内開発については、成人・小児の開発の区別は公開されていないため、小児開発の状況は不明であるが、2022年8月末時点では本邦では未承認の状態であることから、初回適応においてドラッグ・ラグは生じている。
また図2の中止等には、開発中止・中断や続報なしの品目も含まれている。これら品目は臨床試験結果や海外での取り下げなどの科学的な判断に基づくものと共に、事業判断に基づくものも含まれている可能性は否定しきれず、ドラッグ・ラグ/ドラッグ・ロスが含まれる可能性があることを付記しておく。
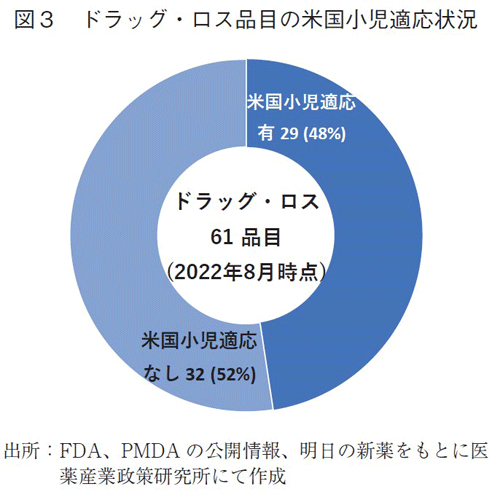
また、国内開発情報が確認されなかった61品目について、米国にて小児適応が取得されているか、調査したところ、61品目中29品目(48%)とほぼ半数で小児適応を有していることが確認された(図3)。なお、小児適応なしの32品目は、感染症・熱帯病12品目、がん8品目、診断薬5品目が含まれていた(データ省略)。
すなわち、米国でオーファンドラッグ指定を受けて承認された新規有効成分のうち、29品目は米国で小児適応を有していたが、国内開発情報が確認されず、本稿でいうドラッグ・ロス(2022年8月末時点)であることが判明した。
3-2. 小児ドラッグ・ロス品目の特徴
さらに、米国にてオーファンドラッグ指定を受けて承認された新規有効成分のうち、国内で開発情報が確認されず、かつ米国で小児適応を得ている29品目について、適応疾患の特徴をみるため、本邦での指定難病7)あるいは小児慢性特定疾病8)の指定対象に該当する疾患であるか、米国での適応疾患の記載を確認した(図4)。
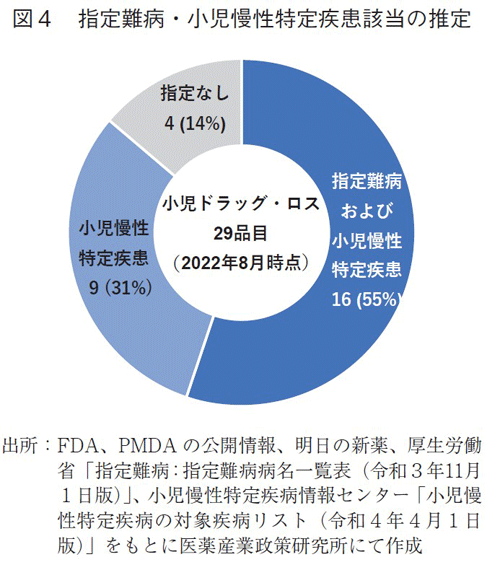
29品目のうち、指定難病および小児慢性特定疾患の対象となるものは16品目(55%)、小児慢性特定疾患のみの対象となっているものは9品目(31%)であった。小児慢性特定疾患の対象は合計25品目(86%)に上り、医療ニーズの高い疾患に対する品目において、本稿でいうドラッグ・ロス(2022年8月末時点)があることが示された。
ドラッグ・ロス(2022年8月末時点)となっている要因に迫るため、これらの29品目について、米国でのFDA申請企業を開発担い手として調査した。
29品目のうち15品目(52%)は新興企業、14品目(48%)は製薬企業であり(図5)、ほぼ半々であった。小児慢性特定疾患対象の25品目に絞って企業分類をみても、新興企業13品目、製薬企業12品目で同様にほぼ半々の割合であった(データ省略)。
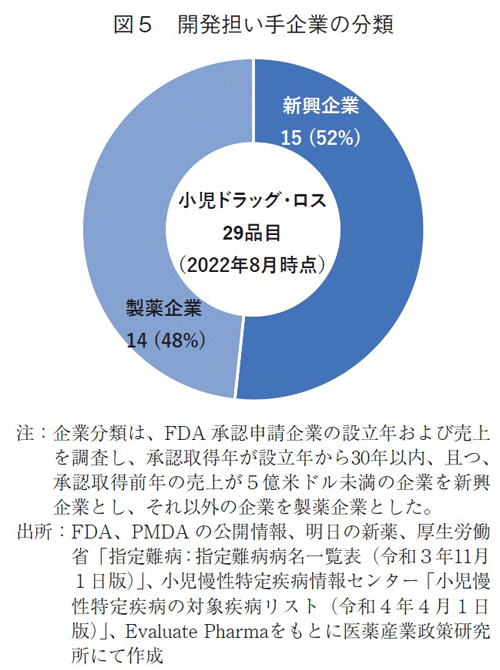
欧米承認品目で国内未承認薬増加の要因として開発担い手に新興企業が多いことを既に報告しているが1~5)、その結果と同様に、小児適応のドラッグ・ロス品目(2022年8月時点)においても新興企業の品目は多かった。その一方、半数は製薬企業品目であったことから、本邦の小児ドラッグ・ロスに特有な課題があることが推察された。
29品目についてその適応となる疾患を表1にまとめた。小児特定慢性疾患の指定がある品目の主な疾患分類は、遺伝性疾患であり、14疾患、21品目であった。次いで希少がんで3品目あった。
小児特定慢性疾患の指定がないものでは、感染症・熱帯病の適応で2疾患、3品目、とその他の疾患適応で1品目であった。

4. まとめと考察
2010年から2021年に米国でオーファンドラッグ指定を受けて承認された品目215品のうち、小児適応を有するが、本邦で開発情報が確認されなかった、本稿でいうドラッグ・ロス(2022年8月時点)は、29品目に上った。本邦での指定難病あるいは小児慢性特定疾病に該当するか、確認したところ、29品目中25品目では対象となっており、本邦で必要とされている疾患領域で小児適応が期待される薬剤のドラッグ・ロス(2022年8月時点)が起こっていることが示された。
29品目の疾病では、遺伝性疾患が大半を占めていた。遺伝性疾患では、先天性疾患の原因遺伝子の解明、治療モダリティーの拡大に伴い、米国における新薬の開発が進展したことにより、薬剤が増えてきたことが想定される9)。米国においてこれら薬剤の開発が急速に進展した要因についてはさらなる調査研究が必要であろう。
希少疾患や小児適応においては、一般的に市場の規模は極めて小さいものの、追加的な研究開発投資が必要のため、経済合理性は成り立たない事業領域と考えられる。グローバルにおいてこの効率性の追求がなされているものと思われるが、遺伝性疾患においては、遺伝子変異などの発生頻度に民族差があることも想定され、本邦における対象患者が諸外国に比べて少ないことも想像に難くなく、本邦においては、より収益性の確保が難しい可能性が高い。また、希少疾患の小児ドラッグ・ロス品目(2022年8月時点)の半数は新興企業品目で、近年の未承認薬増加における動向1~5)と同様であったことから、本邦の市場性や研究開発環境の課題が想定される。さらに小児ドラッグ・ロス品目(2022年8月時点)では製薬企業品目も半数あり、小児適応に特有の課題も想定された。本邦の政策においても、難病・希少疾患や小児適応における医薬品開発の重要性を鑑み、「希少疾病用医薬品指定制度」や「特定用途医薬品指定制度」により、希少疾病や小児用医薬品開発を後押ししている7、8)。しかしながら、欧米に比べてオーファン指定の増加が少ないなど10)、近年の急速な科学の進展や医薬品開発の環境変化に呼応した支援策となっていない可能性もあり、現状の課題分析を踏まえた、制度設計が期待されるところである。希少疾患であっても、本邦での最新医薬へのアクセスを確保するためには、日本における研究開発投資が必要と考えられる。このような希少疾患領域においては、投資効率化のためにもグローバルで同時開発がより一層重要となるとともに、収益性を確保できない希少性の際には、個別企業の事業ではなく、国の医療政策としての小児用の医薬品開発も視野に入れた政策が必要であろう。
この課題の要因については、抗がん剤の小児適用品目を取り上げ、次報の東らによる「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴その2 -抗がん剤-」6)においても考察しており、併せてご参照頂きたい。
本邦のドラッグ・ラグ、ドラッグ・ロスは、最新薬剤を待ち望む患者さんをはじめ、ご家族、医療関係者、すべての関係者にとっても解決が期待される課題である。その課題の要因は複雑かつ多岐に渡ることが想定されるため、解決には個々の制度の改善といった、これまでの延長性上ではなく、製薬産業・医療機関にとっては事業モデルからの変革、薬事規制当局・政策当局にとっても新たな法整備や支援体制・支援策など変革の大きな一歩を踏み出すことが必要であろう。
-
1)医薬産業政策研究所「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュースNo.63(2021年7月)
-
2)医薬産業政策研究所「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」政策研ニュースNo.66(2022年7月)
-
3)医薬産業政策研究所「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」政策研ニュースNo.66(2022年7月)
-
4)医薬産業政策研究所「ドラッグ・ラグ:日本と欧州の未承認薬状況の比較」政策研ニュースNo.67(2022年11月)
-
5)医薬産業政策研究所「新薬の国際普及の計量分析:米国承認新薬の日欧承認に注目して」政策研ニュースNo.67(2022年11月)
-
6)医薬産業政策研究所「ドラッグ・ラグ:小児適応を持つ日本未承認薬の特徴その2 -抗がん剤-」政策研ニュースNo.69(2023年7月)
-
7)
-
8)
-
9)Regulators adopt more orphan drugs, Nature 508, 16-17, 2014
-
10)Matched analysis on orphan drug designations and approvals: cross regional analysis in the United States, the European Union, and Japan, Drug Discovery Today, 21, 544-549, 2016

