目で見る製薬産業 日本で承認された新医薬品とその審査期間 -2022年承認実績と経年動向調査-
医薬産業政策研究所 主任研究員 東 宏
医薬産業政策研究所では、規制当局の公表情報をもとに、医薬品の承認情報および審査期間に関して継続的に収集、分析している1、2、3)。今回のニュースでは、2022年1~12月に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。さらに、経年動向調査から見えた2022年のトピックスを併せて報告する。
調査方法
調査の対象は、独立行政法人医薬品医療機器総合機構(PMDA)のホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とした。品目は審査報告書毎にカウントすることを基本とし、学会等からの要望により同一成分の品目を複数の企業が同時に公知申請したような場合や併用薬物療法等にて複数成分が承認されたものは1つの品目として集計した。各品目の承認情報は、審査報告書、新医薬品の承認品目一覧、添付文書および薬務公報から抽出した。解析には、標準的な統計解析ソフトStata/IC 14.0 for Windows(StataCorp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
新医薬品の承認品目数とその内訳
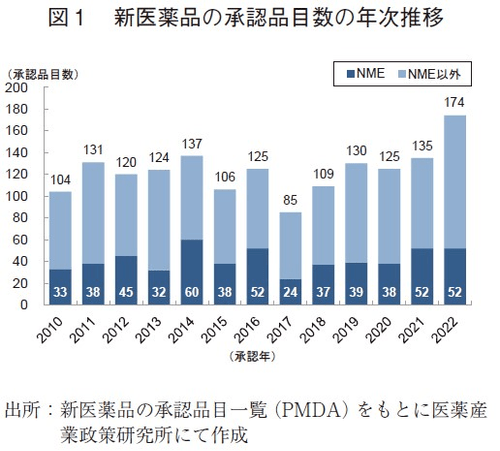
2010~2022年の間に日本で承認された新医薬品の承認品目数の年次推移を図1に示した。日本で2022年に承認された新医薬品の品目数は174品目で、2021年より39品目増加した。これは、2010~2021年の平均承認品目数(119品目)より多く、2010年以降で最多品目数となった。そのうち、新有効成分含有医薬品(NME: New Molecular Entity)は52品目が承認され、2021年と同数であった。NMEの承認品目数は、2000年以降で2014年に次ぎ、過去2番目に多い数であった。
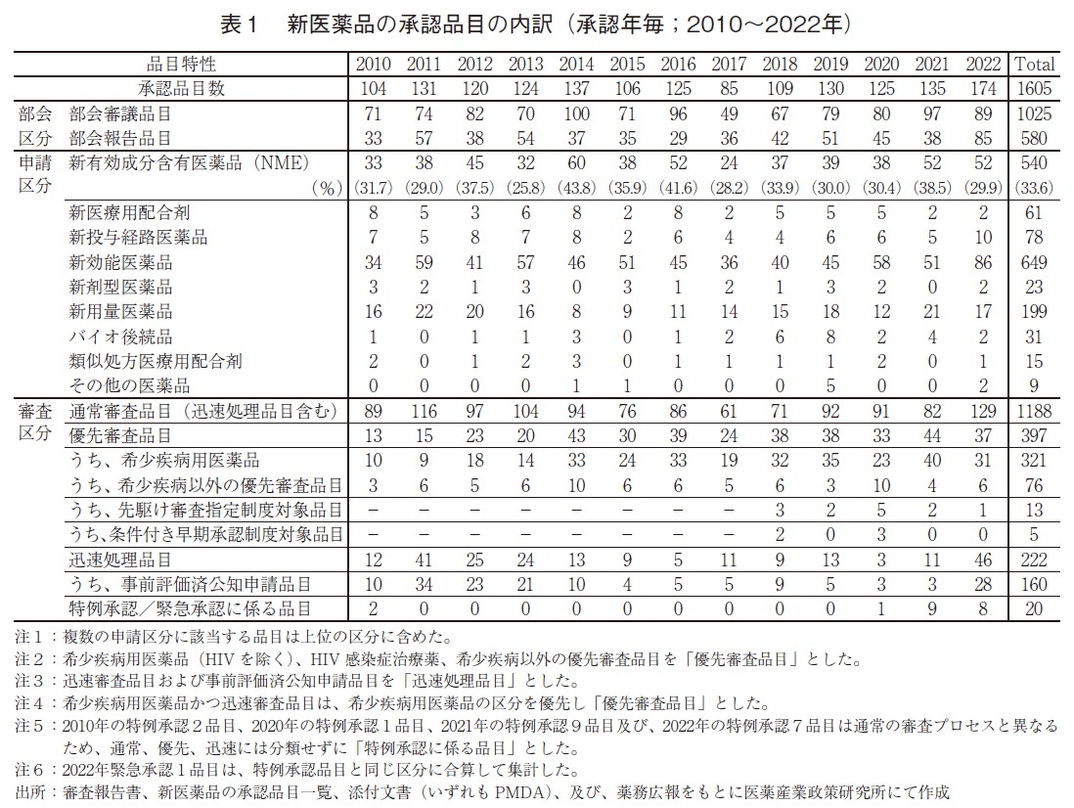
続いて、承認品目の内訳を表1に示した。申請区分別の内訳では、新効能医薬品が86品目と2021年と比較し35品目増加し、その他新投与経路医薬品が10品目で、2021年比で5品目増加した。一方で、新用量医薬品が17品目で2021年と比較し4品目減少した。
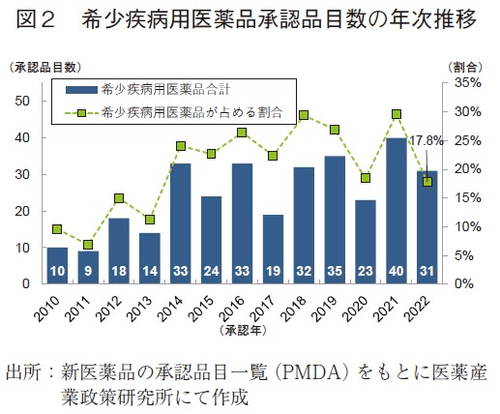
審査区分別の内訳では、通常審査品目が129品目、優先審査品目は37品目であった。優先審査品目が全承認品目に占める割合は21%であり、2014年以降で最も低い水準であった。また、優先審査品目のうち、希少疾病用医薬品は31品目と、2021年と比較して9品目減少した。希少疾病用医薬品は2014年以降増加し、2021年に最多40品目であったが、2022年は2020年以前と同水準となった(図2)。先駆け審査指定制度対象品目(現在は先駆的医薬品指定制度)の2022年承認数については、2021年から1品目減少した1品目であった5)。また、「新型コロナウイルス(SARS-CoV-2)による感染症または感染症の予防」を効能・効果として7品目が特例承認を受け、さらに2022年に新たに制定された緊急承認の区分で1品目が承認を受けた。加えて、迅速処理品目が2022年に46品目と、2021年から35品目増加しているが、これは2022年4月より不妊治療薬が保険適用となり、公知申請品目の増加が主因であった。詳細は考察の項で触れる。
新医薬品の審査期間
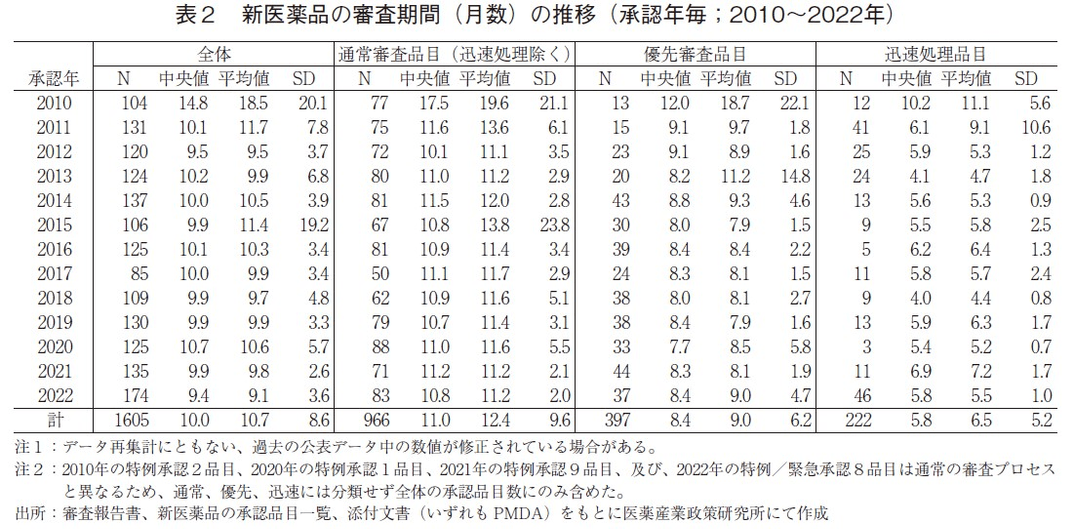
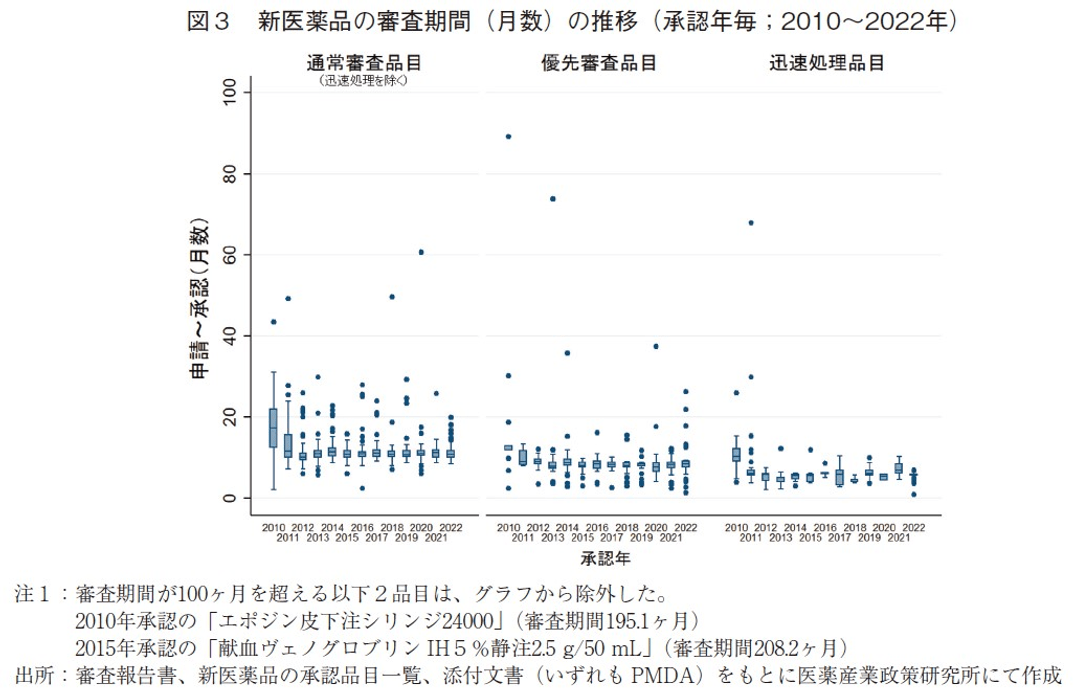
2010~2022年に承認された新医薬品の審査期間の推移を表2および図3に示した。2022年に承認され、全174品目の中央値は9.4ヶ月と、2021年より0.5ヶ月短く、審査期間が大幅に短縮した2011年以降は10ヶ月前後で推移している中、最も短い中央値を示した。
次に審査区分別で見ると、審査期間の中央値は迅速処理品目を除いた通常審査品目では10.8ヶ月、優先審査品目では8.4ヶ月であり、2021年と同水準であった。なお、通常審査品目(迅速処理除く)と優先審査品目それぞれの審査期間の80パーセンタイルは、11.9ヶ月、9.2ヶ月であり、目標値6)とされる12ヶ月以内、9ヶ月以内に近い値で承認されていることが確認できた。
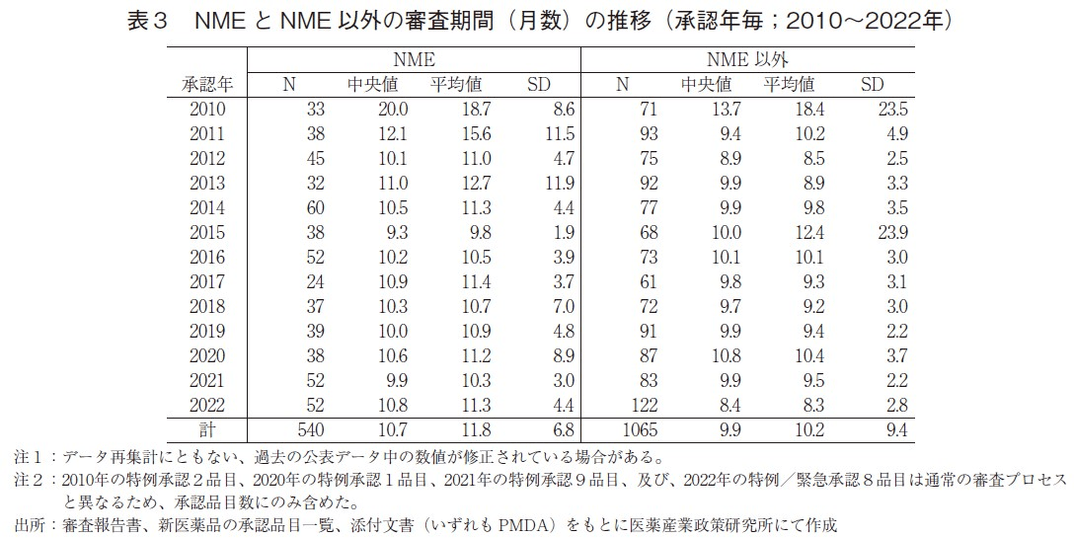
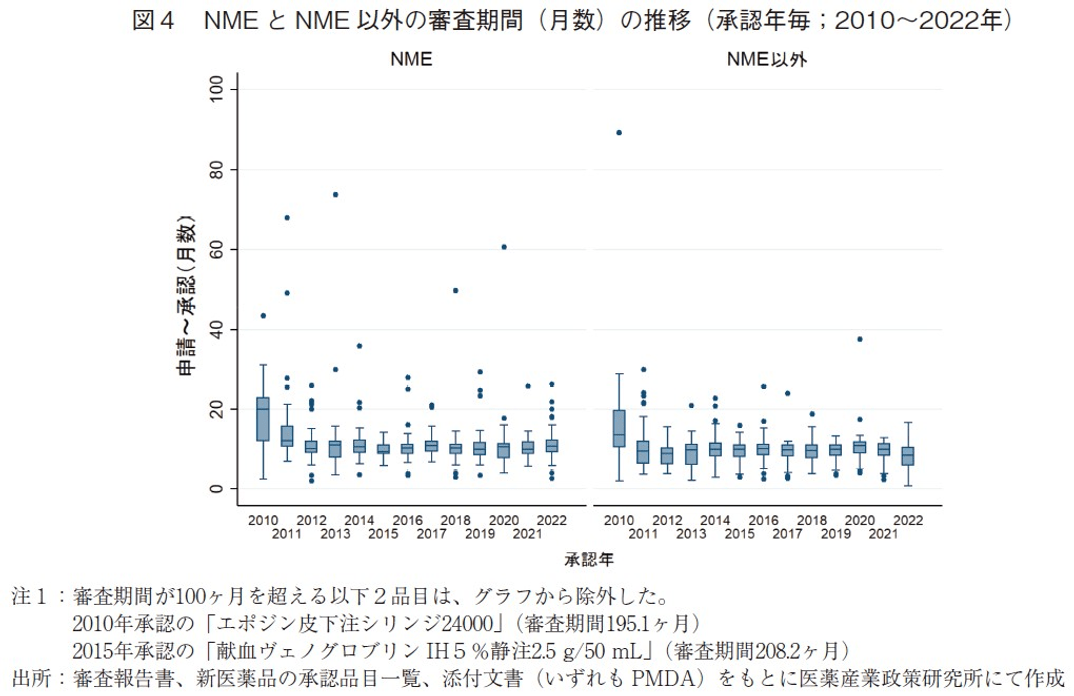
続いて、NMEとNME以外に区分した場合の審査期間の推移について表3および図4に示した。2022年に承認され、NME52品目の審査期間の中央値は10.8ヶ月であり、2021年より0.9ヶ月長かった。一方、NME以外の品目では審査期間の中央値が8.4ヶ月となっており、2021年より1.5ヶ月短く、2010年以降で最も短い審査期間であった。
特例承認および緊急承認に係る品目の承認とその審査期間
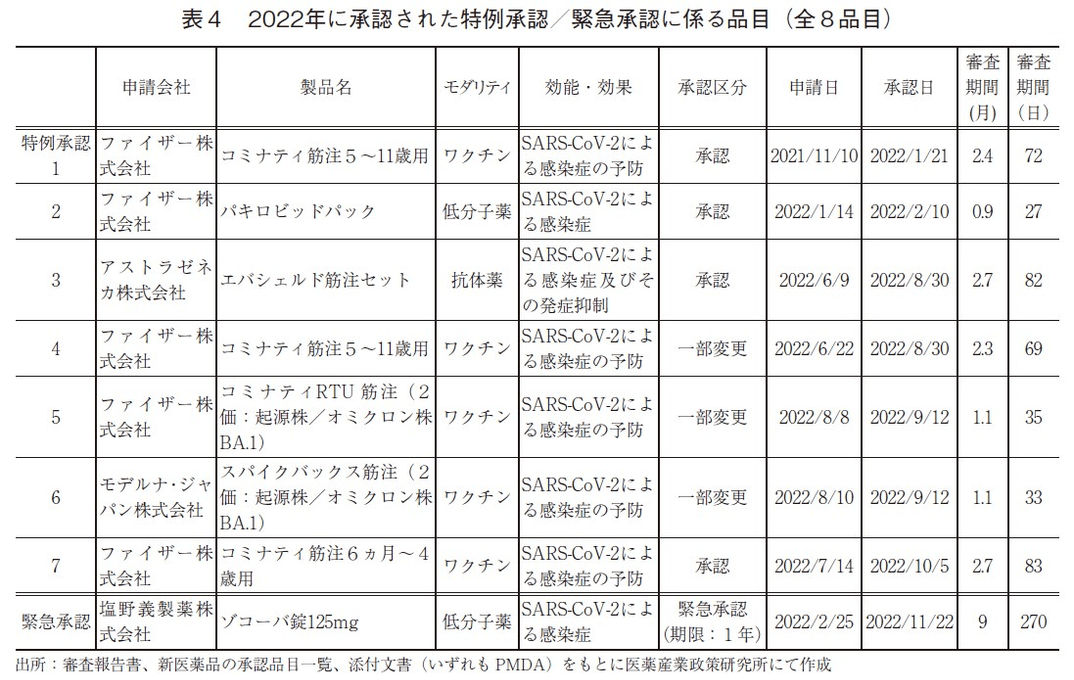
2022年に承認された特例承認および緊急承認に係る品目を表4に示した。2019年12月31日より世界的に流行が始まった新型コロナウイルス感染症(COVID-19)に対する医薬品として、「新型コロナウイルス(SARS-CoV-2)による感染症の予防、感染症及びその発症抑制」を効能・効果とし、2022年新たに7品目が特例承認された。そのうち、2品目がNMEであった。モダリティ別ではワクチンが5品目、低分子薬と抗体薬がそれぞれ1品目であった。全7品目の審査期間の中央値は69.0日(2.3ヶ月)、平均値は57.3日(1.9ヶ月)、ばらつき(標準偏差:SD)は24.6日(0.8ヶ月)であった。なお、COVID-19対応としては、2021年までの10品目を含め、これまで17品目が特例承認を受けた。
また2022年には、緊急時の薬事承認に関して、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(いわゆる薬機法)の一部改正が行われ、緊急承認制度が設けられた。この区分で新たに低分子薬1品目が緊急承認(期限1年)を受け、審査期間は9.0ヶ月、270日であった。
新有効成分含有医薬品(NME)に関する分析
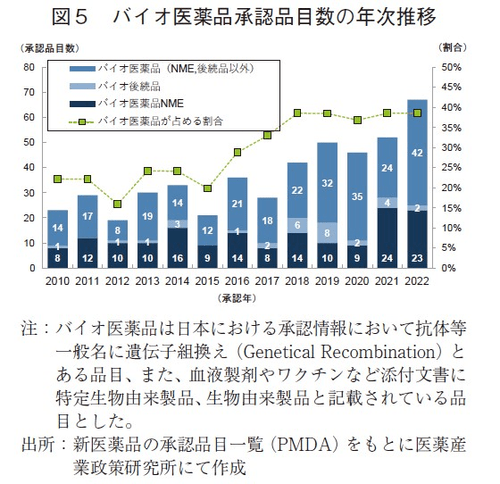
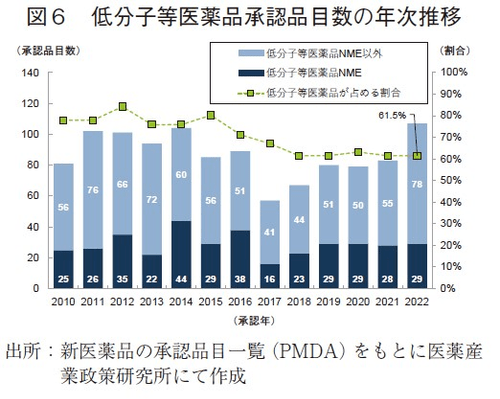
まず、2010~2022年に承認された新医薬品に関して、モダリティ区分ごと、バイオ医薬品(図5)と低分子等医薬品(図6)にてNME該非等の経年分析を行った。2022年に承認された全174品目のうち、バイオ医薬品の承認品目数は67品目であり、2010年以降で最も多かった。その内訳は、NMEが23品目、バイオ後続品が2品目、それら以外(新効能医薬品等)が42品目であった。また、バイオ医薬品承認品目数が全承認品目数に占める割合を経年で調査したところ、2018年以降は37~39%と横這いの水準となっていた。一方、低分子等医薬品について、2022年の承認品目数は107品目であり、2017年以降は上昇傾向がみられ、2015年以降で最多数となった。その内訳はNMEが29品目、NME以外が78品目であった。
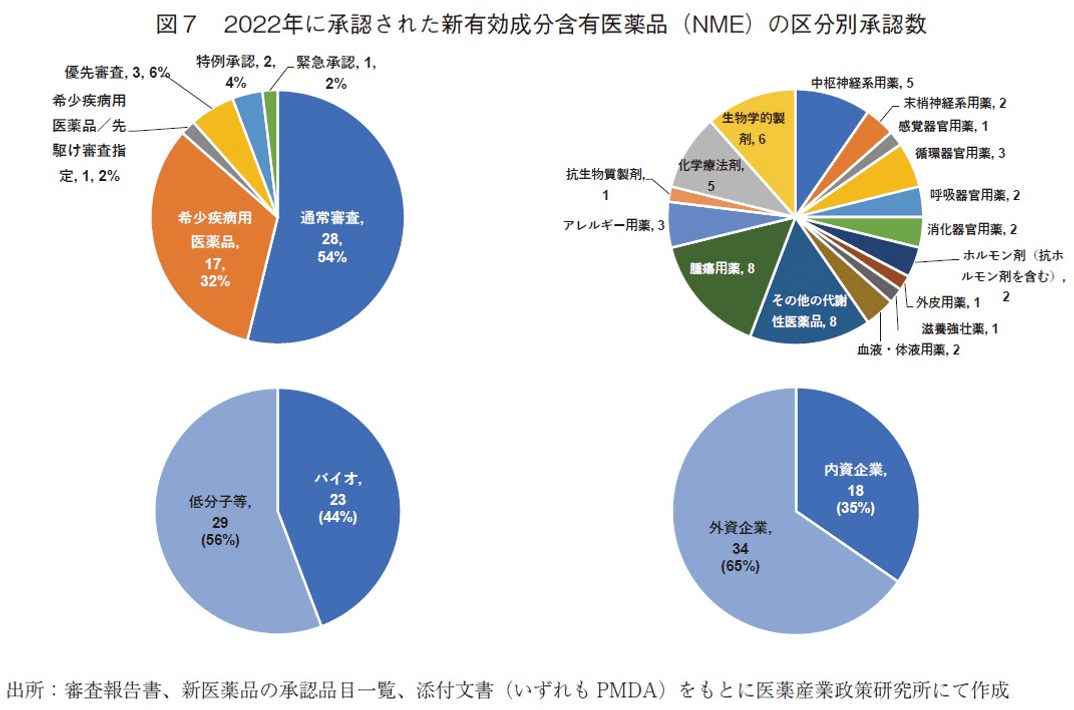
次に2022年に承認されたNMEの内訳に関して調査した(図7)。NMEの審査区分では、通常審査品目が28品目(54%)、希少疾病用医薬品(優先審査品目含む)が17品目(32%)、先駆け審査指定品目(優先審査品目、希少疾病用医薬品含む)が1品目(2%)、希少疾病用医薬品以外の優先審査品目が3品目(6%)、特例承認に係る品目が2品目(4%)、緊急承認に係る品目が1品目(2%)であった。続いて、薬効分類別7)では、腫瘍用薬とその他の代謝性医薬品が最も多く8品目と各々15%を占めた。続いて、生物学的製剤が6品目、化学療法剤と中枢神経系用薬が5品目、アレルギー用薬と循環器官用薬が3品目の順で多く承認された。さらに、バイオ医薬品8)と低分子等医薬品9)にNMEを区分した。2022年承認のバイオ医薬品のNMEは23品目であり、全NMEの44%を占めた。2021年と比べ1品目減少したが、品目数および全NMEに占める割合は、2010年以降で2021年に次ぐ2番目に多い割合であった。一方、低分子等医薬品のNMEは29品目承認されており、2021年と比べ1品目増加し、2019年来同程度の承認数であった。NMEの申請企業を内外資企業別に見ると10)、内資企業のNMEは18品目(35%)、外資企業のNMEは34品目(65%)であった。内資企業のNME割合は2017年以来2、11)の低い水準であった。
新再生医療等製品の承認品目とその審査期間
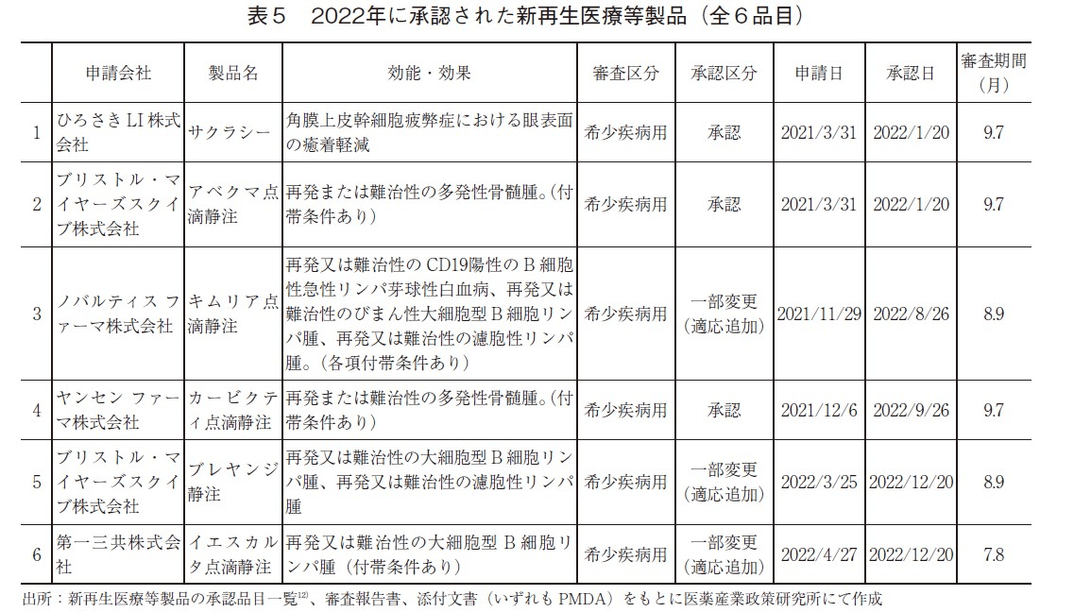
ここからは新再生医療等製品の承認品目とその審査期間について紹介する(表5)。2022年、新再生医療等製品として新たに6品目が承認され、年間の承認数としては過去最多であった。また、全品目が希少疾病用再生医療等製品として承認された。2022年に承認された新再生医療等製品の審査期間については、審査期間中央値が9.3ヶ月(平均値9.1ヶ月、標準偏差0.8ヶ月)であった。
また、再生医療等製品における審査期間の目標値6)として優先品目では全品目の50%を9ヶ月以内に処理とされており、目標に近い期間で承認されていることが確認できた。
考察とまとめ
本稿では2022年に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。
2022年に承認された医薬品は174品目であり、これは弊所調査期間1、2)の2000年以降で最多品目数である。特に部会報告品目が85品目、審査区分では迅速処理品目が46品目、申請区分では新効能医薬品が86品目と目を引く。前年比で各々47、35、35品目増であり、2022年における特徴的項目と捉えられる。例年との大きな違いに、2022年4月より不妊治療薬が保険適用となった事象が主因として挙げられる。厚生労働省のwebページ13)も参照頂きたいが、2020年5月に閣議決定された少子化社会対策大綱に端を発し、社会保障審議会医療保険部会や関連疾病学会、各製薬企業の機敏な対応により、公知申請品目として多く承認された点にある。実際に2022年8月までに32品目が本件関連で承認を受けており、施行から時を待つことなく迅速な承認がされ、不妊に悩む方々へ適時にアプローチできたものと考える。これにより日本の重要課題である少子高齢化に歯止めをかける一助となることを期待する。
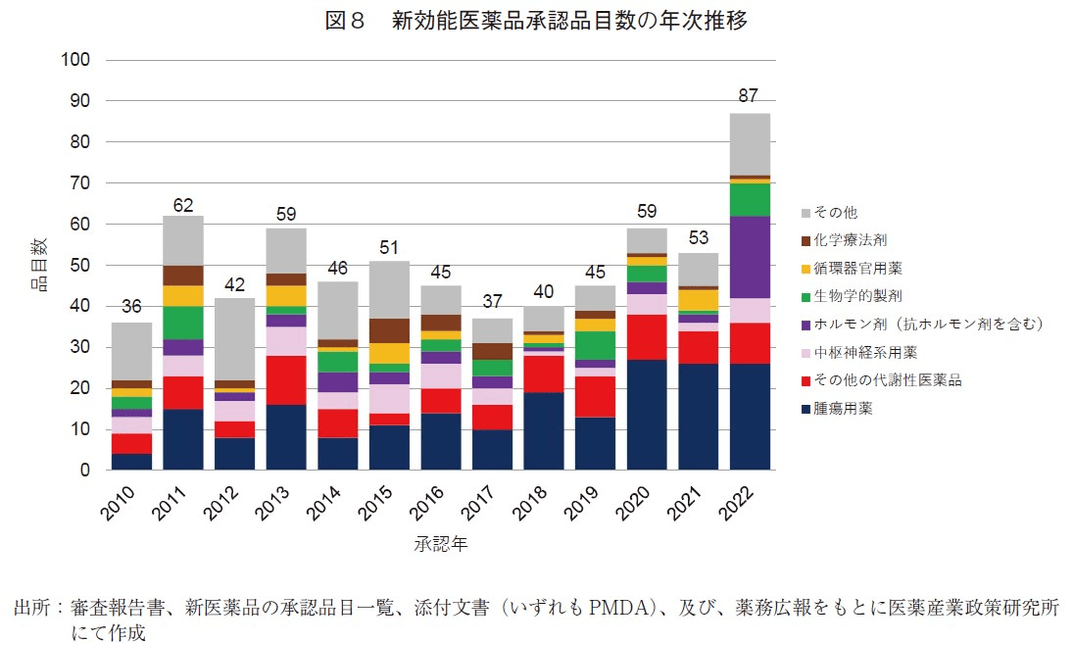
また、適応拡大等の承認である新効能医薬品についてみると(図8)、承認品目数は2017年以降で概ね増加傾向がみられた。薬効分類別では腫瘍用薬が最も多く2010年以降の全承認品目数の30%(197品目)を占める。次いで全期間ではその他の代謝性医薬品、中枢神経用薬と続き、2022年は上述の不妊治療における保険適用も相まってホルモン剤が目立っている。腫瘍用薬の最多要因としては、がん領域の次世代シーケンサーによる原因遺伝子の特定加速、バスケット型治験による単一薬剤の複数疾病への効果検証、あるいはアンブレラ型治験による複数薬剤の単一疾病への効果検証等により、結果、様々な医薬品が様々ながん種へ適応拡大が試みられたものと考えられる。特にPD-1/PD-L1抗体といった免疫チェックポイント阻害剤に関する併用療法等を含む種々の治験が近年進んでいることも大きく影響していると考える。14)
2022年に承認された新医薬品の審査期間に関しては、その中央値は9.4ヶ月と審査期間が大幅に短縮した。その要因としてはNME以外の品目(中央値8.4ヶ月)、特に公知申請による迅速処理品目の多さが大きく影響したと考察するが、一方で全承認品目数にて過去最多であったことを踏まえると、審査当局と製薬業界の巧みな連携と対応が奏功した結果であると考えられる。
特例承認に係る品目の承認とその審査期間に関しては、近年はCOVID-19への対応として非常に意義ある項目となっており、2022年承認分で中央値2.3ヶ月と極めて短期間で審査され、承認されていることを確認できた。ウイルスの変異株出現率を鑑みると、現状の迅速な対応を今後も維持することは大変重要である。加えて、2022年には薬機法の一部改正が行われ、緊急承認制度が施行された。改めて以下に触れることとする。
改正の趣旨は、緊急時において、安全性の確認を前提に、医薬品等の有効性が推定されたときに、条件や期限付の承認を与える迅速な薬事承認の仕組みである。また、外国の承認状況に依らず承認が与えるものとなっている点も重要である。2022年には新型コロナウイルス感染症治療薬「ゾコーバ錠」が本制度初の適用となったが、まずは承認事例を経験した意味で意義深いと考える。併せて、より良い制度へ向けて運用改善や適用要件の適性などの議論が開始されていることから、国民の健康に対するセーフティネットとして臨機応変かつ適切な制度となるよう期待したい。

新有効成分含有医薬品(NME)に関する分析に関して、モダリティ別で分析し、バイオ医薬品と低分子等医薬品の推移を確認した。品目数は共に増加したが、割合としては例年並みであることが確認できた。バイオ医薬品において、非NMEかつ非バイオ後続品が前年比で15品目増加しているが、全39品目中、不妊治療用ホルモン剤が6品目と一定の寄与はあるものの、腫瘍用剤の新効能および新用量で19品目とほぼ半数を占めていたことから、がん領域のバイオ医薬品における位置づけは大きいものと考察する。
新再生医療等製品の承認品目とその審査期間に関しては、過去最多である6品目の承認が確認できた。これは正にモダリティの多様化の一端と捉えられよう。2022年の承認品目はキメラ抗原受容体T細胞療法(CAR-T細胞療法)に代表されるヒト細胞加工製品であり、医薬品の高度技術化が経年で増えていることは非常に意義深いものと考えられる。
これまで、2022年の承認品目とその審査期間調査、2010年からの経年動向からみた2022年の特徴的な事象を報告した。COVID-19と共生し、「Withコロナ時代」を生き抜く上でも医薬品が社会にもたらす影響度は今後増すものと考える。産官学全てのステークホルダーが科学技術の進展を通じてイノベーションを生みだし、患者さんとそのご家族に健康と安心の面で貢献してゆくことに期待する。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年 11月)
-
2)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間 -2021年承認実績と日本市場のグローバル化の現状-」政策研ニュース No.65(2022年3月)
-
3)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較-バイオ医薬品の承認状況も踏まえて-」政策研ニュース No.67(2022年11月)
-
4)
-
5)2022年は先駆け審査指定制度対象品目(申請区分)として、ゼンフォザイム点滴静注用20mgが新有効成分含有医薬品(申請区分)として承認されている。
-
6)
独立行政法人医薬品医療機器総合機構(PMDA)ホームページ
第四期中期目標 Accessed on Jan. 25, 2023 -
7)
-
8)本稿で用いたバイオ医薬品の定義:日本における承認情報において抗体等一般名に遺伝子組換え(Genetical Recombination)とある品目、また、血液製剤やワクチンなど添付文書に特定生物由来製品、生物由来製品と記載されている品目としている。
-
9)本稿で用いた低分子等医薬品の定義:バイオ医薬品と定義されたもの以外を低分子等医薬品としている。
-
10)
-
11)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間-2020年承認実績と過去10年の動向調査-」政策研ニュース No.62(2021年3月)
-
12)
-
13)
-
14)平瀬主税、佐野圭吾、福岡和也「抗悪性腫瘍薬の開発における最近の話題」近畿大医誌 第46巻、1・2号、13~31、2021
-
15)

