Points of View 日本の費用対効果評価制度のこれまでとこれから -日英の比較からの示唆-
医薬産業政策研究所 主任研究員 三浦佑樹
1. はじめに
医薬品の持つ多面的な価値は、新しいモダリティ(以下、新規モダリティ)の登場など様々な形で顕在化されてきている。また、COVID-19感染の拡大に伴い、国民にとって健康と経済をより身近な問題として議論がされ始めた。ワクチンを含む医薬品にフォーカスすると、COVID-19感染拡大に伴う生産性損失の影響などの関心が高まっている。近年、医薬品の価値評価は、本邦の費用対効果評価制度の枠組みでは、有効性・安全性、治療費以外に、仕事への影響や家族・医療者の負担軽減度なども考慮することができるようになってきており、これら医薬品のもつ多面的な要素の影響度を可視化し、また国民の納得を得ることは極めて重要である。しかしながら、これら影響度の可視化には、データ収集の可否や日本人に合わせた指標の開発などいまだに問題もある。
本稿は、本邦の医療技術評価(Health Technology Assessment:HTA)の中で費用対効果評価制度の検討経緯と、分析の枠組みやICER(Incremental cost-effectiveness ratio:増分費用効果比)で捉えきれない要素がどのように検討および評価されてきたかを調査する。本邦と同じような分析手法で医療技術の評価を行い、かつ多くの事例が蓄積されている英国のNICE(National Institutefor Health and Care Excellence:国立保健医療研究所)との比較も行う。費用対効果評価のうち、特に医薬品の多様な価値を正しく評価するために必要なプロセスが現在の費用対効果評価で十分かあるいは拡充が必要となるか考察したい。
2. 日本の費用対効果評価制度
本邦では、2019年4月から費用対効果評価制度の運用が開始された。本制度の運用が開始されるまで、中央社会保険医療協議会(以下、中医協)における検討、施行的導入の結果、有識者の検討結果及び関係業界からの意見等を踏まえ、費用対効果評価専門部会及び合同部会において論点整理及び対応案の検討が行われた1)。その後も中医協費用対効果評価専門部会で継続的な議論がなされ、現在の費用対効果評価制度が運用されている。
本邦の費用対効果評価は、一旦保険収載した後に対象となる品目を選定し、評価結果にもとづいた価格調整を行うことを目的としている点が諸外国と比較して特徴的である。そのため、治療を必要とする患者のアクセス(以下、患者アクセス)を阻害することなく、迅速に保険診療下での医療サービスを提供することができている。価格調整を目的としていることから、その分析手法はICERをもとに算出され、対照技術と比較した際に費用対効果が優れているかどうか等で価格調整が行われる仕組みを取っている。
諸外国のHTAの性格は様々であり、表1のように保険償還の可否の判断材料に用いられているケースと、価格調整に用いられているケースとその国々によって一様ではない。
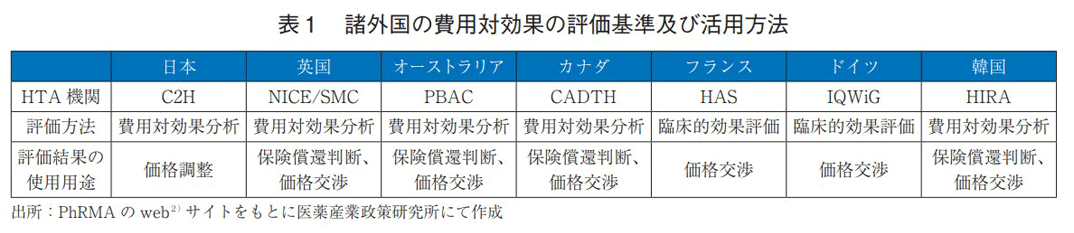
英国NICEを例にすると、QALY(Qualityadjusted life year:質調整生存年)を分析の基本とし3)、ICERを算出する。算出されたICERが定められた費用対効果の閾値(1QALYあたり2~3万ポンド、一部緩和措置もある)の範囲以下であれば費用対効果はよいと判断される。この分析結果は、保険償還の可否の判断に用いられ、2020年3月~2021年12月の期間では抗がん剤を除くと全体の52%(510件/980件)がRecommended(推奨)となり、Not recommended(推奨しない)は、同条件で14%(139件/980件)と報告されている4)。英国では、費用対効果の結果のみを判断材料として用いるわけではなく、終末期の延命による閾値の緩和、不確実性を伴う分析の救済措置など患者アクセスを阻害しないように様々な観点で考慮がされ、ステークホルダー(Clinical expertやPatient expert等)からの意見、アンメットニーズの大きさなどICERに組み込むことのできない要素についても総合的評価の過程で考慮することがある5)。
本邦でも総合的評価について多くの検討がなされており、検討経緯は次項で述べる。
3. 日本の費用対効果評価制度における総合評価(アプレイザル)の検討経緯
試行的導入時の総合的評価は主に、「科学的観点から製造販売業者による分析と公的分析のどちらがより妥当であるか」や「対象品目が抗癌剤等の基準で緩和すべき品目であるか」などを検討していた。そういう点で、NICE等のように文字通り「総合的に」評価するものではなく、評価のスコープとしてはかなり限定的であった6)とされている。
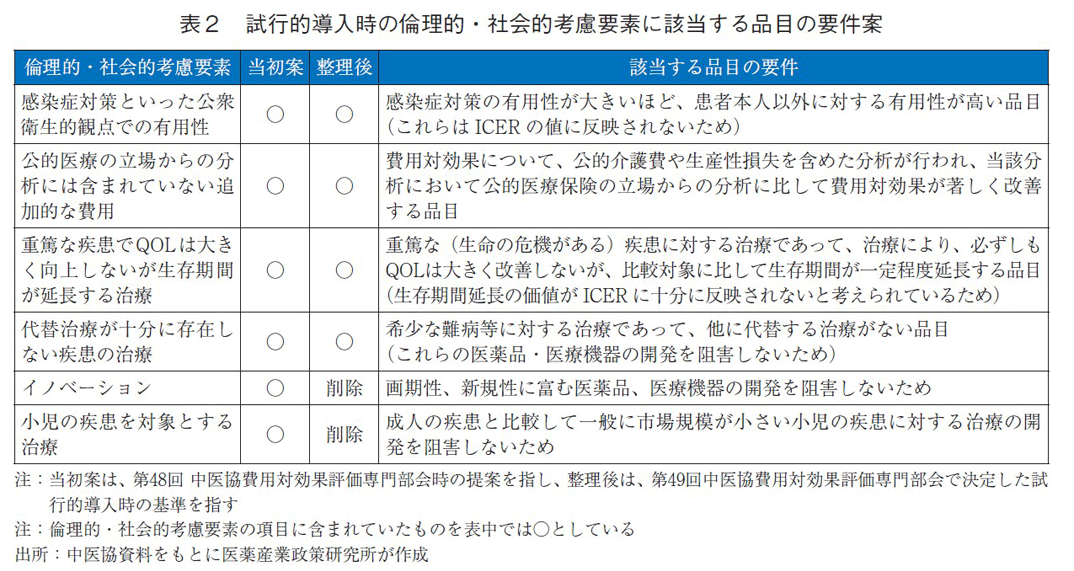
試行的導入の評価に際して、総合的評価の中で、倫理的・社会的考慮要素と該当する品目の要件として、表2が提案された。
第48回中医協費用対効果評価専門部会にて6項目が倫理的・社会的考慮要素として提案がされ、その後に、イノベーション、小児の疾患を対象とする治療の2項目は削除となり、表27)の整理後に示した4項目を総合的評価で考慮する枠組みで試行的導入の評価が行われた。
当初案から整理された項目の削除理由は次の通りである。イノベーションは、薬価算定の段階で既に考慮されていることを踏まえ、項目から外された8)。
小児の疾患を対象とする治療の項目は、数が多くない小児患者の治療機会を奪わないという点から設けられた背景があり、実際、中医協費用対効果評価専門部会における仮想事例によるシミュレーションでも、「ICERが750万円/QALYとなっており、費用対効果が悪い」と判断されたが、「医薬品Aは予後が悪い小児特有疾患Xを対象とした治療薬である」という点を勘案し、「費用対効果評価は受け入れ可能である」と最終評価している。これが典型的な総合的評価における倫理社会的観点からの総合評価であろう。しかしながら、小児疾患は費用対効果評価の対象から外されていることから、アプレイザルの項目に加えなくてもよいのではないかという方向に議論が収斂し、外された経緯がある9)。
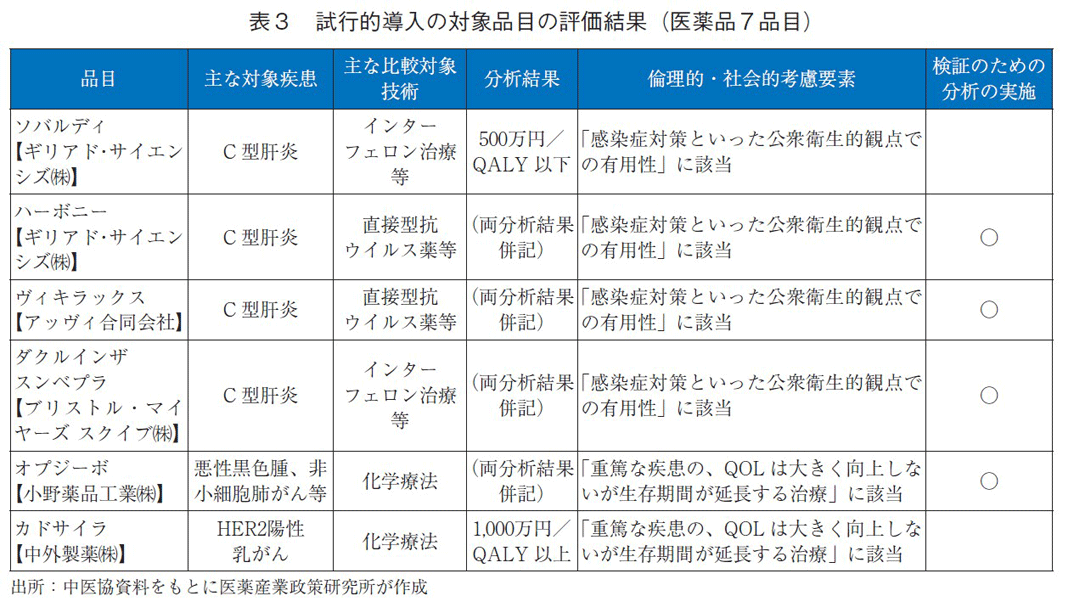
試行的導入時の対象品目となった13品目(医薬品7品目、医療機器6品目)のうち、医薬品の評価結果および、倫理的・社会的考慮要素に該当したかどうかを表3の通り示す10)。
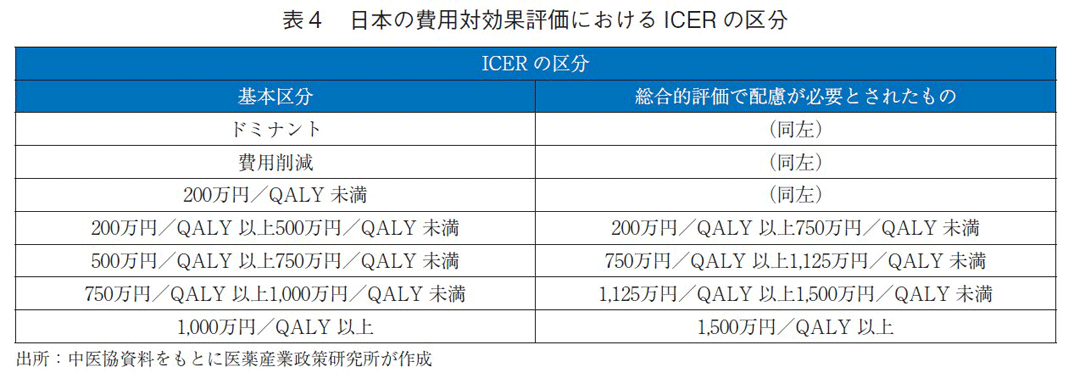
試行的導入の対象となった医薬品7品目の評価結果は表3の通りである。特筆すべき点として、7品目いずれも倫理的・社会的考慮要素に該当し、5品目が感染症対策といった公衆衛生的観点での有用性、2品目が重篤な疾患でQOLは大きく向上しないが生存期間が延長する治療に該当した。7品目のうち、前者に該当した5品目の対象疾患がいずれもC型肝炎の治療薬であり、後者に該当した2品目は抗がん剤であった。この結果は、対象となる疾患が偏っているため、すべての医薬品および費用対効果評価の選定品目に該当するものではないが、ICERに基づいた分析結果と一律の判断基準では費用対効果評価が困難となる事例があるということがわかった。試行的導入の後に抗がん剤等の総合的評価で配慮が必要とされたものは、ICERの基準が基本区分から引き上げられる措置が設けられた(表4)。価格調整時には、ICERの区分に応じて有用性加算等、営業利益率の価格調整係数が該当となる分析対象集団の患者割合等で加重平均したものが用いられる。
表2の「公的医療の立場からの分析には含まれていない追加的な費用」の考慮は、「中央社会保険医療協議会における費用対効果評価の分析ガイドライン」(以下、分析ガイドライン)内で追加分析を行ってもよいとされた。なお、分析に際しては、分析の立場を明記し、それに応じた費用の範囲を決めなければならないともあり、費用や比較対照技術、対象集団などについて公的医療保険制度の範囲で実施する「公的医療の立場」を基本としている。分析の立場と費用の範囲を表5の通り記載する。
前述の通り、日本は公的医療の立場を基本とするため、公的医療費となる医療技術の費用や、入院費用、検査費用、有害事象(Adverse Event:AE)発生時の費用など関連する医療費もすべて含める。公的介護費や家族等による介護費用、生産性損失に関する費用は、価格調整に含めず、分析ガイドライン第2版にて、医療技術にとって重要である場合には、それら分析を行ってもよいとされている。NICEは、基本分析を行う場合は公的医療・介護の立場で分析を行うため、日本における公的介護費の取り扱いに関する検討経緯を記載する。

公的介護費用の取り扱い
公的介護費等について、諸外国における取組みを参考にしながら、引き続き研究班による研究を実施し、その進捗を踏まえつつ、今後検討することとされていた11)。英国では、公的医療・介護の立場をとるが、本邦では公的医療の立場を基本とすると分析ガイドラインでは明記されている。
2019年2月に中医協総会で了承となった分析ガイドライン第2版では、公的介護費用の取り扱いについて、基本分析に含めず、追加的な分析においては、国内の知見に基づき推計された公的介護費を含めてもよいとされている。価格調整には用いないものの、分析結果の公表および事例の蓄積によって今後の仕組みの参考とする位置づけであった12)。
2022年1月に中医協総会で了承となった分析ガイドライン第3版では、公的介護費へ与える影響が、評価対象技術にとって重要である場合には、「公的医療・介護の立場」の分析をおこなってもよい13)との一文は変わらずに追加で、「公的医療・介護の立場」からの分析の場合、実際のデータがあれば家族等の介護者や看護者に与えるQOL値への影響について考慮にいれてもよい旨、追記された。
加えて、昨今の医療保険制度の適正かつ効率的な運営を図るための健康保険法等の一部を改正する法律の成立に伴い、レセプト情報・特定健診等情報データベース(以下、NDB)及び介護保険総合データベース(以下、介護DB)について、各DBの連結解析を可能とするとともに、公益目的での利用促進のため、研究機関等への提供に関する規定の整備が行われた14)。今後、費用対効果評価への活用に期待が高まるものと推察する。
生産性損失の取り扱い
生産性損失の取り扱いに関しても公的介護費と同様の経緯で検討がされていた。分析ガイドライン第2版まで、生産性損失の取り扱いについて、当該疾患によって仕事等ができない結果生じる生産性損失は、基本分析において含めない。追加的な分析においては、より広範な費用を考慮する立場(表5)とし、国内の知見に基づき推計された生産性損失を含めてもよいとされている。価格調整には用いないものの、分析結果の公表および事例の蓄積によって今後の仕組みの参考とする位置づけであった。生産性損失について、諸外国においてもその取扱いは異なっている。英国は、生産性損失を分析結果に加えずに医療技術を評価している。一例を挙げるとNICEの希少疾病を対象とする技術評価ガイダンスで評価されたBylvay(対象疾患:進行性家族性肝内胆汁うっ滞症)の分析に際して、企業側が生産性損失を含んだ費用を提出したものの、NICEから標準手法から外れるとの指摘の後に、生産性損失を抜いた形で再計算を行い、最終的な評価が行われていた。
これら総合的評価の検討経緯を踏まえた上で、分析ガイドライン第2版のもとに行われた費用対効果評価の公的医療以外の立場を取った事例はあったのか、日英間の評価結果から分析に含まれた費用の範囲に違いがあったのか、そして総合的評価の考慮があったのかを調査した。
4. 日本で評価終了となった費用対効果評価対象品目の日英比較による分析
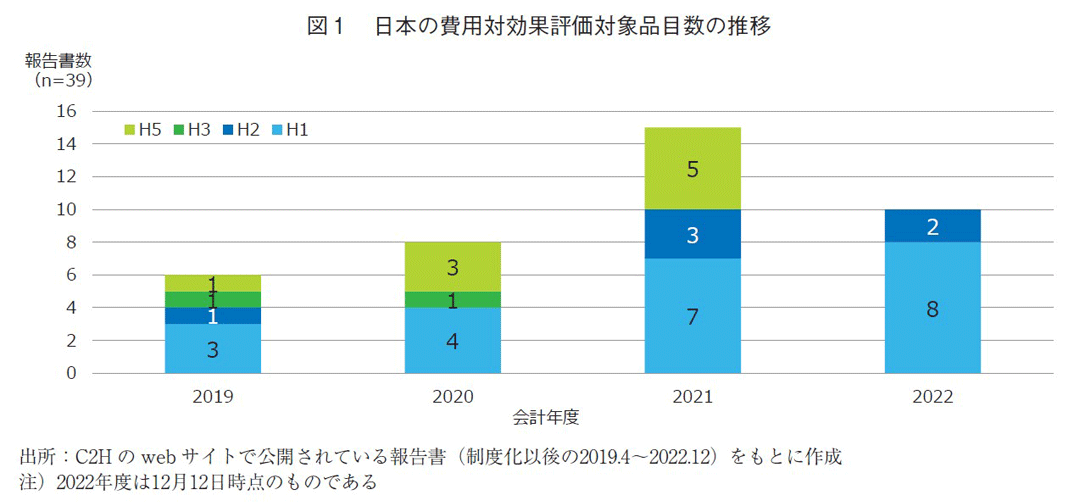
2022年12月時点で国立保健医療科学院 保健医療経済評価研究センター(CORE2 HEALTH:C2H)のwebサイト15)に掲載されている報告書をもとに本制度の対象となった品目区分および経年推移を示した(図1)。
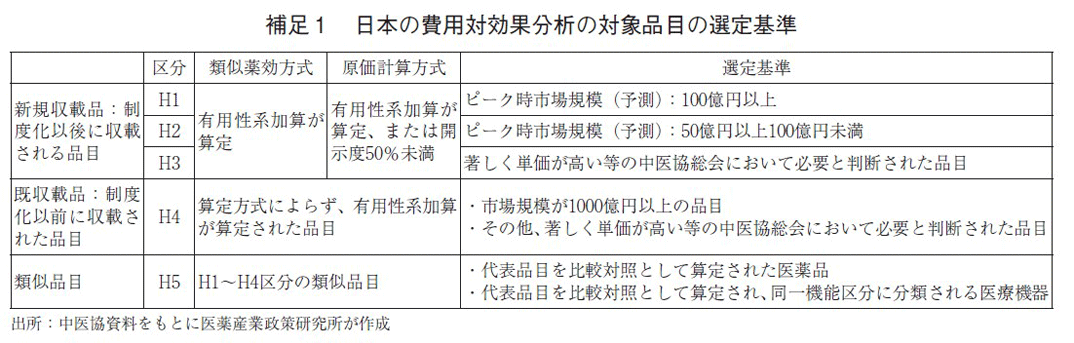
費用対効果評価制度化以降、2019年度では4品目、2020年度は8品目、2021年度は15品目、2022年度は12月12日時点で10品目が対象品目として選定された(図1)。これら品目の区分は、それぞれH1~H5と分類分けされている。これら区分の詳細な分類は巻末の補足1を参照いただきたい。類似薬効方式では、有用性系加算が算定されているもの、原価計算方式では、有用性系加算が算定または、開示度50%未満のもののうち、ピーク時市場規模が100億円以上の品目をH1、50億円以上の品目をH2という区分とし、H1は速やかに評価に取り組むもの、H2は年間の評価可能品目数の上限を目安にピーク時市場規模が高いものから順に評価を実施するとされていた。C2Hの公開情報を見る限り、H2と指定された品目はいずれも評価の実施がなされていた。
費用対効果評価にかかる分析期間は、企業分析が9か月、公的分析が3か月または再分析を行う場合は6か月、専門組織が総合的評価を行う期間が2~3か月程度となっており、合算すると品目選定から1年以上の期間をかけて評価が行われる。日本では、すべての医薬品が費用対効果評価制度の対象となるわけではなく、革新性が高く、財政影響が大きい医薬品・医療機器を対象としている(対象疾患が小児などの例外あり)ため、諸外国と比較すると事例は限定的であることは、分析結果を考察する上で考慮しなければならない。
本調査では、図1のうち、評価ステータスが評価終了となったものを対象とし、「公的医療費の立場」以外の分析の有無や、日英間で分析に含まれた費用あるいは、生産性損失等の取り扱いに違いがあったか調査した。調査対象は、類似品目として掲載されたものを除き、かつC2Hが公開している情報の中に費用、生産性損失に関する情報が載っていたもので、なおかつNICEの評価ガイダンスが公開されているものを対象とした(表6)。
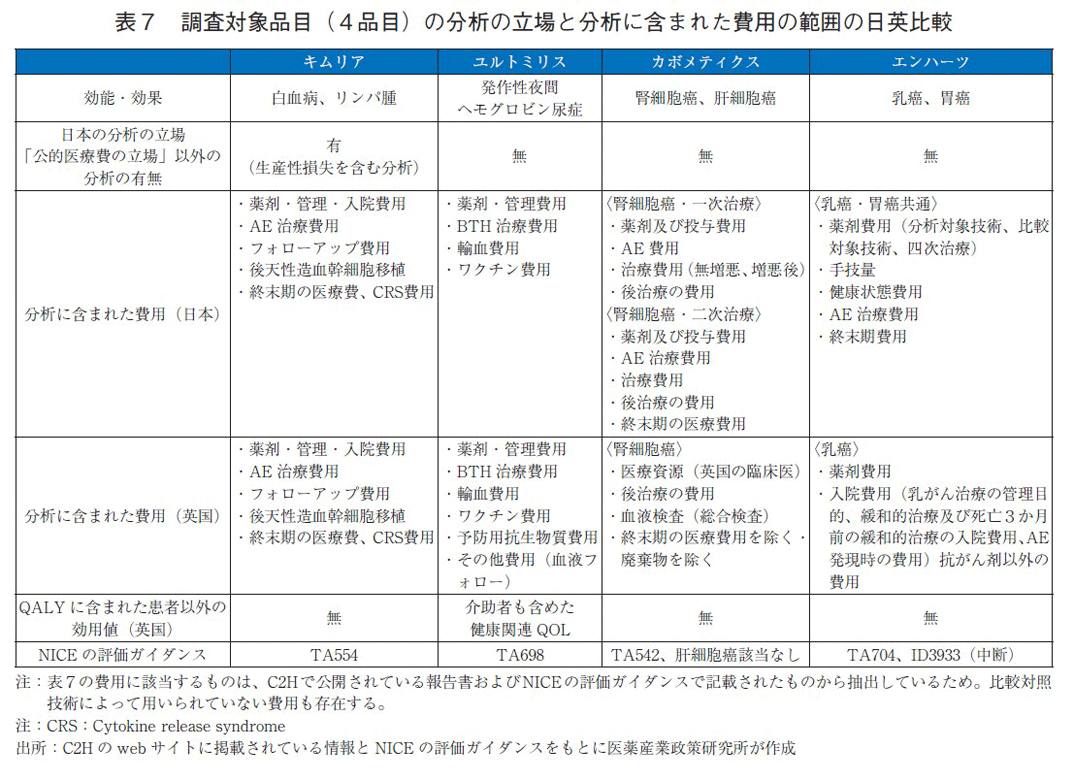
調査対象品目(4品目)は、分析に用いた比較対照技術に応じて、分析に組み込まれた費用が異なるものの、日英(英国は、NICEの結果としている)のいずれも日本の公的医療費に該当する部分のみが費用として分析に含まれているが、英国では介助者のQOLがICERの分母に含まれている品目があることが分かった(表7)。
この結果を踏まえ、日英間の総合的評価の違いを英国NICEの評価ガイダンスをもとに、4品目の総合的評価の内容を確認し、考慮に至った要因があったものを記載した。
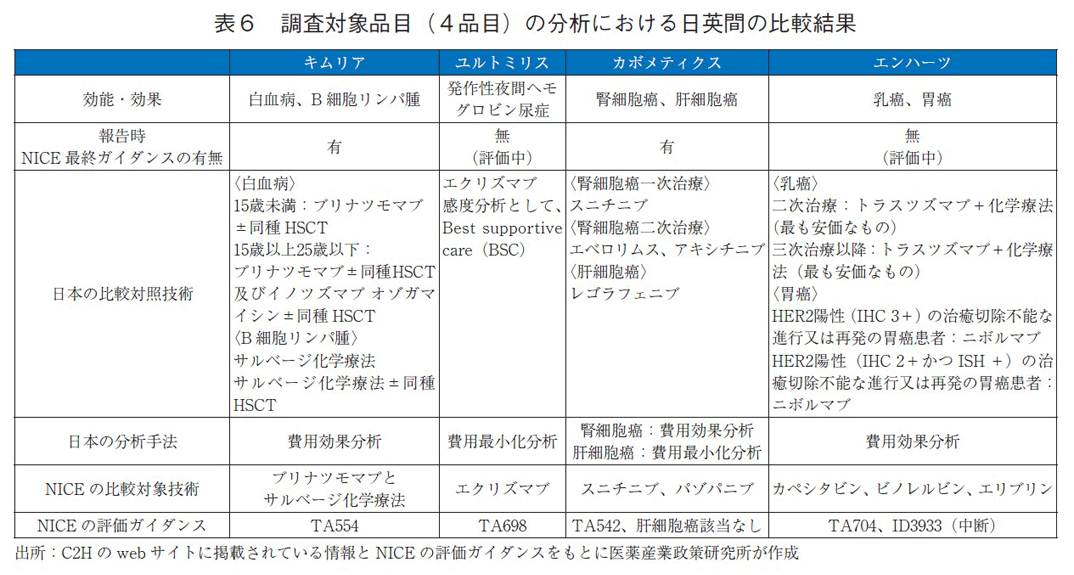
抗がん剤等の配慮が必要となる品目
カボメティクス(一般名:カボザンチニブリンゴ酸塩)は、臨床試験 CABOSUN trialでは認められなかったものの、経済モデルは標準治療(スニチニブ、パゾパニブ)と比較して平均して約6か月寿命を延ばすと推定し、NICEはこれを終末期の考慮事項として考慮16)に加えた。(TA542:未治療の腎細胞癌)日本でもNICEと同様に、通常よりも高い基準(750万円/QALY)が認められている。これは、日本の総合的評価の過程で、抗がん剤等配慮が必要とされる品目であるためだ。費用対効果評価の結果、根治切除不能又は転移性の腎細胞癌の一次治療では、スニチニブを比較対照技術とし、ICERの区分は200万円/QALY以上750万円/QALY未満であった。二次治療以降は、エベロリムス及びアキシチニブを比較対照技術とし、ICERの区分は200万円/QALY以上750万円/QALY未満であった。がん化学療法後に増悪した切除不能な肝細胞癌の二次治療以降では、レゴラフェニブを比較対照技術とし、ICERの区分は費用削減(比較対象技術に対して効果が同等であり、かつ費用が削減)であった。ICER区分に基づいた価格調整係数はいずれも1.0となり、患者割合で加重平均した結果、価格調整において変更なしとなった。
エンハーツ(一般名:トラスツズマブ デルクステカン)は、3か月の生存期間の改善がもっともらしいということで、NICEは終末期の治療の基準を満たしている可能性が高いと結論付けたが、ICERの基準を超えるため、CDF(Cancer Drug Fund:抗がん剤基金)を使用しての条件付き推奨となっている。(TA704)日本でもNICEと同様にエンハーツは抗がん剤であることから通常よりも高い基準(750万円/QALY)が認められている。エンハーツの費用対効果評価結果は、化学療法歴のあるHER2陽性の手術不能又は再発乳癌の三次治療以降では、トラスツズマブ+ビノレルビンを比較対照技術とし、ICERの区分は750万円/QALY以上1,125万円/QALY未満であった。がん化学療法後に増悪したHER2陽性の治癒切除不能な進行・再発の胃癌のうち三次治療の化学療法を実施する、HER2陽性(IHC3+)の患者は、ニボルマブを比較対照技術とし、ICERの区分は1,125万円/QALY以上1,500万円/QALY未満であり、三次治療の化学療法を実施する、HER2陽性(IHC2+かつISH+)の患者を対象とした場合、ニボルマブを比較対照技術とし、ICERの区分は費用増加(比較対象技術に対して効果が同等であり、かつ費用が増加)であった。ICER区分に基づいた価格調整係数は順に0.7、0.4、0.1となり、患者割合で加重平均した結果、2.15%の価格調整となった。
カボメティクスおよびエンハーツは、終末期の治療として認められたため、基準値の引き上げによる措置を受けた。日本でも同様に抗がん剤は、通常よりも高い基準(750万/QALY)を用いている17)ため、これらは日英で同様の考慮を受けていることが分かった。
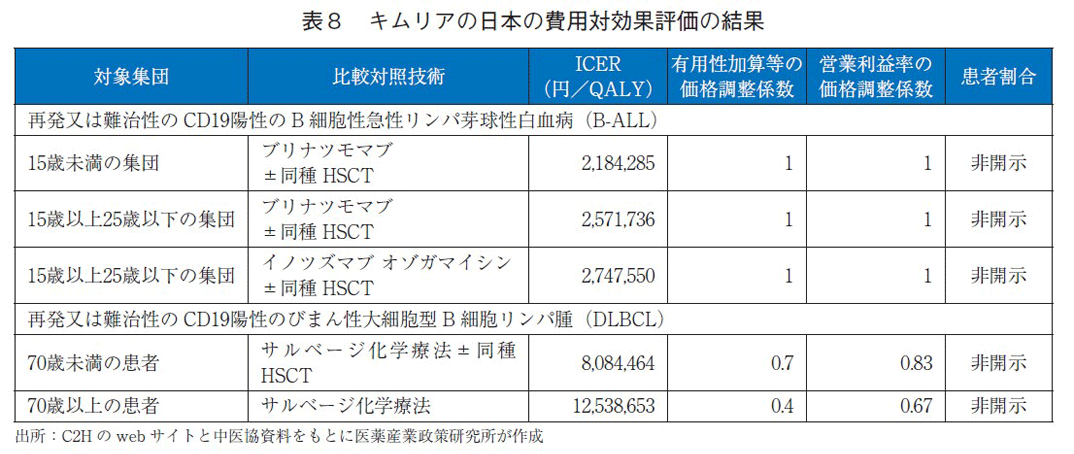
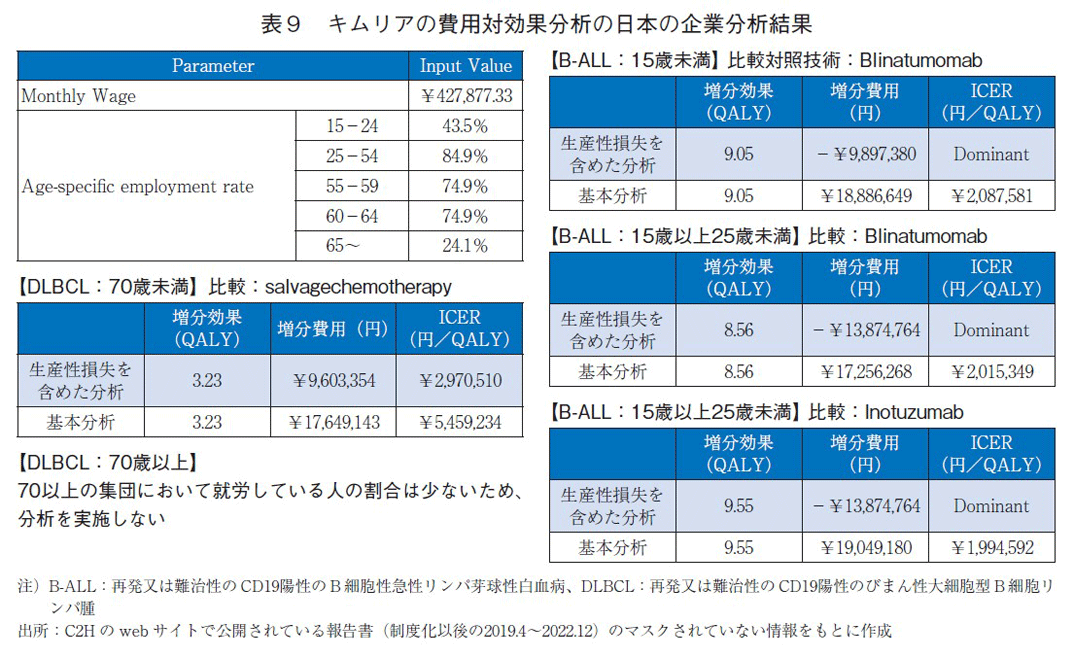
キムリア(一般名:チサゲンレクルユーセル)の日本の費用対効果評価結果を表8に示す。報告書では、患者割合が企業秘密によって開示されていないため、詳細な分析結果は不明であった。白血病の適応症では、いずれの対象集団においてもICERの区分が750万円/QALY未満と価格は妥当と判断されたが、リンパ腫の適応症では、この基準値を上回った。その結果、4.3%の価格調整がなされた。NICEの評価ガイダンスでは終末期の治療基準を満たさなかったため、通常の基準(1QALYあたり2~3万ポンド)にて評価がなされた。日本は、通常よりも高い基準(750万/QALY)を用いて評価を行っていたため、両国間の総合的評価に違いが見られた。総合的評価とは異なるが、NICEはCDFを通じたキムリアの使用を推奨しているため、日英いずれも臨床で使用することは可能となっている点を補足したい。
公的介護費用に関連する品目
日本の分析ガイドライン第3版では、「公的医療・介護の立場」からの分析の場合には、家族等の介護者や看護者に与えるQOL値への影響を考慮に入れてもよいとされている。分析対象とした4品目はいずれも公的医療費以外の立場のうち公的介護の立場を取らなかった(表7)。NICEは、基本分析に公的医療、介護の影響を加えることが認めているが、今回の調査対象品目のうち、費用に公的医療費以外の違いは見られなかったため、効用値に含まれているか調査した。
ユルトミリス(一般名:ラブリズマブ)のNICE評価ガイダンスでは、患者のみならず介助者も含めた健康関連QOLが含まれていた。現在の治療法であるエクリズマブは2週間隔の投与頻度であるが、ユルトミリスは8週ごとの投与頻度でよくなること等に起因していると推察する。介助者の健康QOL値は分析ガイドライン3版以降でICERの算出に用いられるように変更されたため、今後の日本の費用対効果評価分析で盛り込まれることが期待される。
カボメティクスのNICE評価ガイダンスでは、CABOSUN trialでQOLデータが収集されなかったため、チボザニブのガイダンスで使用された効用値を使用している。チボザニブのガイダンスを確認したところ、患者を対象とした生活の質に関する記載は確認できたが、家族等の影響に関しては確認ができなかった。日本は公的医療の立場での分析であるが、二次治療以降を対象としたMETEOR試験(カボザンチニブ、エベロリムスの比較)のデータに基づき、かつ日本人QOL値を使用して推定されているため、家族等の影響は示されていない。
生産性損失に関連する品目
キムリアは、「公的医療費の立場」以外の分析があり、生産性損失を含む企業分析結果を提出している(表9)。分析ガイドライン第2版に則り、生産性損失を含めた分析は価格調整には用いられていないが、生産性に関して記載する費用削減となるような分析結果であった。キムリアは、治療によってほぼ完全な社会復帰が可能となるため、生産性損失に関連した費用に大きな影響を与えた。
キムリアの生産性に及ぼす影響が、今後は他の品目にも適用する可能性があるのかを本事例のみで言及することは難しく、今後の評価事例の蓄積を待ちたい。なおNICEは、前述の通り生産性損失を評価結果に含めていない。今後、日本で生産性損失の影響をどのように価格調整に用いるべきか検討すべき課題である。総合的評価のうち、ICERの区分を抗がん剤等のように引き上げる必要があるか、あるいは1.0を超えるような価格調整係数を用いるべきなのか等、様々なことが考えられる。しかしながら、費用対効果評価の選定品目は、財政影響が大きい品目であり、価格調整の検討には日本の社会情勢を踏まえる必要がある。加えて、生産性損失の影響は、間接的な費用となるため、分析に含める範囲や推計方法などいまだにその取扱いは諸外国でも様々である。今後は、生産性損失を含む分析を行っているオランダや韓国、スウェーデン等の昨今の事例も参考に生産性損失の影響を評価に反映した事例を検討したい。
英国NICE技術評価(Technology appraisal:TA)ガイダンスにおける公的介護費の扱い
日本と英国は分析の立場が異なるといった違いがあったものの、分析ガイドライン第3版では、公的介護費へ与える影響が、評価対象技術にとって重要である場合には、「公的医療・介護の立場」の分析をおこなってもよいとされている。表7は対象品目が4品目と限定的であったため、英国の別の評価ガイダンスを調べた報告をもとに検討を行う。
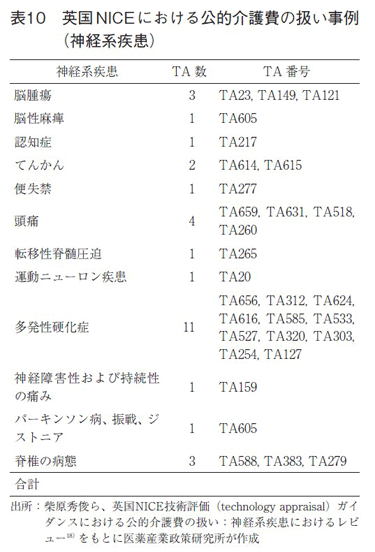
表10で示された英国NICEのTAガイダンス30件の公開資料を対象とした調査の結果、13件において日本の介護保険でカバーされる居宅介護サービスや施設介護サービスに係る費用が含まれており、さらに6件においてもそれらを含めるべく検討が行われていた19)。6件は、費用に含まれる直接非医療費の各項目がPSS(Personal Social Services:社会福祉サービス)でカバーされているサービスの範囲内かどうか識別することは困難であるとの理由から、最終的には介護費用等の直接非医療費を除外した分析結果で最終判断がなされていた。
本報告は、神経系疾患に限定しているものの、英国の分析の立場をもとにすると、43%(13/30件)が公的介護費に係る費用が含まれていた。
5. まとめと今後の展望
本稿では、日本の費用対効果評価制度のこれまでの運用を調査するとともに、英国との比較を通じ、医薬品の多様な価値を正しく評価するために必要なプロセスが現在の費用対効果評価で十分かあるいは拡充が必要となるか考察した。現在の総合的評価では、抗がん剤等配慮が必要となる品目の基準値の引き上げがなされており、抗がん剤への配慮は、英国の終末期の治療のような基準値がないことと比べると柔軟な対応がなされているように感じた。その一方で、患者家族の介護負担軽減、労働生産性の向上など社会的な要素19)の指標となりうる公的介護費や生産性損失を今後はどのように評価していくか、家族介護者等のQOL値が分析に盛り込まれるような動きはあるが、介護費のうち、家族介護者の負担の軽減(身体的・精神的負担等)5)やPSSでカバーされているサービスのように英国では分析に反映、考慮されているものの、日本ではまだ評価に利用されている事例が無いか少ない点や、日本人データの取得問題など、どのように制度として反映していくか今後の検討課題である。公的介護費用の取り扱いで述べたように価格調整を目的とする費用対効果評価制度において、英国のように既にICERに組み込んでいるものは、例えば家族介護者のQOLを分析に盛り込んだように英国を含めた諸外国の事例を参考とし、分析に組み込むことや、総合的評価のプロセスで抗がん剤のように配慮が必要なものとしてICERの区分の基準を引き上げるか、あるいは1.0を超える価格調整係数を設けるか等、様々な措置が考えられる。しかしながら、キムリアのように医療費を超えるような生産性損失の回避がある場合の影響をもたらすような薬剤の場合、財政影響が大きいため、給付と負担のバランスも加味しなければならず、評価プロセスを拡充する際にどの程度価格調整の枠組みで上乗せすることができるのか新たな検討課題となった。
なお今回は、調査対象が4品目と限定的であること、報告書の公開情報が限られていること、制度や経済状況の異なる英国を比較としたため、すべてがこれに当てはまるものではないことを念頭に置き、革新性の高い医薬品の多様な価値を正しく評価するためにも制度の見直しと更なる費用対効果評価事例の蓄積に期待したい。
-
1)
-
2)
-
3)
-
4)医療経済研究機構、令和3年度 厚生労働省保険局医局課による委託事業 薬剤使用状況等に関する調査研究報告書、P40
-
5)医薬産業政策研究所、「英国NICEのHSTから見る医薬品の価値評価」、政策研ニュース No.67(2022年11月)
-
6)
-
7)
-
8)
-
9)齋藤 信也、費用対効果以外の要素をいかに扱うべきか?-アプレイザル(総合的評価)に関する諸問題-、薬剤疫学 Jpn J Pharmacoepidemiol, 23Î1Ð Jan 2018:29
-
10)
-
11)
-
12)
-
13)
-
14)
-
15)
-
16)英国NICEでは終末期の治療の評価で、通常の1QALY あたり2~3万ポンドの基準を超えることを容認している。
-
17)
-
18)柴原秀俊ら、英国NICE技術評価(technology appraisal)ガイダンスにおける公的介護費の扱い:神経系疾患におけるレビュー
-
19)医薬産業政策研究所、「医薬品の多様な価値-国民視点および医療環境変化を踏まえた考察-」、リサーチペーパー・シリーズ No.79(2022年3月)

