Points of View 新薬の革新性と価格プレミアム1) 類似薬が存在しない新薬を対象としたパイロット研究
医薬産業政策研究所 客員研究員 学習院大学教授 西村淳一
医薬産業政策研究所 所長 東京経済大学教授 長岡貞男
1. はじめに
政策研ニュースNo.622)とNo.643)では、日本の類似薬効比較方式の薬価算定対象となった新薬を対象に、その類似薬の価格データを対照群として新薬の価格プレミアム(新薬と類似薬の価格比で評価して新薬の価格が高い程度)を測定することで、革新性との関係を日米独で国際比較分析を行った。その結果、日米独の各国で、革新性が高い新薬はその価格プレミアムが高く設定され、その程度は米国において最も高いことが確認された。
しかし、類似薬が存在していない場合に、新薬の価格がその革新性との関係でどのように各国で設定されているかは、重要な研究課題として残っている。理論的には、類似薬が存在しない場合でも、新薬を利用することで、利用しない場合(または何らかの代替治療を利用した場合)と比較して、健康上の効果(例えばQuality Adjusted Life Years(QALY)で測定)がどの程度向上できるかが分かれば、その革新性を反映する価格への示唆を得ることは可能である。欧米では、このような費用対効果の考え方で新薬の薬価が算定されている国が多いと考えられる。他方で、日本では、類似薬が想定されていない場合には原価計算方式が新薬の薬価算定で利用されてきた。しかし、医薬品の原価とその健康上の効果には直接の因果関係は無く、結果として日本では欧米と比較して、原価計算方式による価格は革新性を十分に反映しない可能性がある。
本稿では、一般成分名、剤形及び規格単位の全てを共通とする日米欧マッチト・サンプルを用いて、日本の原価計算方式によって薬価算定されている新薬の価格が、革新性をどの程度反映しているかを国際比較分析する。薬価算定において類似薬が想定されていないために、革新性の価格への影響を各国で直接評価することを困難であるが、一定の仮定の下では、二国間(例えば米国と日本)で革新性を評価する程度がどの程度異なるかを推定することはできる4)。政策研ニュースNo.64で用いたデータを利用して、類似薬効比較方式の算定対象となった新薬にも本稿と同様の手法をあてはめ、原価計算方式の算定対象となった新薬では革新性の評価の程度が日米欧でどのように異なるかの比較分析を試行的に行う。
2. データと分析の方法
まず、類似薬効比較方式の算定対象となった新薬と類似薬のデータの詳細については政策研ニュースNo.62とNo.64で述べているが、補論1にその詳細を載せておく。次に、原価計算方式の算定対象となった新薬の価格データは類似薬効比較方式の場合と同様に構築している。すなわち、IQVIA社からライセンスしている『Pricing Insights』を利用して、日米独英仏の5か国2010年7月~2019年3月における上市医薬品について四半期レベルで価格データを構築している5)。原価計算方式の場合、中医協の薬価算定情報から類似薬の情報が得られないため、本稿では、当該新薬については同じATC薬効分類(4桁分類)に属する既存薬を対照群とし、それらの既存薬の価格データも収集した6)。これらの新薬と既存薬についても、日米欧で同じ一般成分、剤形及び規格単位ですべて共通となっているものが選ばれている。構築された原価計算方式の算定対象となった新薬は36成分得られているが、既存薬とのマッチングが可能であり、かつ国際比較が可能なものは19成分であった。
原価計算方式の算定対象となった新薬については、以上の手順で得られたデータを利用して、同じ薬効分野の既存薬と比較した新薬の価格プレミアムを用いて、それが革新性をどのように反映しているかを国際比較分析する。価格プレミアムは以下の(1)式より計算している。
価格プレミアム=ln(新薬の価格/既存薬または類似薬の価格) (1)
しかし、原価計算方式によって算定された新薬には類似薬が定義されていないため、新薬と既存薬に共通の標準的な治療の水準(1日投与量)が存在しない(類似薬効比較方式の場合には中医協の一日薬価から算出することができた)。このため、新薬と既存薬の価格比で表される価格プレミアムには、それらの健康上の効果の差ではなく、新薬と既存薬の間の投与量や強度の差を反映する可能性がある。この測定バイアスを除去するため、推定では米国の価格プレミアムを基準とし、日本及び欧州の価格プレミアムとの差を分析の対象とする。
価格プレミアム差分=米国の価格プレミアム-日欧の価格プレミアム (2)
補論2では以上の分析の理論背景を示しており、このような価格プレミアムの差分をとることで、新薬と既存薬の投与量や強度等の差に基づく測定バイアスを除去することができる。
本稿では二つの推定を行う。最初は、日欧の価格プレミアムが米国の価格プレミアムを下回る(あるいは上回る)程度を推定するモデルである。米国では日欧と比べて新薬と既存薬の薬価はいずれも高いが、新薬と既存薬の価格比である価格プレミアムが日欧と比べて高いかどうかはわからない。日本で類似薬効比較方式の算定対象となっている新薬については、日欧の価格プレミアムが米国の価格プレミアムを有意に下回る(以下の推定モデルのzが正である)ことを政策研ニュースNo.62で報告している。本稿では以下の推定モデルを類似薬効比較方式と原価計算方式のそれぞれの算定対象となった新薬にあてはめ、各方式における価格プレミアムの米国との差分の平均値zを得る。
価格プレミアム差分=z+経時的変化のコントロール+誤差項 (3)
ここでzは補論2の理論モデルによれば、米国における医薬品の健康上の効果(革新性の程度)が価格に反映される程度と日欧におけるその効果が価格に反映される程度の差分(補論2のβ*-β)と、新薬と既存薬(または類似薬)の健康上の効果の比率(補論2のln(qi/qo,i))から構成される。後者の新薬と既存薬の健康上の効果の比率は日米欧で共通であると考えられる。そのため、zは日米(あるいは欧米)の間において革新性が価格に反映される程度の違いを主に反映すると予想される。ただし、類似薬効比較方式における新薬と既存薬の健康上の効果の比率と、原価計算方式における新薬と既存薬の健康上の効果の比率が等しいとは限らないため、類似薬効比較方式のzの推定値と原価計算方式のzを単純に比較することはできないことに留意すべきである。
なお、推定式(3)ではコントロール要因として、米国と日欧における新薬の上市後経過年と推定に用いた期間の年ダミーを入れた場合の推定も行った。新薬の上市後に新薬と既存薬(あるいは類似薬)の価格は経年的に変化するので、コントロール要因をモデルに入れることでその影響を考慮できる。この場合、推定値は初期年の価格プレミアムの差分となる。
次に、新薬の革新性と価格プレミアムとの関係についての推定を行う。新薬の革新性は、政策研ニュースNo.64で分析したように、作用機序の新規性及び基礎となる特許(物質特許、結晶特許、用途特許)のサイエンス集約度(引用論文数、これらの論文の被引用数、科学活用速度)の加重平均によって合成指標として構築した。それらの詳細な構築手順は補論1にまとめている。本稿では、類似薬あるいは既存薬の革新性についても新薬の場合と同じ手順で測定を行った。原価計算方式において、新薬と我々が選定した既存薬では創薬における技術基盤が大きく異なる可能性があり、また新薬及び既存薬両方の特許の保護期間中のデータを利用した推定であり、革新性の差が新薬と既存薬の価格比にも影響を及ぼすと想定している。そこで、被説明変数である価格プレミアム(新薬と既存薬の価格比の対数値)に即して、説明変数である革新性の変数も新薬と既存薬の革新性の比の対数値をとることで推定モデルに組み込んだ(補論2の(1.6)式も新薬と既存薬の健康上の効果の比率をとっている)。また比較可能性を維持するために、類似薬効比較方式の分析についても同様に新薬と類似薬の革新性の比の対数値として革新性の変数を構築している。
以下の(5)式において、米国における医薬品の革新性の程度が価格に反映される程度と日欧におけるその程度が価格に反映される程度の差分(補論2のβ*-β)がγに該当する。
革新性差分=ln(新薬の革新性/既存薬または類似薬の革新性) (4)
価格プレミアム差分=定数項+γ革新性差分+経時的変化のコントロール+誤差項 (5)
以上、(3)式と(5)式の推定では、前述したように、日米欧の共通の成分を対象に、日米欧いずれにおいても新薬と既存薬あるいは類似薬の特許保護期間内における価格データに絞って推定を行う。これは特許保護満了後の後発医薬品の参入の影響を分析から除外するためである7)。そのため、この作業の結果、実際の推定では類似薬効比較方式の算定対象となった分析サンプルは約30成分、原価計算方式の算定対象となった分析サンプルは約10成分である。
3. 価格プレミアムの米国との差分の推定結果
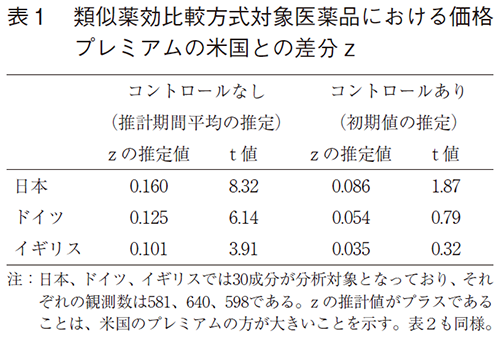
(3)式の推定結果は表1と表2にまとめている。表1は類似薬効比較方式の算定対象となった新薬についてのzの推定結果である。まず、コントロール要因を含めない結果をみると、日本、ドイツ、イギリスいずれにおいてもzの推定値が正となり、またt値が非常に大きいため統計的にも有意といえる。これは日欧の価格プレミアムが米国の価格プレミアムを下回る程度を反映しており、係数値の大きさから日本が最も米国の価格プレミアムを下回っていることがわかる。この結果はコントロール要因である上市後経過年や年ダミーを含まない結果であるため、推定期間の平均的な差をみていることになる。
次に、コントロール要因を入れた推定結果をみると、日本、ドイツ、イギリスいずれにおいてもやはりzの推定値は正である。しかし、統計的に有意であるのは日本のみとなった。コントロール要因を考慮した結果は、価格プレミアム差分の初期値(上市時点)を反映しているため、ドイツとイギリスでは米国との価格プレミアムの差分に上市時点では有意な違いがみられないことを意味する。一方で、日本では上市時点から米国の価格プレミアムを下回る結果となっていた。以上の結果は、米国における価格プレミアムが日欧と比べて経年的に上昇傾向にあることを示している。
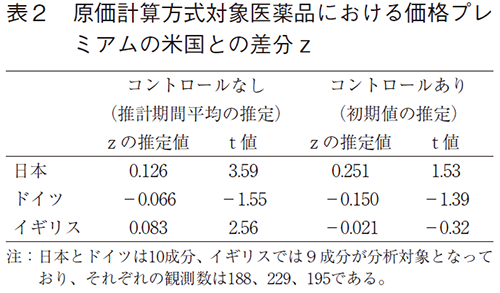
次に、表2は原価計算方式の算定対象となった新薬についてのzの結果である。コントロール要因を含めない結果から、日本とイギリスでは正の係数値となり、ドイツは負の係数値となった。しかし、統計的に有意となったのは日本とイギリスのみである。よって、日本とイギリスでは推定期間の平均的な差でみると、米国の価格プレミアムを下回っているといえる。一方で、ドイツの場合では米国の価格プレミアムとの大きな差はないと考えられる。経時的なコントロール要因を入れたモデルでは、日本のzの推定値は正、ドイツとイギリスでは負となった。しかし、これらのt値は低く、統計的に有意ではない。よって、上市時点でみると、日米欧の価格プレミアムに差はないことがわかる。表1と同様に、米国における価格プレミアムが日欧と比べて経年的に上昇傾向にあることがいえるだろう。
zの推定値には新薬と既存薬(または類似薬)の健康上の効果の比率が含まれるので、表1と表2のzの推定値を直接比較することはできない。しかし、全体的にみて、類似薬効比較方式のzの推定値と比べて、原価計算方式のzの推定値の方がやや低い傾向にあることがわかる。類似薬効比較方式の場合と比べて、相対的にみて原価計算方式の算定対象となった新薬の方が日欧においても米国と比べて革新性が評価されやすい傾向を反映しているのかもしれない。ドイツではその傾向が顕著であり、類似薬効比較方式の結果と比べて、原価計算方式の結果ではzの推定値が有意ではないが負となっている。これが類似薬効比較方式と原価計算方式における医薬品の薬価構造の大きな違いである。このように革新性が評価される程度が、類似薬効比較方式対象の新薬と原価計算方式対象の新薬で異なるかどうかを(5)式から推定する。
4. 革新性と価格プレミアムの推定結果
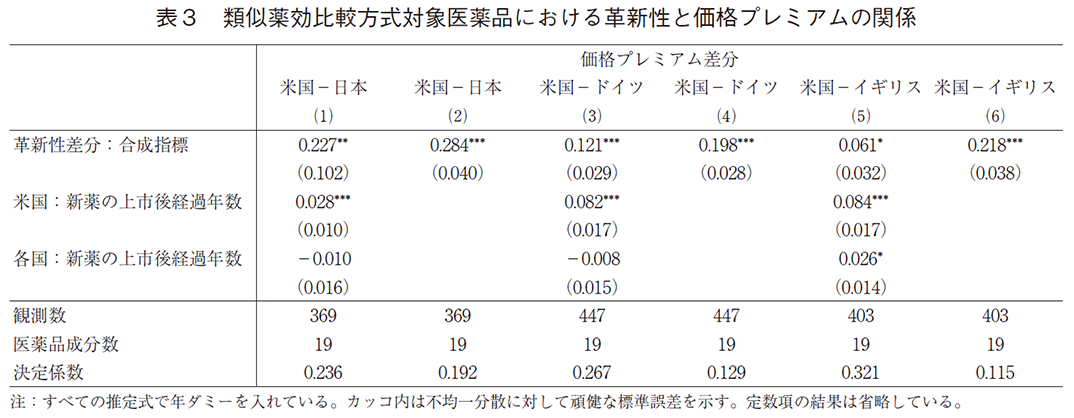
(5)式の推定結果は表3と表4にまとめている8)。表3は類似薬効比較方式の算定対象となった新薬の結果である。モデル(1)と(2)は日米の価格プレミアム差分、(3)と(4)は米独の価格プレミアム差分、(5)と(6)は米英の価格プレミアム差分の結果である。コントロール要因である上市後経過年を含めた推定結果をみると、モデル(1)、(3)、(5)のいずれにおいても革新性差分の係数値は正で有意となった。先に述べた通り、上市後経過年を考慮したモデルでは革新性差分の係数値は原則として上市時点の影響を反映していると考えられる。日本、ドイツ、イギリスの結果を比較すると、日本の係数値が0.227と最も大きく、次にドイツで0.121、イギリスで0.061となっている。この係数値は、米国における革新性の程度が価格に反映される程度と日欧におけるその程度が価格に反映される程度の差分(補論2のβ*-β)となっている。よって、日本で最も革新性が価格に反映される程度が低いことを示している。
次に、上市後経過年を除いたモデル(2)、(4)、(6)をみると、いずれも革新性差分の係数値は正で強く有意であった。上市後経過年の影響を考慮していないため、この係数値は推定期間における革新性差分の平均的な影響を示している。これらの係数値は上市後経過年を含めたモデルの係数値よりもいずれも大きいものとなっている。よって、経年的に米国での価格プレミアムが日欧のそれよりも相対的に上昇することが反映されている。この結果は表1と整合的である9)。以上の推定結果から、新薬の革新性を評価する程度が米国で大きい事が、米国での新薬の価格プレミアムが大きいことの重要な原因であることも示している。
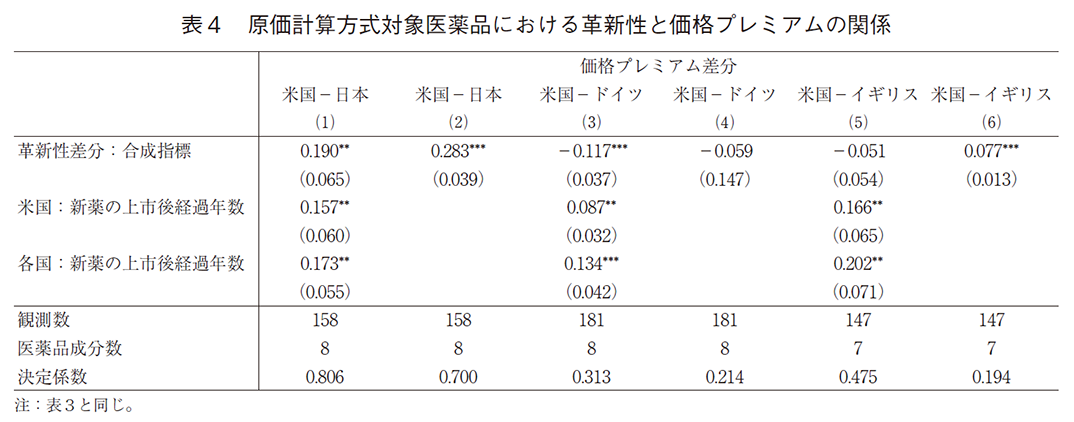
次に、表4は原価計算方式の算定対象となった新薬の結果を示す。コントロール要因である上市後経過年を含めた推定結果をみると、モデル(1)の革新性差分は正で有意だが、モデル(3)では負で有意、モデル(5)では負で非有意となっていた。よって、日本については表3と同様に、革新性が価格に反映される程度が最も低いことは共通しているが、ドイツではむしろ米国よりも革新性が価格に高く反映されており、イギリスでは米国とその程度に差がないことを示している。これらの結果は上市時点の価格プレミアム差分の結果であるが、この結果は表3の類似薬効比較方式の結果と大きく異なっている。
上市後経過年を除いたモデル(2)、(4)、(6)をみると、モデル(2)は正で有意、モデル(4)は負だが非有意、モデル(6)は正で有意となった。表3と同様に、これらの係数値は上市後経過年を含めたモデルの係数値よりもいずれも大きいものとなっている。よって、原価計算方式においても、経年的に米国での価格プレミアムが日欧のそれよりも相対的に上昇することが反映されている。日本については、モデル(1)とモデル(2)の推定された係数値が表3のそれらの係数値とほぼ等しく、この結果は、類似薬効比較方式の算定対象であろうが、原価計算方式の算定対象であろうが、革新性が価格に反映される程度が米国との差分でみて同程度であることを意味している。一方で、ドイツとイギリスについては表3の推定結果と比べて顕著に係数値が下がっており、欧州では日本で原価計算方式の算定対象となった新薬について革新性が高く価格へと反映されていることが示唆される。以上の結果は表2の結果とも整合的である。
5. 分析結果のまとめ
本稿では類似薬が定まっている類似薬効比較方式の算定対象となった新薬に加えて、類似薬が想定されていない原価計算方式の算定対象となった新薬について、日米欧のマッチト・データを構築し価格プレミアムと革新性の関係を分析した。推定の結果、以下のことがわかった。まず、類似薬効比較方式の分析から、日欧の価格プレミアムが米国の価格プレミアムを下回っており、その程度は経年的に大きくなる。さらに、新薬の革新性を評価する程度が米国で大きい事が、米国での新薬の価格プレミアムが大きいことの重要な原因であった10)。特に、日本では新薬の革新性を評価する程度が米欧と比べて低く、ドイツとイギリスは同程度ということもわかった。
次に、原価計算方式の分析から、日本とイギリスの価格プレミアムが米国の価格プレミアムを下回っていたが、類似薬効比較方式ほど顕著ではなく、ドイツではそのような傾向はみられなかった。さらに、新薬の革新性を評価する程度では、日本は米国と比べて低く、類似薬効比較方式の場合と同程度であった。しかし、ドイツとイギリスではその程度は米国と比べて統計的な有意差がなく、むしろ上市時点でみればドイツは米国より革新性を高く評価していた。
上記の結果から、日本については類似薬効比較方式であろうが、原価計算方式であろうが、革新性が価格に反映される程度が米国より低いことに大きな違いがない一方で、欧州では顕著に違いが確認された。本稿の動機の一つとして、日本において原価が薬価のベースとなる原価計算方式の算定対象となった新薬では、その革新性が日本では薬価に反映されにくい可能性を指摘した。このような新薬は類似薬が想定されていないことを考慮すれば、本来的には革新性が高い可能性がある。ドイツやイギリスではそのような革新性が評価された結果となっているのかもしれない。
今回の分析では、特に原価計算方式対象の医薬品はかなり数が限られていること、また薬効分野はかなり狭く限定しているものの、新薬の革新性を評価する上で妥当な既存薬が選定されているかどうかについては、なお検証の必要がある。欧州において原価計算方式で結果が大きく異なる理由として考えられる要因は、類似薬が存在しない状態では結果的に米国での価格が大きな影響を持つことであるが、今後そのメカニズムを含めて、分析を深めたい。
補論1 類似薬効比較方式における新薬の基本データの構築手順
価格データの構築
本稿では様々なデータソースを用いて分析データセットの構築を行った11)。構築手順は以下の通りである。まず、我々がIQVIA社からライセンスしている『Pricing Insights』には、日米独英仏の5か国2010年7月~2019年3月における上市医薬品について月次レベルで価格情報がある(ただし、日本については価格情報が2010年は欠損値)。『Pricing Insights』には流通の各段階での価格情報が収載されているが、本稿では、各国における実勢価格に最も近いと想定される薬局購入価格(PPP)を用いて分析している。
この基本データベースから、一般成分名、国際商品名、剤形及び強度の全てを共通とする医薬品単位で各国の価格情報をマッチングし、各国における四半期ベースで価格データを単純平均したデータベースを作成した。この価格データについて、OECDより2015年時点における各国GDPデフレーターと購買力平価の情報を入手し、2015年価格で実質化し、購買力平価で換算したドルベースの価格データを作成した。
次に、IQVIA World Review Analyst 2018の売上上位300の医薬品リストと日本の中医協の薬価算定情報より特定した、その上位医薬品と対応する類似薬のリストを作成し、『Pricing Insights』より構築したデータベースと接続作業を行った。なお、類似薬のリストは類似薬効比較方式の算定対象となった医薬品のみ得られる。
最終的に、日本で上市され、類似薬効比較方式によって新薬の薬価が決定され、かつ米国及び欧州(独、英、仏)3ヶ国のいずれかでも上市されている医薬品69成分(類似薬効比較方式で算定された新薬69成分とそれぞれの新薬に対応する類似薬のデータ)を構築した。これらの分析対象となる医薬品は一般成分名、国際商品名、剤形及び強度全てにおいて各国共通の薬剤が存在することも条件となっている。
また、新薬と類似薬について、標準的な治療の水準(1日投与量)での価格比を計算するため、中医協の薬価算定資料から各医薬品の一日薬価の情報を入手して、日米欧における新薬の類似薬に対する価格プレミアム(価格比の対数値、新薬の類似薬に対する価格上昇率)を測定した。そのため、この標準的な治療の水準は各国で共通のものと仮定をおいて分析を行っている。
革新性データの構築
4つの新薬の革新性指標を作成した。最初の指標は中医協の「類似薬選定のための薬剤分類」をもとに作成した。
- (1)革新性(新規度):新規作用機序かどうか、あるいは既存作用機序の中で何番目の上市かを、中医協の類似薬選定のための薬剤分類をもとに作成した。本稿では、上市の順位の逆数をとり、その後、対数値をとっている(ln(1/上市の順番))。よって、この数値が大きいほど当該医薬品成分の革新性(新規度)は高いと考えられる。
次に、各医薬品成分を保護する特許群(物質特許、結晶特許、用途特許)をサンエイレポートより特定し、当該特許群に対応する米国特許群が書誌情報(フロントページ)に引用している科学論文群をWeb of Scienceより収集し、以下の革新性指標を作成した。なお、被引用情報には本来、トランケーションの問題があり、また、医薬品の特許が科学技術論文を引用する性向も経時的に変化するので、以下の指標を推定に用いる場合には、新薬の上市年を固定効果としてコントロールしている。
- (2)革新性(科学論文数):各医薬品成分を保護する特許群が科学論文をどの程度引用しているかを測定し、その対数値をとっている(ln(科学論文数+1))。この数値が大きいほど、より多様な科学的知識に依拠した革新性が高い医薬品と考えられる。
- (3)革新性(被引用数):成分単位で特定された科学論文群が、他の科学論文によってどの程度引用されたかを測定し、その被引用数の対数値の平均を計算している(ln(被引用数+1))。この数値が大きいほど、重要度の高い科学的知識に依拠した革新性が高い医薬品と考えられる。この指標は新しい科学論文ほど引用数が少ないバイアスがあると予想されるが、推定では新薬の上市年を導入することでコントロールしている。
- (4)革新性(科学活用速度):医薬品成分を保護する日本で出願された特許の出願時期と、その特許が引用する科学論文の発刊時期の差分(引用ラグ)の平均値をとることで、当該医薬品成分が、公刊された科学論文をどの程度早く活用しているかを測定した。本稿では、この引用ラグの平均値の逆数をとり、その後、対数値をとっている(ln(1/引用ラグ))。よって、この数値が大きいほど、より早く科学的知識を吸収・活用した革新性の高い医薬品と考えられる。
補論2 価格プレミアムのモデルの背景
新薬iと対応する既存薬の健康上の効果は、同じ基準で測定され、それぞれqiとq0,iだとする。これらは、薬を投与しない場合と比較したQALYの改善度合いと考えてもよい。既存薬の薬価は、その国の健康改善への支払い意欲wに比例し、また当該疾患特有の事情(治療に対する需要等)αi、及び当該医薬品の効果を反映して以下のように決定されるとする。

ここでβ≥0であり、もしβ=1、αi=1であれば、既存薬の薬価はその健康上の効果に等しく比例的に設定され、β=0なら価格は健康上の効果を反映しない。
新薬も既存薬と同じフォーミュラ(方程式)を利用し、同時にその効果の高さを反映して決定されているが、新薬ではqiの効果を得るためにはθiだけの処方量が必要だとすると、実質の価格はθipiであり、下記のように書ける。

(1.1)と(1.2)式の価格比をとると、

基準国(米国)でも同様に薬価が決定されているとすると、

原価計算方式対象の新薬のように、類似薬が得られないために1日薬価の情報が得られないことに起因する測定上のバイアスを解決するには、価格比の更に米国との比率を利用できる。すなわち、(1.3)と(1.4)式の比をとると、
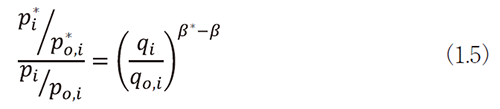
となり、θiの影響を無くすことができる。
(1.5)式の両辺に対数をとると、
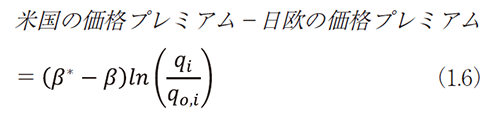
ただし、価格プレミアム=ln(新薬の価格)-ln(既存薬の価格)
(1.6)式の価格プレミアム差分によって、各国において新薬の薬価が既存薬の薬価に対して(処方量の差等で生じる)1日薬価のθ倍であっても、θの影響を除去できる。
-
1)本稿の研究には医薬産業政策研究所の研究員各位から有益なコメントを頂いたことに感謝申し上げたい。本研究は、科研費基盤B(「創薬イノベーションとインセンティブの研究」、18H00854)の支援を受けて実施した。
-
2)医薬産業政策研究所「新薬の比較薬に対する価格プレミアム:日米欧のマッチト・サンプルによる分析」政策研ニュースNo.62(2021年3月)
-
3)医薬産業政策研究所「新薬の革新性と価格プレミアム-日米独のマッチト・サンプルによる分析-」政策研ニュースNo.64(2021年11月)
-
4)補論2(価格プレミアムのモデルの背景)を参照。
-
5)フランスにおける価格データも他国と同様に構築しているが、対照群となる既存薬の上市が少なく、サンプルサイズが半減してしまうため、今回の分析からフランスは除外している。
-
6)新薬と同じATC薬効4桁分類(例えばL01B0-ANTIMETABOLITESというレベル)なので、ある程度、対照群となる既存薬は限られる。ただし、当該新薬がそのATC薬効4桁分類において各国で最も上市が早いケースも複数あり、その場合は分析対象のサンプルから除外される。一方で、既存薬の候補が複数得られる場合もあり、その場合は各国における価格データの充実度や剤形及び規格データの統一性を重視して一つの既存薬を対照群として選定している。補論2によれば、剤形及び規格データが日米欧で統一されており、各国における標準的な治療の水準(1日投与量)に大きなバイアスがなければ選定によって推定結果に大きなバイアスが生じることはない。
-
7)日米欧各国における各成分の特許保護期間の情報については『Pricing Insights』より入手して利用した。本データでは日本の再審査制度によるデータ保護期間については把握されていないが、特許権の存続期間延長制度を利用した情報は反映されている。医薬産業政策研究所「新有効成分含有医薬品の特許期間と再審査期間の比較-2」政策研ニュースNo.56(2019年3月)によれば、2000~2016年に日本で承認された新有効成分含有医薬品(NME)について、390品目のうち342品目(88%)は特許保護期間が再審査期間を上回っていた。
-
8)日本については外国平均価格調整の影響を考慮した推定も行ったが、革新性差分の係数値に大きな変化はなかった。
-
9)これらの結果は、サンプルと説明変数の構成が異なるが、医薬産業政策研究所「新薬の革新性と価格プレミアム-日米独のマッチト・サンプルによる分析-」政策研ニュースNo.64(2021年11月)の推定結果と整合的なものとなっている。
-
10)ここでの分析対象の新薬は、日本で類似薬効比較方式の算定対象となっているものである。ドイツやイギリスにはそのような制度はないが、ICERのような医薬品の費用対効果の評価において、実態として日本と同様に類似薬との比較で価格が算定されている可能性が示唆される。
-
11)主に用いたデータソースは以下である。①IQVIA. Pricing Insights、②サンエイレポートの特許保護期間や再審査期間情報、③中医協の薬価算定情報から構築した医薬産業政策研究所作成の薬価情報(加算率、外国平均価格調整率等)、④OECDのGDPデフレーターと購買力平価情報、⑤IQVIA World Review Analyst2018の売上上位医薬品情報。

