目で見る製薬産業
日米欧の新薬承認状況と審査期間の比較
-バイオ医薬品の承認状況も踏まえて-
医薬産業政策研究所 主任研究員 東 宏
医薬産業政策研究所 主任研究員 吉田昌生
医薬産業政策研究所では、日本、米国、及び欧州の医薬品の承認情報及び審査期間に関して、独立行政法人医薬品医療機器総合機構(PMDA)、U.S. Food and Drug Administration(FDA)、及びEuropean Medicines Agency(EMA)がそれぞれホームページ等で公表している情報をもとに、継続的に収集、分析している1)。政策研ニュース第64号2)では2020年の承認実績を中心に日米欧の新薬承認状況と審査期間の比較を、政策研ニュース第65号3)では2021年に日本で承認された医薬品情報に関する分析結果をした。第63号4)、5)、第66号6)、7)では本継続調査を基盤とし、ドラッグ・ラグの現状を報告した。今回のニュースでは、2021年に日本、米国、および欧州で承認された新薬の承認品目数、審査期間等に関して調査した。また、日本の特例承認を受けた新型コロナウイルス感染症(coronavirus disease 2019:COVID-19)の治療薬についても調査した。併せて、近年増加しているバイオ医薬品の承認状況について薬事上特別措置の適用を中心に報告する。
調査方法
PMDA、FDA及びEMAのそれぞれのホームページに公表されている情報をもとに、標準的な統計解析ソフトStata/IC 14.0 for Windows(StataCorp LP, College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
日本は、政策研ニュース第65号と同様、対象はPMDAホームページの「新医薬品の承認品目一覧」8)に掲載されている医薬品とし、品目数は審査報告書ごとにカウントすることを基本に、同一成分の品目を複数企業が同時申請した場合や併用薬物療法にて複数成分が承認された場合は1品目として集計した。New Molecular Entity(NME)の集計は、申請区分が新有効成分含有医薬品に該当するものを対象とした。米国は、FDA Center for Drug Evaluation Research(CDER)が承認した「CDER Drug and Biologic Approvals for Calendar Year」9)に掲載されているNew Drug Application(NDA)及びBiologic License Application(BLA)に該当する医薬品を対象とした。NMEの集計は、「CDER New Molecular Entity(NME) Drug & Original BLA Calendar Year Approvals」9)に掲載されている医薬品を対象とした。
欧州は、EMAが中央審査方式にて承認し、「European Medicines Agency Annual Reports」10)に掲載された医薬品を対象とした。NMEの集計は、「New active substance」に分類されている医薬品を対象とした。
なお、上記で示した各極の調査対象に含まれる医薬品の種類・範囲はそれぞれ異なっており、医薬品承認品目数の推移等についての3極間の比較を厳密にはできないことは調査の限界として事前に提示しておく11)。
また、薬事上の特別措置として、日本では優先審査、迅速審査、希少疾病用医薬品、先駆け審査指定制度12)、条件付き早期承認制度を、米国ではPriority Review、Accelerated Approval、Orphan、Fast Track、Breakthrough Therapyを、欧州ではAccelerated Assessment、Orphan、Conditional Approval、Exceptional Circumstances、Priority Medicine(PRIME)を対象に集計した。各薬事上の特別措置の内容は補足(Page 138)にまとめた。
新医薬品の承認品目数の日米欧比較
過去7年間(2015~2021年)の日本、米国、及び欧州で承認された新医薬品の承認品目数を図1に示した。日本において2021年に135品目が承認され、そのうちNMEは52品目であった。これは共に過去7年間で最多の承認数であった。米国では2021年に115品目が承認され、そのうちNMEは50品目であった。2020年と比較し、何れも減少したが、NMEは2018年、2020年に次ぐ3番目の承認数であった。欧州では2021年に170品目であり、そのうちNMEは51品目であった。弊所集計がある2013年以来、承認品目数もNMEも過去最多の承認数であった。
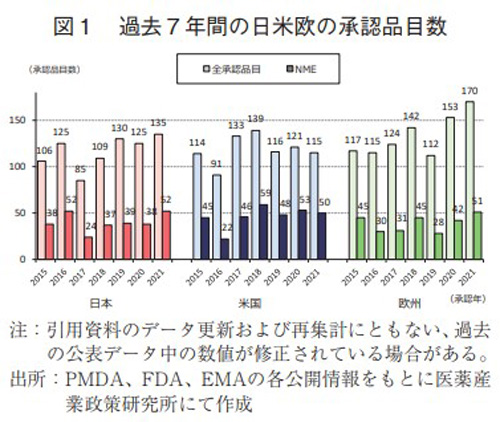
薬事上の特別措置を受けた承認品目数(NME)
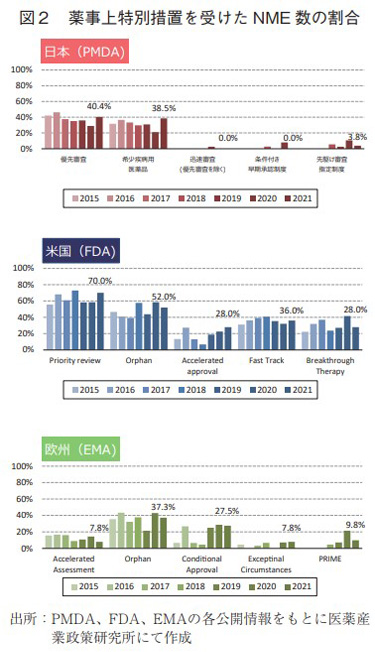
日米欧で過去7年間(2015~2021年)に承認されたNMEのうち、各地域の薬事上の特別措置を受けた品目数とその割合について調査した(図2)。
2021年に日本で承認されたNME 52品目中、優先審査(希少疾病用医薬品を含む)は21品目(40.4%)、希少疾病用医薬品は20品目(38.5%)、迅速審査(優先審査を除く)は0品目、条件付き早期承認制度の適用対象品目は0品目、先駆け審査指定制度の指定品目は2品目(3.8%)であった。優先審査、希少疾病用医薬品のNMEの割合は、昨年までの傾向に反発し、過去最高水準に近かった。一方、先駆け審査指定制度は減少し、迅速承認と条件付き早期承認制度対象の承認品目はなかった。
米国では、2021年承認されたNME 50品目中、Priority reviewは35品目(70.0%)、Orphan指定品目は26品目(52.0%)、Accelerated approval品目が14品目(28.0%)、Fast Track指定品目は18品目(36.0%)、Breakthrough Therapy指定品目は14品目(28.0%)であった。中でもAccelerated approvalは2011年以降で最多であった昨年12品目を上回る高い水準であった。
欧州については、2021年に承認されたNME 51品目中、Accelerated Assessmentは4品目(7.8%)、Orphan指定品目は19品目(37.3%)、Conditional approvalを受けた品目は14品目(27.5%)、Exceptional Circumstancesは4品目(7.8%)、PRIME指定品目は5品目(9.8%)であった。Conditional approvalが2014年以降最多品目数であり、割合も2020年に次ぐ2番目の多さだった。
新医薬品の審査期間の日米欧比較
日米欧で2021年に承認された新医薬品の審査期間(月数)を昨年と比較した結果を表1に示した。なお、日本の特例承認品目について審査プロセスの違いから中央値等の算出から除外している。
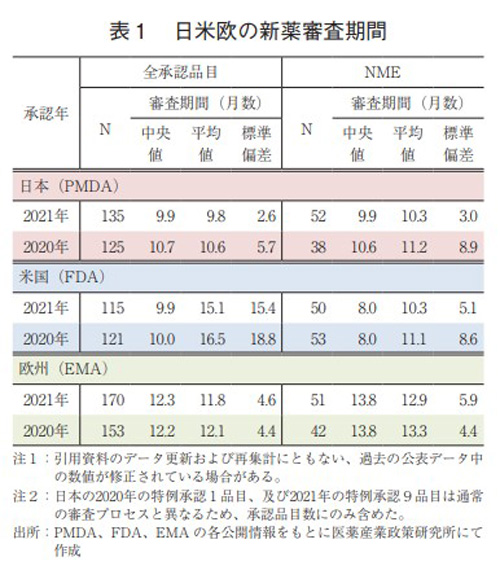
2021年承認品目のそれぞれの審査期間(中央値)は日本9.9ヶ月、米国9.9ヶ月、欧州12.3ヶ月であり、2020年と比較して日本と米国の審査期間の差は縮小した。NMEに関しては、2021年承認品目のそれぞれの審査期間(中央値)は、日本9.9ヶ月、米国8.0ヶ月、欧州13.8ヶ月であった。昨年よりも、日本のみ審査期間(中央値)が短縮されており、米国・欧州は変わらなかったことから日米の審査期間の差は縮小した。
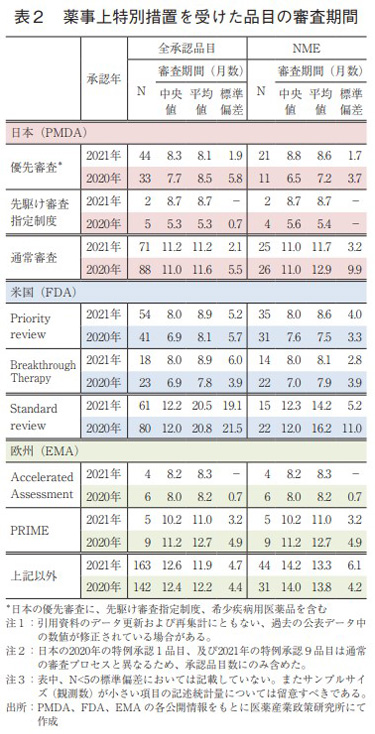
薬事上の特別措置を受けた品目の審査期間
2021年承認品目のうち、審査期間の短縮を目的とした薬事上の特別措置(日本:優先審査、先駆け審査指定制度、米国:Priority review、Breakthrough Therapy、欧州:Accelerated Assessment、PRIME)を受けた品目について表2に示した。特に先駆け審査指定制度、Breakthrough Therapy、PRIMEの枠組みは、重篤な疾患に対して高い有効性が期待される医薬品について、開発段階における助言の実施や五月雨的な審査(Rolling review)あるいは優先審査など、優先的な取り扱いを行うことで更なる迅速な実用化を図り、アンメット・メディカル・ニーズの早期解決を目指すものである13)。(補足 Page 138)
日本での2021年の優先審査品目承認数は、全承認品目(44品目)、NME(21品目)と2020年より増加、審査期間(中央値)はそれぞれ8.3ヶ月、8.8ヶ月であった。昨年より承認に月数を要したものの、中央値として9か月以内に収まっている。また、審査期間のばらつき(標準偏差)が非常に小さく安定していたことも確認できた。一方、先駆け審査指定制度の指定品目として2品目(ともにNME)が承認されたが、1品目の審査期間はPMDAが目標とする6ヶ月を超過していた。理由についてはまとめと考察の章で触れる。通常審査品目承認数は2020年と比べて減少、審査期間(中央値)は2020年と比較して若干長くなっていた。
米国での2021年のPriority review指定品目の承認数については、全承認品目(54品目)でNME(35品目)とともに2020年から増加していた。審査期間(中央値)はそれぞれ8.0ヶ月、8.0ヶ月と2020年より長くなっていた。Breakthrough Therapy指定品目については、18品目(うちNME14品目)が承認されており、審査期間(中央値)はともに8.0ヶ月、8.0ヶ月とPriority reviewと同様であった。日本の先駆け審査指定品目と比較すると、指定品目数が非常に多いことが昨年同様に確認されている。
欧州では、日本や米国と比較して優先的に審査を受けた品目の割合は少ないが、2021年の Accelerated Assessment指定品目の審査期間(中央値)は8.2ヶ月と、指定を受けていない品目と比較して4ヶ月以上短く、昨年同様であった。また、PRIMEの指定品目については、5品目(全てNME)が承認され、審査期間(中央値)は10.2ヶ月であった。NMEにおいては、薬事上の特別措置を受けた品目の審査期間が、通常審査品目と比較して顕著に短縮しており、日本及び米国との比較でも措置の恩恵を一番受けた結果となっている。
審査期間の中央値の年次推移(日米欧)
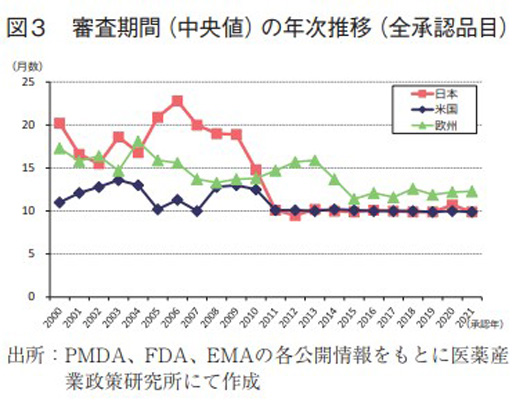
日本、米国、及び欧州で承認された医薬品の承認年毎(2000~2021年)の審査期間(月数)を表3に、審査期間の中央値の年次推移を図3に示した。また、NMEについては日本の審査期間が大幅に短縮した後の2013年から2021年の期間を調査対象とし、承認年毎の審査期間(月数)を表4に、審査期間の中央値の年次推移を図4に示した。
調査対象の全期間における審査期間の中央値は、日本11.1ヶ月、米国10.1ヶ月、欧州13.3ヶ月であった(表3)。2021年は日本9.9ヶ月、米国9.9ヶ月、欧州12.3ヶ月と昨年同様の審査期間を維持していた。年次推移でみると、2011年に日本で大幅な審査機関の短縮が行われて以来、米国と比肩する審査期間(中央値)で概ね10ヶ月程度、欧州も2015年からは審査期間を短縮(約12ヶ月)している。
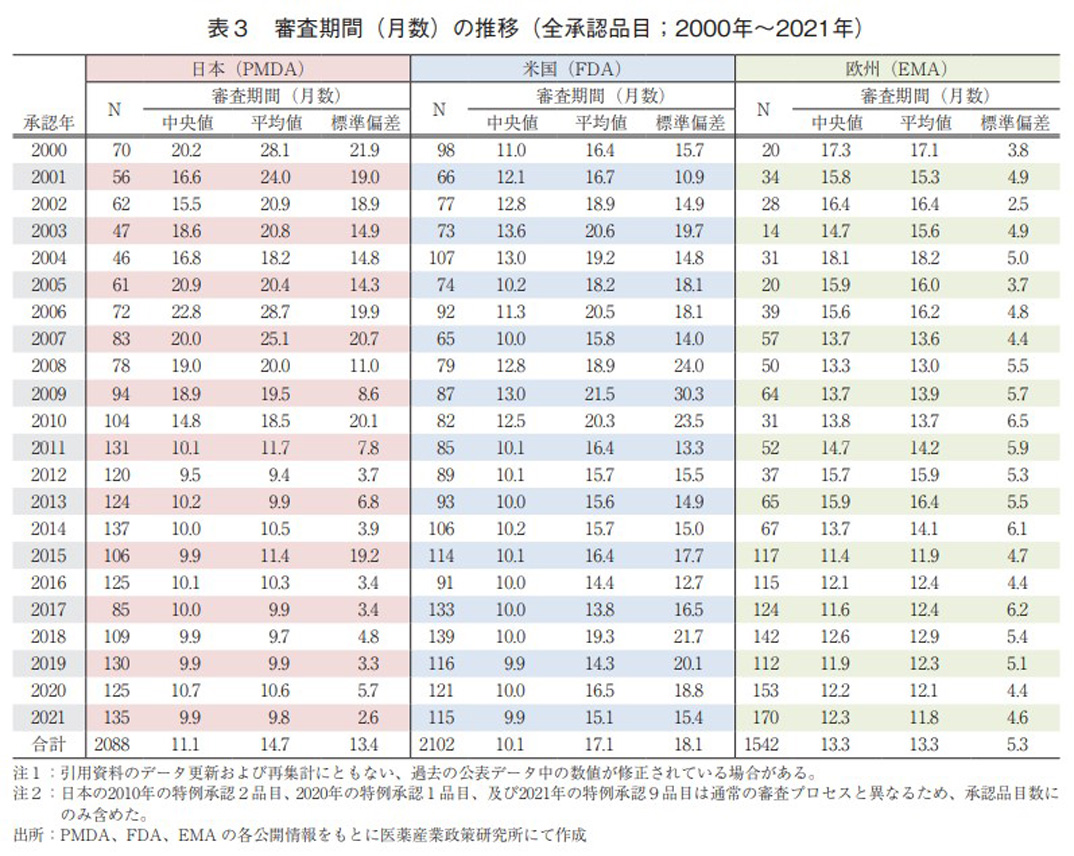
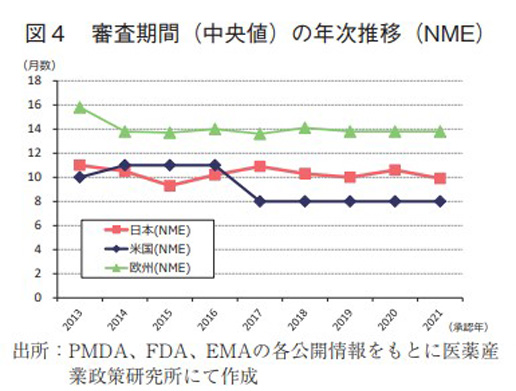
一方、NMEについて調査対象の全期間における審査期間(中央値)は、日本10.2ヶ月、米国8.1ヶ月、欧州14.1ヶ月であった(表4)。2021年の審査期間(中央値)は、日本9.9ヶ月、米国8.0ヶ月、欧州13.8ヶ月であり、各地域とも昨年と同じ、もしくは短い審査期間であった。2014~2016年の期間については、日本におけるNMEの審査期間(約10ヶ月)は米国よりも短く推移していたが、2017年に米国におけるNMEの審査期間が3ヶ月短縮し、以降は米国、日本、欧州の順で現在まで推移していた(図4)。
COVID-19医薬品の審査期間の日米欧比較
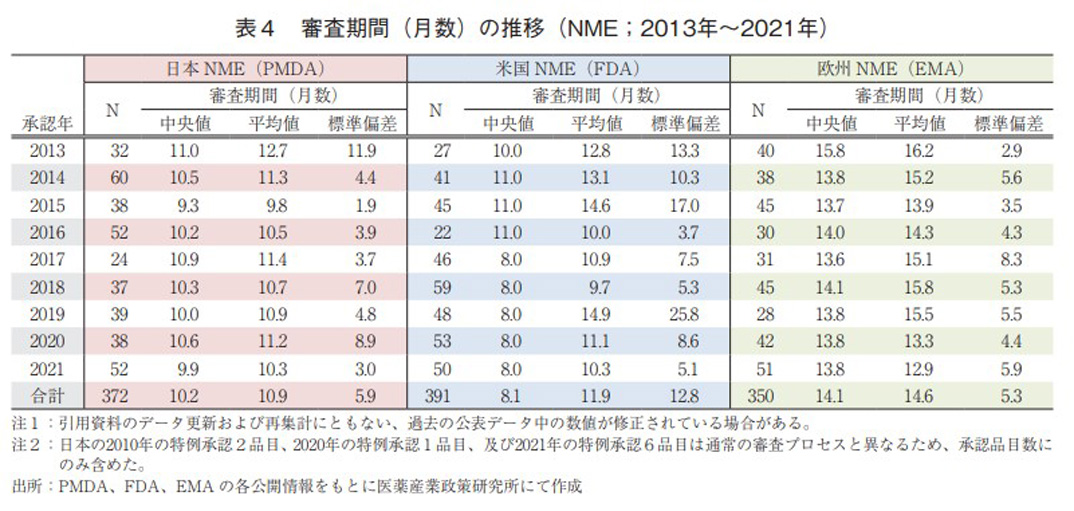
これまでの集計では、日本の特例承認品目について審査プロセスの違いから中央値等の算出から除外していた。特例承認品目には、COVID-19の治療薬が多く該当している。これまでも政策研では調査報告を重ねており、政策研ニュース第64号2)ではCOVID-19ワクチンの審査期間の日米欧比較を報告している。本稿では日本においてこれまでCOVID-19関連で承認されたワクチン以外の低分子薬及び抗体薬に区分される特例承認に係る品目と各々の審査期間を表5に示す。なお、同品目の一部変更承認は除外して集計した。
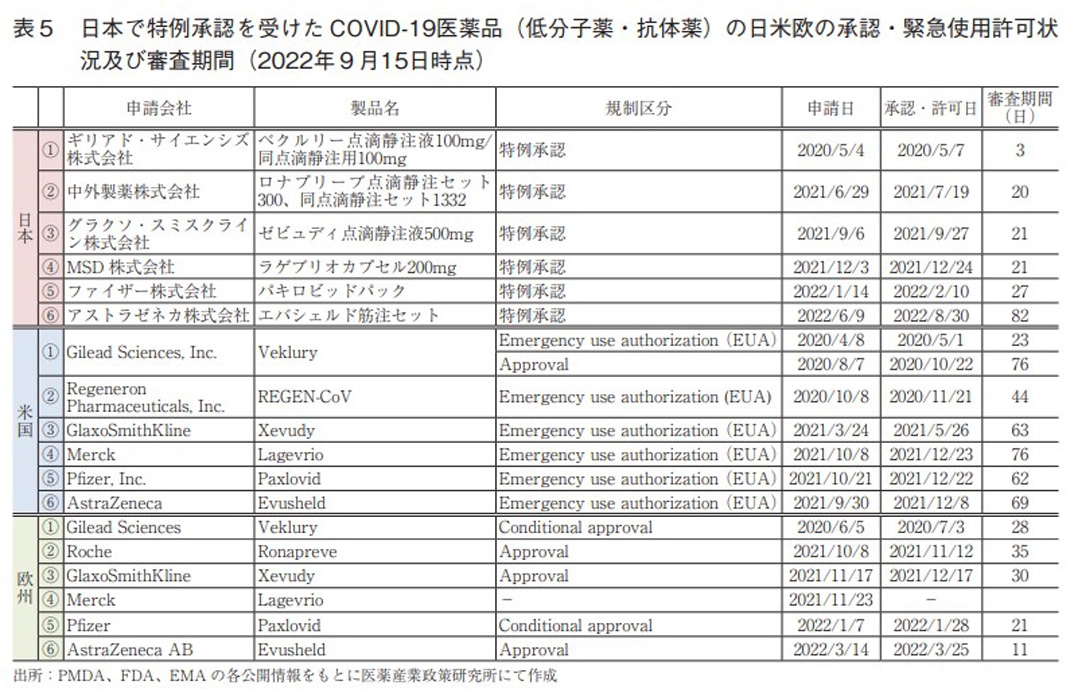
各極での薬事上特別措置の違い、及び各制度での指定要綱については、政策研ニュース第64号2)で詳細に報告している。事前審査の状況などがあるが故に、各医薬品の審査期間の直接的な比較は容易ではないことを留意されたい。
本邦では2020年から全6品目が特例承認されており、審査期間の中央値は21.0日、平均値は29.0日、標準偏差は27.2日であった。直近の1品目を除くと全て4週以内で承認されており、海外での実績があるにせよ、緊急性高く承認が為されていることが確認できた。
米国の特徴として3極の中で一番早く申請・承認・使用許可がなされており、その審査期間の中央値は63.0日、平均値は59.0日、標準偏差は19.3日であった。国際間で初の審査が行われる状況下では、審査期間が他の地域と比較し長くなるのは当然とも考えられる。
欧州は1品目未承認の医薬品があり、5品目での審査期間中央値は28.0日、平均値は25.0日、標準偏差は9.3日であった。治験データの段階的提供によるRolling review(逐次審査)が上手く活用され、円滑にばらつきが小さく承認あるいは条件付き承認が為されている印象である。ただし、未承認薬の今後の承認状況によっては統計量が大きく変化するので、注意が必要である。
バイオ医薬品の審査期間の日米欧比較
近年、従来型の低分子医薬品と比較しバイオ医薬品の存在感が増しており、前報の医薬品市場の上位100品目の世界売上高の割合において、半数以上を占めていることが報告されている14)。これに関して、バイオ医薬品に係る承認期間および特例措置の面から各地域の比較を試みた。まず本検討を行った背景を記す。バイオ医薬品は低分子薬に比べその高い指向能力から、疾病原因により直接的に効力を発揮し、故に有効性や画期性が高く、多くの薬事上の特別措置を受けているのではないか、と仮説を立てた。その結果、審査期間にも何らかの変化がみられないか、と考えた。
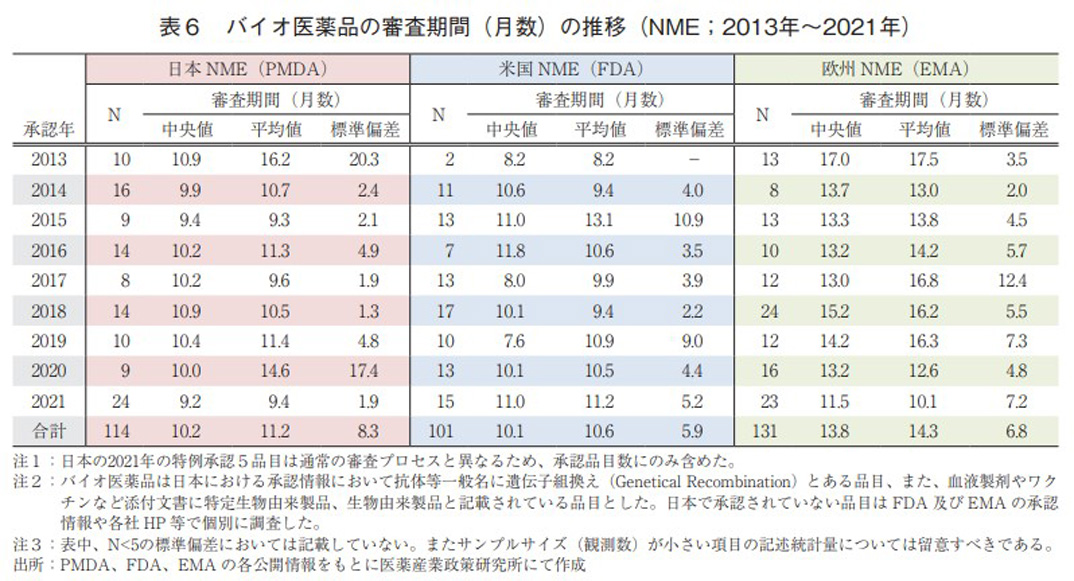
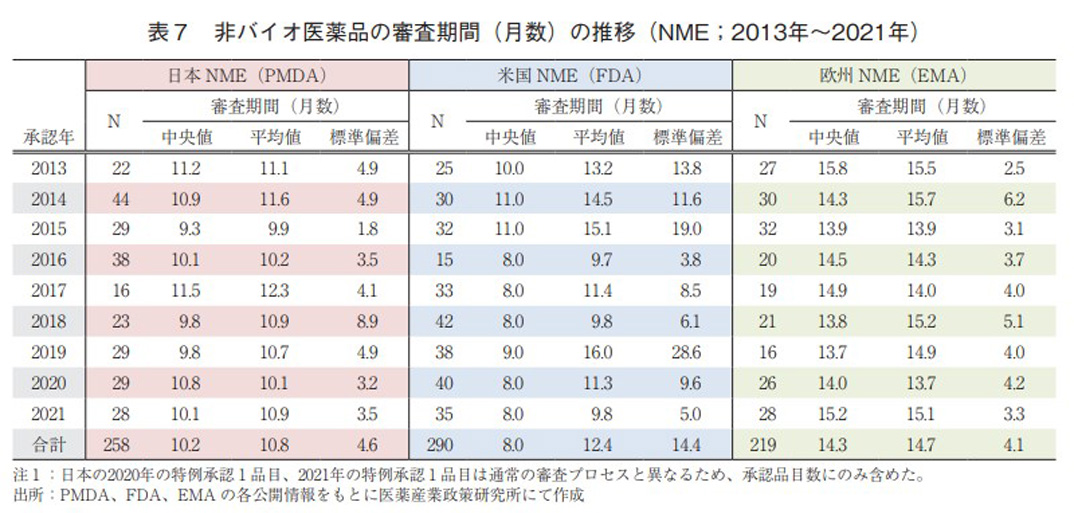
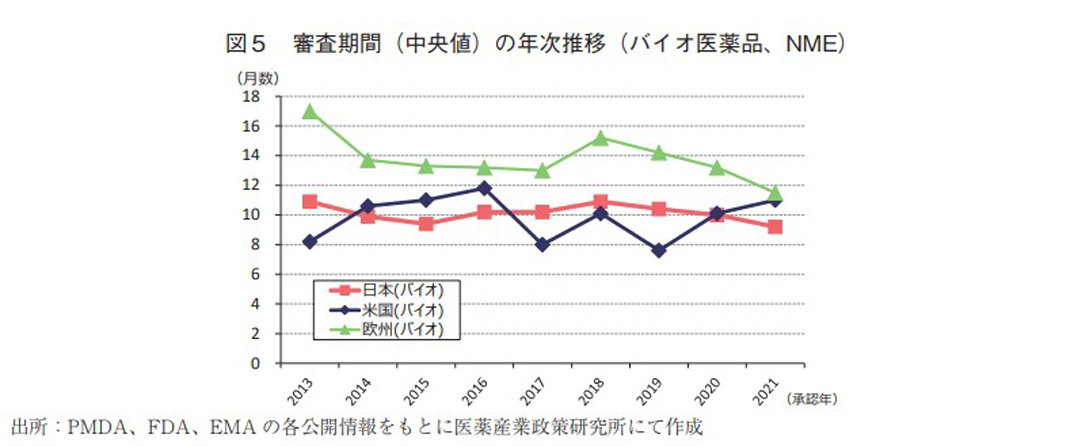
日本、米国、及び欧州で承認されたバイオ医薬品のNMEにおける承認年毎(2013~2021年)の審査期間(月数)を表6に、審査期間の中央値の年次推移を図5に示した。日本では集計年全体では114品目のバイオ医薬品がNMEとして承認されており、全体の承認期間(中央値)は10.2ヶ月であった。特に2021年の品目数が近年では非常に多く24品目承認されていた。米国での承認は101品目であり、承認期間(中央値)は10.1ヶ月であった。年毎の承認期間(中央値)がばらつく結果が見られた。欧州での承認は集計年全体で131品目であった。一方、全体の承認期間(中央値)は13.8ヶ月であったが、2018年以降迅速化の傾向がみられた。比較参考として非バイオ医薬品のNMEにおける承認年毎(2013~2021年)の審査期間(月数)を表7に示す。
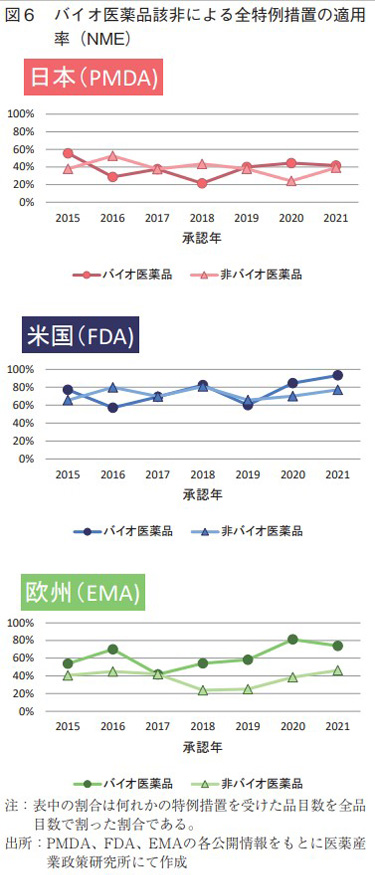
次に、日米欧で2015~2021年に承認されたバイオ医薬品のNMEのうち、各地域の薬事上の特別措置を受けた比率をバイオ医薬品該非に分けて調査した(図6)。日本および米国では、単年ごとの相違はあれども、バイオ医薬品と非バイオ医薬品の割合は凡そ近しい傾向にあり、重なるような推移が見て取れる。一方、欧州ではバイオ医薬品が薬事上の特別措置を受ける比率において調査期間内では常に非バイオ医薬品以上であることが確認できた。
考察とまとめ
本稿では、日本、米国、及び欧州で2021年に承認された新医薬品の承認品目数および審査期間について、それぞれの規制当局の公表情報を元に集計、比較調査した。
2021年の承認品目数は、過去7年間において、日欧で最高水準であり、米国でも高水準の承認状況であった。2020年から本格的にCOVID-19流行による様々な制限や影響が表面化する中、少なくとも医薬品の承認という面では企業、審査当局、さらには承認へのデータを取得する為の治験を実施した病院施設を含め、まずは一番困難な時期を巧みに乗り越えられたのではないだろうか。但し、仮に治験の遅延など影響があった場合、承認数に直結するのはもう少し時間を要するだろうことから、今後の動向にも注意を向けておきたい。
薬事上の審査期間項目について、特徴として表1および表2にあるように、2021年は日本において承認期間のばらつきが非常に小さかった年であった。一点、先駆け審査指定制度において目標の6ヶ月に間に合わなかった品目が1品目あったが、当局より理由が明示されている15)。(①資料提出から承認申請まで期間が短かった、②審査目標期限内での臨床試験結果の確認が困難、③がん原性試験成績の再評価が必要など)。審査期間が短いことは勿論のこと、安定的であることは、医療従事者含め各ステークホルダーに堅牢な予測と準備を可能にさせ、なにより新しい医薬品を待つ患者さんに明るい希望を着実にもたらすことができると考える。今後も迅速かつ着実な審査が継続することに期待して止まない。
薬事上の特別措置においては、重篤な疾患に対して高い有効性が期待される医薬品について、先駆け審査指定制度、Breakthrough Therapy、PRIMEなどが昨年と比較し減少する結果となった。とりわけ2021年での確たる要因を見い出せてはおらず、今後の推移も注視すべきだが、傾向が継続するようであればアンメット・メディカル・ニーズの高い領域の医薬品アクセスに対する課題ともなり得るので、注視する。とりわけ、日本においては画期性の高い医薬品のアクセスを良好にすべく、先駆的医薬品等指定品目が増加するか否かに注目したい。
COVID-19に関する日本の特例承認品における日米欧比較について、まず米国が緊急使用許可日ならびに承認日が早く、審査期間が長いことは特徴として挙げられる。これを日欧が追随して許可・承認している図式であるが、これは感染状況の経緯と医薬品開発の世界での立ち位置が如実に表れていると考えた。即ち米国はCOVID-19の累積患者数が世界でワースト1である時期が最も多く、医薬品が最も必要とされる地域であった16)。加えて、そもそも医薬品の開発で世界の中心であることも起因する。一方日欧はそういった米国事例を横目に見つつの当局判断となったが、2極あるいは各医薬品で事前審査有無の違いがあれ、正式申請後ほぼ20~30日であったことは興味深い。無論、個々の審査状況あるいは使用場面の違いにより、長短の例外を認めるが、ある種、緊急的・特例的な案件の手続きに要する最短期間の一端ともいえよう。
バイオ医薬品該非別の調査について検討した結果、表5および表6の数値比較において、明確な審査期間の差は認められなかった。日本ではバイオ医薬品該非に問わず10.2ヶ月で同等、欧州ではバイオ医薬品で若干の差が見られたものの、反して米国ではバイオ医薬品が長い結果となった。また図6にあるように、日米ではバイオ医薬品であるからといって薬事上の特別措置を受ける比率はあまり変わらないという事実がある。欧州は特別措置を受ける比率が非バイオ医薬品より高く、それが若干の期間差につながった可能性もある。総合的に考察すると、バイオ医薬品に該当するか否かは承認期間を左右するとは言い難く、各特例措置の適用率の差を考慮すべきである。日米欧3極の審査期間をプールし追加解析(詳細非開示)を行った結果、薬事上特別措置の適用率向上は全品目の審査期間の短縮に寄与することが示唆されたものの、効果は小さく、適用外品目の審査期間の延長によって効果が相殺されている可能性が示唆される。
ここまで、日本(PMDA)、米国(FDA)、及び欧州(EMA)における承認状況と審査期間、および、薬事上の特別措置を調査してきたが、各地域とも通常審査に比べ迅速な承認を実現していることが確認できた。補足(Page 138)にまとめたように、薬事上の各種特別措置は重要な意味を持って制定されており、その活用は医薬産業が社会に貢献できている裏付けとなる。医療科学技術の進歩にうまく対応し、いかに高水準の医療を適時的に提供できるかが鍵となるであろう。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較-COVID-19ワクチンの事例も踏まえた日本の課題-」政策研ニュース No.64(2021年11月)
-
3)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間-2021年承認実績と日本市場のグローバル化の現状-」政策研ニュース No.65(2022年3月)
-
4)医薬産業政策研究所.「ドラッグ・ラグ:国内未承認薬の状況とその特徴」政策研ニュース No.63(2021年7月)
-
5)医薬産業政策研究所.「ドラッグ・ラグ:国内NME承認品目の上市状況-米国・欧州との上市時期比較-」政策研ニュース No.63(2021年7月)
-
6)医薬産業政策研究所.「ドラッグ・ラグ:未承認薬は日本のアンメット・メディカル・ニーズに応えうるか?」政策研ニュース No.66(2022年7月)
-
7)医薬産業政策研究所.「ドラッグ・ラグ:なぜ、未承認薬が増えているのか?」政策研ニュース No.66(2022年7月)
-
8)
-
9)
-
10)
-
11)主な各極の調査対象範囲外の薬事承認は以下の通り。日本では、PMDAホームページの「新再生医療等製品の承認品目一覧」に掲載されている製品を対象としていない。米国では、FDA Center for Biologics Evaluation and Research(CBER)対象品目(ワクチン、血液および血液製剤、組織およびその他バイオ医薬品)は集計に組み入れていない。また、「New Drug Application(NDA) and Biologic License Application(BLA) Efficacy Supplement Calendar YearApprovals」に掲載の適応・効能追加の承認は調査対象範囲に含まれない。なお、各極のNMEについては、調査対象年に日本の申請区分が「新有効成分含有医薬品」、米国の「New Molecular Entity(NME) Drug & Original BLACalendar Year Approvals」に掲載、欧州の「New active substance」に分類されて薬事承認を受けていれば、過去に同一有効成分が承認されている場合でもNMEとして集計している。
-
12)先駆け審査指定制度は、2019年11月に改正薬機法が成立、2020年9月に施行されたことで法制化され、新たに先駆的医薬品指定制度として創設された。2022年9月現在、先駆的医薬品に指定され承認を得た医薬品はまだない。
-
13)秦利幸、伊藤好美、小池恒、河野典厚、「先駆け審査制度について」薬剤学、76(6)、402-409(2016)
-
14)医薬産業政策研究所.「世界売上高上位医薬品の創出企業の国籍-2021年の動向-」政策研ニュース No.67(2022年11月)
-
15)
-
16)

