Points of View 新モダリティの開発動向調査 - mRNA とマイクロバイオーム-
医薬産業政策研究所 主任研究員 高橋洋介
はじめに
近年、多様な創薬モダリティ(以下、モダリティ)が医薬品として実用化され始めており、医薬産業政策研究所ではこれまでに様々な刊行物において最新の動向を報告してきた1)、2)。中でも政策研ニュースNo.55では、核酸医薬、遺伝子治療、細胞治療の3つのモダリティに関して重点的に最新動向を報告している3)。本稿においては、それ以降に新しく実用化されたモダリティとしてmRNAを、そして今後まもなく実用化されるであろうモダリティとしてマイクロバイオームを取り上げ、最新動向を紹介することとしたい。
なお、mRNAは広義の核酸医薬の一モダリティであると解釈することも可能であるが、現在実用化されている核酸医薬(アンチセンス核酸やsiRNAなど)の多くは化学合成によって製造される分子量が数千から数万台前半の分子である一方で、mRNAは生物学的手法によって製造される分子量数万~数十万の分子であり、モノとして大きく性質が異なることから別モダリティとして取り扱うこととした。また、マイクロバイオームは元来微生物叢を指す用語であり、必ずしも医薬品としてのモノを指す用語ではないが、本稿ではマイクロバイオームに対して様々な影響を与えるモノについて広く俯瞰した上で、特に医薬品として研究開発の進んでいる領域について掘り下げて考察することとする。
1章 mRNA
mRNA(messenger RNA)とは、RNA(リボ核酸)の一種であり、ヒトをはじめとした多くの生物で共通に保存されている遺伝情報伝達物質である。分子生物学の基本的な概念であるセントラルドグマ「DNA→(転写)→mRNA→(翻訳)→タンパク質」という遺伝情報伝達の中で、mRNAは重要な役割を担っている。mRNAを医薬品として応用し投与するということは、セントラルドグマを鑑みるとタンパク質を補充しようとするアプローチに近い。なんらかの要因により、あるタンパク質が量的に減少し疾患発症につながっている場合には、当該タンパク質を補充することで疾患治療につながる可能性が高く、言わば遺伝子治療的な用途でmRNAを用いることが出来る。一方で、元来生体内に存在しないタンパク質を生体内に供給しようとする場合には、当該タンパク質は生体内で異物として認識されやすく、その結果として免疫系を賦活化(獲得免疫)することでワクチンとしての応用可能性が広がる。
COVID-19パンデミック下において、mRNA技術はワクチンとして実用化され、公衆衛生の向上に多大な貢献を果たしたことから、非常に注目度の高まっているモダリティである。本稿では、mRNAに関連する医薬品の研究開発動向を俯瞰し、今後のmRNA医薬品に関して展望してみたい。次いで、日本で承認されている2種のmRNAワクチンとして、ファイザー社/ビオンテック社のコミナティ筋注及びモデルナ社のスパイクバックス筋注を取り上げ、生体内に元来存在している天然型のmRNAと比較しながら、どのような革新的な科学技術が組み込まれているのかを分析するとともに、同時にさらなる研究開発の余地についても考察してみたい。
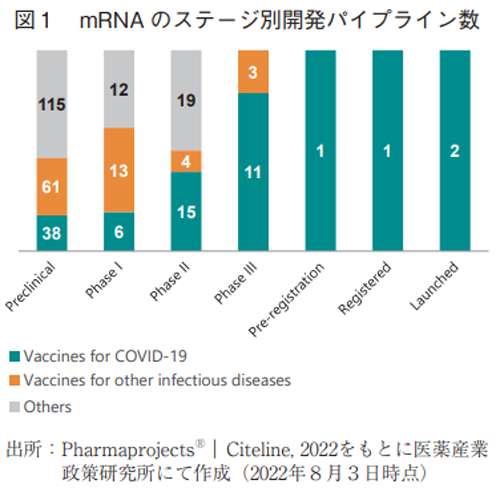
医薬品データベースであるPharmaprojectsを用いて、mRNA医薬の開発パイプラインの現状(開発中止されているものは除く)について、網羅的に検索した4)。図1では、各ステージ別のパイプライン数を、COVID-19に対するワクチン、COVID-19以外の感染症に対するワクチン及びそれ以外(主に治療薬であるが、がんワクチンもここに分類される)に分類して示した。調査の結果、上市済み(Launched)のmRNA医薬は2品目で、申請段階(RegisteredとPre-registration)に2品目という状況であり、これらはいずれもCOVID-19に対するワクチンであった。Phase IIIには合計14品目存在し、このうち11品目がCOVID-19に対するワクチンで(変異株に対するワクチンは別カウント)、高い割合を占めていた。早期段階の品目になればなるほどCOVID-19に対するワクチンの割合は低く、その他の感染症ワクチンとしての開発品やOthersに分類されるパイプラインが数多く存在していた。Othersの中には、がん治療薬(がんワクチン)や単一遺伝子欠損に基づいて発症する遺伝性疾患を適応とするものが複数存在しており5)、今後mRNA技術は感染症予防ワクチンとしてだけではなく、様々な疾患へと応用範囲が拡大していくことが期待される。
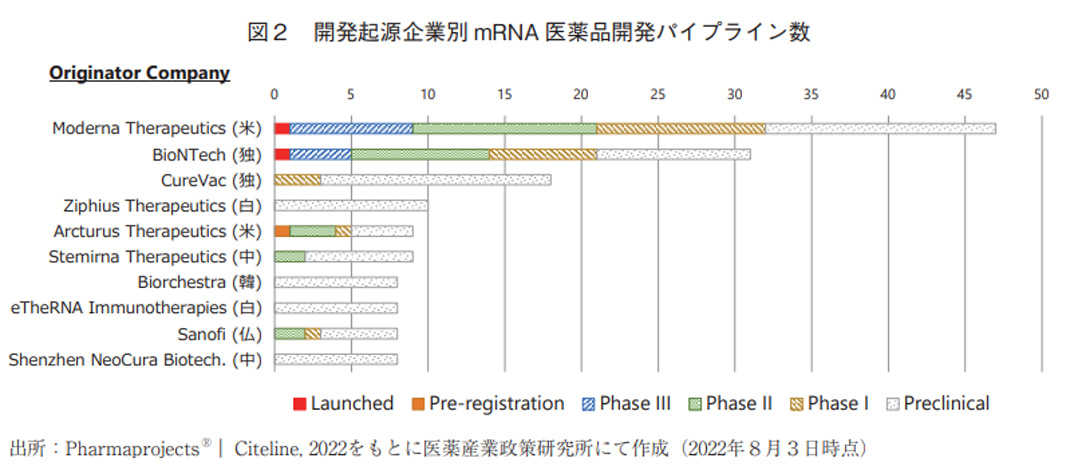
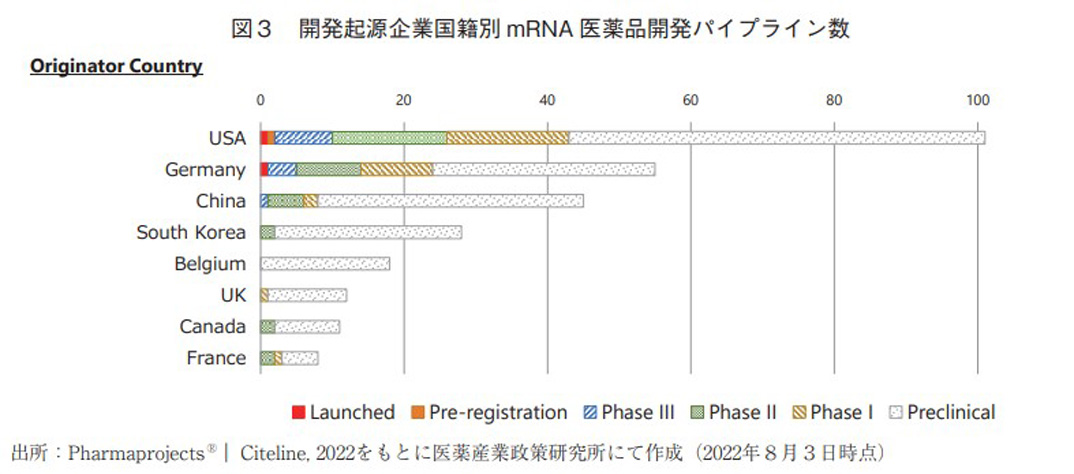
また、これらmRNA医薬の開発パイプラインを、オリジネーター企業またはオリジネーター企業の国籍別に分類して図2及び図3に示した。パイプラインを最も多く保有しているのはModernaTherapeutics(モデルナ社、米国)で、それに次ぐのがBioNTech(ビオンテック社、ドイツ)であった。実際にこの上位2社からCOVID-19ワクチンが実用化されており、またこの2社は他社と比して後期臨床段階まで進んだパイプラインを多数保有していることから、mRNA医薬領域で特に高い研究開発力を有している企業と考えられる。企業国籍別に分類すると、先述の2社が存在する米国とドイツが上位の2か国を占めた。それに次いで、中国、韓国、ベルギーの順でランク入りしており、日本企業の存在感は薄かった(2022年8月3日の調査時点において、日本企業オリジンのパイプラインは1品目のみ)。
mRNAは元来生体内に存在している機能性分子であり、これを医薬品として応用することは極めて合理性の高い戦略であると思われるが、実際には様々な課題が存在しており、実用化に至るまでには山あり谷ありのドラマチックなストーリーが存在する。その物語は他の記事6)で詳細に記述されているので本稿での紹介は避けることとし、本稿では先んじて実用化されたファイザー社/ビオンテック社(以降では、日本での製造販売元であるファイザー社とする)及びモデルナ社のmRNAワクチンに組み込まれている様々な要素をそれぞれの添付文書7)、8)、9)、10)やインタビューフォーム11)、12)を通して俯瞰しながら、それぞれの要素に対してどのような最適化研究の余地があるのかを考察することとする。また、本稿執筆中の2022年9月12日に、ファイザー社及びモデルナ社のオミクロン株BA.1に対応した2価ワクチンが承認(特例承認)された。以降では、特に断りのない場合には起源株に対する1価ワクチン(従来型ワクチン)に関して言及することとし、従来型ワクチンから2価ワクチンにおいて変更された点についても一部では言及することとする。
修飾核酸
両ワクチンともに、RNAを構成する塩基部分(AGCU)のU(ウリジン)をN1-メチルシュードウリジンに置換するという塩基部位の修飾が施されている。これは野生型mRNAを投与した場合に生じる過剰な免疫応答(副作用)を回避する目的で採用されたものであり、現ビオンテック社上級副社長であるカタリン・カリコ博士らの研究成果13)に基づいている。この画期的な研究成果がmRNAを医薬品として応用する上でのターニングポイントとなったことは間違いないが、ここには更なる改良の余地が存在するかもしれない。修飾核酸に求められる要件として、(1)安全性の高さ(自然免疫の回避)、(2)DNAベクターからmRNAへの高効率かつ高精度な転写(RNAポリメラーゼの反応性)、(3)mRNAから目的タンパク質への高効率かつ高精度な翻訳(リボソームでの反応性)、などが考えられる。これらのバランスを取りながら最適の修飾核酸を見出すことは容易ではないが、mRNAが実際に医薬品として応用可能であることが実証された今だからこそ、徹底的かつ緻密な最適化研究の余地があるのではないだろうか。
製造/製剤化/保管方法
通常mRNAはDNAベクターをベースとし、転写酵素(RNAポリメラーゼ)を用いた生物学的手法によって合成される。実際に、コミナティ筋注(ファイザー社)のインタビューフォームやスパイクバックス筋注(モデルナ社)のインタビューフォームを見ると、具体的にどのようなRNAポリメラーゼを用いているかまでは判別出来ないものの、生物学的手法によって製造されていることが記載されている。製造方法のさらなる改良の余地としては、製造原料としてのDNAベクターへの改変(転写効率を高める改変など)、転写酵素の改良(転写効率を高める、転写精度や純度を高めるなど)、mRNAの精製方法、安定性の高い保存方法の開発など、さらなる技術開発の余地があるかもしれない。2社のワクチンでは、添加剤の成分や含有量が異なり、また投与時の調製方法(溶解後に直接投与するか、生理食塩水で希釈してから投与するか)なども異なっている。さらに、2社ともに従来型ワクチンと2価ワクチンでは製剤/添加剤に変更点があり、ファイザー社のワクチンでは投与液調製時の生理食塩水による希釈が不要になった他、添加剤の組成なども変更されている。モデルナ社のワクチンでは、製剤中の有効成分の濃度などが変更されたことに基づく投与液量の変更や、添加剤の濃度なども変更されている。これら変更点の理由は明確でないものの、従来型ワクチン実用化後に蓄積された様々な研究成果や情報、医療従事者などのワクチン使用者の声などが反映され、よりよいワクチンへと改良が施されたということではないだろうか。このようにワクチンとして用いる場合には通常の医薬品以上に大量生産・保管方法・流通方法などを考慮することが重要となり、これらの要素を一つずつ最適化することが必要だろう。
DDS方法
ファイザー社及びモデルナ社のワクチンでは、ともにLNP(Liquid Nano Particle)が輸送担体として用いられている。LNPによって体内動態(組織移行性・細胞内移行性)の制御が可能となるだけでなく、内包するmRNA自体の安定化やさらにはワクチンのアジュバント効果にも関与するとされている。LNP自体は核酸医薬(オンパットロ)などで実用化実績はあるものの、まだまだ発展途上の技術であり、さらなる最適化研究の余地があるのではないだろうか。2社の従来型ワクチンを比較すると、それぞれ異なる成分から構成されるLNPが用いられている。両者のワクチンそれぞれについて、従来型ワクチンから2価ワクチンでLNPの変更がないか確認したところ、ファイザー社では大きな変更点はなく、モデルナ社では僅かながらLNP の構成成分の一つ(PEG脂質)に関して濃度が変更されている。この変更理由は明らかではないが、蓄積された情報をもとに改良が施されたということであろう。
一方で、ワクチンとしてではなく遺伝子治療としてmRNAを用いる場合には、ワクチンとは標的組織指向性などで特徴の異なるLNPが必要となるだろう。もしくは、さらに視野を広げてmRNAのDDS全体を捉える場合には、将来的にはLNPに変わる優れたDDS手法が見出されるなどの研究開発の進展に期待したい。
その他
上記以外にも様々な点で改良研究の余地がある。例えば、抗原部位の設計(アミノ酸配列)、mRNAのコドン最適化(例えば、プロリンの場合CCU、CCC、CCA、CCGのいずれを用いるか)、キャップ構造、至適投与量の設定(ワクチンと遺伝子治療などの目的によって異なる)、投与部位や投与方法(最適な投与部位の検討、投与器剤の開発など)、化学合成による製造方法の確立などが考えられる。
mRNA 全体考察
以上、実用化された2種のmRNAワクチンに含まれる様々な要素技術について分析をし、今後の研究開発の発展性に関して考察を行った。COVID-19パンデミックという有事において、それまでに蓄積されてきた様々な基礎研究成果とmRNAの実用化研究の経験14)を結集し、画期的なワクチンが速やかに創製されたことは注目に値する出来事であるが、同時に平時における備えとしての基礎研究と実用化研究の推進の重要性も再認識させられた。
COVID-19パンデミックはまだ収束したとは言えない状況であるが、今後も様々な新興感染症が人類を襲ってくる可能性が高く、さらに優れたワクチンを創製できるように備えなければならない。先述した通りmRNA領域での日本企業の存在感が薄い現状であるが、日本国民の健康を守るためには海外企業に頼るのではなく日本企業が画期的なワクチンを創製できる基盤を整備することが経済安全保障の観点から重要となる。様々な要素技術が含まれているmRNAワクチンにおいて、日本の強みを活かせる領域で研究開発を進展させることも一案である。例えば、LNPは数種類の低分子~中分子で構成されているため、低分子創薬で実績を持つ日本の製薬企業の強みを発揮出来る領域かもしれない。mRNAワクチン創製には様々な要素技術の組み合わせが必要不可欠であることから、競争領域(mRNAの配列など、医薬品としての根幹にあたる部分)においては各製薬企業での取り組みが重要にはなるが、非競争領域もしくは非競争とまでは言えなくとも協働可能領域(DDS方法、安全性を高める方法、製造方法などの周辺技術)については、オールジャパンのコンソーシアムなどで基礎研究を推進して日本独自の技術を確立するということも考えられる。日本独自の技術の知的財産権を確保出来れば、コンソーシアム加盟企業が共通して利用可能となり、有事の際には協調的に国産ワクチン開発に応用することが出来る体制への備えとなり、また海外企業に実施権を与えていくことは、ヘルスケア領域での国際貢献と同時に、日本の経済成長にも貢献出来る可能性がある。また、前述した通りmRNAについてはワクチン以外の用途に応用出来る可能性も秘めており、特にタンパク質補充を目的とした遺伝子治療への応用が期待される。遺伝子治療の場合には、適応疾患毎に異なる標的組織/細胞に送り届けるためのDDS手法などは競争領域となりえるが、この場合でも一定の協働可能領域は存在していると考えられ、日本の国際競争力を高めるためにもコンソーシアムとして取り組む意義があるのではないだろうか。
2章 マイクロバイオーム
ヒトの腸内には約1,000種、約100兆個の腸内細菌が存在しているとされており15)、一人の人間を構成する全細胞数は37兆や60兆個と言われていることから、人の全細胞数をしのぐほどの多数の腸内細菌と共存している状況である。このように様々な微生物が共生している環境・総体がマイクロバイオームとして定義され、腸内以外にも口腔や鼻腔など様々な表面粘膜上におけるマイクロバイオームに関する研究が活性化している。腸内細菌を大まかに分類すると、善玉菌・悪玉菌・中間菌の3つに分類することが可能であり、これらの腸内細菌の存在バランスが健康状態に密接に関連している。腸内細菌のバランスは、食事や年齢、生活環境などの影響を受けるとともに、肥満、糖尿病、大腸がん、動脈硬化症、炎症性腸疾患などの疾患に罹患することによっても変動すると言われている16)。近年では、乱れた腸内細菌のバランス(dysbiosis、ディスバイオーシス)を元に戻すことで疾患治療につながるのではないかとの考えのもとに、様々な研究アプローチが進行中であり、本稿ではこれらについて概説することとする。
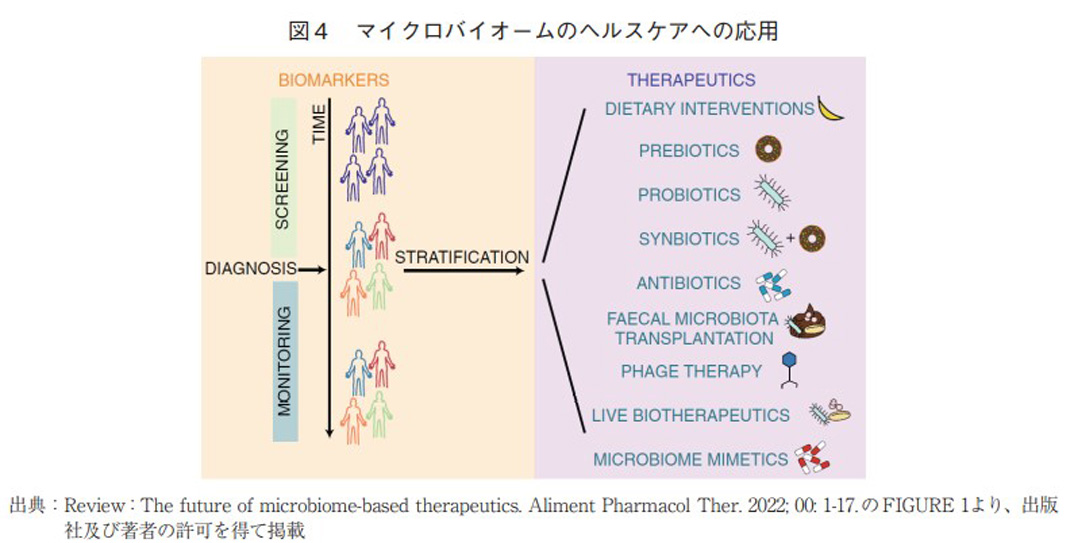
マイクロバイオームに関する研究領域について、Gulliverらは図4のように、疾患の診断や患者の層別化などにマイクロバイオームを活用するBIOMARKERS領域(左側)、人や患者の健康に介入し健康増進や疾患治療等に応用しようとするTHERAPEUTICS領域(右側)の2領域に分類している17)。本稿では、THERAPEUTICS領域に分類される各要素について解説することとする。
- (1)DIETARY INTERVENTION:食事療法と言い換えることも可能であり、特定の疾患などにおいて腸内環境を考慮に入れた上で用いられる食事のことを指す。流動食や、特定の成分(添加物、グルテン、FODMAPs18)など)を含まない食事などがこれに該当する。
- (2)PREBIOTICS:腸内に存在する特定の菌(特に善玉菌)を増やす作用のある食品を指し、食物繊維やオリゴ糖などが典型例として挙げられる。
- (3)PROBIOTICS:生体に良い影響を及ぼす菌(乳酸菌やビフィズス菌など)を含む食品を指し、ヨーグルトや納豆などが典型例である。歴史的に食品やサプリメントとして人が接種してきたもので、安全性が十分に確認されている食品である。
- (4)SYNBIOTICS:PREBIOTICSとPROBIOTICSを組み合わせて食品として接種されるものを指し、PROBIOTICSの効果を最大化することを意図したものである。
- (5)ANTIBIOTICS(抗菌薬):腸内細菌に影響を与える医薬品であり、広義のマイクロバイオーム関連創薬に含まれる。
- (6)FECAL MICROBIOTA TRANSPLANTATION(FMT):糞便移植のことを指し、善玉の菌を含むドナーの便をディスバイオーシス状態である患者の消化管へと移植する手法である。
- (7)PHAGE THERAPY:バクテリオファージを用いて、特定の菌を特異性高く殺傷する方法である。国際社会でも大きな課題となっているAMR(多剤耐性菌)に対する治療法として、ファージセラピーは新しい有望な技術として注目されている。マイクロバイオームに作用する治療法ではあるが、狭義にはPHAGE THERAPYというモダリティとして捉える考え方もある。
- (8)LIVE BIOTHERAPEUTICS:単一もしくは複数の細菌種から構成された医薬品/医薬品候補であり、医薬品や食品としての十分な使用実績のないもの(Genetically modified microorganism;GMMなども含みうる)であるが、PROBIOTICSとの定義は曖昧である場合が多い。医薬品のカテゴリーとして医療用に用いる場合には臨床試験が必要と考えられ、FDAホームページではCenter for Biologics Evaluation and Researchの管轄下でINDや薬事承認が必要であるとされている19)。ほぼ同義でLive Biotherapeutic Products(LBPs)と総称されることも多く、FDAではこの表現が用いられている。
- (9)MICROBIOME MIMETICS:マイクロバイオームと宿主(人)との相互作用を模したものを指し、細菌由来の成分(タンパク質、多糖など)、食品代謝物(短鎖脂肪酸など)、宿主由来の成分などが存在する。
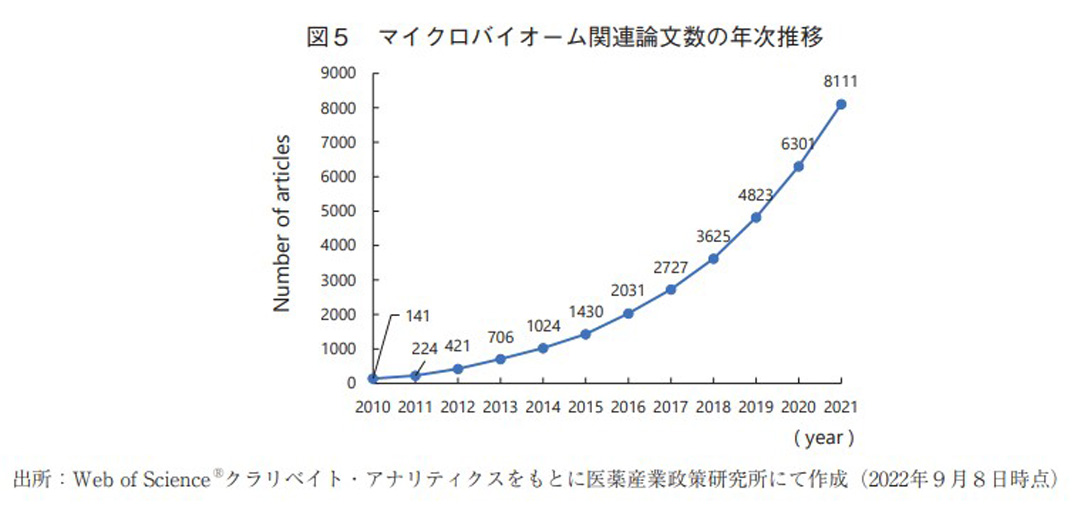
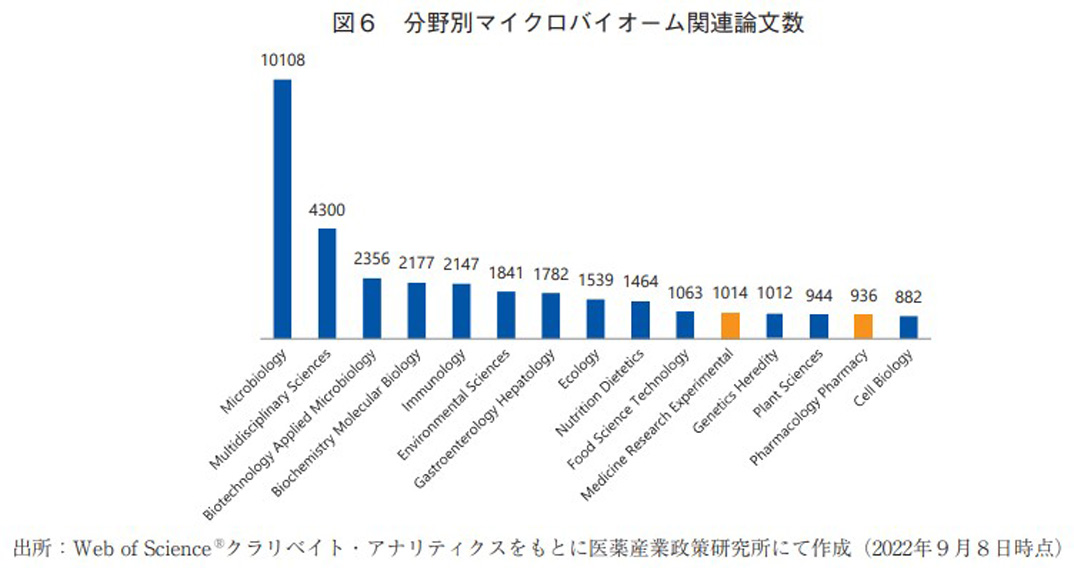
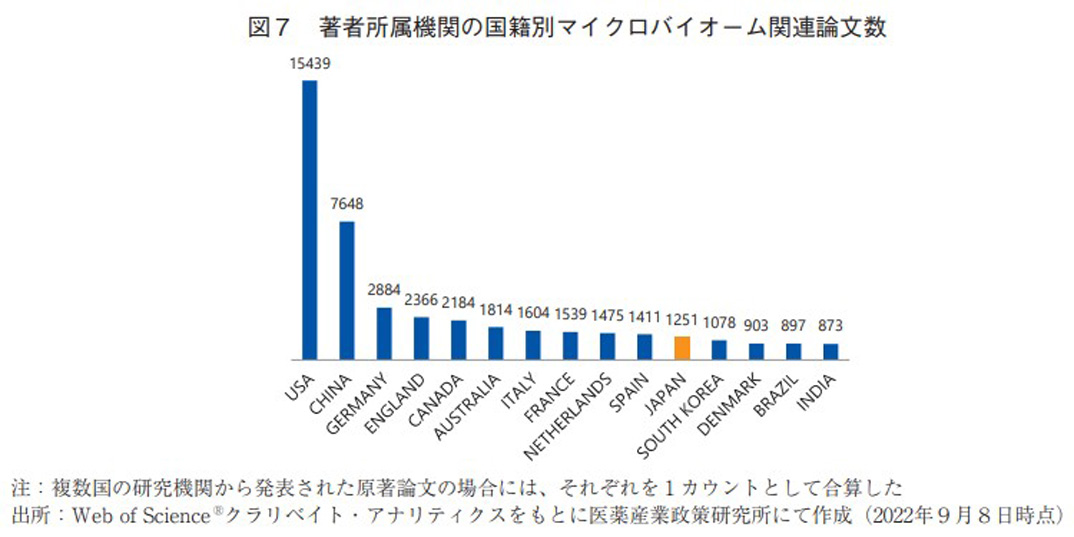
マイクロバイオーム領域の研究動向調査を目的とし、Web of Science(クラリベイト社)を用いて、「トピック:microbiome」と設定した上で原著論文に限定した検索を行った。ヒットした原著論文数の年次推移は図5の通りである。2010年以降の論文数は右肩上がりに上昇し続け、近年ではさらに急峻な伸びを示していることから、本領域の注目度はますます高まっていることが確認できる。さらに論文の分野をWeb of Science上に搭載されている機能20)を用いて分類した。結果は図6の通りであり、医薬品に直接的に関連すると思われるMedicine Research ExperimentalやPharmacology Pharmacyに分類される論文数の割合は限定的であったが、Microbiologyなどのマイクロバイオーム領域の根幹に関わる基礎研究分野の論文数が非常に多く存在していた。将来的には、これら基礎研究の成果が医薬品などへの応用研究につながることを期待したい。また上記検索条件でヒットした論文に対して、著者の所属研究機関の国籍に関する調査も行った。その結果は図7の通りであり、米国、中国の順に多く、日本は11位にランクされた。上位の2国には大きく水をあけられているものの、3位のドイツ以降は比較的僅差で多数の国が並んでおり、マイクロバイオーム領域では日本も一定の研究レベルを保持出来ていると考えられた。
マイクロバイオームがモダリティとして注目を集めることになった最も大きな契機は、難治性C.difficile感染症(CDI)に対してFMTの高い有効性が次々と報告されたことである16)。抗生物質投与などに基づく腸内細菌叢の構成異常(ディスバイオーシス)が引き金となり、病原性のC. difficileが腸内で増殖・定着することでCDIを発症(再発)するが、FMTによって正常な腸内細菌叢を回復させ、治療や予防に効果を発揮するというメカニズムである。それらの報告以降、FMTやLBPsを応用した医薬品としての研究開発が活性化しつつある。医薬品データベースであるPharmaprojectsによってマイクロバイオームに関連する開発中の医薬品候補21)を調査したところ、各段階における開発品数は図8の通りであった。
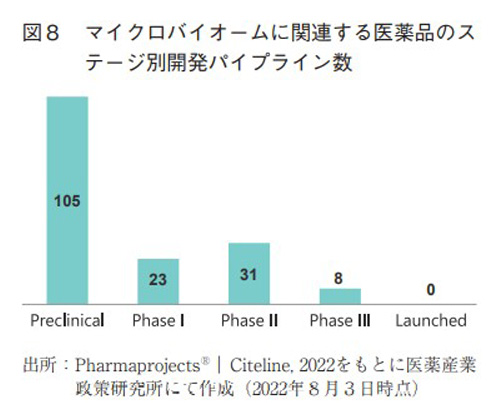
2022年8月現在では上市済み(Launched)の医薬品はなく、最も進んでいるのがPhase III段階にある8品目である。中でも開発が先行しているのは、共に2017年にCDIを適応疾患としてPhaseIIIを開始しているRebiotix社(2018年にFerring社が買収)のRBX2660とSeres TherapeuticsのSER-109の2品目であり、この2品目に関してはコラムとして別項で詳述しているので参照いただきたい。残る6品目については、2019年にPhaseIIIを開始したものが1品目、2021年にPhase IIIを開始したものが2品目、2022年にPhase IIIを開始したものが3品目であり、本稿執筆時点(2022年9月)ではPhase III試験成績に関する具体的な情報は公開されていない。Phase IIやそれ以前の初期のパイプライン数も現時点ではそれほど多くなく、モダリティとしては夜明け目前というような段階であろう。
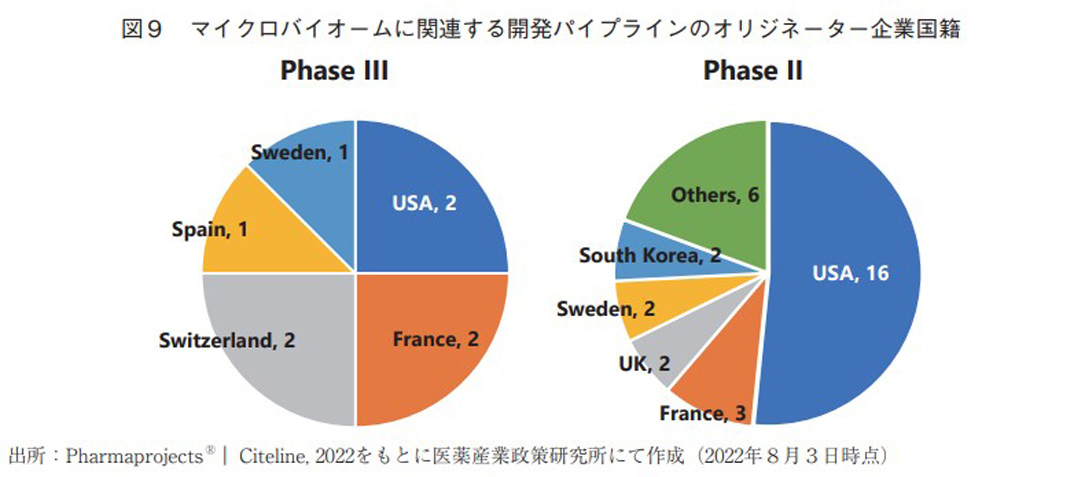
Phase IIIもしくはPhase IIにある開発パイプラインに関して開発企業国籍(HQ)を分析した結果を図9に示した。米国や欧州の企業の開発事例が多く、この中に日本企業に由来する開発品は皆無であった。
Phase II以上のステージにある計39品目の開発品に対して、適応疾患領域のトレンドを分析し図10に示した。感染症領域で9品目あり、そのうちで過去の臨床研究等で最もエビデンスレベルが高いと思われるCDIに対する開発品目が6品目と最多であり、その他の感染症治療薬が3品目であった。
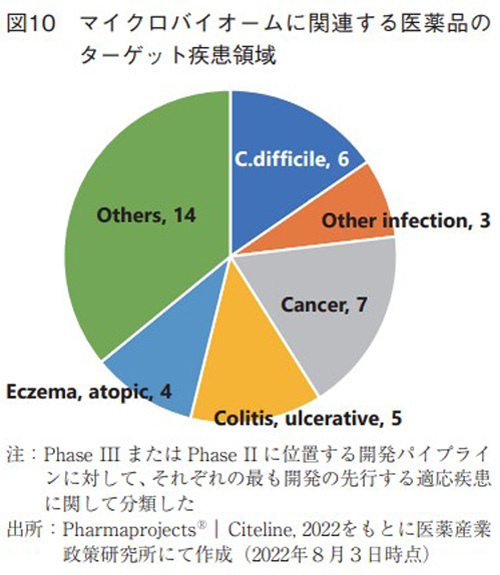
感染症に次いで多いのが、がん領域で7品目であった。マイクロバイオームは宿主の免疫系へ様々な影響を与え、さらには免疫チェックポイント阻害剤の抗腫瘍効果を増大するなど、複数の基礎研究成果が報告されており24)、実際にがん免疫領域での作用を応用した開発パイプラインが多く存在していた。
その他では、腸内細菌の定着する場である腸における疾患(潰瘍性大腸炎など)や免疫系が深く病態に関わるような疾患(アトピー性皮膚炎や食物アレルギー、移植片対宿主病など)で開発事例が多く存在していた。品目数としては多くないものの、不眠症などの神経系をターゲットとした開発品も存在している。脳と腸が自律神経系や液性因子などを介して互いに密接に影響を及ぼしあっていることは「脳腸相関」として古くからよく知られていた事実であるが、近年ではこの脳腸相関に腸内細菌も関与していることが注目され始め25)、様々な疾患や症状(摂食障害、不安障害、自閉スペクトラム症、パーキンソン病など)に関連しているとの研究成果が出て来ている26)、27)。このようにマイクロバイオームに関連した創薬の幅は広がりつつある状況であり、今後の基礎研究の進展には注目しておきたい。
以上、マイクロバイオーム領域に関わる医薬品の研究開発の状況を概観した。現状では、我が国は一定の基礎研究レベルを保有していると考えられたものの、医薬品としての開発研究は世界に比して遅れていることが確認できた。ただし、医薬品としての性質に合致するLBPsやFMTの実用化では遅れているものの、歴史的に様々な発酵食品を食してきた文化的背景から、健康食品分野では数多くの実用化例がある。マイクロバイオームのコントロールが人の健康増進に重要であることは明確であり、具体的な用途や目的に応じて医薬品として開発を進めるべきか、食品/サプリメントとして実用化を進めるべきか、合理的に判断出来ることが重要であり、それを下支えするためのガイドラインや行政体制の整備/構築(適切に審査・認定できる体制)も重要となるであろう。
マイクロバイオームは健康人であっても人種差・個人差・環境差などが大きく、低分子医薬など以上に効能効果において人種差が大きいことも想定される。そのため、マイクロバイオームを医薬品として応用する場合には、海外で実用化された医薬品を日本人にそのまま適用することは難しい可能性が高く、日本人に適した医薬品の研究開発は日本国内で進める必要があるだろう。日本国内ではまだ規制整備などが追い付いていない状況ではあるが、PMDA内にマイクロバイオーム専門部会が設置されて、創薬課題や規制/ガイダンスなどの議論が進みつつある28)。また、2017年には日本マイクロバイオームコンソーシアム(JMBC)が設立され、2022年4月現在で31社の企業や団体が参画し、産学連携を通して産業化を推進しようとする活動も行われている29)。このように、日本国内においてもマイクロバイオームの実用化に向けた様々な試みが開始されている。
COVID-19パンデミックがマイクロバイオーム領域(特に、ドナーからレシピエントへの移植を伴うFMT領域)の研究開発の推進に多大な影響を与えているとの報告もあるが30)、人類がこのパンデミックを乗り越えるとともに、マイクロバイオーム領域の研究開発が進展することを期待したい。
コラム
マイクロバイオーム領域の医療用医薬品として、特に開発先行しているのがRBX2660及びSER-109の2つである。ともにPhase IIIでの良好な成績が報告されており、近日中にもFDAから承認される可能性がある。本コラムではこの2つの開発品について紹介することとする。 RBX2660はRebiotix社というバイオスタートアップ企業に由来する開発候補品であり、現在はRebiotix社を買収したFerring社によって開発が進められている。RBX2660は、ドナー糞便から精製・抽出し調製した腸内細菌カクテルであり、凍結下で保管される。溶解後に液剤として腸内投与して用いられる。RBX2660の腸内投与によって、ディスバイオーシス状態にあった患者の腸内細菌叢を正常化させ、C. Difficile感染(CDI)の再発を予防できるというメカニズムである。Ferring社のホームページ情報によると、RBX2660はFDAからFast Track、Orphan Drug、Breakthrough Therapyの指定を受けており、Phase III試験(PUNCH CD3試験;プラセボ対照、多施設共同、無作為化二重盲検並行群間比較試験として米国及びカナダで実施)での好成績を経て、現在申請段階にある22)。2022年9月22日にはFDAのVRBPAC(Vaccines and Related Biological Products Advisory Committee)が開催され、RBX2660のデータがレビューされた結果、CDIの再発抑制効果及び安全性に関して、ともに過半数の肯定的意見が提示されている。RBX2660の近日中の承認取得が後押しされたと言えるだろう。また、Ferring社はRBX2660に次ぐCDIに対する開発候補品としてRBX7455を有しており、現在臨床段階(2021年よりPhase III)にある。RBX7455は製剤面で改良されており、具体的には凍結乾燥を施した経口投与可能な腸溶性製剤であり、室温保存が可能となっている。
SER-109は、Seres Therapeutics社が開発を進める候補品であり、Orphan Drug、BreakthroughTherapyの指定を受けている。Seres Therapeutics社のホームページ情報によると、Phase III試験(ECOSPOR III試験;プラセボ対照、多施設共同、無作為化二重盲検並行群間比較試験として米国及びカナダで実施)において CDIの再発率の減少などを確認出来たことが報告されており、2022年9月7日中にはBLA(Biologics License Application)のrolling submissionを完了したとプレスリリースが出されている23)。RBX2660と同様にドナー糞便から精製・抽出し調製した腸内細菌カクテルであるが、こちらは経口投与可能な腸溶性の製剤として開発されており、室温保存が可能となっている。なお、SER-109の商業化プロセスでは、すでにスイスのNestle社との業務提携契約が結ばれており、承認後のグローバル展開が見据えられている。
Ferring社の経腸投与のRBX2660を経口投与可能なSER-109が追う構図であり、それをさらにRBX7455が追いかける状況である。近い将来、複数のマイクロバイオーム領域の医薬品が実用化され、人々の健康増進に貢献することを期待したい。
まとめ
本稿では、近年実用化されたモダリティとしてmRNAを、また近い将来実用化されるであろうモダリティとしてマイクロバイオームを取り上げ、最新の状況の概説や今後の展望を述べてきた。
mRNAにおいては、COVID-19パンデミックという外部要因も影響して類まれなるスピードで実用化に至ったが、突貫工事で実用化に至ったという側面も否定できず、mRNAワクチンのさらなる有効性の向上や、少なからず報告される副反応31)の軽減が期待されるところである。また遺伝子治療目的で活用する場合にはまだ実用化例はなく、いくつか諸課題が残っている状況である。様々な用途でmRNAという技術を活用出来るように、今後はモダリティとしての洗練・最適化研究も進み、日本企業の貢献度が拡大していくことを期待したい。
マイクロバイオームに関しては、海外では医薬品としての実用化が目前に迫っている状況である一方で、日本では開発が遅れている現状が見て取れた。本領域の意義や市場性は今後ますます拡大していくと考えられるものの、製薬企業としてどこまで足を踏み入れていくのがよいか、健康食品企業やIT企業などと協業して国民の健康増進に貢献していくのがよいか、日本特有の環境要因なども考慮して慎重に判断することが必要となるであろう。そのためにも、日本国内での規制整備を早急に行って、日本企業の参入を促すことが重要である。また、マイクロバイオーム領域の基礎研究を、産学連携を含めて、積極的に推進していくことが重要であろう。
-
1)医薬産業政策研究所、「新薬における創薬モダリティのトレンド-多様化/高分子化の流れと、進化する低分子医薬-」、政策研ニュース No.64(2021年11月)
-
2)医薬産業政策研究所、「次世代創薬基盤技術の導入と構築に関する研究」、リサーチペーパー・シリーズ No.77(2021年5月)
-
3)医薬産業政策研究所、「新モダリティの開発動向の調査 ~核酸医薬、遺伝子治療、細胞治療を中心に~」、政策研ニュース No.55(2018年11月)
-
4)Pharmaprojectsにおいて、以下の検索式を用いて調査した(Therapeutic Class:Messenger RNA)
-
5)Phase II段階にはOthersに分類されるパイプラインが19品目存在しており、このうち12品目が癌を適応とするものであり、その他では角膜炎、メチルマロン酸血症、プロピオン酸血症、嚢胞性線維症、糖原病 III型、心不全を対象とするパイプラインが存在する
-
6)Dolgin E. The tangled history of mRNA vaccines. Nature. 2021 Sep;597(7876):318-324.
-
7)
-
8)
-
9)
-
10)
-
11)
-
12)
-
13)Karikó K, Buckstein M, Ni H, Weissman D. Suppression of RNA recognition by Toll-like receptors: the impact ofnucleoside modification and the evolutionary origin of RNA. Immunity. 2005 Aug;23(2):165-75.
-
14)COVID-19流行前から、モデルナ社はサイトメガロウイルスやジカウイルス感染症などに対するmRNAワクチンを臨床入りさせており、ビオンテック社はがんワクチンとしてmRNAを臨床入りさせていた
-
15)
-
16)実験医学 Vol.40 No.9 2022.6 特集:マイクロバイオーム創薬
-
17)Gulliver EL, Young RB, Chonwerawong M, D’Adamo GL, Thomason T, Widdop JT, Rutten EL, Rossetto Marcelino V,Bryant RV, Costello SP, O’Brien CL, Hold GL, Giles EM, Forster SC. Review article: the future of microbiome-basedtherapeutics. Aliment Pharmacol Ther. 2022 Jul;56(2):192-208.
-
18)Fermentable, Oligosaccharides, Disaccharides, Monosaccharide, AND Polyolsの頭文字を取って作られた用語であり、過敏性腸症候群においてはFODMAPsの含有量の少ない食事療法が効果的との報告がある
-
19)
-
20)Web of science Ⓡクラリベイト・アナリティクスでは、各論文を「Web of Science分野」としてタグ付けしており、これをもとにして原著論文の分野別分類を行っている
-
21)検索式を(Mechanism Of Action is Microbiome modulator)AND(Origin is Biological, bacterial cells)とした。この検索式の対象となるのは、概ね図3におけるFMT及びLBPsのどちらかに該当する。
-
22)
-
23)
-
24)Zhou P, Hu Y, Wang X, Shen L, Liao X, Zhu Y, Yu J, Zhao F, Zhou Y, Shen H, Li J. Microbiome in cancer: Anexploration of carcinogenesis, immune responses and immunotherapy. Front Immunol. 2022 Aug 8;13:877939.
-
25)
-
26)Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders. NatRev Microbiol. 2021 Apr;19(4):241-255.
-
27)Agirman G, Hsiao EY. SnapShot: The microbiota-gut-brain axis. Cell. 2021 Apr 29;184(9):2524-2524.e1.
-
28)
-
29)
-
30)Kazemian N, Kao D, Pakpour S. Fecal Microbiota Transplantation during and Post-COVID-19 Pandemic. Int J MolSci. 2021 Mar 16;22(6):3004.
-
31)

