Points of View 新薬はなぜ、承認から60日で患者さんに届くのか -60日ルールの誕生と現状、これから-
医薬産業政策研究所 主任研究員 吉田晃子
1. はじめに
わが国では、承認された新薬がおよそ60日で薬価収載、すなわち保険適用となり患者さんに届く1)。それはなぜか。一言でいえば、「60日ルール2)」というきまりがあり、それが守り続けられているためである。その結果、承認された新薬を患者さんに早期に届けることに貢献している。
では、承認から薬価収載までの60日間に何がなされているかと言うと、医療機関等で保険診療に用いられる医療用医薬品として、医師が処方できるよう薬価を決め、官報3)に収載する手続き等がなされている。
諸外国ではどうか。諸外国とは、医療保険制度や薬価を決めるプロセス等が異なる。しかし、多くの国では、承認後、新薬が患者さんに届くまでの期間は、保険償還リストへアクセスできるようになるまでと捉えられている4)ことから、価格を決め、リストに収載するといった手続きがなされている点では、日本と類似しているだろう。そして、その期間は短いことが患者さんにとって望ましく、様々な場面で比較されている。わが国と同様に、社会保険方式であり皆保険制度に等しい5)ドイツでは平均120日(中央値50日)、フランスでは平均527日(中央値474日)、欧州連合では平均504日となっている4)。
わが国で承認された新薬が患者さんに届くまでの期間がおよそ60日であることは、世界に誇れる速さであると言えよう。では、なぜ速いのだろうか。
本稿では、承認された新薬が60日で患者さんに届くようになった背景とその前後の変化、近年の状況を見ていき、60日で患者さんに届く理由について考えてみる。
2. 日米MOSS協議概要と60日ルールができるまで

過去の中央社会保険医療協議会議事録6)によると、新医薬品については、1985年の日米MOSS協議に基づき、それ以降、薬事法7)に基づく承認から薬価収載までのこの期間を原則60日以内、遅くとも90日以内にするということで、約束がルール化(以降、「60日ルール」と記載)されている。日米MOSS協議とは、日米貿易摩擦下に行われたMarket-Oriented Sector-Selective talks8)のことで、「市場重視型分野別協議」と訳される。市場重視型とは、市場アクセスを制限する障壁を取り除くことに重点を置いたアプローチであることを意味する。1985年1月、中曽根首相・レーガン大統領の日米首脳会談において、アメリカ側から日本において市場開放が期待される分野として、①電気通信、②エレクトロニクス、③医薬品・医療機器、④林産物の4分野があげられた。これを受けて、各省の次官による日米2国間協議が進められることになった。医薬品・医療機器分野は、6回の協議を経て、1985年12月11日に基本的合意(参考:図1)が達成され、この合意により、医薬品・医療機器の承認審査手続きの簡素化・迅速化が実施されるとともに、「健康保険の診療報酬設定に関し透明性を一層確保し、また、新製品をより高い頻度で、定期的に収載するための手続きの設定」が検討されていく。その結果、それまでは年に何回といった取り決めはなく、慣例的に年2回程度だった新薬の収載は、1986年度より年4回収載へと変更された。承認を受けた医薬品がいつ保険適用になるのか見通せないという米国側の強い主張が通った格好であり、これが60日ルールの始まりである。具体的な合意事項としては、「新薬は、承認後、より早く薬価収載されるよう、製造又は輸入の承認時期に合わせて年4回定期的に収載される。承認後できるだけ早く、原則60日以内、遅くとも90日以内に収載する。この方針は、1986年度以降に承認された新薬に適用される。」というものであり、有効期限はない。
現在では、「医療用医薬品の薬価基準収載等に係る取扱いについて」2)として、厚生労働省医政局長、保険局長による通知として発出され、「新医薬品の薬価基準収載が施行されるまでの標準的な事務処理期間は、当該新医薬品の承認から原則として60日以内、遅くとも90日以内とする。9)」ことが明記されている。
3. 日米MOSS協議前後の変化および近年の状況
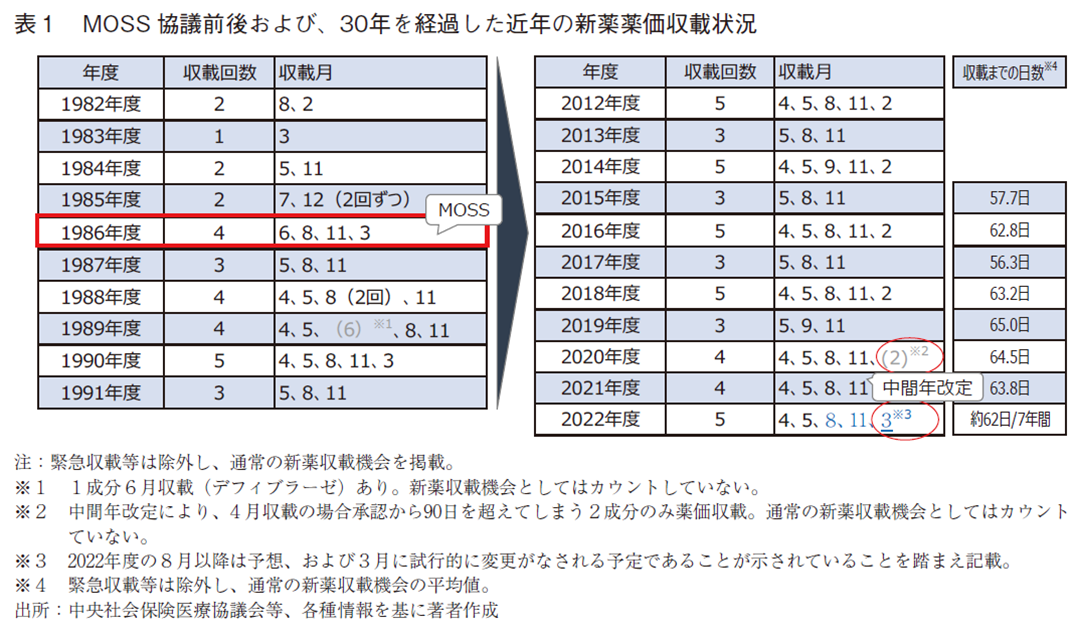
表1は、日米MOSS協議での合意前後および、その後30年を経過した近年の新薬薬価収載状況を示している。1986年度より年4回収載が開始され、導入から3年経過した1989年度には改定前年度(奇数年度)は3回、改定年度(偶数年度)は5回の、現在と同様の定期的な新薬の薬価収載が行われており、近年まで規則正しく維持されている。実際には、新薬の収載時期は、2月、5月、8月、11月の年4回である。このうち改定年は2月収載が4月となることで初回が90日以内収載となる。通常の新薬収載機会の直近7年間平均値では、90日以内収載を含めても、承認後収載まで62日となっていた。
また、表1には、2021年度に行われた初の中間年薬価改定時の新薬収載月の変更(2021年2月収載は4月収載に変更)と、今後の見通しも記している。今後も、2021年度と同様の措置が続けば、偶数年の2月の新薬収載(1~3月期の新薬薬価収載)機会がなくなることへの懸念が出されていた。これに対し、2023年の初回の新薬収載時期を試行的に3月とする方針が示されているが、それ以降については、現状では明らかになっていない。今後は、60日ルールに則った収載機会の確保を維持しつつも、薬価制度改革等により、新薬収載月の並びに軽微な変化が起きるのかもしれない。
4. 収載遅れについて
では、60日ルールに納まらずに薬価収載された、いわゆる「収載遅れ」については、どの程度生じているのだろうか。
政策研ニュースNo.6410)では、2018年度薬価制度抜本改革(以降、「抜本改革」と記載)による「収載遅れ」への影響をみている。調査期間(2014年10月以降、2021年9月までの7年間)に薬価収載された新薬(再生医療等製品を除く全365成分)について、抜本改革前(171成分)と抜本改革後(194成分)に分けて調査した。その結果、「収載遅れ」は6.4%(抜本改革前)から6.7%(抜本改革後)とわずかに上昇していた。しかし、いずれも11成分および13成分と該当数は少なく、また、その間の年次推移でも近年の上昇および低下傾向は見られなかった。
「収載遅れ」の理由を公開資料から確認することはできない。また、薬価交渉に起因する場合もそうでない場合もあるが、薬価が決まらずに薬価収載は迎えられないことから、薬価交渉が「収載遅れ」の一因にはなり得る。また、薬価制度改革によるルールの変更点が、薬価交渉における双方の認識のずれを生じさせることもあるだろう。実際、抜本改革後の収載事例では、抜本改革における変更点(新薬の有用性の程度や、原価計算方式の開示度、外国価格との乖離)がその一因となって、「収載遅れ」を引き起こしている可能性があったことを報告している。
革新的な新薬を早期に国民に届ける観点で、薬価制度の改革と「収載遅れ」との関係性については、引き続き見ていく必要があると著者は考える。
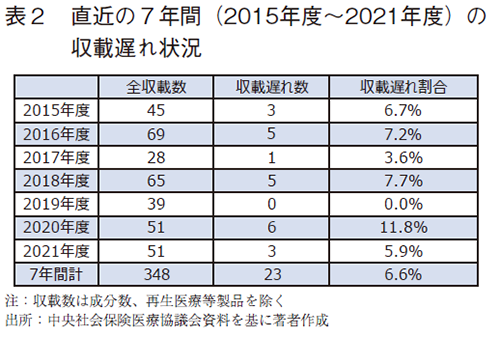
さて、本稿では、「収載遅れ」状況を更新して示す。直近の7年間(2015年度~2021年度)では23品目、6.6%が「収載遅れ」であった。(表2)この結果からも、多くの新薬が60日ルールに則り薬価収載していることがわかる。
5. おわりに
わが国で、承認された新薬が60日で患者さんに届くようになった背景とその前後の変化、近年の状況を見てきた。60日ルールの背景には日米MOSS協議での合意があり、40年近く経過する今もそのルールは厳守され、もはやわが国に根付いていると言える。ルールであるとは言え、根付くことは容易ではない。これほどまで長く、承認された新薬が60日で患者さんに届き続ける理由は何だろうか。
当該期間の中心となる薬価交渉においては、規制当局である厚生労働省と製薬企業双方の認識のずれを早期になくすことが肝要である。薬価に関する公式交渉(面談)は2回、通常各1時間程度と限られている。しかしながら、薬事審査と並行したより早い段階での非公式相談を重ねる等のやりくりにより、早期の合意が実現できている。
つまり、一つには、薬価交渉の当事者である規制当局/製薬企業双方に共通するポイントがあると考察する。それは、革新的な新薬を早期に国民に届けるというルールを守る明確な理由が存在すること、そして、当事者としてのリーダーシップと行動の習慣化があることである。その結果、60日以内に納めようとやりくりされてきているといった方が正しいかもしれない。
ただし、忘れてはならないことがある。多くはないが「収載遅れ」が生じていること、また、「収載遅れ」の要因にもなりうる薬価交渉やその環境、薬価制度等、様々な変化があることである。医薬品については、モダリティの多様化をはじめ革新性等、新薬そのものの変化もあり、薬価の決め手となる交渉材料は多量化、多様化かつ複雑化している。そうした中で、60日ルールができた頃と現在、そして未来においては、60日の中身に違いがあるだろう。規制当局/製薬企業双方に共通するポイント(革新的な新薬を早期に国民に届けるというルールを守る明確な理由が存在すること、当事者としてのリーダーシップと行動の習慣化)だけでは、やりくりできない課題が生じることもある。そうした場合には、承認された新薬が患者さんに届くまでの期間を維持しつつ、ギャップを埋める柔軟な対応を検討していかなければならない。
例えば、公式交渉(面談)の機会や時間について、ドイツでは4回、各4時間程度が設けられている11)。様々な変化を勘案し、現在の公式交渉(面談)では課題が生じ、その解決策となり得る場合には、60日の中で機会を増やす、もしくは時間を延ばす検討がなされてもよいかもしれない。
また、医薬品そのもののイノベーションがある中で、現状プロセス、アプローチでは課題が生じ、その解決策となり得る場合には、60日の中に現状とは異なるプロセス、アプローチを入れる検討があってもよいだろう。
「国民皆保険の持続性」と「イノベーションの推進」を両立し、国民が恩恵を受ける「国民負担の軽減」と「医療の質の向上」を実現する観点等から、今後も必要な薬価制度改革が行われるものと思われる。一方で、わが国では、承認された新薬が患者さんに届くまでの期間がおよそ60日と、世界に誇れる速さであることは、国民視点で守り続けてゆかなければならない。
参考書籍
- 厚生省50年史編集委員会編、「厚生省50年史」、厚生問題研究会、1988
- 厚生省編、「厚生白書」(昭和60年版~昭和63年版)、厚生省、1985~1988
- 日本製薬工業協会編、「製薬協20年の歩み」、日本製薬工業協会、1988
- 日本製薬工業協会編、「製薬協50年の歩み」、日本製薬工業協会、2018
- 日本製薬団体連合会編、「日薬連50年誌」、日本製薬団体連合会、1999
- 大阪医薬品協会「50年の軌跡」、大阪医薬品協会、1998
- 株式会社医薬情報研究所、「薬事行政,薬価制度70年の軌跡」、新薬と臨床第70巻 No.4、株式会社医薬情報研究所、2021
-
1)2015年度~2021年度に薬価収載された新薬(成分数、ただし再生医療等製品を除く)では、93.4%が60日もしくは90日のルール内で薬価収載されており、収載が遅れたものも含め、承認から収載までの日数は平均値で73日、中央値で58日であった。
-
2)2022年2月9日付 医政発0209第1号 保発0209第2号「医療用医薬品の薬価基準収載等に係る取扱いについて」の「(2)新医薬品の薬価基準収載の時期等」に記載される部分を指す。
-
3)法令など政府情報の公的な伝達手段であり、明治16年(1883年)に太政官文書局から創刊された。現在では、内閣府が行政機関の休日を除き毎日発行する。
-
4)
-
5)
-
6)
-
7)2014年11月、薬事法は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(薬機法)に名称変更されている。
-
8)「1986 MOSS Agreement on Medical Equipment and Pharmaceuticals( Jan. 9, 1986)」、アメリカンセンターJAPAN WEBサイト、(参照:2022/6/1)
-
9)ただし書きには、この限りでない場合として、新医薬品の薬価基準収載希望書が指定された期限内に提出されない場合、薬価算定組織に出席して直接の意見表明又は中医協総会の審議結果によって決定された薬価算定案等に不服がある場合、当該新医薬品の迅速な供給が困難であることその他新薬収載希望者に特別の事情がある場合若しくは新薬収載希望者からの申し出により、薬価基準収載希望書の取り下げがあった場合に該当する場合、薬価基準収載希望書に係る不備の補正の指示に応じない場合、必要な資料が指定された期限内に提出されない場合の記載がある。
-
10)医薬産業政策研究所「新薬の薬価収載状況-2018年度薬価制度抜本改革の収載時薬価への影響-」政策研ニュースNo.64(2021年11月)、なお、「6.9%(抜本改革前)から7.2%(抜本改革後)」は、「6.4%(抜本改革前)から6.7%(抜本改革後)」の誤記であったため、本稿で修正する。
-
11)医療経済研究機構、「薬剤使用状況等に関する調査研究報告書(令和4年3月)」、143頁

