Points of View 創薬の成功確率分析 -臨床試験に焦点を当てて-
医薬産業政策研究所 主任研究員 高橋洋介
はじめに
医薬品産業はハイリスク・ハイリターン型の産業であると言われている。研究開発の着手から製品の上市・販売に至るまで、10年を超える期間を要することが一般的であり、その過程において多額の研究開発投資が必要となる。さらに、「薬効が不十分であった」、「安全性面の懸念が生じた」、「市場性を欠くことが明らかとなった」など様々な要因で研究開発を断念せざるを得ないことが多く、創薬の成功確率は低いのが現状である。結果として、長期間にわたる多額の投資をまったく回収出来ないという事例も枚挙に暇がない状況であり、他産業と比較しても類を見ないほどのハイリスク産業と考えられる。
リスクの低下(≒創薬の成功確率の向上)という観点では、科学技術の進展等を背景に様々な取り組みがなされており、革新的な新薬を上市する上で一定の成果をあげている1)。実際に、生活習慣病などをはじめとする様々な疾患に対する新薬が創製され、患者さんの医療ニーズを充足し、年々治療満足度は高まりつつある2)。この結果、近年では未充足ニーズが多い領域へと研究開発ターゲットがシフトされる傾向にあるが、これら難病・希少疾患は一般的に創薬の難易度が高く、結果的に成功確率が低下してしまうということも考えられ、今後も当面はハイリスク型の産業であり続けるだろう。
本稿では、バイオ医薬品など様々な新規モダリティが実用化されつつある現在において、実際にはどの程度の研究開発成功率であるのか、成功確率に関わる先行研究の結果と対比しながら分析・考察することとした。
先行研究の情報整理
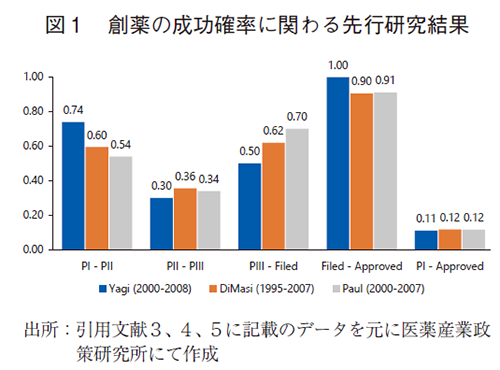
創薬の成功確率についてはいくつか先行研究があるが、包括的なレポートとして、医薬産業政策研究所の元主任研究員である八木らによる報告3)、DiMasiらの報告4)、Paulらの報告5)などがある。これら先行研究では、それぞれが異なる母集団からの独自のアンケート調査結果等をもとに、Phase ⅠからPhase Ⅱ、Phase ⅡからPhase Ⅲ、Phase Ⅲから承認申請(Filed)及びFiledから薬事承認(Approved)における成功確率(次相移行確率)を求め、それらの積を以ってPhase ⅠからApprovedに至る創薬の成功確率(ここでは臨床試験の成功確率を指す)を算出している。収集したデータの対象期間は、それぞれ2000年~2008年、1995年~2007年、2000年~2007年であり、この期間に次相へ移行したプロジェクトもしくは開発を中止したプロジェクトを集計しており、プロジェクトの開始時期には条件をつけていない。八木らの報告は、日本国内の製薬企業に対するアンケート結果に基づくものであり、日本の製薬企業が国内開発した場合の成功確率と、海外で開発した場合の成功確率を区別して集計している。その他2報は欧米の製薬企業を対象とした調査結果であることから、八木らの報告からは海外での成功確率の結果を引用することとし、3報の数値を比較して図1に示した。
これら3報ではPhase Ⅰ及びPhase Ⅲの成功確率に差が認められた。Phase Ⅰの成功確率は八木らの報告で0.74と最も高い数値であった。この理由については、推測の域は出ないものの、日本の製薬企業の方が非臨床段階で厳格かつ精緻な篩にかけてPhase Ⅰに進んでいる、日本国内で開発先行していたプログラムを後追いで海外Phase Ⅰを実施する場合がある、などの理由によりPhase Ⅰ成功確率が高く算出されている可能性が考えられた。一方でPhase Ⅲの成功確率は八木らの報告で最も低い数値となっている。少なくとも2000年代においては、海外の企業の方がPhase Ⅲ成功確率が高かったものと推察される。
近年のデータを加味した創薬成功確率算出
先行研究で用いられたデータは2000年代までのものに限定されており、必ずしも近年の成功確率を反映しているとは限らない。抗体医薬の承認取得例は、2000年代から徐々に出て来ているものの、品目数が大きく伸びたのは2010年代になってからである1)。また、核酸医薬、遺伝子治療、遺伝子細胞治療、抗体薬物複合体(ADC)などの新規モダリティの実用化に関しては2010年代以降である。このことを鑑みると、モダリティの多様化に伴って、現在の創薬の成功確率は変化している可能性がある。このような背景から、医薬品パイプラインのデータベースであるEvaluatePharmaを用いて、創薬の成功確率の近年の状況を検討することとした。
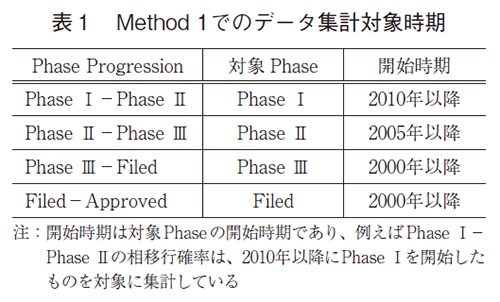
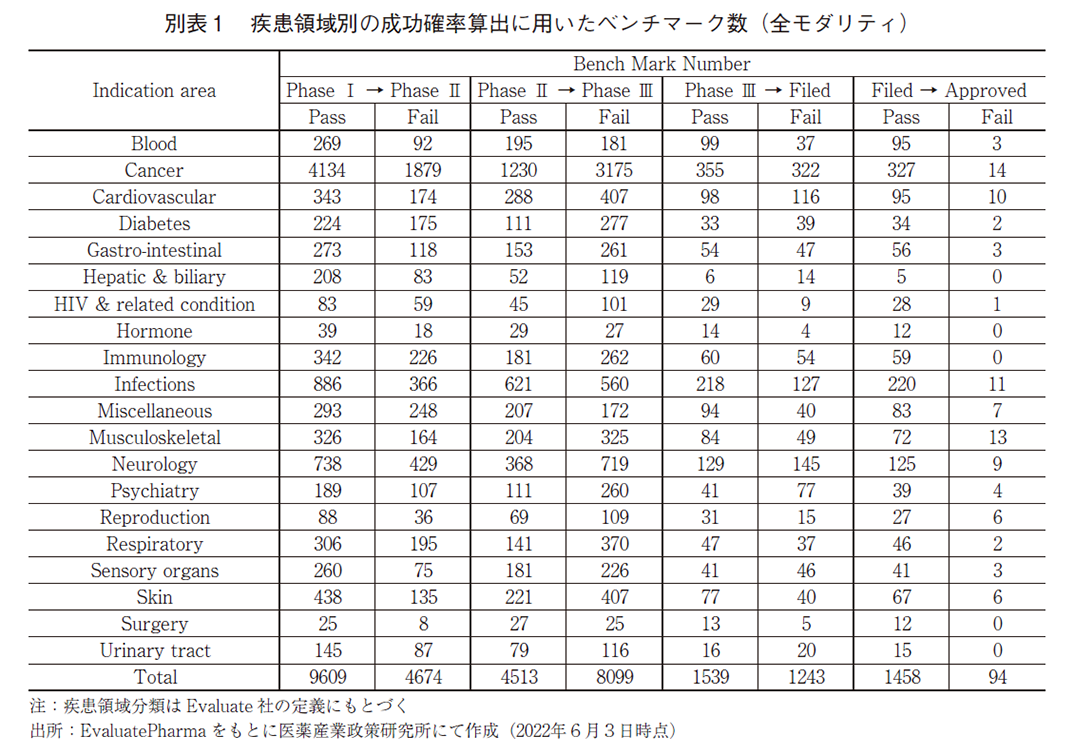
本研究における成功確率の算出方法として、2つの手法を用いた。1つ目の方法論(Method 1とする)は、PRTS法としてEvaluatePharmaに標準搭載されている成功確率の算出方法である。各相における次相への移行確率(Phase Progression Probability)を以下の式により算出し、それらの積を取ることでPhase Ⅰから承認(Approved)に至る成功確率を求める方法であり6)、これは前述の3報の先行研究とも類似の方法論である。Phase Progression Probability算出で用いるPASSもしくはFAILのベンチマーク数は、比較的近年の状況を反映した結果とすることを意図して、表1に示した期間を対象として設定されている。後期の相については十分なサンプル数を確保する目的で対象期間を長く設定されている。またこの手法では、プログラム毎にカウントしており、一つの医薬品の候補化合物(プロダクト)であっても、複数の適応疾患で臨床試験が実施されている場合には、それぞれを別カウントとして集計している。
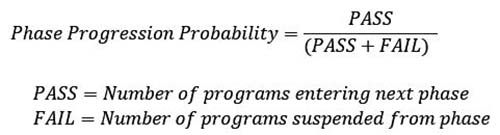
2つ目の方法論(Method2とする)は、データベースに収載されている開発の成否が明らかとなっている全プロダクト(現在開発中であるプロダクトは除く)を対象として、承認品目数の割合を求める方法論である。この手法では、プロダクト毎(≠プログラム毎)にカウントしているため、一つのプロダクトが複数の適応疾患で開発している場合には、一つでも成功例があった場合にはAPPROVEDとして一カウントしている。古いものでは、1980年代に開発されていたプロダクトから成功確率の算出に組み込んでおり、この手法で導かれる成功確率は、全期間を平均化して評価した成功確率であると捉えることが出来る。注意すべき点として、データベース上に開発中止として収載されているプロダクトには一部臨床入り前の段階で開発中止となっているものが含まれている可能性があり、この場合には成功確率を低く見積もっている可能性がある。

疾患領域別の成功確率(Method1による)
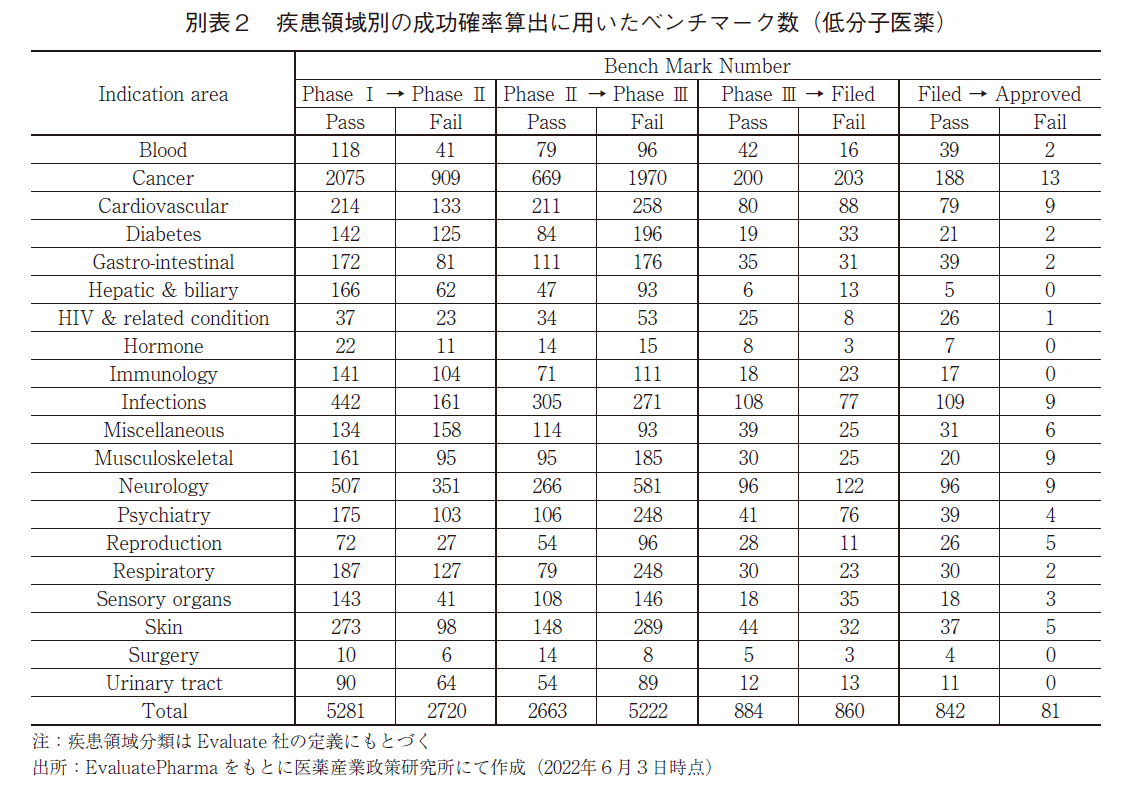
疾患領域別に、Phase ⅠからApprovedに至る成功確率を図2aに示し、確率算出に用いたプログラムの数(ベンチマーク数)は巻末の別表1に示した。疾患領域の分類方法に関してはEvaluatePharma上での分類基準を用いている。また、一つのプロダクトで複数の疾患領域の開発を進めているものが多数存在することから、Method2で疾患領域別の成功確率を算出することは実施していない。
Phase Ⅰの成功確率は疾患領域別で大きな違いは認められず、概ね70%程度であった。Phase Ⅰにおける主要評価項目は安全性や薬物動態に関するデータであることが多く、疾患領域別で大きな違いが見られないのは妥当な結果であると考えられる。一方で、Phase Ⅱ及びPhase Ⅲにおける成功確率は疾患領域によって異なっており、ここでの成功確率が最終的な成功確率(臨床入りから承認まで)の高低に大きく影響していた。成功確率が低いのはCancer、Diabetes、Hepatic & biliary、Neurology、Psychiatry、Respiratoryであり、成功確率が高いのはBlood、Hormone、Infectionsであった。全疾患領域での成功確率(図中のTotalが該当)は、それぞれ0.67(Phase Ⅰ-Phase Ⅱ)、0.36(Phase Ⅱ-Phase Ⅲ)、0.55(Phase Ⅲ-Filed)、0.94(Filed-Approved)及び0.13(PhaseⅠ-Approved)であり、この数値は先行研究における報告値(図1)と概ね同程度であった。
以降では、成功確率が低い疾患領域について考察することとする。Diabetesに関しては、本疾患カテゴリーの中でも1型糖尿病または2型糖尿病に対する開発プロダクト及び承認済医薬品が非常に多く存在し、競合品が多く開発競争が熾烈である7)ことに基づく市場性の問題が、成功確率の低さの一因であると考えられる。Hepatic & biliaryの疾患領域の中では、非アルコール性脂肪肝炎(NASH)もしくは非アルコール性脂肪性肝疾患(NAFLD)を適応とする開発品が過半数を占めており、この2疾患に絞った場合の成功確率はわずか3%程度に過ぎず(データ割愛)、この2疾患に対する創薬難易度の高さが本領域の成功確率の低値に起因していた。その他のCancer、Neurology、Psychiatry、Respiratoryにおける成功確率の低さは、実際の病態を反映した非臨床動物モデルの構築が未解決、疾患概念に対してヘテロな患者層から構成されている、疾患バイオロジーの理解が不十分である、標的組織への医薬品の送達が困難である、このような課題を有する創薬難易度が高い疾患が数多く含まれていることなどが要因として考えられる。
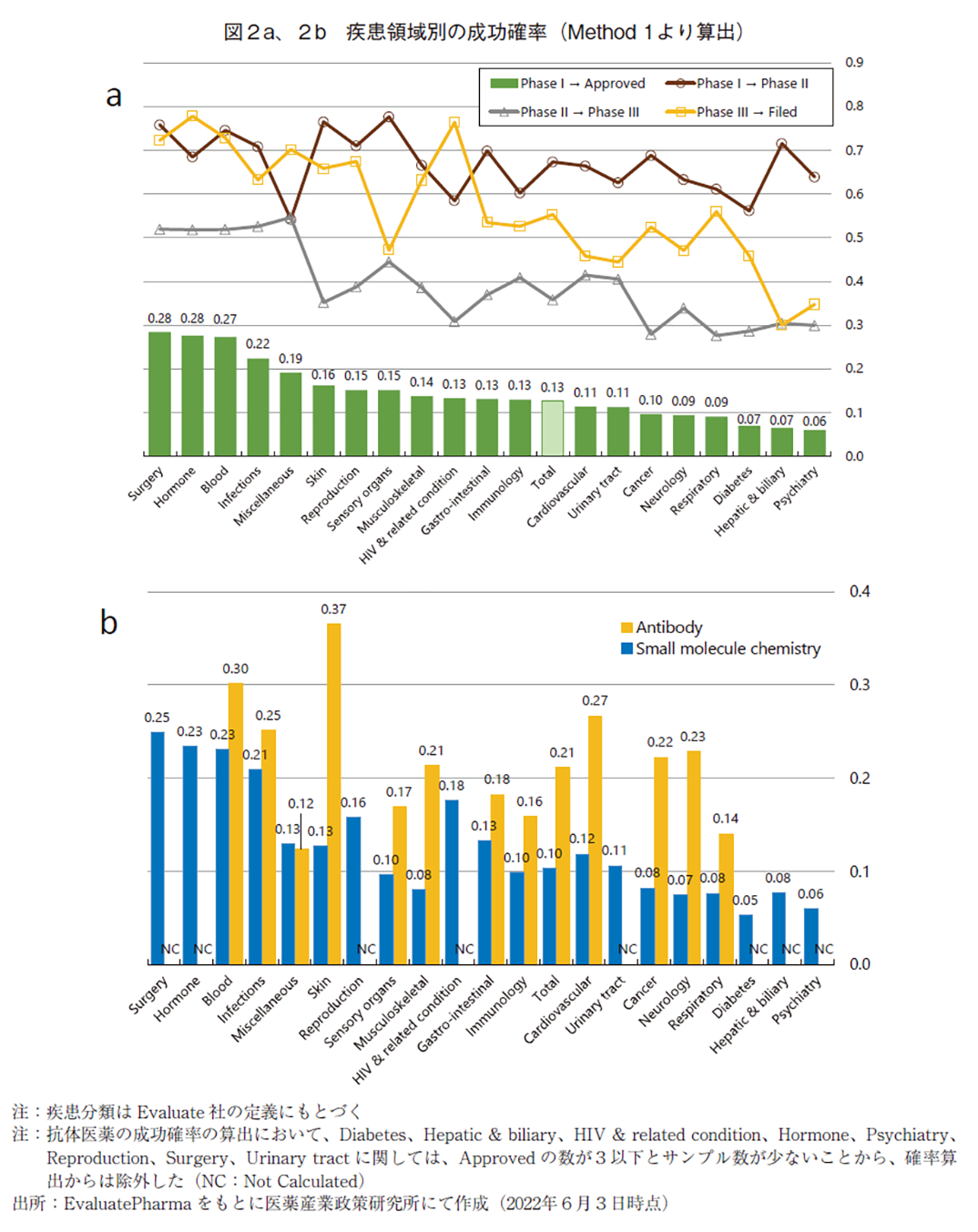
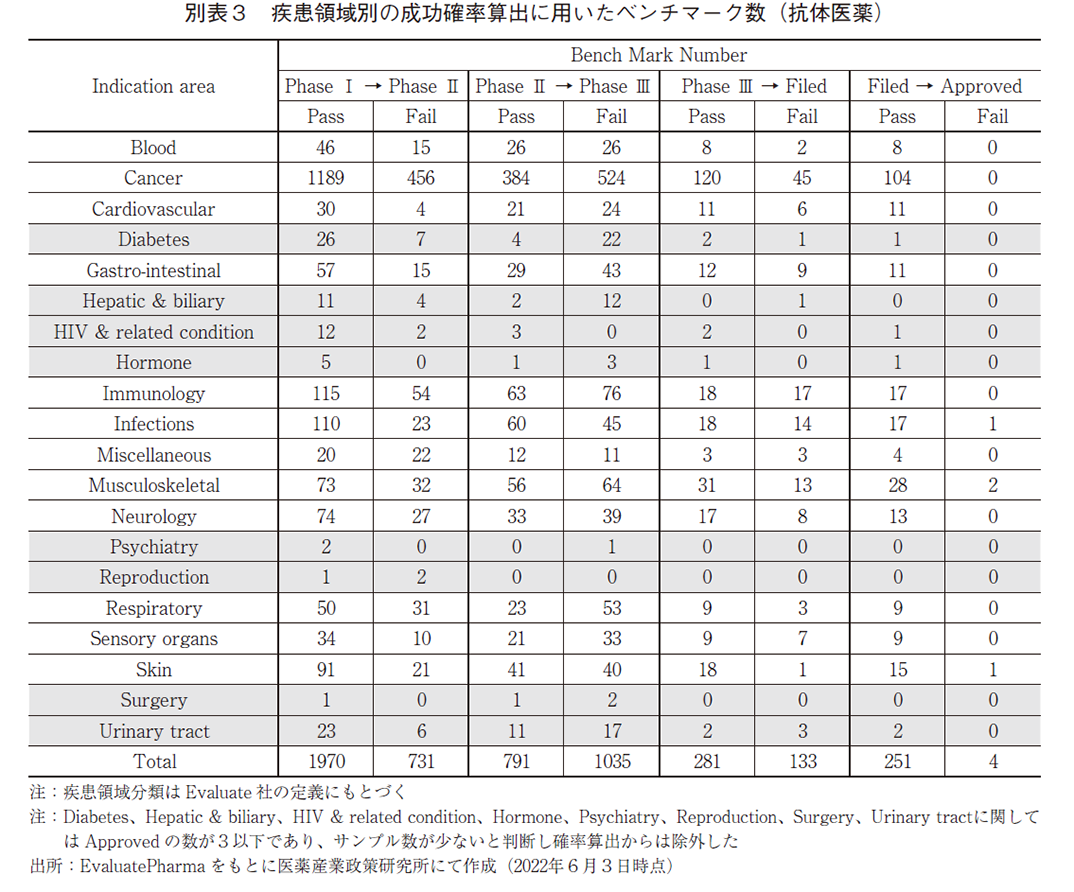
また、比較的実用化例の多い低分子化合物及び抗体医薬に関しては、当該モダリティに限定した疾患領域別の成功確率を図2bに示し、確率算出に用いたプログラム数は別表2及び別表3に示した。総じて、抗体医薬の方が低分子医薬に比して成功確率が高い傾向にあり、Skin、Musculoskeletal、Cardiovascular、Cancer、Neurologyにおいては2倍以上の成功確率であった。Skin領域における抗体医薬の成功確率の高さを分析すると、本領域の中では乾癬治療薬のプログラムが数多く存在し、その多くがPhase Ⅲ試験で成功していることが特徴的であり(データ割愛)、全体の成功確率を高めていた。同様にMusculoskeletalの領域について分析すると、抗体医薬では関節リウマチや乾癬性関節炎のプログラム数が多く、これらの多くが全疾患領域での水準を上回る確率で臨床試験に成功し(データ割愛)、成功確率を高めていた。これらに共通するのは免疫反応を抑制することによって疾患治療を企図した医薬品ということであり、抗体医薬によって細胞表面の分子を標的とする創薬アプローチが適合しやすい疾患が多く存在しているのではないだろうか。Cancerに関しては、血液がんよりは固形がんで成功確率が高く、固形がんの中では膀胱がんや非小細胞性肺がんなどで水準を上回る成功確率であったことが確認出来たが(データ割愛)、成功確率の高さにつながる本質的な要因を見出すことは困難であった。Cardiovascularの領域では家族性高コレステロール血症や脂質異常症において成功例が多く、Neurologyの領域では視神経脊髄炎や片頭痛において成功例が多く、これらが成功確率の高さを牽引していたが(データ割愛)、上記と同様に本質的な成功確率の高さの原因を見出すことは困難であった。
モダリティ別の成功確率(Method1による)
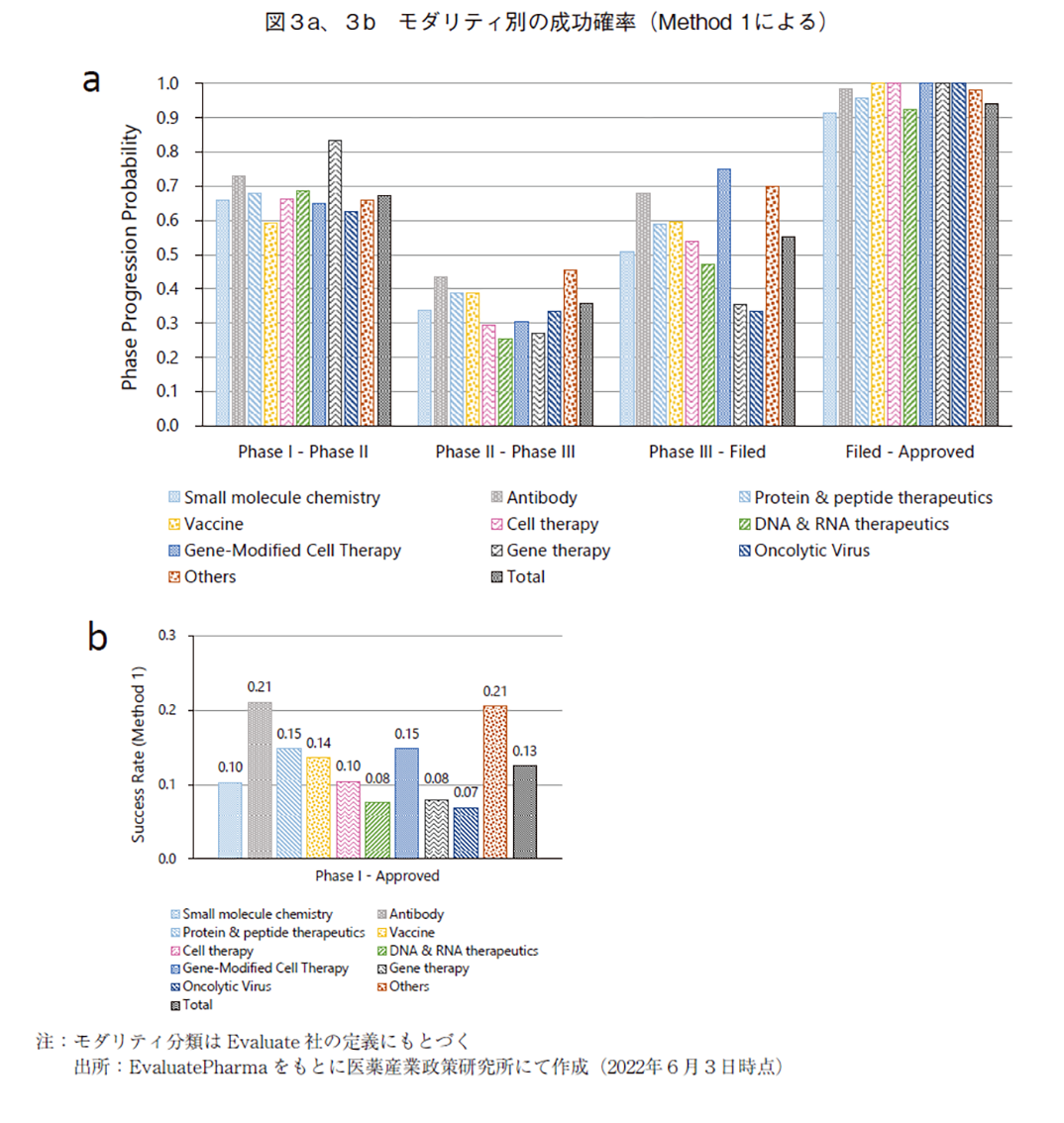
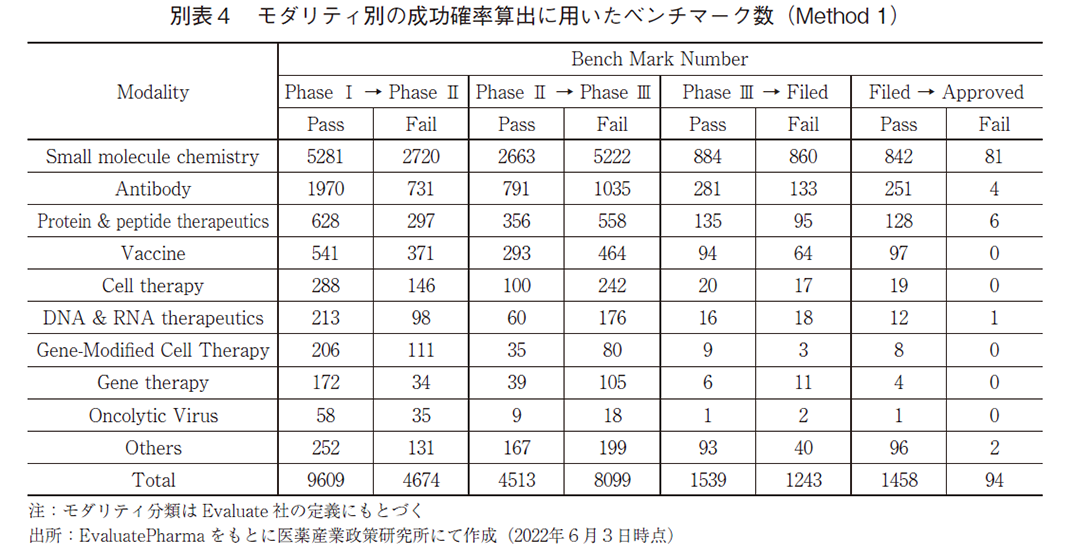
Method1によって、モダリティ別の各Phaseにおける成功確率及びPhase Ⅰから承認(Approved)に至る成功確率を算出し、図3a、図3b及び表2に示した。また、確率算出に用いたプログラムの数(ベンチマーク数)は巻末の別表4に示した。なお、モダリティの分類方法に関してはEvaluatePharmaでの分類基準を参考とした8)。
Phase Ⅰの成功確率は概ねどのモダリティも7割程度であったが、遺伝子治療においてやや高く、8割超という結果であった。遺伝子治療のPhase Ⅰ成功確率の算出に用いたベンチマークを精査すると、難病・希少疾患を対象としたプログラムが多く、これらではFirst in Human試験が患者を対象としたPhase Ⅰ/Ⅱ試験と実施されているケースが複数存在していた(データ割愛)。このようなケースでは、Phase ⅠをPass してPhase Ⅱへと進んだとして解析しているため(言い換えると、Phase Ⅰ/Ⅱ試験の成否はPhase Ⅱ試験の結果として集計している)、このことが見かけ上のPhase Ⅰ成功確率を高めている可能性がある。
Phase Ⅱの成功確率は、いずれのモダリティにおいても他のPhaseの成功確率に比べて総じて低く、研究開発を進めていく上でもっともドロップしやすいという結果であった。この結果は図1で示した先行研究における結果とも類似していた。
Phase Ⅲの成功確率はモダリティ間での差が大きく、低分子化合物では概ね0.5であった。成功確率が高いのは、抗体医薬、遺伝子細胞治療、その他(Others)であった。抗体医薬については、モダリティとして成熟期を迎えており、創薬ストラテジーが確立したことで成功確率が高まっているのではないかと考えられる。遺伝子細胞治療の成功確率の高さに関しては、現時点ではサンプル数が少ない(別表4参照)ために断定的なことは言えないものの、Phase Ⅱまでの臨床試験で顕著な有効性が確認出来たことに基づき、確度の高いPhase Ⅲ試験を計画出来ていたのではないかと推察出来る。
Phase Ⅰ開始からApprovedに至る成功確率は、全モダリティを総計すると約13%であった。全モダリティの過半数を占める低分子医薬では約10%の成功確率で全体をやや下回っていた。抗体医薬では約21%と比較的高い成功確率であり、本研究におけるモダリティの分類方法に従うと最も高い最高確率を誇っていた。Othersの成功確率は約21%と高い数値であるが、ここには様々な種類のモダリティ(天然物、ゲノム編集など)が含まれている中で、診断薬や血漿分画製剤の成功確率が高く(データ割愛)、Others全体としての成功確率を高めているという結果であった。
モダリティ別の成功確率(Method2による)
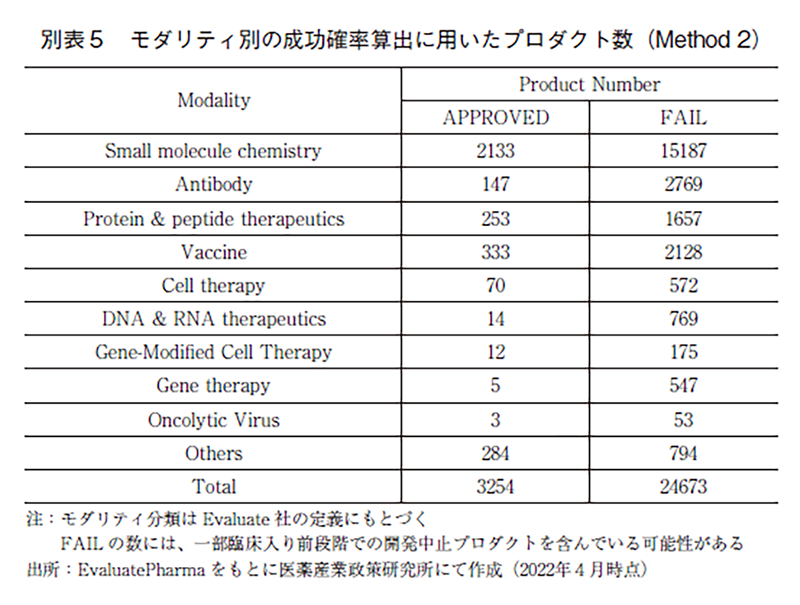
Method2によってモダリティ別の成功確率を算出した結果を図4に示した。Method2では、データベースに収載されている全プロダクトに対して、承認数と開発中止数の合計に対する承認数の割合を算出しているため、Phase毎の成功確率ではなく、全開発期間を通した成功確率のみが算出可能となる。
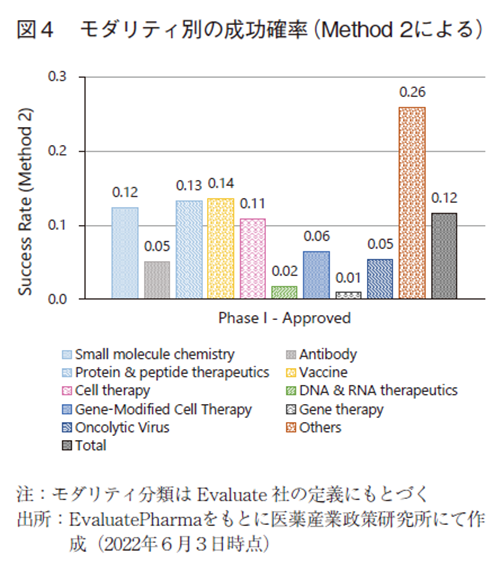
全モダリティを合算した場合の成功確率は約12%であった。全モダリティの過半数を占める低分子に関しては約12%の成功確率であった。一方で、抗体医薬、核酸医薬、遺伝子細胞治療、遺伝子細胞治療などの成功確率はいずれも顕著に低い数値であり、近年実用化され始めたモダリティであるほど低い数値となる傾向であった。また、Method1の場合と同様に、Othersの成功確率は約26%と高い数値であり、ここに含まれる診断薬や血漿分画製剤の成功確率の高さが牽引していた(データ割愛)。
モダリティ別の成功確率(Method1及びMethod2の比較)
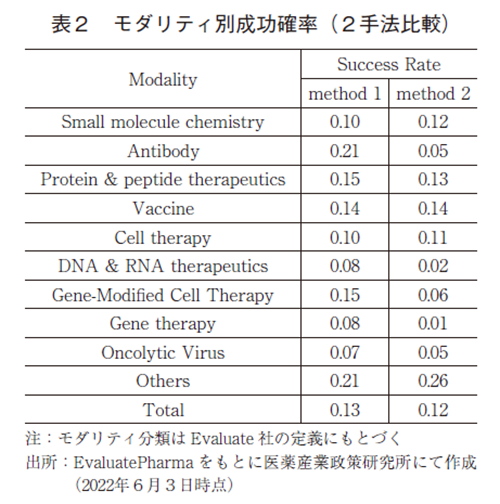
Method1及びMethod2において算出したモダリティ別の成功確率を表2に示した。Method1は、前述の通りの期間を対象にベンチマークを設定して成功確率を算出しているため、比較的近年の状況を反映した成功確率と考えられる。一方で、Method2はデータベースに収載されている全データを対象としているため、古く(1980年代)から直近に至るまでの全期間を対象とした成功確率であると読み替えることが出来る。
低分子に関しては、いずれの分析方法においても10%程度の成功確率であり、常時この程度の数値で安定しているのではないかと考えられる。図1では先行研究における成功確率を示しているが、2000年代に実施された先行研究で対象としている医薬品の90%以上は低分子であることから、今回の分析において低分子の成功確率が10%程度であったという結果は、先行研究のPhase Ⅰ~Approvedまでの成功確率と同程度であり、一貫した結果であった。
創薬モダリティ毎に成功確率を評価した結果、Method1とMethod2では成功確率の異なるモダリティが複数存在しており、抗体医薬、核酸医薬、遺伝子治療及び遺伝子細胞治療においては、Method2での成功確率は著しく低いという結果であった。抗体医薬に関しては、全期間の成功確率(Method2)は非常に低い数値となっているが、近年の成功確率(Method1)は低分子医薬のそれよりも高い数値となっている。この原因は、抗体医薬というモダリティの黎明期において数多くの失敗例が存在していた一方で、そこから得た知見やノウハウなどを活用することで徐々に技術的に成熟し9)、現在は創薬モダリティとしての収穫期に至り、近年の高い成功確率につながってきたのではないかと考えられる。同様の観点で、2010年代後半から実用化例の増えてきている核酸医薬、遺伝子治療、遺伝子細胞治療などのいわゆる新規モダリティの状況を見てみる。全期間の成功確率(Method2)は非常に低い数値となっている一方で、近年の成功確率(Method1)はやや高い数値であり、低分子医薬よりやや低いもしくは同等以上となってきている。このことから、これらモダリティはまさに黎明期を抜けようとしているところであると考えられ、今後数多くの革新的な医薬品へと応用されることを期待したい。
抗体医薬と遺伝子細胞治療に関しては、近年の成功確率(Method1)が低分子医薬を大きく上回っており、特に成功確率が高いモダリティとして注目に値する数値である。2021年にはBIO、Informa Pharma Intelligence、QLS Advisorsによる共著のレポートが発刊され、ここではMethod1と類似の手法によって算出されたモダリティ別の成功確率が報告されている10)。モダリティの分類方法や分析に用いたデータの対象期間が異なるために厳密な比較は出来ないものの、ここではCAR-TやsiRNA/RNAi、モノクローナル抗体の成功確率が高いというデータが示されており、一部の新規モダリティでは成功確率が高まっていることが読み取れる。
まとめと考察
製薬産業が直面している創薬リスクを理解・把握するために、研究開発の成功確率の現状を調査するとともに、疾患領域別や、創薬モダリティによる成功確率の差を考察した。
本稿ではPhase Ⅰ以降の成功確率の分析を行ったが、実際には基礎研究着手時からPhase Ⅰに至るまでの初期過程で研究開発を断念するケースも相当数存在する。このことを考慮に入れると、実質的な成功確率は本稿で示した数値より遥かに低いものと推察される。一連の調査の結果として、新規モダリティでは当該モダリティの黎明期において特に成功確率が低い傾向が見て取れたが、COVID-19パンデミック下でmRNAワクチンのような新規モダリティが多大な貢献を果たしたことに代表されるように、新規モダリティの医療貢献やその社会へのインパクトは非常に大きいことが明確となっており、長期的な観点から研究開発を進める重要性・必要性がある。
成功確率が著しく低い中で、創薬をビジネスとして成立させ、革新的な新薬を次々と創製出来る環境を整えるためには、道半ばで開発中止せざるを得なかった数多くのプロジェクトに対する多額の研究開発投資を、成功した一部の革新的新薬からもたらされる利益によって回収出来ることが必須であり、これを可能とするような薬価制度・社会保障制度・税制などによる下支えが重要であるだろう。また、当然のことながら成功確率を高めるための取組みも重要であり、特にアカデミアを中心とした基礎研究の活性化を支援する施策も講じる必要があるだろう。
製薬産業が、官や学などのステークホルダーと密に連携し、リスクの低減方法や分散方法などを学術面・規制面それぞれから検討し、より良い未来の創造へと貢献出来ることを期待しながら、本稿を閉じたいと思う。
-
1)医薬産業政策研究所、「新薬における創薬モダリティのトレンド -多様化/高分子化の流れと、進化する低分子医薬-」、政策研ニュース No.64(2021年11月)
-
2)公益財団法人ヒューマンサイエンス振興財団 令和2年度(2020年度)国内基盤技術調査報告書「60疾患に関する医療ニーズ調査(第6回)」【分析編】
-
3)医薬産業政策研究所「医薬品開発の期間と費用 -アンケートによる実態調査-」リサーチペーパー・シリーズNo.59(2013年7月)
-
4)Innovation in the pharmaceutical industry: New estimates of R&D costs. DiMasi JA, Grabowski HG, Hansen RW. J Health Econ. 2016 May; 47: 20-33.
-
5)How to improve R&D productivity: the pharmaceutical industry’s grand challenge. Paul SM, Mytelka DS, Dunwiddie CT, Persinger CC, Munos BH, Lindborg SR, Schacht AL. Nat Rev Drug Discov. 2010 Mar; 9(3): 203-14.
-
6)
-
7)
-
8)EvaluatePharmaにおける技術分類(括弧内に記載)をもとに、Monoclonal antibody及びRecombinant antibodyを合わせてAntibodyとして、以下に示す通りに再分類した。
低分子医薬:Small molecule chemistry、抗体医薬:Antibody、組換えタンパク:Protein & peptide therapeutics、ワクチン類:Vaccine、細胞治療:Cell therapy、核酸医薬:DNA&RNA therapeutics、遺伝子細胞治療:Gene-modified cell therapy、遺伝子治療:Gene therapy、腫瘍溶解性ウイルス:Oncolytic virus、その他:Others -
9)山崎達美、「バイオ医薬の研究開発の経験から見えたこと」、生物工学会誌 第94巻 第9号
-
10)

