目で見る製薬産業 日本で承認された新医薬品とその審査期間-2021年承認実績と日本市場のグローバル化の現状-
医薬産業政策研究所 主任研究員 吉田昌生
医薬産業政策研究所では、規制当局の公表情報をもとに、医薬品の承認情報および審査期間に関して継続的に収集、分析している1、2、3)。今回のニュースでは、2021年1~12月に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。併せて、2010年から2021年の継続的な調査から見えてくる日本市場のグローバル化の現状を、新有効成分含有医薬品の承認数の視点から調査分析したので報告する。
調査方法
調査の対象は、独立行政法人医薬品医療機器総合機構(PMDA)のホームページの「新医薬品の承認品目一覧」4)に掲載されている医薬品とした。品目は審査報告書毎にカウントすることを基本とし、学会等からの要望により同一成分の品目を複数の企業が同時に公知申請したような場合や併用薬物療法等にて複数成分が承認されたものは1つの品目として集計した。各品目の承認情報は、審査報告書、新医薬品の承認品目一覧、添付文書および薬務公報から抽出した。解析には、標準的な統計解析ソフトStata/IC 14.0 for Windows(Stata Corp LP,College Station, TX, USA)を使用し、審査期間は承認申請日から承認日までの期間として算出した。期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数、平均値、標準偏差を併記した。
新医薬品の承認品目数とその内訳
2010~2021年の間に日本で承認された新医薬品の承認品目数の年次推移を図1に示した。日本で2021年に承認された新医薬品の品目数は135品目で、2020年より10品目増加し、2010~2020年の平均承認品目数(118品目)より多い結果であった。そのうち、新有効成分含有医薬品(NME:New Molecular Entity)は52品目が承認され、2020年と比較して14品目増加した。なお、新医薬品およびNMEの承認品目数は、2000年以降で2014年に次ぐ過去2番目に多い数であった。
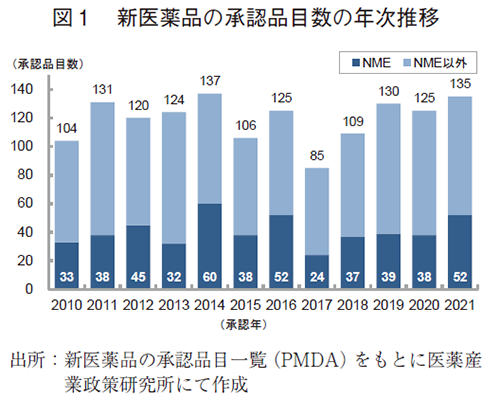
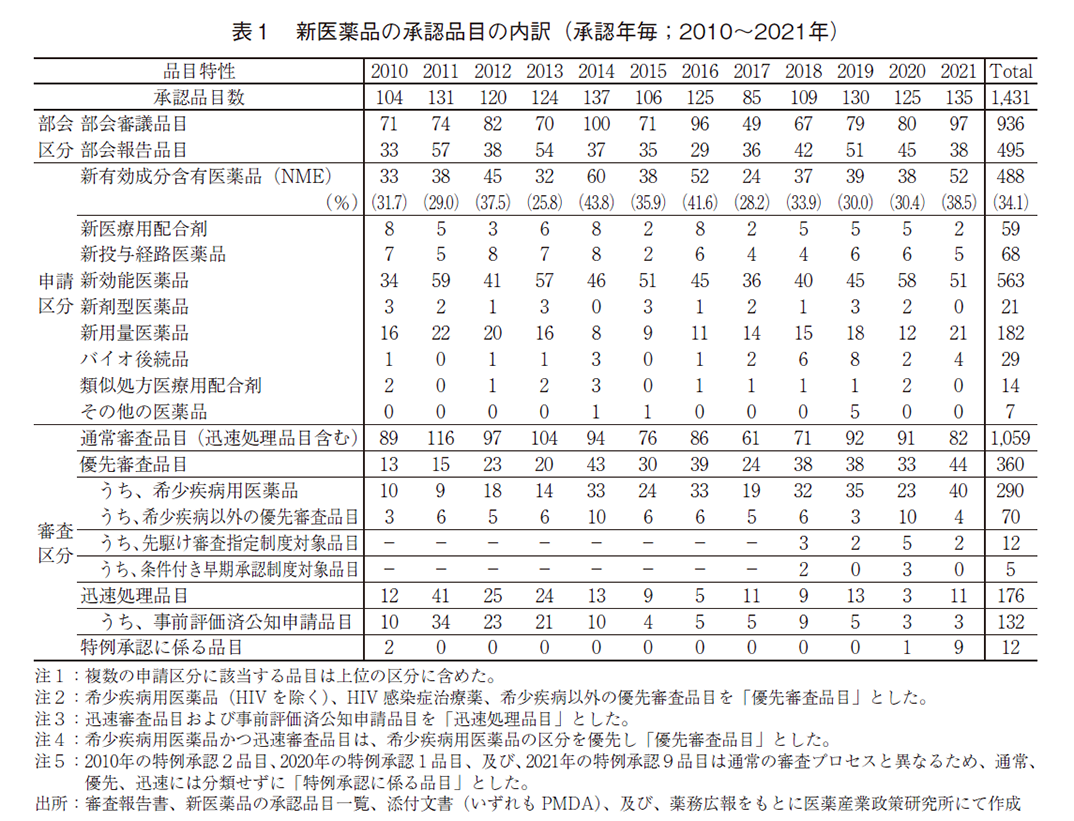
続いて、承認品目の内訳を表1に示した。申請区分別の内訳では、2021年は前述のNMEの他、新用量医薬品が21品目、バイオ後続品(バイオシミラー)が4品目であり、これらの数値は2020年より増加した。一方、2020年に59品目承認された新効能医薬品については7品目減少し、51品目であった。
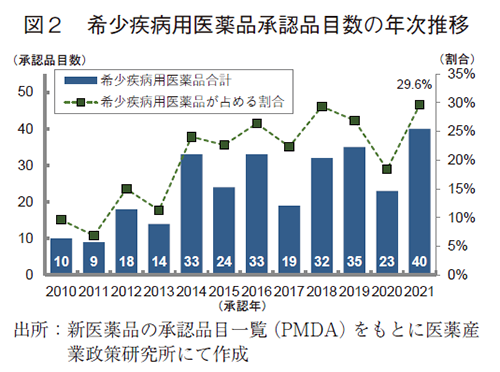
審査区分別の内訳では、通常審査品目が82品目、優先審査品目は44品目であった。優先審査品目が全承認品目に占める割合は33%であり、2014年以降は高い水準(30%前後)で推移していた。また、優先審査品目のうち、希少疾病用医薬品は40品目と、2020年と比較して17品目増加した。希少疾病用医薬品は2014年以降増加し、20~30品目前後で推移していたが、2021年は40品目とこれまでで最も多かった(図2)。2020年に過去最多の5品目が承認された先駆け審査指定制度対象品目の2021年承認数については、3品目減少した2品目であった5)。加えて、現在も世界中で感染拡大が続く「新型コロナウイルス(SARS-CoV-2)による感染症または感染症の予防」を効能・効果として、9品目が特例承認を受けた。
新医薬品の審査期間
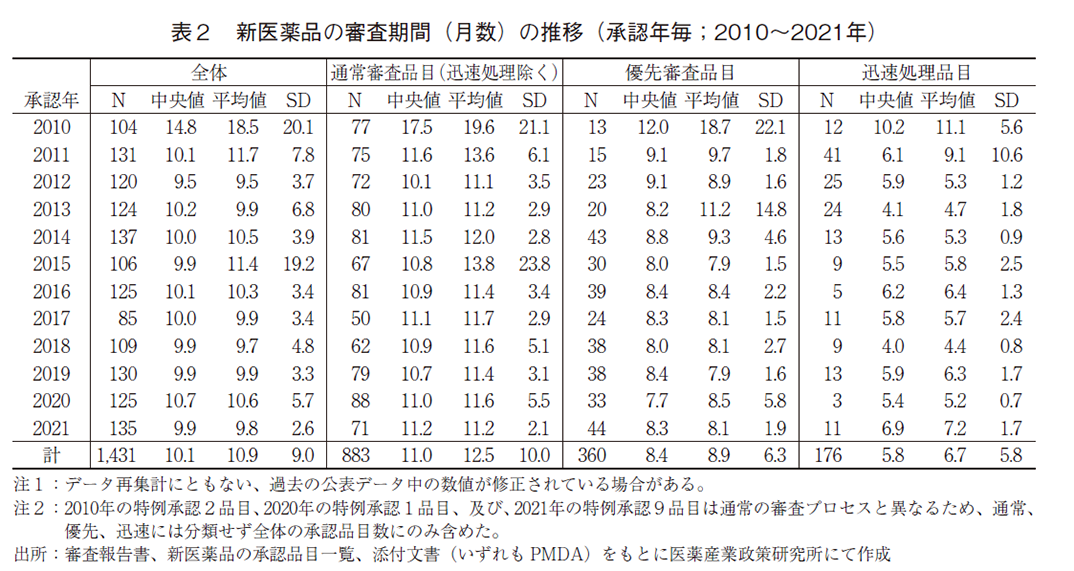
2010~2021年に承認された新医薬品の審査期間の推移を表2および図3に示した。2021年に承認された全135品目の審査期間の中央値は9.9ヶ月と、2020年より0.8ヶ月短く、2019年と同様で、審査期間が大幅に短縮した2011年以降は10ヶ月前後で推移していた。また、審査期間のばらつき(標準偏差:SD)は、2010年以降で最小であった。
次に審査区分別で見ると、審査期間の中央値は迅速処理品目を除いた通常審査品目では11.2ヶ月、優先審査品目では8.3ヶ月であり、こちらも2011年以降の審査期間と同様であった。なお、通常審査品目(迅速処理除く)と優先審査品目それぞれの審査期間の80パーセンタイルは、11.9ヶ月、9.1ヶ月であり、目標値6)とされる12ヶ月以内、9ヶ月以内に近い値で承認されていることが確認できた。
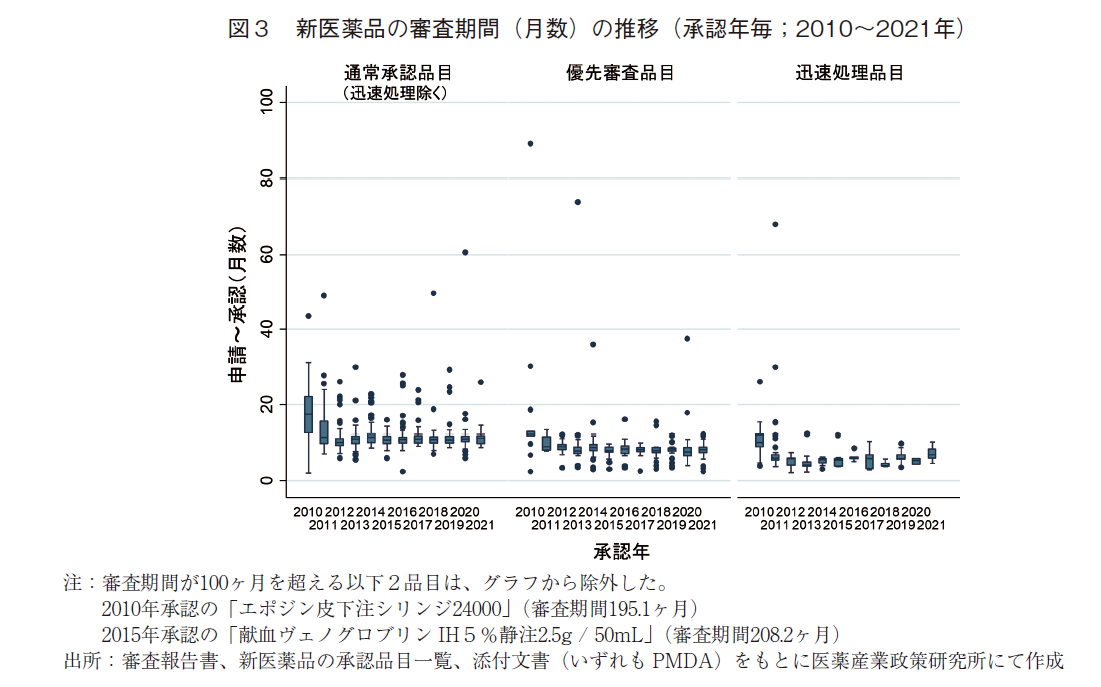
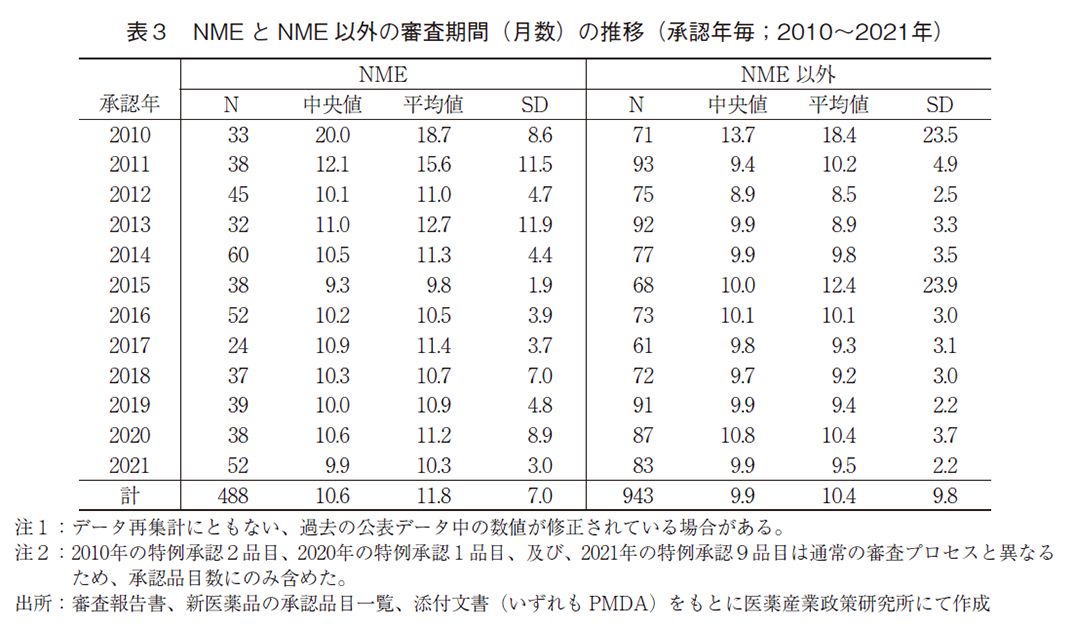
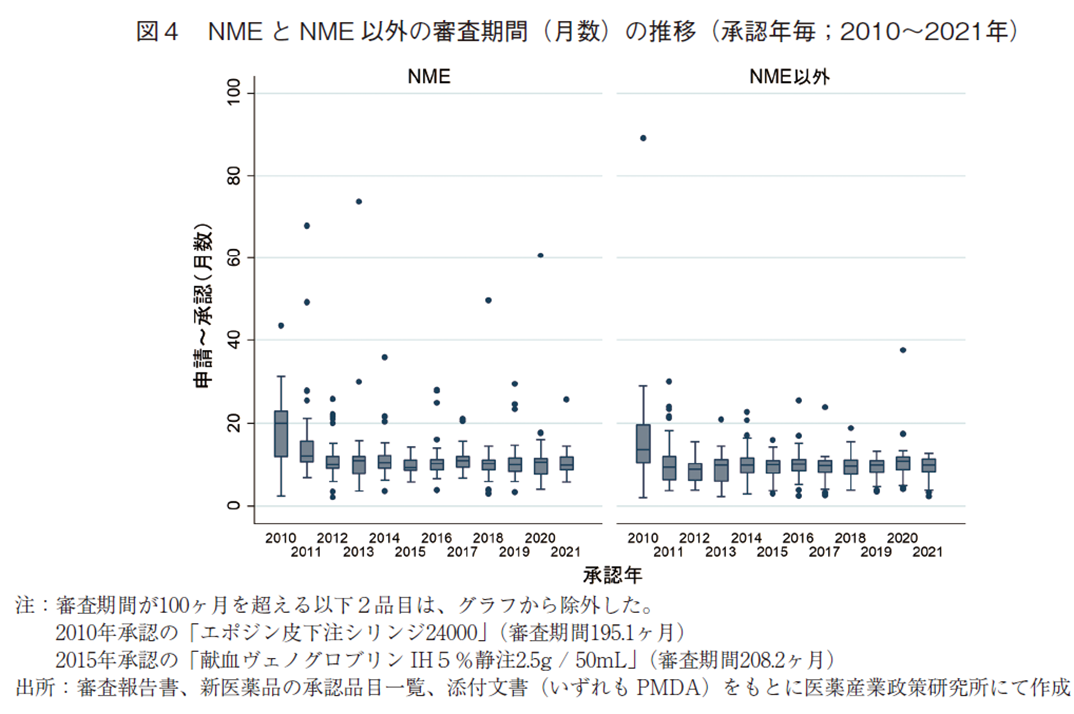
続いて、NMEとNME以外に区分した場合の審査期間の推移について表3および図4に示した。2021年に承認されたNME52品目の審査期間の中央値は9.9ヶ月であり、2020年より0.7ヶ月短く、2015年に次ぐ審査期間であった。NME以外の品目についても審査期間の中央値が9.9ヶ月となっており、2020年より0.9ヶ月短かった。
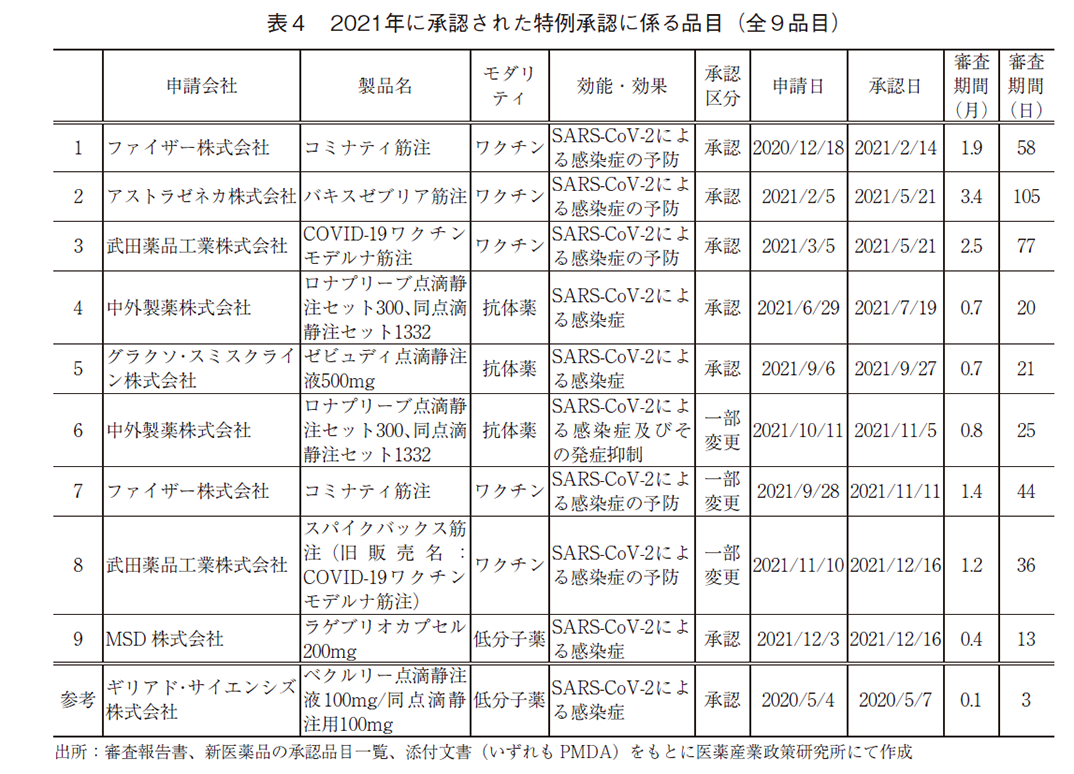
特例承認に係る品目の承認とその審査期間
2021年に承認された特例承認に係る品目を表4に示した。参考として、2020年に承認された1品目を併記している。2021年、現在も世界中で感染拡大が続く「新型コロナウイルス(SARS-CoV-2)による感染症の予防、感染症及びその発症抑制」を効能・効果として、9品目が特例承認された。そのうち、6品目がNMEであった。また、モダリティ別に見ると、ワクチン5品目(うち、NME3品目)、抗体薬3品目(うち、NME2品目)、低分子薬1品目(うち、NME1品目)との内訳であった。
次に新型コロナウイルス感染症(COVID-19)への対策として特例承認を受けた品目のモダリティ別の審査期間を表5に示した。特例承認については通常の審査プロセスと異なるため、あくまで参考値としてみていただきたい。COVID-19対策としては、2020年の1品目を含めこれまで10品目が特例承認されており、審査期間の中央値は30.5日、平均値は40.2日であった。表2、3と比較すると、特例承認品目は通常の審査プロセスに比べて短期間で審査が実施されていたことがわかる。また、モダリティごとに審査期間中央値および平均値を比較すると、ワクチン、抗体薬、低分子薬の順に審査期間が短くなる傾向が見られた。
新有効成分含有医薬品(NME)に関する分析
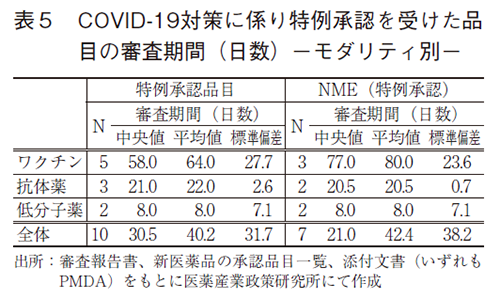
2021年に承認されたNME(52品目)の内訳に関して調査した(図5)。NMEの審査区分では、通常審査品目が25品目(48%)、希少疾病用医薬品(優先審査品目含む)が18品目(38%)、先駆け審査指定品目(優先審査品目、希少疾病用医薬品含む)が2品目(3%)、希少疾病用医薬品以外の優先審査品目が1品目(2%)、特例承認に係る品目が6品目(11%)であった。なお、2021年の希少疾病用医薬品として承認されたNMEの数は2014年に次ぐ多さであった2)。また、2021年に特例承認を受けたNMEの数については過去最多であった。
NMEの申請企業を内外資企業別に見ると7)、内資企業のNMEは23品目(44%)、外資企業のNMEは29品目(56%)であった。2010年以降、内資企業のNME品目数割合は2012、2019年を除いて5割以下であり2)、2021年は2020年と同程度であった。
続いて、バイオ医薬品8)と低分子等医薬品9)にNMEを区分した。2021年承認のバイオ医薬品のNMEは24品目であり、全NMEの46%を占めた。このバイオ医薬品NMEの承認数および全NMEに占める割合は、2010年以降で最多数および最高であった2)。一方、低分子等医薬品のNMEは28品目承認されており、2019、2020年と同程度の承認数を維持していた2)。
薬効分類別10)では、腫瘍用薬が最も多く14品目と27%を占めた。続いて、その他の代謝性医薬品が12品目、生物学的製剤6品目、ホルモン剤5品目、中枢神経系用薬4品目、化学療法剤3品目の順で多く承認された。生物学的製剤の6品目にはCOVID-19ワクチンが3品目含まれ、化学療法剤の3品目はCOVID-19用のウイルス剤であった。また、本政策研ニュースにおいて湯淺らが報告した抗菌薬(抗性物質製剤)に関して11)、2021年のNME承認数は1品目であった。
新有効成分含有医薬品(NME)のグローバル化
2010年から2021年の継続的な調査から見えてくる日本市場のグローバル化の現状を、新有効成分含有医薬品(NME)の承認数の視点から調査分析した。なお、グローバル化を本稿では、グローバル承認品目(日本に加えて米国、欧州の2極のいずれかで承認された品目)の割合で定義する。
本調査では、2010年から2021年に国内で承認されたNME488品目(表1)を対象とし、前回のニュース3)で報告した「日米欧の新薬承認状況」のデータをもとに欧米での承認状況等をアップデートした。各調査時点において、日本のPMDAに加えて、米国のFDA、欧州のEMAの2極のいずれかで承認された品目をグローバル承認品目、FDAとEMAでは承認されておらずPMDAでのみ承認された品目をローカルドラッグと定義し12)、それぞれを抽出した。
2021年末調査時点のNME488品目の内訳は、グローバル承認品目が362品目(74%)、ローカルドラッグが126品目(26%)であった。なお、本結果は2021年末の一時点のデータであり、ローカルドラッグの中には2022年以降に欧米で承認される品目が含まれる可能性があることに注意が必要である。
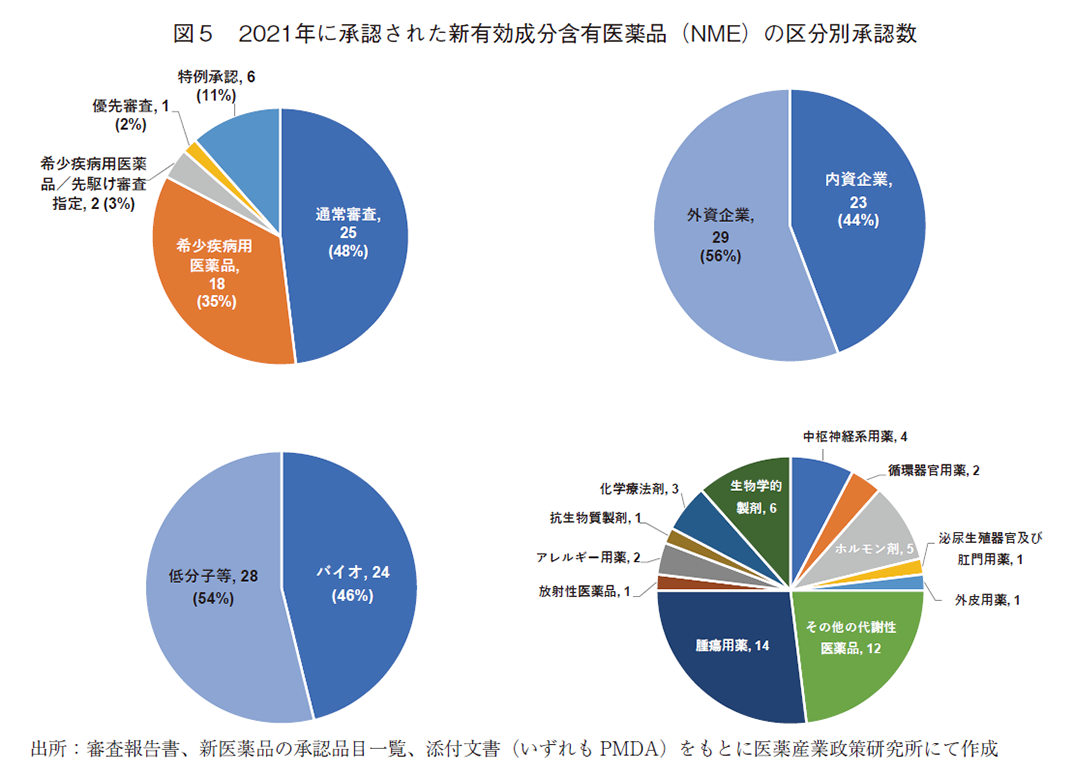
次に、日本市場のグローバル化の進展を確認するため、2014年から2021年の各年末調査時点における直近5年の日本で承認を受けたNMEを対象とし、各調査時点でのグローバル承認品目およびローカルドラッグを抽出した。単年のNME承認数推移では日本と欧米との間の承認ラグ(遅延)の小さい品目の影響が大きくなりグローバル承認品目の推移を見る上でブレ(振れ幅)が大きくなるため、各年調査時点での直近5年合計値として承認品目数を算出している(図6)
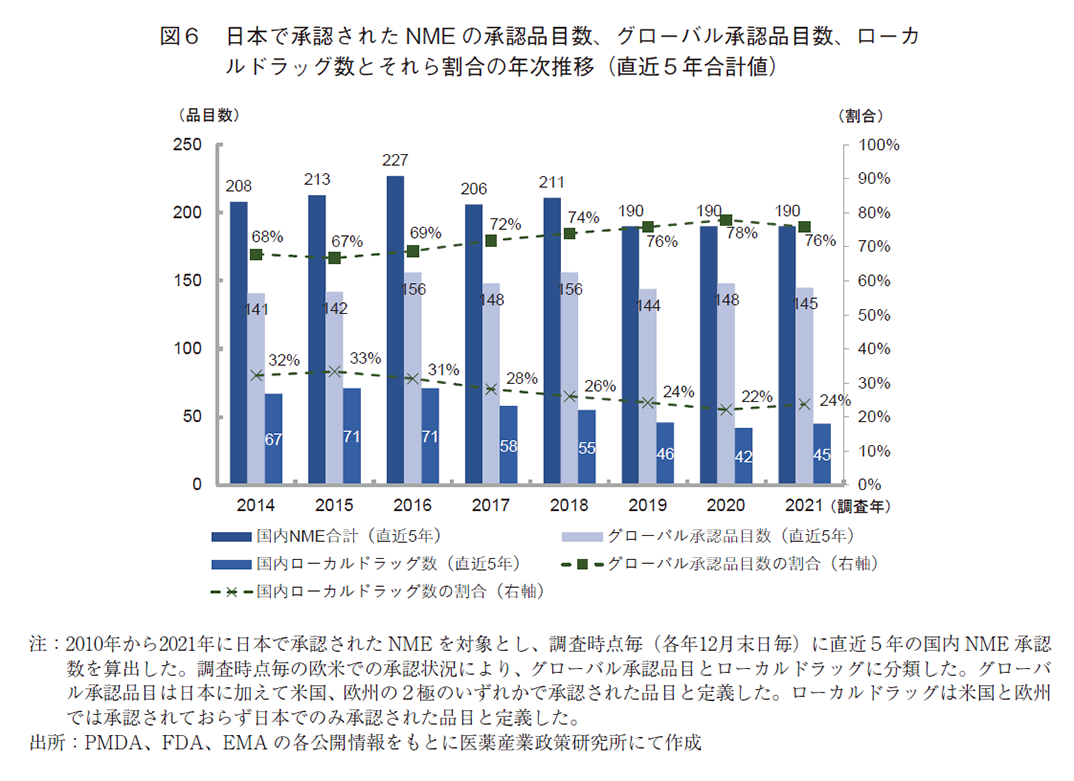
図6のグローバル承認品目数の推移を見ると、2014年調査時点以降141~156品目の間を推移しており、最大でも対2014年比で10%程度の増加数に留まっていた。一方、ローカルドラッグ数については、2014年と2021年を比較すると22品目(対2014年比:33%)減少していた。なお、グローバル承認品目数の国内NME合計に占める割合の推移を見たところ、2014年の68%からほぼ経年的に割合が上昇し、2021年では76%をグローバル承認品目が占めた。
以上のことから、日本におけるNMEの承認数の視点からみたグローバル化の状況は、グローバル承認品目数は大きく増加してはいないものの、ローカルドラッグ数が減少しているため、全体としてはグローバル承認品目の割合が経年で高くなっている(≒グローバル化が進展している)という構造であることがわかる。
続いて、上記変化の要因を調査するため、国内で承認されたバイオ医薬品8)のNMEについて同様の分析をおこなった(図7)。バイオ医薬品のグローバル承認品目数の推移を見ると、2014年調査時点の42品目から2021年には61品目と19品目(対2014年比:45%)増加していることを確認した。一方、バイオ医薬品のローカルドラッグ数については、2014年と2021年を比較すると10品目(対2014年比:71%)減少した。なお、バイオ医薬品のグローバル承認品目数について国内バイオNME合計に占める割合の推移を見たところ、2014年の75%から経年的に割合が上昇し、2021年調査時点では94%をグローバル承認品目が占めることを確認した。
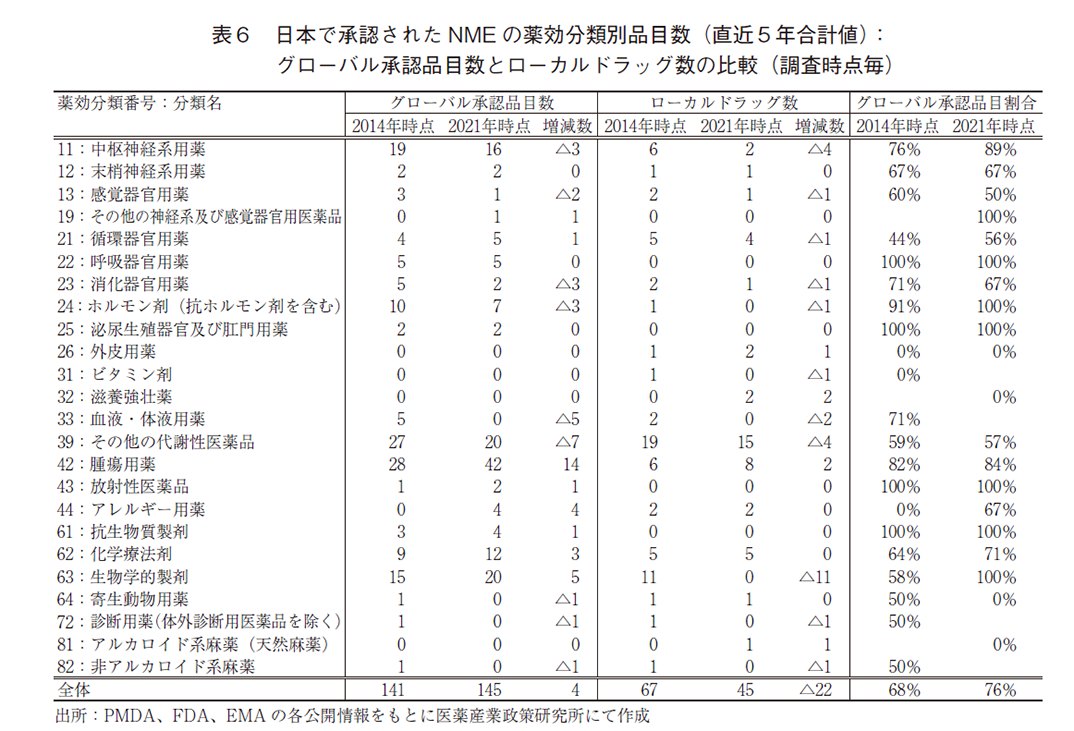
加えて、図6で示した2014年調査時点のグローバル承認品目141品目およびローカルドラッグ67品目と、2021年調査時点のグローバル承認品目145品目およびローカルドラッグ45品目について、薬効分類別10)に品目数を調査した(表6)。
2014年と比較して2021年にグローバル承認品目数が増加している薬効分類は8分類あり、そのうち腫瘍用薬の14品目増加が最多、生物学的製剤の5品目増加が続いた。減少している薬効分類については9分類あり、その他の代謝性疾患の7品目減少が最多であり、血液・体液用(5品目減少)については2021年調査時のグローバル承認品目数はゼロであった。
また、ローカルドラッグについて2014年と2021年を比較すると、ローカルドラッグ数が増加している薬効分類は4分類のみであり、その他の分類は軒並み減少していた。特に、生物学的製剤については最多の11品目減少し2021年調査時のローカルドラッグ数はゼロであった。なお、2014年調査時のローカルドラッグであった生物学的製剤11品目について詳細に調査したところ、9品目がワクチンであった。
最後に、薬効分類別にグローバル承認品目の割合の変化を比較した。2014年、2021年の各調査時点でそれぞれ10品目以上のNME承認品目のあった薬効分類のうち、最もグローバル承認品目の割合が増加したのは生物学的製剤(58%→100%)であり、続いて中枢神経系用薬(76%→89%)、化学療法剤(64%→71%)、腫瘍用薬(82%→84%)の順で増加し、その他の代謝性医薬品(59%→57%)のみ減少していることを確認した。
上記の調査を総合すると、腫瘍用薬や生物学的製剤のグローバル承認品目数の増加、国内向けの生物学的製剤(主にワクチン)数の大幅な減少がバイオ医薬品NME承認品目におけるグローバル承認品目割合の増加を促進したのに加え、NME承認品目数の多数を占める薬効分類群の多くでグローバル承認品目の割合が増加したことにより、国内NME承認品目に占めるグローバル承認品目の割合が増加した(≒グローバル化が進展した)ことが明らかとなった。
新再生医療等製品の承認品目とその審査期間
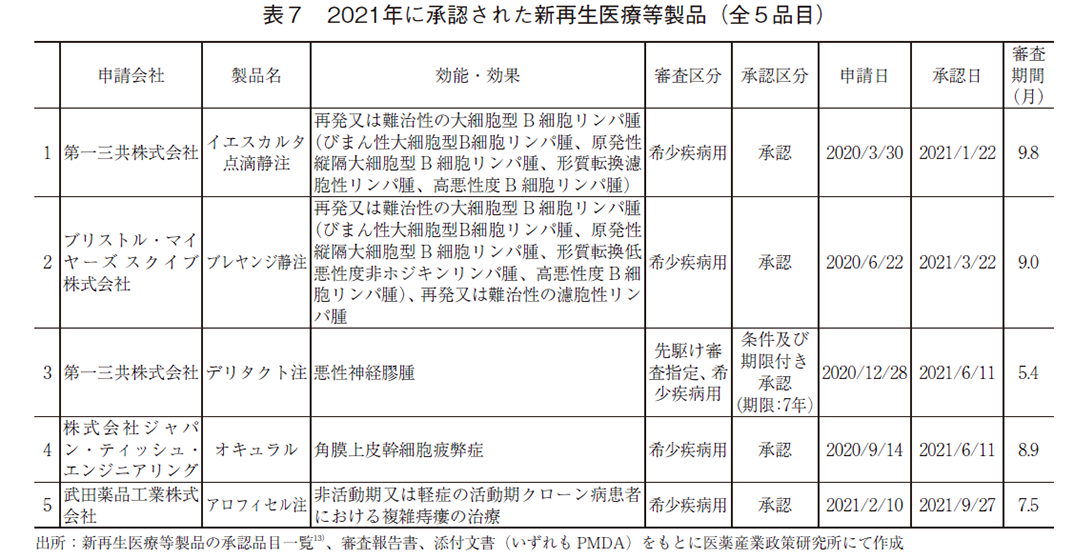
ここからは新再生医療等製品の承認品目とその審査期間について紹介する(表7)。2021年、新再生医療等製品として新たに5品目が承認され、年間の承認数としては過去最多であった。なお、国内初の腫瘍溶解性ウイルス製剤であるデリタクト注は、7年間の期限付き・条件付きでの承認となっている。また、全品目が希少疾病用再生医療等製品として承認されており、そのうちの1品目は先駆け審査指定再生医療等製品であった。
2021年に承認された新再生医療等製品の審査期間については、審査期間中央値が8.9ヶ月(平均値8.1ヶ月、標準偏差1.7)であった。2020年までに承認された新再生医療等製品(全11品目)の審査期間中央値11.7ヶ月(平均値15.6ヶ月、標準偏差10.4)2)と比較すると、審査期間の短縮が見られる。また、再生医療等製品における審査期間の目標値6)として優先品目では全品目の50%を9ヶ月以内に処理とされており、目標に近い期間で承認されていることが確認できた。
考察とまとめ
本稿では、2021年に日本で承認された新医薬品と新再生医療等製品の承認状況およびその審査期間について調査した。また、現在も猛威を振るう新型コロナウイルスに対する治療薬に適応された特例承認に係る品目に関する同情報をまとめた。加えて、2021年に承認された新有効成分含有医薬品(NME)についての各区分別承認数、および、2010~2021年に承認されたNME承認品目数の視点から見た日本市場のグローバル化に関する分析をおこなった。
日本で2021年に新医薬品として承認された品目数は135品目であり、過去11年間の年平均承認品目数より高い水準であった。その内訳を見ると、NMEが2020年に比べて14品目増加するなどの特徴が見られた。また、2021年に承認された希少疾病用医薬品は40品目とこれまでで最も多く、製薬企業等による希少疾病で苦しむ患者さんに向けた医薬品創出の取り組みが積極的におこなわれていることがわかる。
2021年に承認された新医薬品の審査期間に関しては、その中央値は9.9ヶ月と審査期間が大幅に短縮した2011年以降10ヶ月前後で推移しており、審査期間のばらつき(標準偏差)については2010年以降で最小であった。COVID-19の流行下において様々な制約が存在する中、患者さんの健康や公衆衛生上の課題に貢献をするため、審査当局と製薬業界との協力が適切になされていたと考えられる。
特例承認に係る承認品目とその審査期間の調査では、2021年に過去最多の9品目が特例承認を受けたことを確認し、2020年のベクルリーを含めたCOVID-19への対策として特例承認を受けた10品目の審査期間を示した。本結果により、特例承認品目は通常の審査プロセスに比べ圧倒的に短い期間で審査が実施されており、特例承認が緊急時の対応としての役割を果たしていることを再確認した。また、モダリティごとに比較すると、ワクチン、抗体薬、低分子薬の順に審査期間が短くなる傾向が見られた。前回ニュース3)で詳しく述べたが、ワクチンのNME(特例承認)については、国内第I/II相試験に基づく日本人における有効性と安全性や海外臨床試験とのブリッジングの確認に時間がかかっていた可能性がある。一方、低分子薬のNME(特例承認)の場合は、承認審査時の主な臨床試験等の試験成績として取り扱われた国際共同第III相試験に日本も参画していたことが審議結果報告書から確認できており、承認審査の迅速化に寄与したと考えられる。
今後の緊急時の薬事承認のあり方についてであるが、令和3年12月27日に厚生科学審議会医薬品医療機器制度部会より「緊急時の薬事承認のあり方等に関するとりまとめ」が公表されており14)、「緊急承認制度」として制度化される予定である。参考までに、制度化予定の新たな制度(緊急承認制度)と現行制度との比較を示す(表8)15)。制度が発動する要件として、感染症のアウトブレイクに加え、原子力事故や放射能汚染、バイオテロなども幅広く含むとされており、ワクチンや治療薬だけでなく、医薬品全般、医療機器、再生医療等製品も対象とする。特例承認と異なり、2年程度の期限付きでの承認となり期限内での有効性の確認の必要性が明記され、海外で使用されている品目に限らず国内先行での承認も可能な制度となる。これまでの緊急時の承認制度の課題については以前のニュース2、3)にて詳しく取り上げているため参照いただきたいが、時代に見合った制度が整備されることは将来おこりうるパンデミックに備える上で必須であり、各種課題を克服した制度となることを期待する。

2021年に承認されたNMEに関する各区別承認数の分析からは、審査区分別での調査において希少疾病用医薬品のNMEや特例承認のNMEの割合が例年と比べて高かった。先にも述べたが、製薬産業等の希少疾病やCOVID-19への取組の結果として表れた数字であろう。また、2021年承認のバイオ医薬品のNMEが過去最多であった。バイオ医薬品については、前年の調査2)ではNMEの承認数増加よりも新効能医薬品やバイオ後続品の増加が顕著であったが、特例承認に関する調査結果からも見られたように、2021年はCOVID-19対策としてのワクチンや抗体薬が科学の進歩により短期間で開発され5品目もの数が承認されたのに加え、通常の審査プロセスでの承認品目においても長年の研究開発の努力が結実した片頭痛の予防を適応としたCGRP抗体が同年に3品目承認16)されるなどの影響があったと考えられる。
NMEの承認数の視点から調査した日本市場のグローバル化に関する分析では、グローバル承認品目の割合が経年で高くなっていることを示し、その理由として、腫瘍用薬や生物学的製剤のグローバル承認品目数の増加や国内向けの生物学的製剤(主にワクチン)数の減少等が、国内NME承認品目に占めるグローバル承認品目の割合を押し上げる一因となっていることを明らかにした。腫瘍用薬のグローバル承認品目数の増加については、海外発・外資企業由来の品目が多いためグローバルで開発されている品目が多く、また、近年は疾患セグメントが細分化されておりセグメントごとの国内市場はそれほど大きくないため、グローバルに開発を行っているグローバル承認品目の割合が増加していると考えられる。また、生物学的製剤のグローバル承認品目の増加についても、海外発・外資企業由来の品目が多いためグローバルで開発されている品目が多く、特にワクチンについてはCOVID-19での対応でも明らかになったが、近年では海外からの品目に依存している。この国内でのワクチンの状況については本政策研ニュースにて高砂により詳細が報告されている17)。患者さんの医薬品へのアクセスという面において、日本でのみ展開されるローカルドラッグも国内市場のニーズに特化して貢献をしてきたと考えるが、海外企業の進出や疾患の市場特性により、承認品目の視点からもグローバル化が進んでいく中、国内製薬企業は国内に特有のニーズに応え続けることはもとより、いかに世界で貢献できる薬を開発できるかが今以上に問われていくことになろう。
新再生医療等製品の承認品目と審査期間の調査からは、2021年に承認された5品目の審査期間中央値が8.9ヶ月と、2020年までに承認された新再生医療等製品(全11品目)の審査期間に比べて短縮が見られた。また、承認された5品目の全てが希少疾病用再生医療等製品として承認されており、これまで治療が困難であった疾患に対する新たな治療選択肢としての地位を確立しつつある。
以上、2021年の承認品目とその審査期間調査と共に、継続的な調査から見えてくる日本市場のグローバル化の現状をNMEの承認数の視点から取り上げてきた。医薬品の研究開発が多様化・高度化する中、環境変化に対応し、患者さんの健康や公衆衛生上の課題に貢献していくことを念頭に、新たなイノベーションと価値が生み出されていくことを期待する。
補足
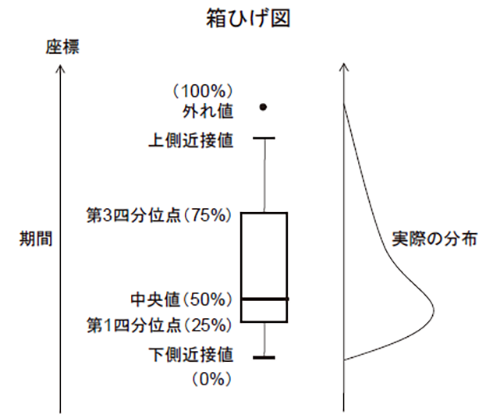
期間が著しく長い品目や特例により短い品目が存在することから、主たる基本統計量は中央値とし、サンプル数(N)、平均値、標準偏差(SD)を併記した。また、図3、図4は、データの分布がわかるよう箱ひげ図で示した。箱ひげ図の箱の中央の線は中央値(50%)、箱の下端、上端の線はそれぞれ第1四分位点(25%)、第3四分位点(75%)を示している。すなわち、100個のサンプルがあった場合、25番目のサンプルの値が第1四分位点、50番目が中央値、75番目が第3四分位点となる。箱の上下の近接値(ひげ)は箱の高さ(第1四分位点~第3四分位点の長さ)の1.5倍以内で中央値から最も離れているサンプルを示している。近接値外にある外れ値は点として示される。
-
1)医薬産業政策研究所.「日本における新薬の臨床開発と承認審査の実績」リサーチペーパー・シリーズ No.69(2016年11月)
-
2)医薬産業政策研究所.「日本で承認された新医薬品とその審査期間-2020年承認実績と過去10年の動向調査-」政策研ニュース No.62(2021年3月)
-
3)医薬産業政策研究所.「日米欧の新薬承認状況と審査期間の比較-COVID-19ワクチンの事例も踏まえた日本の課題-」政策研ニュース No.64(2021年11月)
-
4)独立行政法人医薬品医療機器総合機構(PMDA)ホームページ「新医薬品の承認品目一覧」(Accessed on Jan 7 2022)
-
5)2021年は先駆け審査指定制度対象品目(申請区分)として、オラデオカプセル150mg、イズカーゴ点滴静注用10mg の2品目が新有効成分含有医薬品(申請区分)として承認されている。
-
6)
-
7)本稿で用いた内外資企業の定義:厚生労働省「医薬品・医療機器産業実態調査:用語の解説」を参照。
-
8)本稿で用いたバイオ医薬品の定義:日本における承認情報において抗体等一般名に遺伝子組換え(Genetical Recombination)とある品目、また、血液製剤やワクチンなど添付文書に特定生物由来製品、生物由来製品と記載されている品目としている。
-
9)本稿で用いた低分子等医薬品の定義:バイオ医薬品と定義されたもの以外を低分子等医薬品としている。
-
10)
-
11)医薬産業政策研究所.「日本と欧米の抗菌薬開発の状況と課題」政策研ニュース No.65(2022年3月)
-
12)本ニュースでのローカルドラッグの定義は、FDA とEMA では承認されておらずPMDA でのみ承認された品目としており、それ以外の他の国・地域で承認されている品目、調査時点で海外開発がなされている品目、海外開発を実施したが様々な理由により中止・中断した品目等も含まれるため、厳密には国内に特化している品目とは限らないことを申し添えておく。
-
13)独立行政法人医薬品医療機器総合機構(PMDA)ホームページ「新再生医療等製品の承認品目一覧」(Accessed on Jan 7 2022)
-
14)
-
15)
-
16)医薬産業政策研究所.「新薬における創薬モダリティのトレンド-多様化/高分子化の流れと、進化する低分子医薬-」政策研ニュース No.64(2021年11月)
-
17)医薬産業政策研究所.「感染症予防ワクチンの創製について」政策研ニュース No.65(2022年3月)

